21.1 Léčba lokalizovaného onemocnění (stádium I, II a operabilní III. stádium)
Základem je léčba chirurgická. Pokud je to možné, pak by u všech T1 tumorů měl být proveden ledvinu šetřící výkon, ve všech ostatních případech je provedena radikální nefrektomie. Ledvinu šetřící výkon by se měl provést i u T2 tumorů, pokud je technicky možný (v případě solitární ledviny nebo renální insuficience). Regionální lymfadenektomie je indikována u vysoce rizikových tumorů nebo v případě radiograficky patrné lymfadenopatie z důvodů zpřesnění stagingu a prognózy, i když její onkologický benefit nebyl jednoznačně prokázaný. Miniinvazivní přístupy (laparoskopický nebo robotický) mají nižší morbiditu oproti otevřenému přístupu. Onkologické výsledky jsou srovnatelné. Miniinvazivní přístup by měl být preferován vždy, pokud nejsou ohroženy onkologické, funkční nebo perioperační výsledky. U nádorů malého objemu (small renal mass, tj. ≤ cca 3 cm) u pacientů s kratší předpokládanou dobou života je možné sledování nebo miniinvazivní postupy, např. RFA. U těchto nemocných je indikována biopsie nádoru s výjimkou pacientů se závažnými komorbiditami, které znemožňují aktivní léčebný přístup ve smyslu operace nebo termoablace.
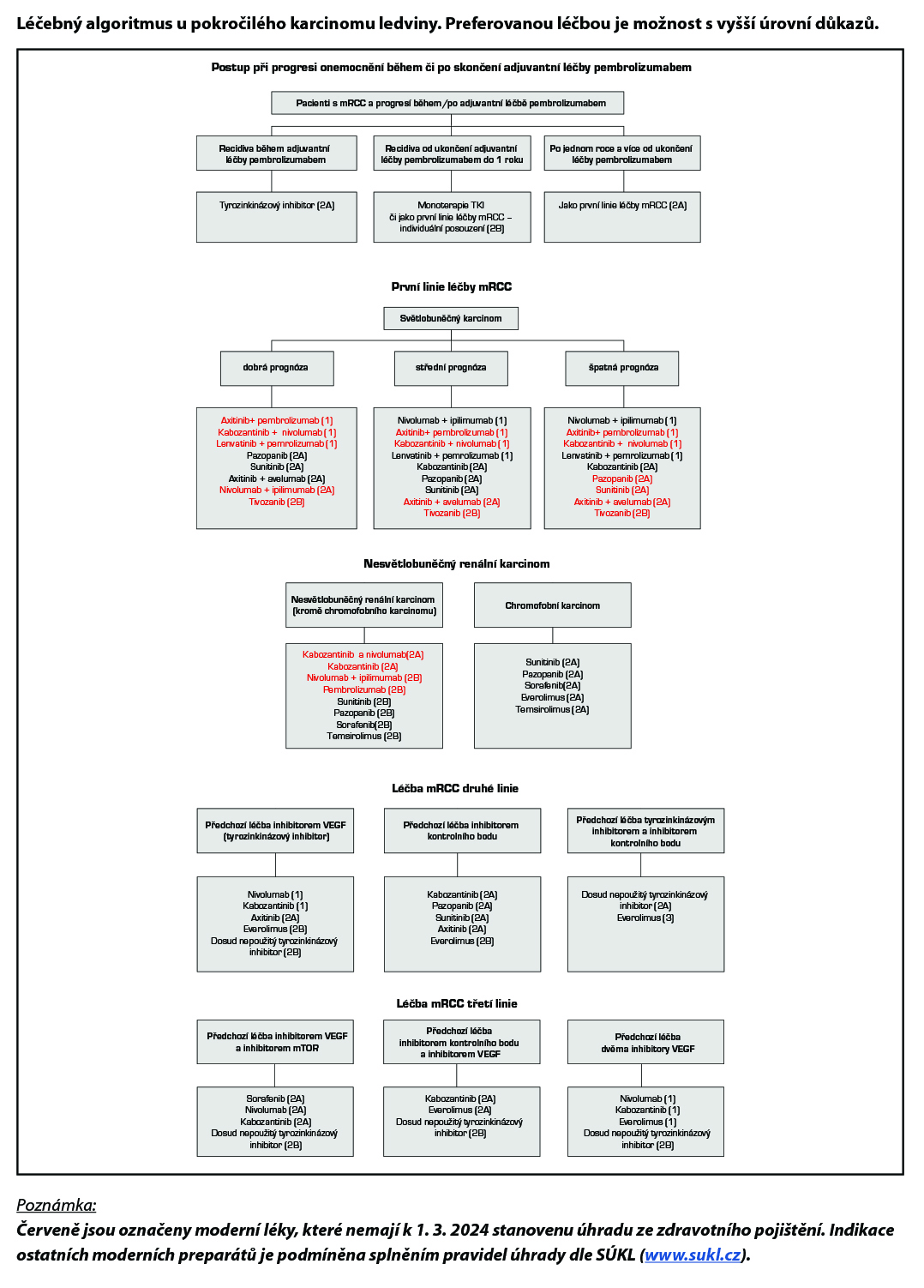
Adjuvantní léčba pembrolizumabem může být zvažovaná u pacientů s operabilním světlobuněčným RCC se středním nebo vysokým rizikem (střední riziko: pT2, grade 4 nebo sarkomatoidní složka, N0M0 nebo pT3, jakýkoliv grade, N0M0; vysoké riziko: pT4, jakýkoliv grade, N0 M0 nebo jakékoliv pT jakýkoliv grade, N1M0) po pečlivé konzultaci pacienta s ohledem na OS a potenciálních dlouhodobých nežádoucích účinků (úroveň důkazů 2A). Možnosti léčby po progresi léčby jsou uvedené ve schématu níže. U pacientů po metastasektomii (do jednoho roku od nefrektomie) pro oligometastatické onemocnění lze nabídnout adjuvantní pembrolizumab po kompletní resekci (stupeň doporučení 2A).
21.2 Léčba generalizovaného onemocnění (neoperabilní lokálně pokročilé onemocnění a IV. stádium)
21.2.1 Chirurgická léčba metastatického karcinomu ledviny
- Paliativní nefrektomie je indikována v případě výskytu konzervativně neřešitelných lokálních příznaků, jako je například neztišitelné krvácení.
- Cytoredukční nefrektomii jako zahájení léčby indikujeme individuálně v závislosti na celkovém stavu pacienta a rozsahu onemocnění. Výsledky studie CARMENA by neměly vést ke kontraindikaci cytoredukční nefrektomie u pacientů především s nízkým objemem metastatického onemocnění, ECOG stavem 0–1 a v příznivém či středním riziku (především pak
v přítomnosti jednoho rizikového faktoru). Navíc ve studii CARMENA byl hodnocen sunitinib, který nepředstavuje preferovanou možnost léčby první paliativní linie. Klinické výsledky jednotlivých podskupin pacientů podstupující léčbu moderní imunoterapií byly lepší, pokud podstoupili primární nebo odloženou (při efektu systémové terapie) cytoredukční nefrektomii. U pacientů v nepříznivé rizikové skupině je primárně indikovaná systémová léčba. U všech nemocných podstupujících primárně systémovou terapii je možné zvážit, dle odpovědi na léčbu, odloženou cytoredukční nefrektomii (úroveň důkazů 2A). - Chirurgická léčba metastáz je doporučena pouze v případě možnosti jejich kompletního odstranění a zvážení přínosu vs. operační zátěže (úroveň důkazů 2A).
21.2.2 Systémová léčba metastatického karcinomu ledviny
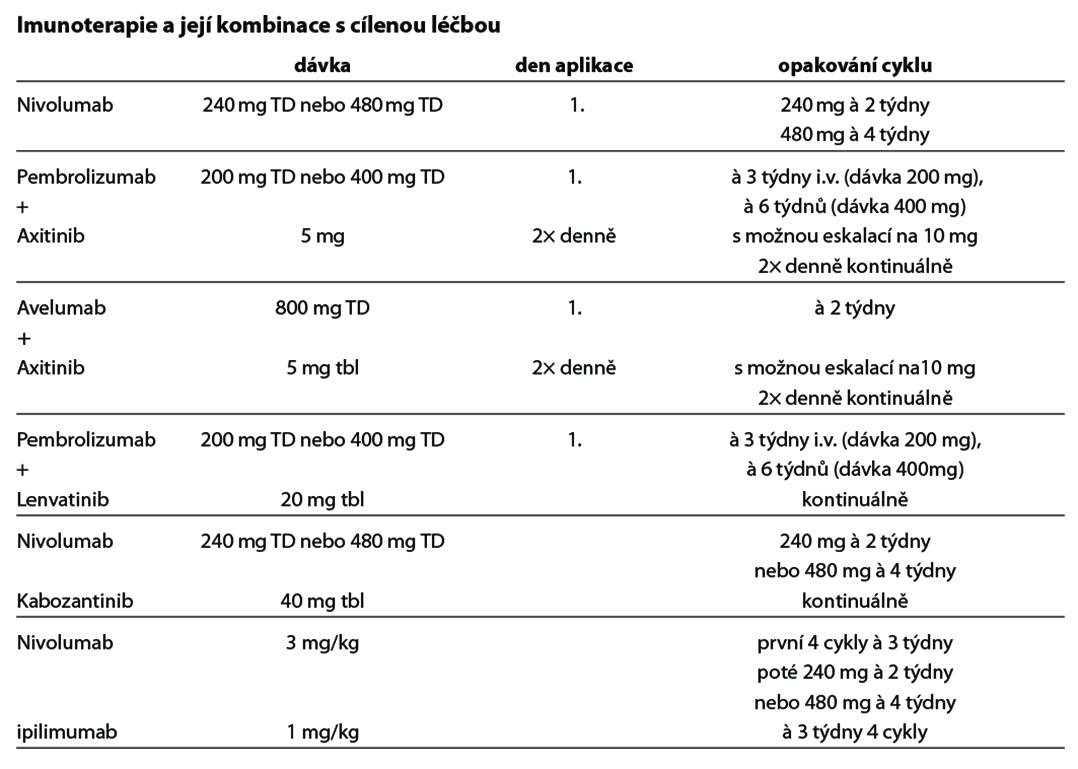
Pro léčbu v první linii cílené terapie multikinázovými inhibitory se používá skórovací systém dle MSKCC z roku 2002 (Motzer a kol. 2002) – tabulka 1 nebo dle IMDC (Heng a kol. 2009) – tabulka 2. Při použití kombinované terapie (TKI a checkpoint inhibitory, či nivolumabu a ipilimumabu) se používá skórování dle IMDC. Při stanovení prognostické kategorie je nutno dodržovat aktuální indikační omezení a způsob úhrady stanované SÚKL – úhrada může být vázána jen na MSKCC nebo jen na IMDC kritéria.


Komentář k léčebným schématům
- Uvedená doporučení jsou založená na nejnovějších medicínských poznatcích a nemusí se vždy shodovat s pravidly úhrady léku od plátce péče.
- Pokud se týká kombinace, je v první linii paliativní léčby pacientů s mRCC v dobré prognostické skupině ze zdravotního pojištění hrazena kombinace axitinibu a avelumabu, v případě kontraindikace či nevhodnosti imunoterapie lze podat sunitinib nebo pazopanib (je možno zvolit i strategii sledování – watch and wait). U pacientů se střední a špatnou prognózou je v první linii léčby pacientů s mRCC doporučena kombinovaná terapie s inhibitorem kontrolního bodu (viz Léčebný algoritmus paliativní léčby I. linie). V případě kontraindikace či nevhodnosti imunoterapeutických kombinací lze podat u pacientů se střední prognózou kabozantinib, sunitinib nebo pazopanib v monoterapii, u pacientů se špatnou prognózou kabozantinib v monoterapii.
- U nemocných s mRCC by mělo být vždy preferenčně zvažováno zařazení do klinické studie.
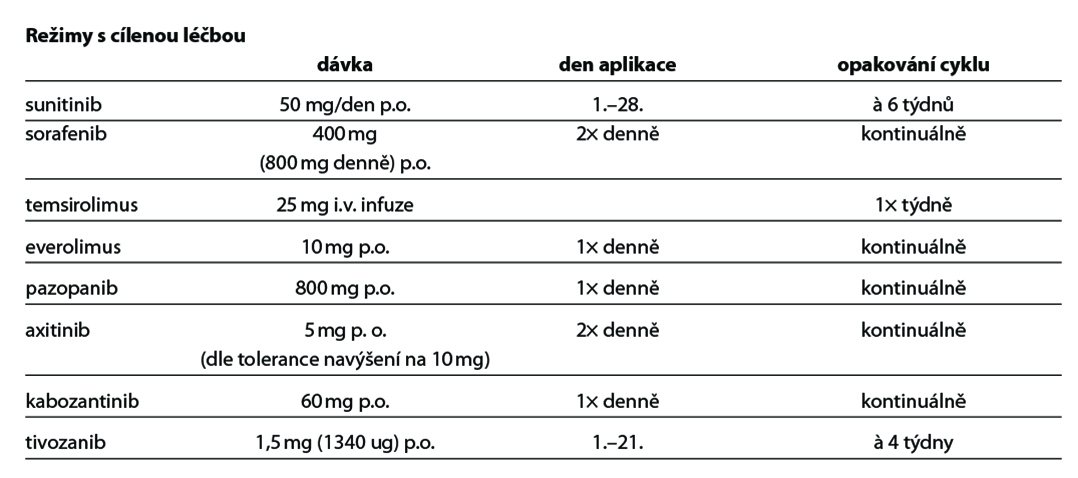
- Doporučuje se zahajovat terapii plnou dávkou cíleného léku s redukcí dávky při limitující toxicitě (2A).
- Několik studií ukázalo, že na základě PFS v první linii léčby nelze předpovídat PFS na 2. linii terapie.
- U sarkomatoidního podtypu RCC je dle nejnovějších dat nutno preferovat především kombinovanou imunoterapii chechpoint inhibitory, které mají ve srovnání s konvenční léčbou tyrozinkinázovámi inhibitory až trojnásobný response rate (1; nutno dodržovat úhradové omezení); poté lze zvážit chemoterapii v režimech jako pro sarkomy měkkých tkání (viz příslušná kapitola Modré knihy) (2B).
- U nemocných s indolentním průběhem onemocnění je možné sledování bez systémové protinádorové léčby (2A).
- Počet linií léčby mRCC by neměl být limitován jinak než stavem nemocného a dostupností léků (2A). Vyšší počet použitých linií pozitivně koreloval v retrospektivních studiích s celkovým přežitím pacientů.
Doporučení uvedená v Modré knize vychází z medicíny založené na důkazech. Postupně se budeme snažit k jednotlivým doporučením přičlenit také určitý stupeň, který vyjadřuje míru důkazů a míru doporučení ČOS. Vycházíme z modifikovaného systému, který používá NCCN a ESMO.
ČOS: Stupně evidence a doporučení
Stupeň 1 Založeno na vysokém stupni důkazů, jednotné doporučení ČOS, že léčba je vhodná.
Stupeň 2A Založeno na nižším stupni důkazů, jednotné doporučení ČOS, že léčba je vhodná.
Stupeň 2B Založeno na nižším stupni důkazů, doporučení ČOS, že léčba je vhodná.
Stupeň 3 Založeno na jakémkoliv stupni důkazů, v rámci ČOS není shoda o vhodnosti léčby.
Literatura:
- Escudier B, Porta C, Schmidinger M,et al.; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Renal cell carcinoma: ESMO Clinical
Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2019 May 1;30(5):706-720. - Powles T, Albiges L, Bex A, et al. ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. ESMO Clinical Practice Guideline update on
the use of immunotherapy in early stage and advanced renal cell carcinoma. Ann Oncol. 2021 Dec;32(12):1511-1519. - NCCN Clinical Practice Guidelines in Oncology, Kidney Cancer v. 1. 2024.
Renální karcinom-follow-up
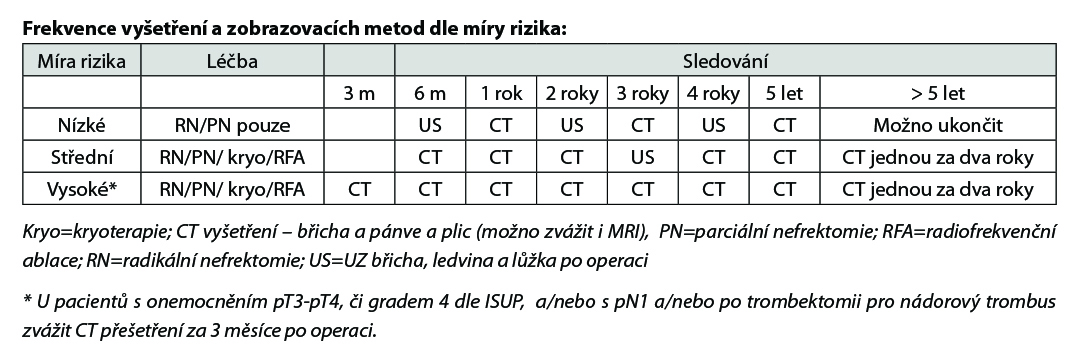
Zobrazovací vyšetření a laboratorní vyšetření jsou indikovány dle úvahy lékaře na základě klinického vyšetření. Kontroly a vyšetření se pak u pacientů s RCC zaměřují na pooperační komplikace, renální funkce (kontroly GFR, biochemie, krevní obraz, moč+sed), lokální a kontralaterální rekurence a vzdálené metastázy. Doba sledování není jasná, všeobecné doporučení
je minimálně 5 let po operaci (pozdní relapsy u low- risk tumorů nejsou vyloučené). Základním vyšetřením je CT vyšetření břicha a pánve (možno též zvážit i MRI pro snížení radiační zátěže), CT hrudníku. CT hrudníku může být později nahrazeno RTG plic. UZ břicha a pánve se doporučuje u pacientů s nízkým rizikem- viz níže uvedená tabulka. Kostní skan a CT/PET vyšetření se provádí jen v indikovaných případech.
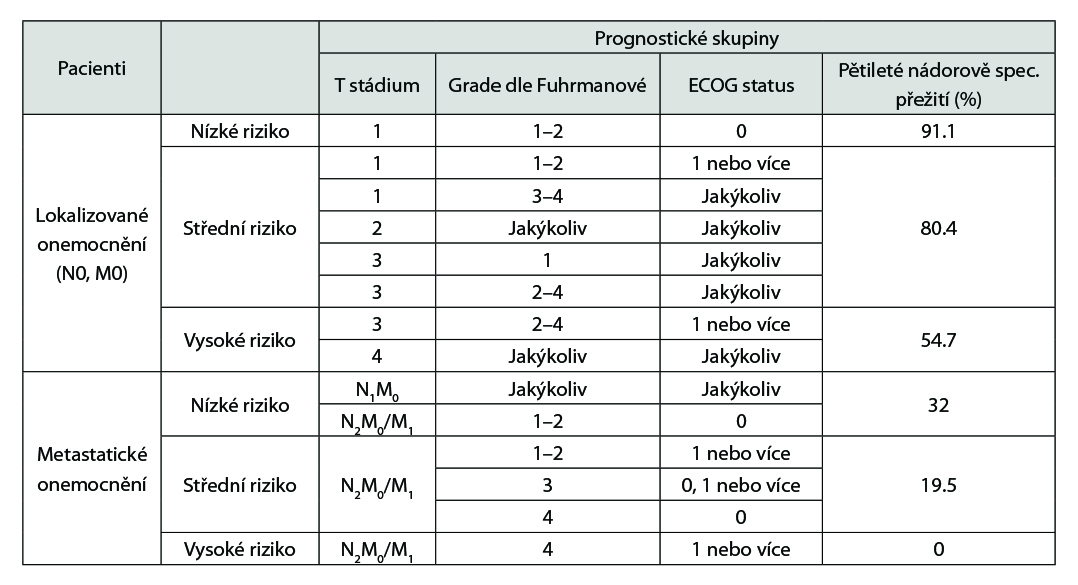
U pacientů s RCC provádíme skórování rizika rekurence dle nomogramů, následně dle stupně rizika se stanovuje frekvence kontrol a vyšetření, nejčastěji užíváme nomogramy: UISS či SSIGN. Níže je uvedená tabulka UISS, lze použíti on-line kalkulátory: www.mdcalc.com/ucla-integrated-staging-system-uiss-renal-cell-carcinoma-rcc www.mdcalc.com/ssign-score-renal-cell-carcinoma-rcc
Stanovení míry rizika dle UISS (University of California Los Angeles Integrated Staging System):
Literatura
- Zisman A, Pantuck AJ, Wieder J, et al. Risk group assessment and clinical outcome algorithm to predict the natural history of patients with surgically resected
renal cell carcinoma. J Clin Oncol. 2002 Dec 1;20(23):4559-66. - Frank I, Blute ML, Cheville JC, et al. An outcome prediction model for patients with clear cell renal cell carcinoma treated with radical nephrectomy based on
tumor stage, size, grade and necrosis: the SSIGN score. J Urol. 2002 Dec;168(6):2395-400 .