32.1. Doporučení pro léčbu anémie u onkologických pacientů erytropoezu stimulujícími proteiny (ESP)
Úvod
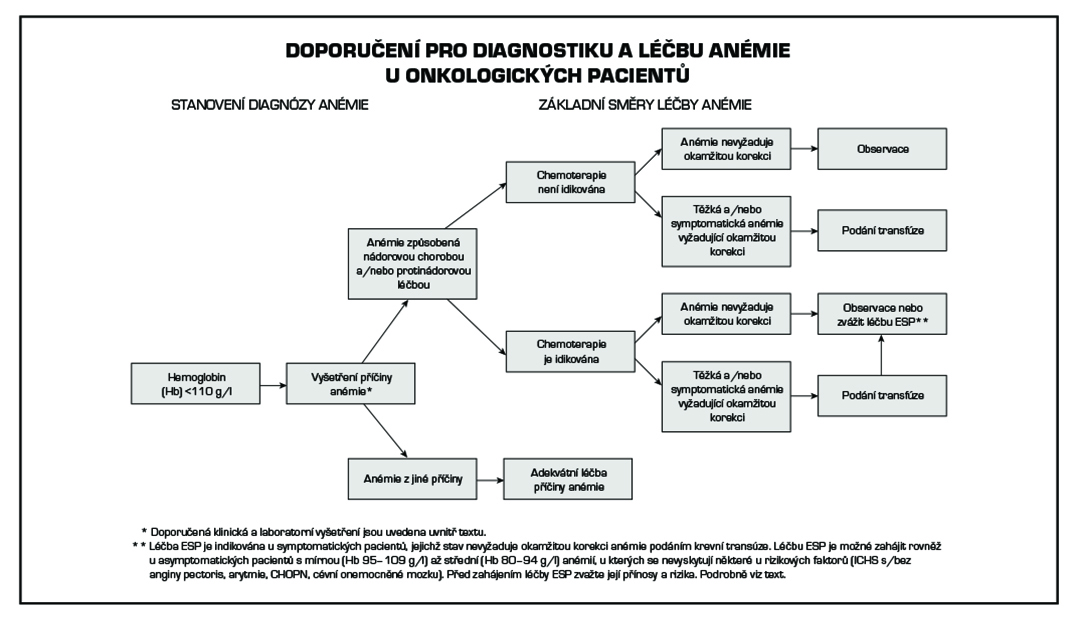
Příčina anémie u onkologicky nemocných je multifaktoriální. Je proto nutné spolehlivě vyloučit jiné příčiny anémie, tj. akutní nebo chronické krvácení, hemolýzu, deficit vitaminu B12, folátu nebo železa, špatný nutriční stav pacienta, nebo anémii při renální insuficienci. Ke správnému zhodnocení příčiny anémie doporučujeme provést následující laboratorní vyšetření: KO+diff + retikulocyty, hladina železa a jeho vazebná kapacita, hladiny ferritinu, solubilní trasferinový receptor, transferinu, vitaminu B12, folátu, LDH, bilirubinu konjugovaného a nekonjugovaného, urey, kreatininu, clearance kreatininu, albuminu, celkové bílkoviny, dále Coombsův test a v neposlední řadě vyloučit krvácení.
Dle CTCAE v5.0 se rozlišují čtyři stupně anémie:
• Mírná, G1 Hb ≥ 100 g/l
• Střední, G2 Hb 80–99 g/l
• Těžká, G3 Hb < 80 g/l
• Život ohrožující, G4 Hb život ohrožující
32.1.1 Zahájení léčby anémie
Před zahájením léčby anémie je nezbytné vyhodnocení klinické symptomatologie a současně se vyskytujících komorbidit s cílem určit, zda stav pacienta a/nebo závažnost anémie vyžadují její rychlou korekci krevní transfúzí. Pro léčbu symptomatické mírné až střední anémie pacientů s maligním onemocněním nemyeloidního typu, kteří podstupují chemoterapii, jsou v současnosti jako alternativa krevních převodů k dispozici ESP. V posledních letech došlo na základě systematického zhodnocení přínosu a rizik spojených s podáním ESP k výraznému zúžení indikace k jejich podání.
Přestože poslední metaanalýza studií s ESP neprokázala statisticky významný vliv na progresi nádoru a zvýšení mortality nemocných (7), zůstávají kritéria bezpečného podávání ESP na základě výsledků jednotlivých studií posuzujících mortalitu a progresi nemoci při léčbě ESP, ve shodě s doporučeními ASCO/ASH, EORTC, NCCN a EMA, opatrná:
1. ESP by měly být zvažovány pouze u pacientů s nemyeloidními malignitami v paliativní léčbě.
2. Hladina EPO v séru < 500 IU/l (maximální efekt lze očekávat u pac. s EPO pod 200 IU/l).
3. ESP by měly být podávány nemocným s cílem snížit počet krevních převodů a zlepšit kvalitu života.
4. Cílová hladina Hb by neměla přesáhnout 120 g/l.
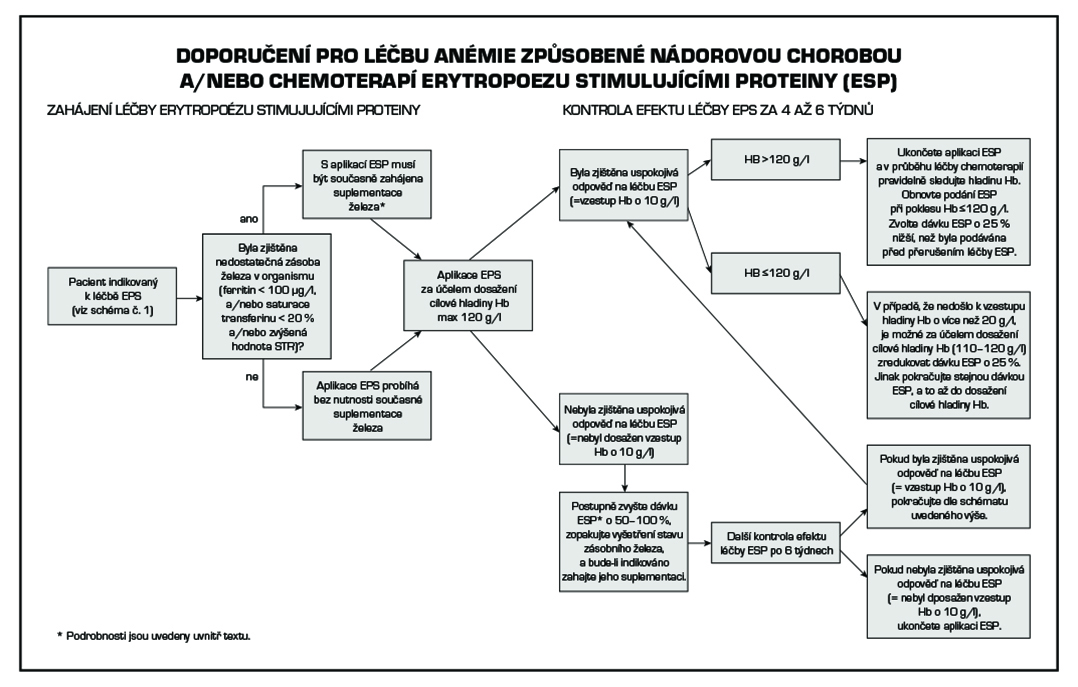
5. Léčba by měla probíhat za p.o. nebo i.v. suplementace železa s kontrolou saturace transferinu (ferritin může být ovlivněn základní chorobou) a solubilních transferinových receptorů (STR).
6. V průběhu léčby by měl lékař pamatovat na zvýšené riziko TEN – tromboembolické nemoci (7,5 % vs. 4,9 %).
7. Pokud je léčba ESP zahájena, měla by být podávána nejnižší účinná dávka, jež zabrání nutnosti podávání krevních převodů. Léčba by měla být ukončena u pacientů bez jednoznačné léčebné odpovědi po 6 týdnech.
8. Léčebná odpověď by měla být v závislosti na zvoleném přípravku pravidelně kontrolována po 4 až 6 týdnech léčby.
Před nasazením ESP by měl být pacient náležitě poučen o přínosech a rizicích ESP a podání krevních převodů a konečné léčebné rozhodnutí by mělo vycházet z pacientovy preference.
Data srovnávající jednotlivé preparáty s obsahem ESP neprokázala v souhrnu jednoznačnou přednost kteréhokoliv z přípravků v otázce účinnosti a bezpečnosti.
32.1.2 Suplementace železa
Při zvýšené hodnotě solubilních transferinových receptorů (STR) a hodnotě ferritinu < 100 mg/l, a/nebo saturaci transferinu < 20 % je nutné zahájení suplementace preparáty železa. Perorální podávání preparátů železa nedosahuje takové účinnosti, jako intravenózní aplikace železa. Intravenózní aplikace železa je však spjata s rizikem nežádoucích účinků, včetně alergické reakce, a proto je preferována až po selhání perorálních přípravků nebo v případě nutnosti rychlého doplnění zásoby železa v organismu (absorpce Fe ze střeva činí maximálně 15 % podaného množství). Absorpce železa je dokonalejší, je-li preparát podáván na lačný žaludek a je potencována nápoji s obsahem kyseliny askorbové (vitamín C, 70–100 mg), citrónové a jablečné. V případě parenterální aplikace železa je nezbytné vypočítat celkovou chybějící dávku Fe, aby nedošlo k předávkování organismu. Potřebná dávka Fe (mg) = (150 – pacientův Hb g/l) × tělesná hmotnost (kg) × 3.
Literatura:
- NCCN Clinical Practice Guidelines in Oncology™, Cancer and Chemotherapy Induced Anemia, V.2.2021. Dostupné z: http://www.nccn.org/professionals/
physician_gls/PDF/anemia.pdf. - Bokemeyer C, Aapro MS, et al.: EORTC guidelines for use of erythropoietic proteins in anaemic patiens with cancer: 2006 update. Eur J Cancer, 2007, 43, str.
258-270. - Buliková A. Anémie z poruchy syntézy hemu. In: Penka M, Buliková A, Matýšková J., et al. Hematologie I - neonkologická hematologie. Grada 2001, 1. vydání,
201 stran, str. 18-19. - Rizzo, D., J., Brouwers, M., Hurley, P. et al. ASCO/ASH Clinical Practice Guideline Update on the Use of Epoetin and Darbepoetin in Adult Patients with Cancer.
JCO, 28(33), 2010. str. 4996-5010. - Kleinová J. Anémie onkologicky nemocného. Interní medicína pro praxi, 2011;13 (Suppl.C), str. C20-C26.
- Aapro M, Jelkmann W, Constantinescu SN, Leyland-Jones B. Effects of erythropoietin receptors and erythropoiesis-stimulating agents on disease progression
in cancer.,Br J Cancer. 2012 ;106(7):1249-58.
32.2 Doporučení pro prevenci a léčbu neutropenie u pacientů léčených chemoterapií pro maligní nádorové onemocnění
Úvod a definice pojmů
Neutropenie je závažný nežádoucí účinek systémové protinádorové léčby, limitující její podávání. Komplikace vzniklé v důsledku neutropenie jsou spojeny s nárůstem morbidity, mortality, finančních nákladů na podpůrnou léčbu a při kurativním záměru protinádorové léčby mohou nepříznivě ovlivnit její celkový výsledek. Za komplikace neutropenie považujeme: I) febrilní neutropenii (FN), II) snížení relativní intenzity dávky (RDI) chemoterapie. Za určitých okolností je vhodné těmto stavům předcházet použitím růstových faktorů myelopoézy (G-CSF). Cílem tohoto doporučení je definovat racionální použití G-CSF pro prevenci a léčbu neutropenie u pacientů léčených chemoterapií pro maligní nádorové onemocnění (mimo myeloproliferativní choroby).
Dle WHO se rozlišují čtyři stupně neutropenie:
• G1 neutrofily v rozmezí 1,5–1,9 ×109/l
• G2 neutrofily v rozmezí 1,0–1,5 ×109/l
• G3 neutrofily v rozmezí 0,5–1,0 ×109/l
• G4 neutrofily v rozmezí < 0,5 ×109/l
I) Febrilní neutropenie je definována jako stav, kdy dochází ke vzniku teploty a/nebo jiných známek infekce v době poklesu počtu neutrofilů v periferní krvi pod 0,5×109/l (nebo 1,0×109/l s předpokladem dalšího poklesu). Teplotou se rozumí vzestup tělesné teploty na nejméně 38,3 °C (orální teplota); nebo teplota 38 °C a vyšší, přetrvávající déle než 1 hodinu; nebo vzestup teploty na nejméně 38 °C dvakrát během 24 hodin.
II) Snížení relativní intenzity dávky (RDI) chemoterapie. Ke snížení RDI dochází v důsledku redukce intenzity dávky chemoterapie (i jednotlivých cytostatik) a/nebo prodloužení intervalů mezi jednotlivými aplikacemi chemoterapie oproti původnímu plánu. Intenzita dávky = mg/m2/týden, relativní intenzita (%) je poměr mezi dosaženou (skutečnou) intenzitou dávky a plánovanou intenzitou dávky.
32.2.1 Použití G-CSF v profylaxi a léčbě febrilní neutropenie
Profylaktické použití G-CSF je racionální pouze v případě protinádorové léčby s kurativním záměrem nebo paliativní léčby prokazatelně prodlužující celkové přežití pacientů nebo dobu do progrese onemocnění. I v případě použití G-CSF k profylaxi FN by nemělo být opomenuto realizovat režimová opatření vedoucí ke snížení rizika výskytu infekce v době neutropenie, včetně sanace infekčních fokusů.
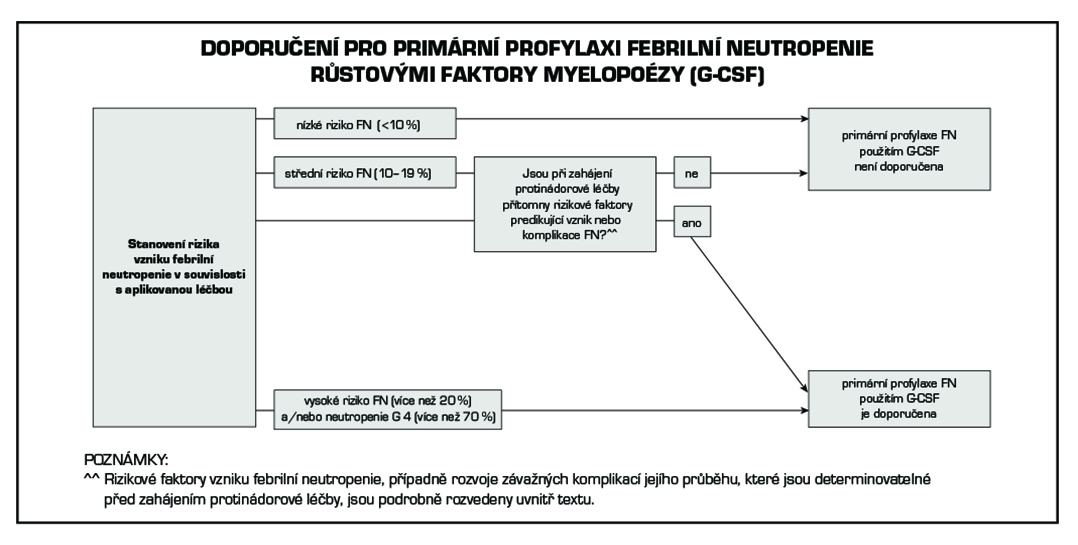
32.2.2 Primární profylaxe febrilní neutropenie
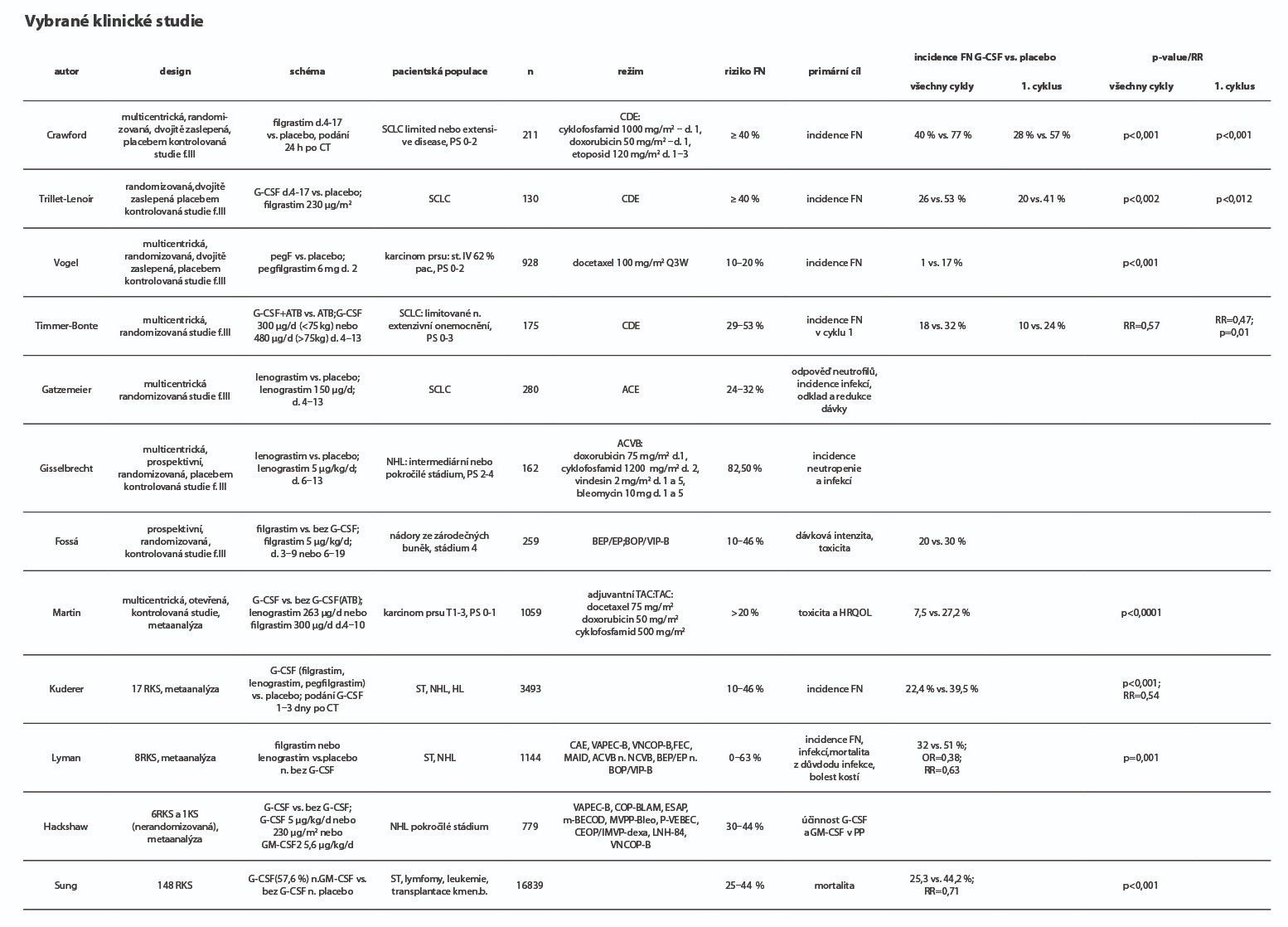
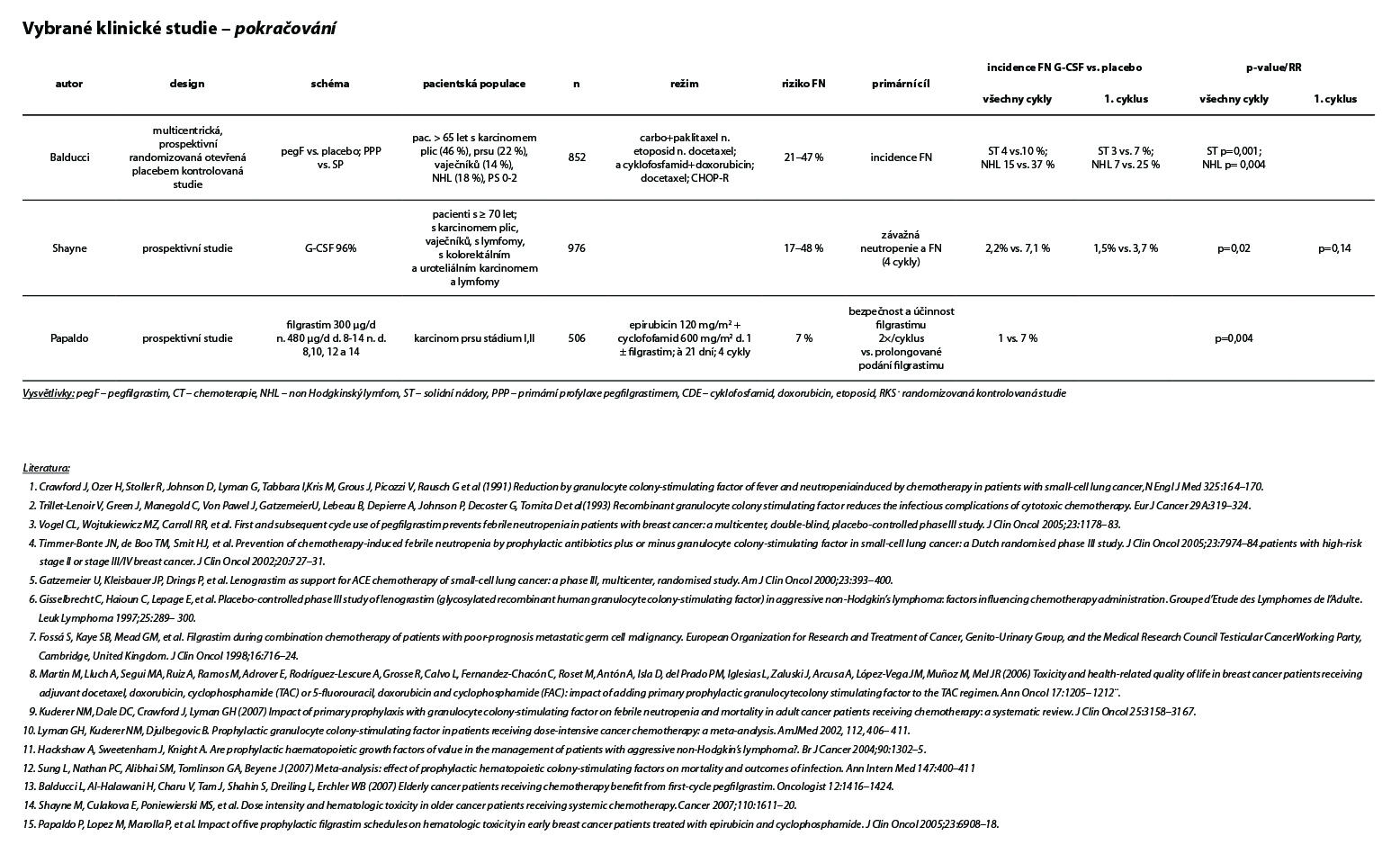
Riziko vzniku FN je individuální, výrazně však narůstá s výskytem rizikových faktorů, které mohou být spjaty s pacientem nebo souviset s aplikovanou léčbou. Profylaktickým použitím G-CSF je možné snížit riziko vzniku těžké neutropenie G4 a zkrátit dobu jejího trvání. V důsledku použití G-CSF může být celková incidence FN významně snížena. Relativní riziko vzniku FN u pacientů, jenž měli v primární profylaxi G-CSF, je oproti kontrolní skupině nižší, a pohybuje se nejčastěji v rozmezí 0,43 až 0,67. S tím souvisí i omezení nutnosti hospitalizace pacienta, aplikace empirické antibiotické léčby a další podpůrné léčby a v neposlední řadě i vznik život ohrožujících komplikací. Na straně druhé není rutinní použití G-CSF za účelem primární profylaxe FN opodstatněné, a to z několika důvodů: a) většina běžně používaných chemoterapeutických režimů není spojena s vyšším rizikem vzniku FN než 20 %, b) riziko vzniku FN je možné individualizovat na základě rizikových faktorů, c) finanční náklady spjaté s použitím G-CSF.
Vznik konkurenčního prostředí na trhu s G-CSF, který nastal v souvislosti s příchodem G-CSF v podobě tzv. biosimilars (podobných biologických přípravků), vede k významné redukci finančních nákladů na tuto podpůrnou léčbu.
Rizikové faktory vzniku febrilní neutropenie:
Febrilní neutropenie vzniká nejčastěji (až 74 % epizod) v průběhu prvních dvou sérií chemoterapie. Rozhodnutí o zahájení primární profylaxe FN G-CSF je možné stanovit na základě algoritmu, který obsahuje schéma č. 1. Jako první krok zhodnotíme rizikové faktory spjaté s plánovanou léčbou (myelotoxický potenciál a incidence febrilní neutropenie spojená s uvedeným režimem), následně rizikové faktory související se stavem pacienta.
Obecně platí, že primární profylaxe FN pomocí G-CSF je doporučena pro pacienty mající zvýšené riziko vzniku FN, případně i riziko komplikací jejího průběhu, u kterých je plánována léčba s vysokou incidencí FN a/nebo neutropenie G4. Jedná se například o dávkově denzní režimy, nebo i „standardní“ režimy s incidencí FN ≥ 20 % (nebo neutropenie G4 ≥ 70 % – režimy, kde není známé riziko FN). Naopak primární profylaxe FN pomocí G-CSF se nedoporučuje u nerizikových pacientů nebo při aplikaci chemoterapie s nízkým výskytem FN. Odkaz na podrobný seznam chemoterapeutických režimů s údaji o incidenci FN a neutropenie G3 a G4 naleznete na konci této kapitoly v seznamu literatury. Při rozhodování o zahájení primární profylaxe FN je nezbytné hodnotit všechny rizikové faktory. S ohledem na cíl a možnosti onkologické léčby je racionálním řešením využít v primární profylaxi neutropenie u paliativní léčby, zejména klade-li si za cíl pouze zmírnit symptomy nemoci, i jiné prostředky, např. redukci dávky chemoterapie nebo její odklad, použití jiného chemoterapeutického režimu s ekvivalentní protinádorovou účinností, ale s nižším rizikem vzniku FN.
Rizikové faktory vzniku febrilní neutropenie:
a) související s protinádorovou léčbou:
• myelotoxické chemoterapeutické režimy vedoucí k nadiru neutrofilů <0,5×109/l a k délce trvání neutropenie G4 > 5 dní
(pravděpodobnost vzniku teploty stoupá o přibližně 10 % s každým dnem, kdy je hodnota neutrofilů < 0,5×109/l),
• předpokládaný pokles neutrofilů < 0,1×109/l,
• samostatným rizikovým faktorem je nadir neutrofilů < 0,25×109/l a lymfocytů < 0,7×109/l,
• konkomitantní radioterapie,
• závažné poškození slizničních a kožních bariér (G3 a G4 toxicita).
b) související se stavem pacienta:
• přítomnost dvou a více závažných komorbidit (CHOPN, diabetes mellitus, srdeční selhávání nebo hemodynamicky nestabilní pacient (hypotenze, arytmie), špatný nutriční stav, přítomnost anemického syndromu, nízký PS – performance status, nedostatečné renální funkce (GFR < 30 ml/s), infiltrace kostní dřeně nebo předchozí radioterapie na rozsáhlou část osového skeletu, primární imunodefekt),
• věk ≥ 65 let,
• přítomnost otevřené rány, dočasných katetrů a/nebo akutní infekce,
• sepse/závažná infekce v období uplynulých 4 týdnů,
• vznik FN v průběhu hospitalizace,
• nedostatečná compliance pacienta.
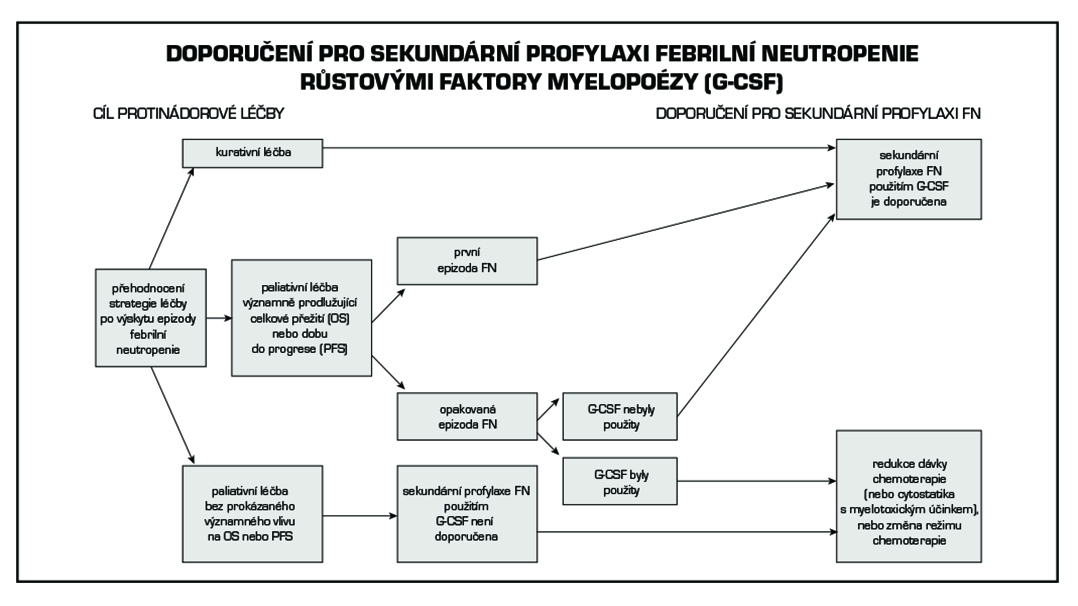
32.2.3 Sekundární profylaxe febrilní neutropenie
Proběhlá epizoda FN je samostatným rizikovým faktorem k výskytu dalších epizod FN v průběhu dané chemoterapie. S novou epizodou FN se zvyšuje i pravděpodobnost vzniku komplikací jejího průběhu, včetně dalšího prodloužení intervalů mezi jednotlivými aplikacemi chemoterapie a/nebo redukce intenzity dávky chemoterapie. Obecně platí doporučení použit G-CSF k sekundární profylaxi FN v případě kurativní léčby nebo paliativní léčby prokazatelně prodlužující celkové přežití pacientů nebo dobu do progrese onemocnění. U paliativní léčby by mělo použití G-CSF předcházet komplexním zvážení situace, kdy bereme v úvahu dobu do restituce myelopoézy, komorbidity pacienta, možnosti další protinádorové léčby, včetně zodpovězení si otázky, zda lze od redukce dávky hematotoxického cytostatika reálně očekávat zkrácení délky trvání a závažnosti neutropenie. S ohledem na cíl a možnosti onkologické léčby je racionálním alternativním řešením využít v sekundární profylaxi FN u paliativní léčby redukci dávky chemoterapie nebo její změnu za režim s nižší myelotoxicitou. Toto řešení je primárně voleno u paliativní chemoterapie, která si klade za cíl pouze zmírnit symptomy nemoci.
32.2.4 Léčba febrilní neutropenie
Není doporučeno rutinní užívání G-CSF v léčbě nekomplikované FN. Randomizované studie prokázaly, že podání růstových faktorů myeloidní řady zkracuje délku trvání neutropenie, zvyšuje léčebnou odpověď na antibiotický režim a v některých studiích také zkracuje délku hospitalizace. Nesnižuje úmrtnost na FN a nezkracuje dobu podávání antibiotik. Z aplikace G-CSF v době vzniku nebo v průběhu FN má prospěch pouze skupina nemocných s přítomností závažných komplikací nebo s rizikovými faktory jejich rozvoje.
Jedná se o nemocné s:
1) FN komplikovanou:
• multiorgánovým selháváním při septickém syndromu,
• kardiopulmonálním selháváním,
• generalizovanou mykotickou infekcí,
• zánětlivým plicním infiltrátem.
2) rizikovými faktory morbidity a mortality FN (v době vzniku/v průběhu FN):
a) související s protinádorovou léčbou:
• protrahovaná (>10 dnů) neutropenie <0,5×109/l,
• pokles neutrofilů <0,1×109/l,
• pokles CD4+ lymfocytů < 0,2×109/l.
b) související se stavem pacienta:
• přítomnost dvou a více závažných komorbidit (CHOPN, diabetes mellitus, špatný nutriční stav, přítomnost anemického syndromu, nízký PS – performance status, primární imunodefekt, zmatenost),
• věk >_ 65 let,
• vznik FN v průběhu hospitalizace,
• přítomnost otevřené rány, dočasných katetrů a/nebo akutní infekce,
• závažné poškození slizničních bariér (toxicity G3 a G4),
• nedostatečná compliance,
• renální selhání,
• hemodynamická nestabilita (hypotenze, arytmie),
• krvácení, DIC.
Poznámka:
Pokud febrilní neutropenie vznikne v době profylaktického podávání G-CSF, pak je-li podáván filgrastim pokračuje se dál v jeho aplikaci, pokud byl profylakticky použit pegfilgrastim, další G-CSF se již neaplikují.
32.2.5 Použití G-CSF v primární a sekundární profylaxi snížení relativní intenzity dávky aplikované chemoterapie (RDI)
Použití G-CSF v primární i sekundární profylaxi redukce RDI je racionální v případě protinádorové léčby s kurativním záměrem, a to pouze u těch diagnóz a/nebo chemoterapeutických režimů, kde již byla prokázána závislost mezi výsledkem léčby (délkou OS – celkové přežití, DFS – čas do progrese choroby) a dodržením plánované RDI (včetně dávkově-denzních režimů). Za účelem hodnocení intenzity dávky chemoterapie byl vytvořen projekt DIOS, který je dostupný na internetové adrese: http://dios.registry.cz. Projekt DIOS nabízí mimo jiné i možnost správně spočítat RDI.
32.2.6 Dávkování a způsob podání přípravků G-CSF
Výběr přípravku faktoru G-CSF závisí na rozhodnutí lékaře. V případě biosimilars byla u všech registrovaných přípravků (Accofil®, Biograstim®, Grastofil®, Nivestim®, Ratiograstim®, Tevagrastim®, Zarzio®) prokázána stejná biologická účinnost a zaměnitelnost s originálním přípravkem. Filgrastim (originální přípravek Neupogen®) a biosimilars G-CSF: 0,5 MIU (5 μg)/kg/den. Z důvodů růstové stimulace myeloidních buněk by první dávka filgrastimu neměla být podána v rozmezí 24 hodin před a 24 hodin po cytotoxické chemoterapii. Filgrastim může být podáván denně, upřednostňována je aplikace podkožní injekcí. Denní podávání filgrastimu by mělo pokračovat až do doby, než byla překonána nejnižší očekávaná hranice množství (nadir) neutrofilů a než se jejich počet vrátil zpět do normálního rozmezí. Pegfilgrastim (Neulasta®), lipegfilgrastim (Lonquex®): 6 mg/cyklus chemoterapie. U osob s hmotností 45 kg a vyšší je doporučená jednorázová podkožní aplikace pegylovaných filgrastimů 6 mg na jeden cyklus chemoterapie. Pegylovaný filgrastim by neměl být podán dříve než za 24 hodin po cytotoxické chemoterapii a zároveň ne později než 14 před zahájením dalšího cyklu léčby. Jeho použití je tak vhodnější u chemoterapie s 3týdenními cykly.
32.2.7 Nežádoucí účinky a kontraindikace použití G-CSF
Nejčastějším nežádoucím účinkem, který byl pozorován v souvislosti s podáváním doporučených dávek G-CSF byly bolesti pohybového systému mírné až střední intenzity. Tyto bolesti lze obvykle potlačit běžnými analgetiky. G-CSF nesmí být podávány pacientům se známou přecitlivělostí na účinnou nebo na kteroukoli pomocnou látku. Filgrastim nesmí být používán ke zvýšení dávky cytotoxické chemoterapie nad rámec ustanovených režimů dávkování. Filgrastim nesmí být podáván pacientům s těžkou vrozenou (kongenitální) neutropenií (Kostmanův syndrom).
Literatura:
- Aapro MS, Bohlius J, Cameron DA, et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of
chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours.,Eur J Cancer. 2011 ;47(1):8-32. - Klastersky J, Awada A. Prevention of febrile neutropenia in chemotherapy-treated cancer patients: Pegylated versus standard myeloid colony stimulating
factors. Do we have a choice?,Crit Rev Oncol Hematol. 2011;78(1):17-23. - Choi CW, et al. Early lymphopenia as a risk factor for chemotherapy-induced febrile neutropenia. Am J Hematol. 2003;73(4):263-6.
- Tomíška M, Burgetová D, Ráčil Z, Adam Z. Léčba infekcí u pacientů s maligními chorobami. In: Adam Z, et al. Obecná onkologie a podpůrná léčba, Grada
2003, pp 437-497. - NCCN Clinical Practice Guidelines in Oncology™, Myeloid Growth Factors, V. 2. 2022.
- Doporučený postup léčby febrilní neutropenie v Masarykově onkologickém ústavu v Brně.. http://www.mou.cz/file.html?id=103.
- Doorduijn JK, Buijt I, van der Holt B, et al. Economic evaluation of prophylactic granulocyte colony stimulating factor during chemotherapy in elderly patients
with aggressive non-Hodgkin‘s lymphoma. Haematologica. 2004 Sep;89(9):1109-17. - Vogel CL, Wojtukiewicz MZ, Carroll RR, etl. al. First and Subsequent Cycle Use of Pegfilgrastim Prevents Febrile Neutropenia in Patients With Breast Cancer:
A Multicenter, Double-Blind, Placebo-Controlled Phase III Study. J Clin Oncol 2005;23:1178-1184. - Cooper KL, Madan J, Whyte S, Stevenson MD, Akehurst RL Granulocyte colony-stimulating factors for febrile neutropenia prophylaxis following chemotherapy:
systematic review and meta-analysis., BMC Cancer. 2011 Sep 23;11:404.