Konference: 2004 XXVIII. Brněnské onkologické dny a XVIII. Konference pro sestry a laboranty
Kategorie: Maligní lymfomy a leukémie
Téma: Maligní lymfomy a leukémie
Číslo abstraktu: 130
Autoři: MUDr. Jana Marková; MUDr. Zdeněk Král, Ph.D.; Doc. MUDr. Petr Cieslar, CSc.; Prof. MUDr. David Feltl, Ph.D., MBA; MUDr. Heidi Móciková, Ph.D.; MUDr. Lenka Volková; prof. MUDr. Pavel Klener, DrSc.; doc. MUDr. Tomáš Kozák, Ph.D., MBA; prof. MUDr. Jiří Vorlíček, CSc., dr.h.c.
Onemocnění poprvé popsal v roce 1832 anglický patolog Thomas Hodgkin. Předpokládal, že masivní zvětšení krčních, nitrohrudních a abdominálních lymfatických uzlin a sleziny není reaktivní nebo zánětlivé etiologie, ale že se spíše jedná o nádorovou proliferaci. Na počátku 20. století Sternberg a Reedová popsali patognomonické tzv. Hodgkinovy–Reedové a Sternbergovy buňky (H/RS buňky). V té době převažoval názor o infekční etiologii choroby. V r. 1978 byly H/RS buňky poprvé izolovány a kultivovány in vitro. Teprve v r.1992 byl mikromanipulačními metodami a genovou biotechnologií prokázán monoklonální původ H/RS buněk a tím definitivně i jejich nádorový původ (destruktivními mutacemi geneticky poškozené monoklonální B lymfocyty germinálních center, neschopné produkovat imunoglobuliny a unikající apoptóze).
Paralelně s těmito převratnými laboratorními poznatky se díky pokrokům v oblasti léčby výrazně zlepšila prognóza těchto většinou velmi mladých pacientů, avšak do popředí začaly vystupovat pozdní následky léčby (plicní toxicita, kardiotoxicita, poruchy fertility, thyreopatie, psychosociální problémy a nejzávažnější – sekundární malignity).
Moderní techniky vysokovoltážní radioterapie v 60. letech min. století zaznamenaly vysoké procento vyléčení u pacientů s počátečními stadii onemocnění. Vývoj polychemoterapie MOPP otevřel novou éru v léčbě pokročilých stadií. Zklamání však přineslo zjištění, že další nová schemata konvenční polychemoterapie (ABVD, alternující MOPP/ABVD a hybridní schemata těchto kominací) nezlepšila celkové přežití v pokročilých stadiích. Teprve v poslední době nové principy chemoterapie s eskalaci dávky a intenzifikací času znamenají větší naděje na zlepšení kontroly tumoru a zvyšují procento přežití právě v nejrizikovější skupině pacientů.
Tabulka 1
Zavedení nových citlivých diagnostických metod (PET) umožňuje aplikovat léčbu podle odpovědi tumoru a významně snižuje „over treatment“ s nebezpečím dlouhodobých následků. Riziko sekundárních malignit (především leukémií) je ovlivněno individuální variabilitou enzymů důležitých při detoxikaci cytostatik. Také odlišná genetická výbava jednotlivých pacientů způsobuje rozdílnou náchylnost k těžkým pozdním následkům radioterapie.
Cílem léčby je dosáhnout maximální účinnosti s minimálním výskytem komplikací. Proto je nezbytné objasnit individuální charakteristiky biologie nádoru a dispozici ke vzniku závažných časných i pozdních následků léčby
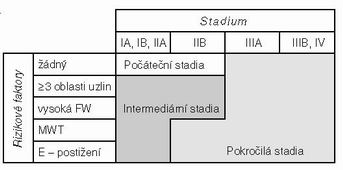
Alokace a definice terapeutických skupin podle DHSG – viz xls. Alokace (tab. č. 1)
Rizikové faktory HL (RF).
Podle Německé studijní skupiny HL (Deutsche Hodgkin Lymphom Studiengruppe – DHSG). Určují spolu se stadiem terapeutickou skupinu (počáteční – bez RF, intermediární a pokročilá – s RF).
a) MMT (≥ 1/3 maximálního průměru hrudníku)
b) Extranodální postižení
c) Vysoká FW (≥ 50 mm/h při A symptomech, ≥ 30 mm/h při B–symptomech)
d) ≥ 3 oblasti uzlin
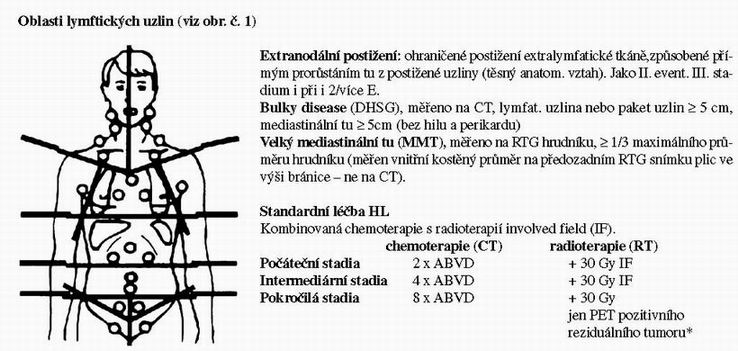
Poznámky:
- Vyjímka: LPHL(histologický subtyp lymfocytární
predominance) stadium IA bez rizikových faktorů: samotná RT 30
Gy
IF - *PET vyšetření se provádí u reziduálního tumoru > 2,5
cm (měřeného na CT)
- Otázka standardní léčby pokročilých stadií HL: chemoterapie ABVD považovaná za „zlatý standard“ má u pokročilých stadií 10 – 20% progresí (během léčby a do 3 m po léčbě) a dále 20 – 30% relapsů. Celkem u 40-50% pacientů během 10 letého sledování konvenční léčba selhává. Výsledky chemoterapie samotným ABVD, alternujícím M(C)OPP + ABVD nebo hybridními schematy M(C)OPP/ABV jsou stejné. O nový zlatý standard soutěží chemoterapie s intenzifikací dávky a/nebo času: BEACOPP a Stanford V (viz přehled randomizovaných studií léčby pokročilých stadií HL).
Pacienti s pokročilými stadii HL > 60 let. U pacientů bez komplikujících onemocnění je indikovaná kurativní terapie:
6–8 x ABVD + 30 Gy jen PET pozit. rezid. tumoru nebo 4 x (COPP + ABVD) + 30 Gy jen PET pozit. rezid. tu. U pacientů, kde vzhledem ke komorbiditě je nutno již primárně použít paliativní terapii je indikovaná především radioterapie: EF (extended field) RT u nodálního postižení (CS IIB, III) a u stadia IV 6 – 8 x COPP + 30 Gy jen PET pozit. rezid. tu.
Mezinárodní prognostický index pro pokročilá stadia (IPS – Hasenclever 1998)
7 rizikových faktorů, každý z nich zhoršuje prognózu o 7 – 8% při 5-ti letém sledování: věk > 45 let, mužské pohlaví, stadium IV, albumin < 40 g/l, hemoglobin < 10. 5 g/dl,
počet leukocytů > 15. 109/l počet lymfocytů < 0. 6. 109/l nebo 8%. Pozn: platí jen pro pokročilá stadia!!
Pokročilá stadia HL – strategie léčby v různých zemích
(randomizované studie)


Strategie léčby první recidivy Hodgkinova lymfomu
Po stagingu a histologickém ověření (CAVE: 10% progresí a 5% relapsů jsou NHL).
Recidiva po primární radioterapii (RT)
CSI/II, infield recidiva 6 x ABVD
CS I/II, outfield recidiva 4 x ABVD + IF RT
CS III/IV, in i outfield recidiva 8 x ABVD*
Recidiva po terapii počátečních stadií (po kombinované chemo-radioterapii)
Časná recidiva (méně než 1 rok po terapii) HDT + ASCT
Pozdní recidiva (více než 1 rok po terapii) 8 x ABVD*
Recidiva po terapii intermediárních stadií (po kombinované chemo-radioterapii)
Časná / pozdní recidiva HDT + ASCT
Recidiva po terapii pokročilých stadií (po kombinované chemo – radioterapii, event. jen chemoterapii)
Časná/pozdní recidiva HDT + ASCT
Recidiva po terapii LPHL st. I a II, bez RF (po samotné RT 30 Gy IF)
Časná/pozdní recidiva
Při recidivě, kterou je možno ozářit: RT.
Ostatní: konvenční polychemoterapie (8 x ABVD*), lépe Mabthera 4 x 375 mg/m
* DHSG: 8 x BEACOPP eskalovaný
U mladých pacientů s HL a s přáním mít děti se vedle běžných vyšetření nutných ke stanovení stadia a rizikových faktorů (iniciální staging) provádí opatření směřující k zachování fertility. U žen se provádí farmakologická ochrana gonád (FOG). Útlum folikulogeneze na prepubertální úroveň sníží senzitivitu ovariální tkáně k cytostatikům. Podávají se analoga GnRH. U žen, které mají stálého partnera je možno provést IVF (in vitro fertilizaci) s následným zmrazením embryí. Nevýhodou tohoto postupu je oddálení začátku chemoterapie při hormonální stimulaci vaječníků s odběrem oocytu a nebezpečí navození hyperkoagulačního stavu s projevy trombotizmu či DIC (ovariální hyperkoagulační syndrom v kombinaci ze změnami koagulace způsobenými samotným tumorem před a/nebo při zahájení chemoterapie) a v některých centrech zatím experimentálně kryokonzervace ovariální tkáně získaná laparoskopickým odběrem. U mužů kryokonzervace spermatu.
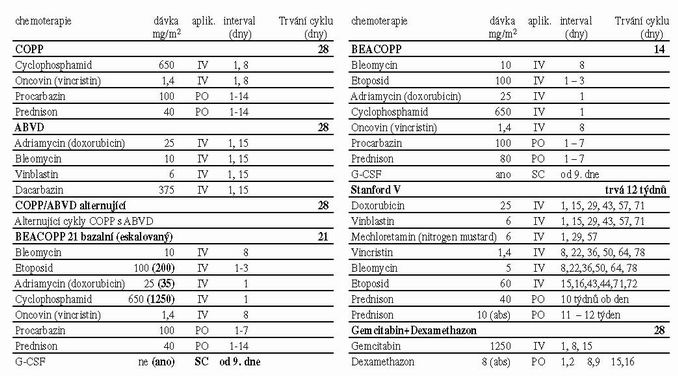
Tabulka 2
Závěr
Za pokroky v léčbě stojí obrovské úsilí předních světových onkologických pracovišť. Je důležité, aby péče o pacienty s HL (většinou velmi mladé) byla soustředěna do specializovaných center s možností komplexní onkologické péče s kvalitní mezioborovou spoluprací, zahrnující přesnou diagnostiku a odpovídající terapii, která může zaručit trvalé vyléčení a minimalizaci pozdních následků. Chemoterapie – schemata, viz. tab. č. 2
Podporováno grantem IGA NR/8033-6/2004
Datum přednesení příspěvku: 26. 5. 2004





