Jde o velice heterogenní skupinu metastatických nádorů, u kterých se v době diagnózy přes standardizovaný postup vyšetření nepodaří najít primární ložisko. Jedná se o 3–5 % všech malignit.
Podle histologického vyšetření jsou tyto nádory děleny na:
• Dobře a středně diferencovaný adenokarcinom (60 %),
• Špatně diferencovaný karcinom (včetně špatně diferencovaného adenokarcinomu) (25 %),
• Skvamózní (spinocelulární) karcinom (5 %),
• Nediferencovaný nádor (5 %),
• Karcinomy s neuroendokrinní diferenciací (5 %).
je nutná spolupráce s patologem se snahou blíže určit možný původ tumoru. Je třeba vyloučit neepitelový původ nádoru (především kurabilní lymfom, dále sarkom, melanom) a jiná potenciálně kurabilní onemocnění, zejména extragonadální germcell tumory, karcinom štítné žlázy, hormonálně dependentní karcinom prsu u žen, karcinom prostaty u mužů a některá další, kde je známa specifická léčba.
Asi 25 % pacientů s předpokládaným nádorem neznámého origa mělo v minulosti nějakou předchozí malignitu. V těchto případech je vždy třeba zvážit relaps předchozího nádoru. V nejasných případech se doporučuje komparativní sekvenování tkáně z předchozí malignity a nového nádoru k identifikaci jakýchkoli klonálních vztahů, a tedy k potvrzení nebo vyvrácení nové diagnózy.
Prognóza pacientů s diseminovaným nádorem neznámého origa jako celku je nepříznivá. Histologicky převažují adenokarcinomy, 50 % pacientů má mnohočetné postižení. Je možné vyčlenit dvě skupiny nemocných na základě klinických a patologických kritérií (viz schéma 1).
1. Příznivá prognóza – 10–20 % pacientů, specifické podtypy onemocnění, jde o chemosenzitivní, potenciálně kurabilní onemocnění, vhodným multidisciplinárním přístupem je možné dosáhnout dlouhodobé kontroly onemocnění u 30–60 % pacientů, medián celkového přežití je však horší než u diseminovaného onemocnění známého origa. Volba optimální léčebné strategie je pro dosažení dlouhodobého přežití zásadní.
2. Nepříznivá prognóza – většina pacientů, onemocnění je málo citlivé k podávané terapii a medián přežití je obecně zpravidla < 1 rok. I v rámci této skupiny je možné vyčlenit dvě odlišné podskupiny nemocných – skupinu s dobrým celkovým stavem (PS 0-1) a normální hodnotou laktátdehydrogenázy (LD), s očekávaným přežitím 1 rok a skupinu s PS ≥2 a/nebo zvýšenou LD. Je doporučována účast v klinických studiích, individuálně empirická systémová léčba nebo léčba symptomatická.
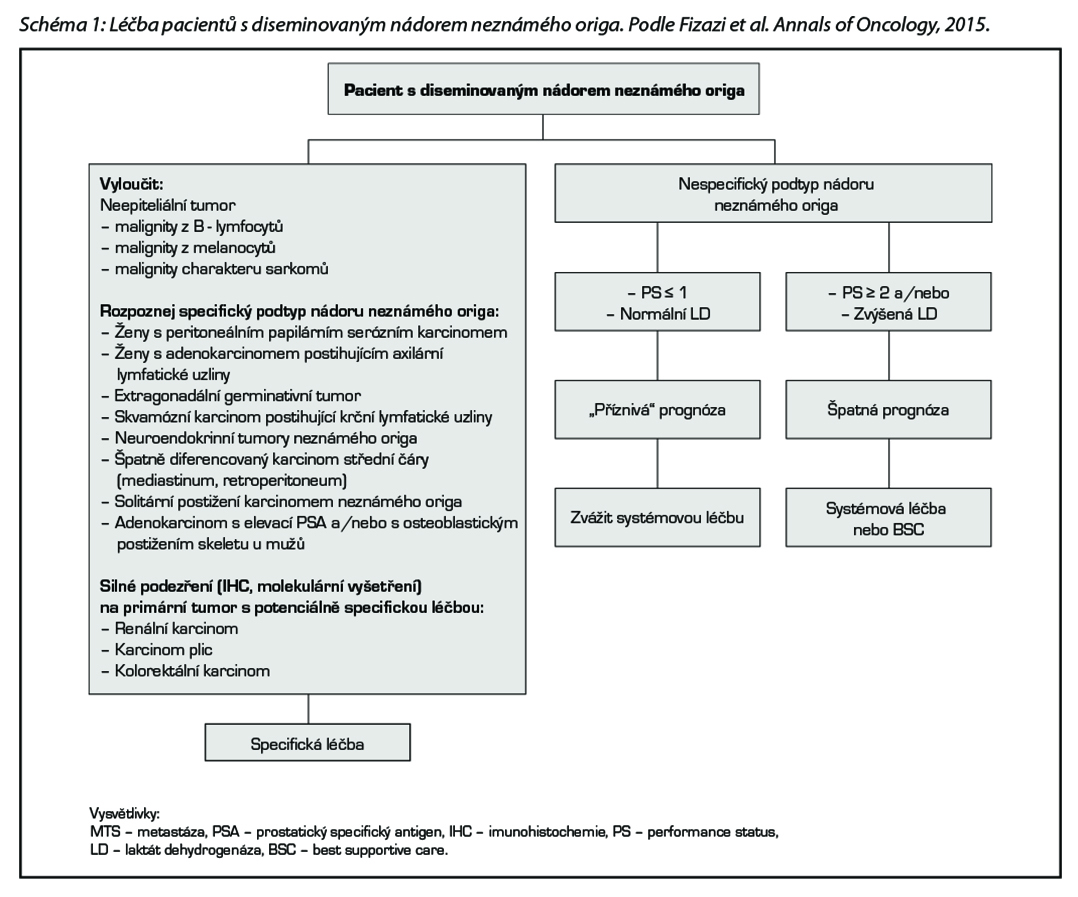
Postup by měl být zvážen vždy individuálně dle klinicko-patologického podtypu, do kterého pacient patří. Součástí léčebné strategie může být chirurgický výkon, radioterapie, systémová léčba (hormonoterapie, chemoterapie, imunoterapie a cílená léčba v indikovaných případech) a lokoregionální léčebné postupy (embolizace jaterní tepny, chemoembolizace, kryochirurgie jater, radiofrekvenční ablace aj.), psychosociální podpora. Systémovou léčbou chceme u těchto nemocných dosáhnout prodloužení přežití a zmírnění symptomů onemocnění. Léčbu volíme podle histologického typu onemocnění, očekávaného benefitu pro pacienta a profilu nežádoucích účinků dané kombinace. Pokud je dostupná vhodná klinická studie, měla by být pacientům nabídnuta.
Vzhledem k potenciálním možnostem léčby pomocí cílených terapií nebo imunoterapie by mělo být sekvenování nové generace (NGS-next generation sequencing) prováděno rutinně pomocí panelu pokrývajícího relevantní molekulární cíle. Kromě NGS by měla být provedena analýza stavu mikrosatelitní nestability (MSI). Testování nádorové mutační zátěže (TMB) a exprese PD-L1 by mělo být zváženo.
Data z randomizovaných studií k posouzení klinické užitečnosti přístupů založených na NGS u nádorů neznámého origa však zatím nejsou k dispozici. Klinický benefit NGS není tedy doposud přesně definován, proto by užití těchto technik mělo být zvažováno s ohledem na klinický stav pacienta, komorbidity a prognózu, nejlépe cestou Molecular tumor boardu s úmyslem dosáhnout nejlepšího možného léčebného výsledku pro konkrétního nemocného.
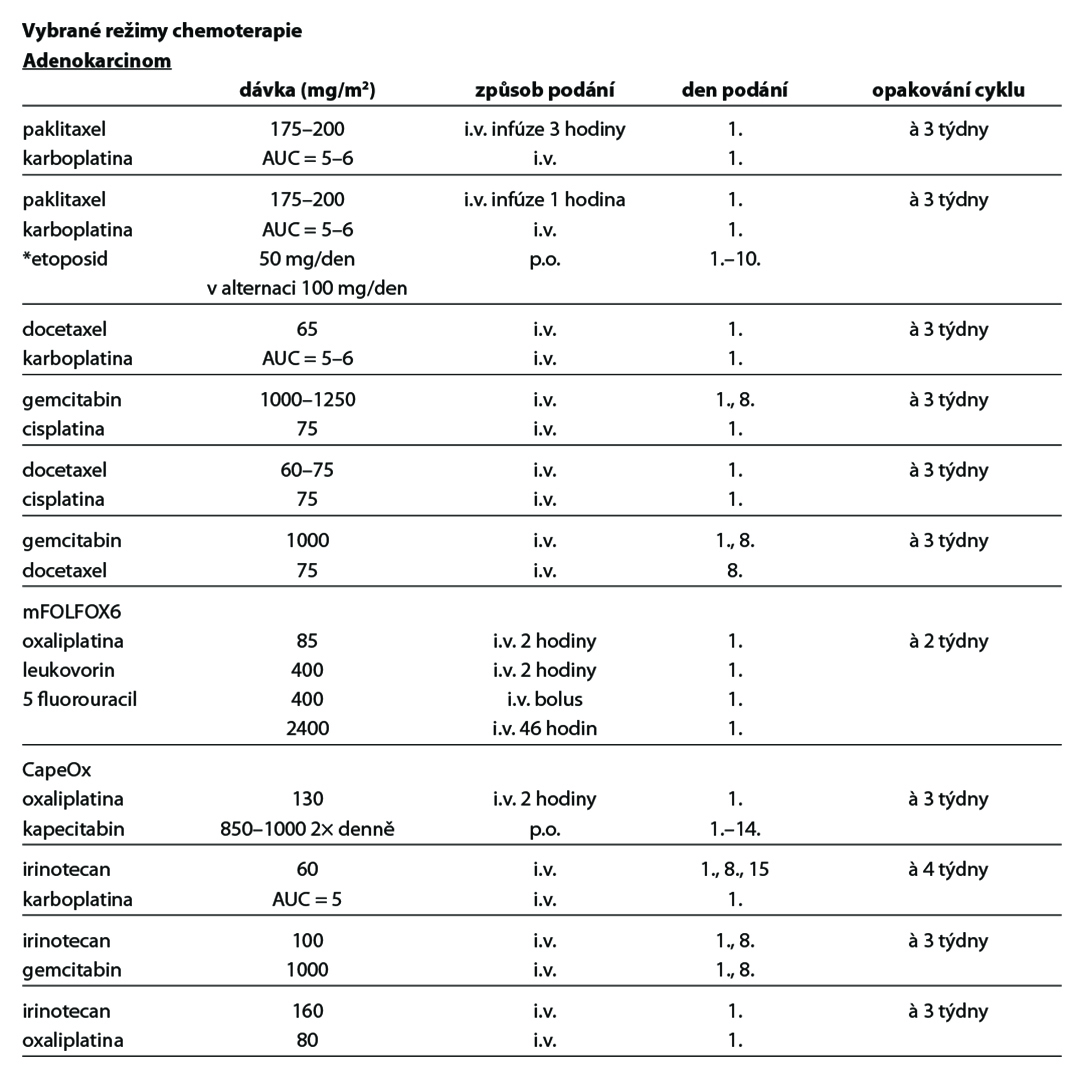
Léčba jednotlivých klinických variant postižení adenokarcinomem, spinocelulárním karcinomem a neuroendokrinním nádorem neznámého origa je uvedena v následujícím přehledu.
Adenokarcinom nebo karcinom blíže nespecifikovaný (anaplastický/nediferencovaný epiteliální nádor)
A. Lokalizované postižení
- Hlava a krk – léčit jako nádory hlavy a krku (krční disekce a/nebo radioterapie, pokročilá stádia indukční chemoterapie na bázi cisplatiny nebo kombinovaná chemo-radioterapie). Tkáň nádoru by měla být testována na expresi p16 a v případě pozitivity na stav lidského papilomaviru (HPV). U pacientů s relapsem onemocnění nebo vzdálenými metastázami je doporučeno vyšetřit expresi PD-L1 a stanovit stav viru Epstein-Barrové (EBV).
- Supraklavikulární (unilaterální nebo bilaterální) – léčit jako nádory hlavy a krku.
- Axily
a. Ženy – léčit jako karcinom prsu (axilární disekce, mastektomie nebo radioterapie na oblast prsu, adjuvantní chemoterapie/hormonoterapie),
b. Muži – disekce axilárních uzlin ± radioterapie ± chemoterapie.
- Mediastinum
a. < 40 let – léčit jako germinativní nádor vysokého rizika dle protokolu pro testikulární nebo ovariální nádory,
b. 40–50 let – léčit jako germinativní nádor vysokého rizika (testikulární tumory) nebo germinativní nádor (ovariální tumory) nebo jako nemalobuněčný plicní karcinom – konzultace s patologem,
c. ≥ 50 let – léčit jako nemalobuněčný plicní karcinom.
- Plicní ložiska – chirurgická resekce, pokud jsou resekabilní, neresekabilní – chemoterapie, stereotaktická radioterapie (SBRT), léčba symptomů.
- Pleurální výpotek – lokální léčba, při ER+/PR+ léčba pro karcinom prsu, ostatní případy – chemoterapie, léčba sympomů
- Peritoneum, ascites – histologie konzistentní s ovariálním karcinomem (serózní papilární adenokarcinom), negativní pro primární tumor jater – léčit jako ovariální karcinom (chirurgický debulking + chemoterapie taxan/platina), ostatní – chemoterapie, léčba symptomů. Při izolované peritoneální karcinomatóze je možno indikovat cytoredukční operaci ± hypertermickou intraperitoneální chemoterapii (HIPEC). Je doporučeno genetické testování mutace BRCA 1 a 2, v případě pozitivity PARP inhibitor.
- Retroperitoneální masa – histologie konzistentní s germinativním tumorem – léčit jako germinativní tumor vysokého rizika (muži) nebo germinativní nádor dle protokolu pro ovariální nádory (ženy), negerminativní nádor chirurgie ± radioterapie, chemoterapie pro selektované pacienty.
- Tříselné uzliny – jednostranné – disekce uzlin ± radioterapie ± chemoterapie, oboustranné – bilaterální disekce ± radioterapie ± chemoterapie.
- Játra – resekabilní – chirurgická resekce ± chemoterapie, neresekabilní – léčit jako diseminované onemocnění a/nebo lokoregionální léčba.
- Kosti – izolovaná nebo bolestivá léze, event léze s hrozící patologickou frakturou – chirurgická resekce pro hrozící frakturu (dobrý celkový stav) a/nebo radioterapie. Muži s blastickými MTS a elevací PSA v séru nebo IHC pozitivitou v tumoru – androgenní deprivace ± radioterapie.
- Centrální nervový systém – dle doporučení pro metastatické onemocnění CNS.
- V případě oligometastatického onemocnění je indikována lokální terapie (např. chirurgie/RT aj.)
B. Diseminované onemocnění
Individuálně systémová léčba, léčba symptomů.
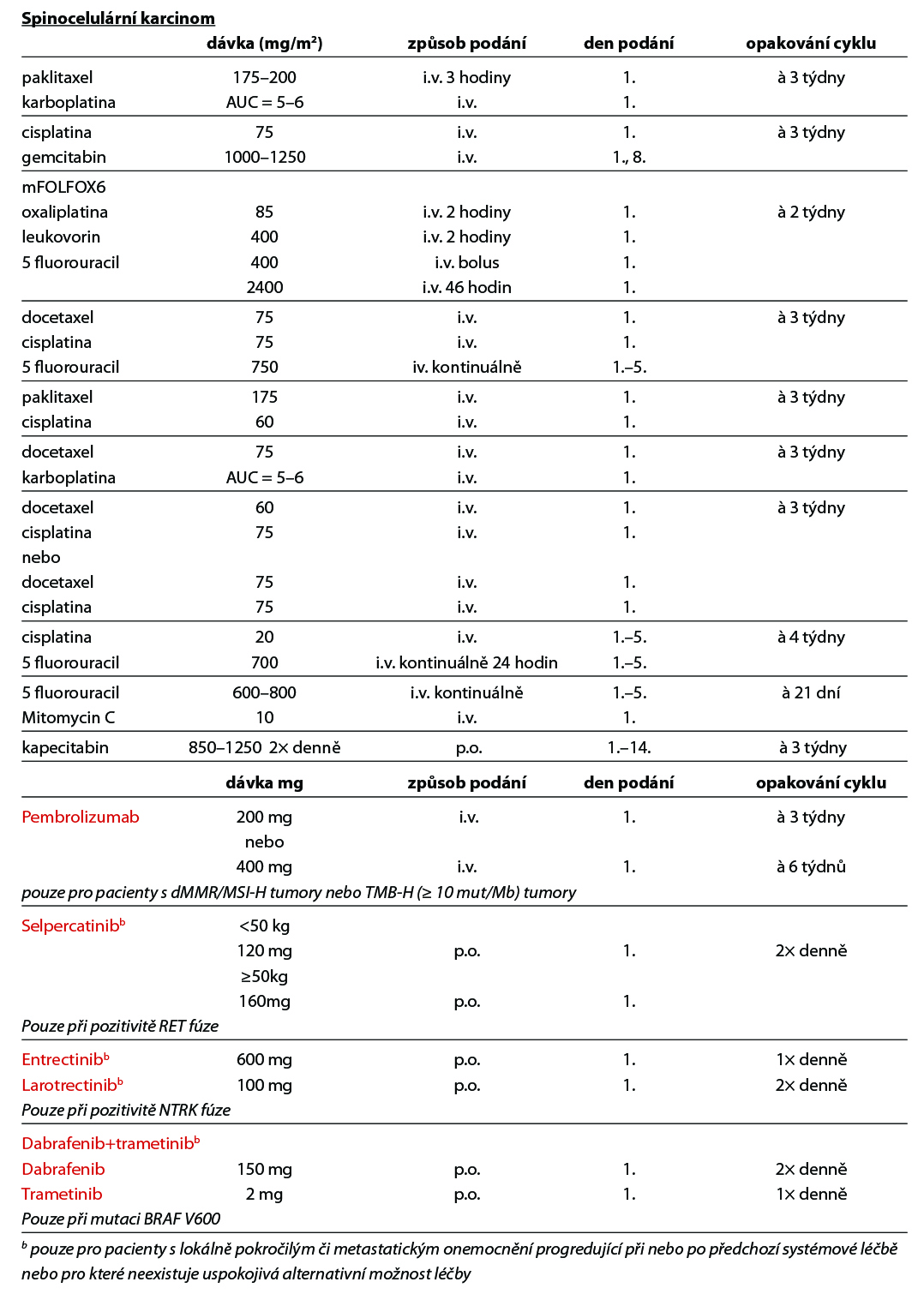
Spinocelulární karcinom
A. Lokalizované postižení
- Hlava a krk – léčit jako nádory hlavy a krku
- Supraklavikulární (unilaterální, bilaterální) – léčit jako nádory hlavy a krku
- Axily – disekce axilárních uzlin ± radioterapie ± chemoterapie
- Mediastinum – léčit jako nemalobuněčný plicní karcinom
- Mnohočetná plicní ložiska – chemoterapie, léčba symptomů
- Pleurální výpotek – chemoterapie, léčba symptomů
- Tříselné uzliny – unilaterální – disekce uzlin ± radioterapie ± chemoterapie, bilaterální – bilaterální disekce uzlin ± radioterapie ± chemoterapie (5-fluorouracil + cisplatina, 5-fluorouracil + Mitomycin C)
- Kosti – solitární, nebo bolestivá léze nebo hrozící patologická fraktura – chirurgická resekce (dobrý celkový stav) a/nebo radioterapie, mnohočetné postižení – individuálně chemoterapie, léčba symptomů
- Centrální nervový systém – dle doporučení pro metastatické onemocnění CNS
B. Diseminované postižení
Individuálně systémová léčba, léčba symptomů.
Neuroendokrinní tumory
a. špatně diferencovaný (high-grade nebo anaplastický) nebo malobuněčný typ jiný než plicní neuroendokrinní tumor – léčit jako malobuněčný plicní karcinom
b. dobře diferencovaný neuroendokrinní tumor – léčit jako karcinoid
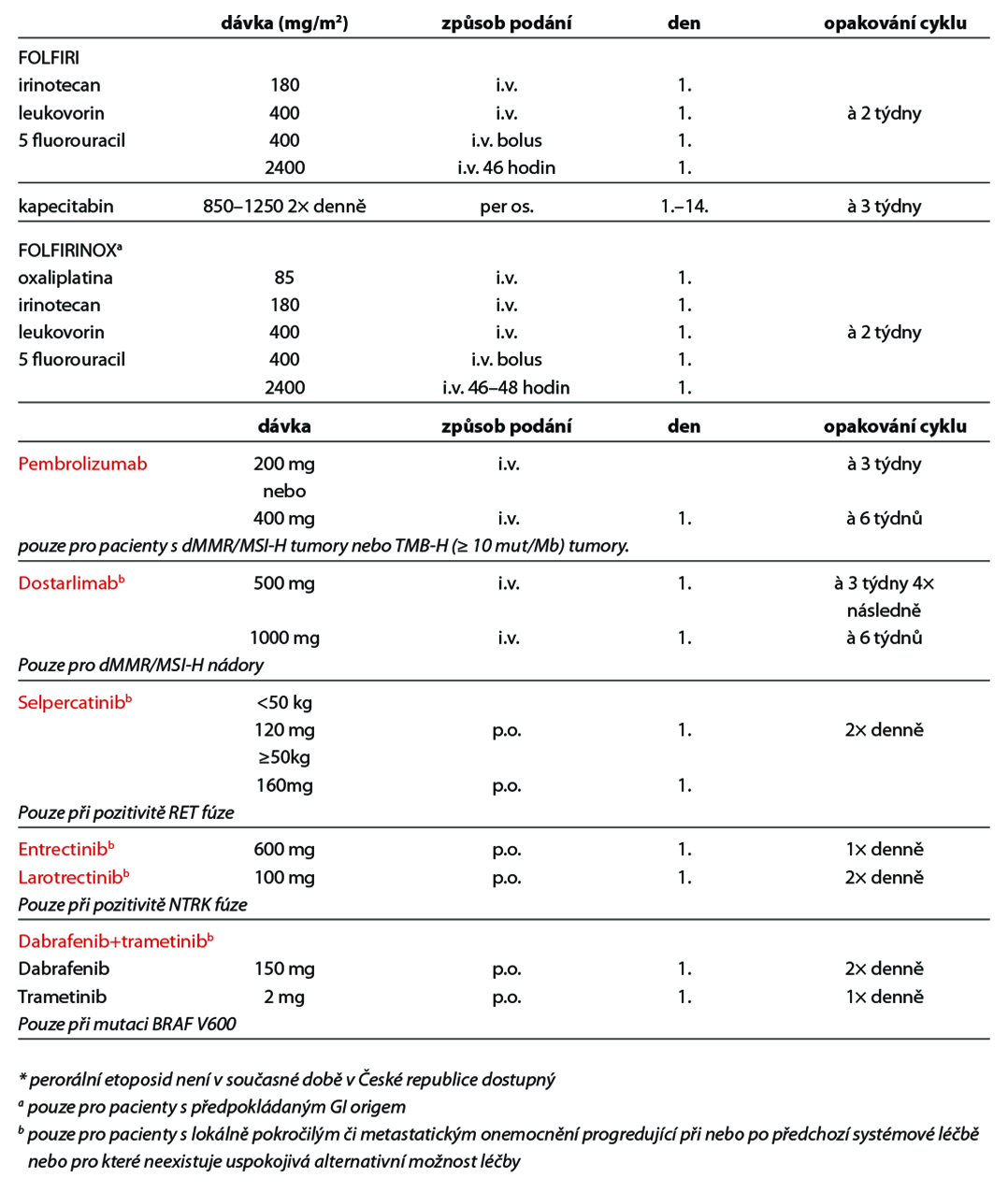
U pacientů s pozitivní fúzí NTRK se doporučuje léčba inhibitorem NTRK.
U pacientů s aktivační mutací EGFR, ALK a ROS1 fúzí se doporučuje léčba příslušným TKI.
U pacientů s mutacemi BRAF V600E může být možností léčba inhibitorem BRAF od druhé linie; Inhibitory BRAF mohou být zváženy jako léčba první linie, pokud jsou předpokládaným primem plíce. Pokud nejsou k dispozici žádné klinické studie ve druhé linii, lze jako alternativní možnosti zvážit molekulárně cílenou léčbu nebo imunoterapii.
Kromě nemocných s MSI-H nebo dMMR s podezřením na origo v colon, kteří mohou být léčeni imunoterapií v první linii, by měla být imunoterapie rezervována do druhé linie.
Aktuální úhradová pravidla jednotlivých léčiv je nutno sledovat na stránkách www.sukl.cz
Neuroendokrinní tumor
Léčebné režimy – viz kapitola neuroendokrinní nádory.
Sledování po léčbě:
U pacientů s nepříznivým typem nádoru neznámého origa, kteří absolvovali terapii, by měl být po ukončení léčby proveden restaging pomocí UZ, CT nebo MR dle lokality postižení a dále v 3měsíčních intervalech, za předpokladu, že je pacient způsobilý pro další terapii.
Pro pacienty s oligometastatickým onemocněním, kteří podstoupili lokální ablativní léčbu, nejsou stanovena žádná doporučení pro rutinní sledování. Vzhledem k tomu, že včasná diagnostika lokálního relapsu může umožnit další lokální ablativní léčbu, sledování pomocí UZ, CT nebo MR (dle lokality postižení) by mělo být prováděno v 3–6měsíčních intervalech během prvních 2 let, následované 6–12měsíčními intervaly v třetím až pátém roce sledování.
S ohledem na zvýšené riziko sekundárních malignit by pacienti, kteří dlouhodobě přežívají, měli absolvovat screening malignit doporučený pro běžnou populaci. Pokud rodinná anamnéza a/nebo molekulární vyšetření vedou k podezření na zárodečnou mutaci predisponující ke zvýšenému riziku vzniku malignity, mělo by být nabídnuto genetické poradenství a testování.
Pravděpodobnost přežití je v prvním roce kolem 20 %, 80 % nemocných má medián přežití je 3–10 měsíců. Celkové přežití je kratší u adenokarcinomu a nediferencovaného karcinomu ve srovnání se spinocelulárním karcinomem (1leté přežití <20 %, resp. 36 %). Zvyšující se věk je spojen s kratším přežitím. Pacienti s projevy zhoubných nádorů neznámého origa omezenými na lymfatické uzliny mají lepší prognózu než pacienti s extranodálním onemocněním.
U některých přeživších s tímto typem malignity se mohou následně vyvinout (a) původně skryté primární nádory odpovědné za jejich metastatické onemocnění nebo (b) druhé sekundární malignity. Tito nemocní mají zvýšené riziko pro rozvoj několika typů sekundárních malignit, přičemž nejvyšší rizika byla pozorována u zhoubných nádorů tenkého střeva, mužských pohlavních orgánů a aerodigestivního traktu. Významná rizika byla také pozorována pro rozvoj non-Hodgkinského lymfomu a spinocelulárního karcinomu kůže.
Literatura
- NCCN Clinical Practice Guidelines in Oncology. Occult Primary (Cancer of Unknown Primary [CUP]). Version 1/2024. Dostupné online na https://www.nccn.
org/professionals/physician_gls/pdf/occult.pdf - Krämer A, Bochtler T, Pauli C, Baciarello G, Delorme S, Hemminki K, Mileshkin L, Moch H, Oien K, Olivier T, Patrikidou A, Wasan H, Zarkavelis G, Pentherouda-
kis G, Fizazi K; ESMO Guidelines Committee. Cancer of unknown primary: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann
Oncol. 2022 Dec 15:S0923-7534(22)04769-X. doi: 10.1016/j.annonc.2022.11.013 - Fizazi K, Greco FA, Pavlidis N, et al. Cancer of unknown primary site: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann of Oncol
2015;26 (Suppl 5):133–38. - Varadhachary GR, Raber MN. Cancer of unknown primary site. N Engl M Med 2014;371:757-65.
- Kang S, Jeong JH, Yoon S, Yoo C, Kim KP, Cho H, Ryoo BY, Jung J, Kim JE. Real-world data analysis of patients with cancer of unknown primary. Sci Rep. 2021
Nov 29;11(1):23074. doi: 10.1038/s41598-021-02543-1.





