Definice paliativní péče
Paliativní péče je komplexní péče orientovaná na kvalitu života u pacienta, který trpí onemocněním v pokročilém nebo konečném stadiu. Cílem paliativní péče je zmírnit bolest a další tělesná a duševní strádání, při tvorbě plánu péče respektovat pacientova přání a preference, chránit jeho důstojnost a poskytnout podporu jeho blízkým.
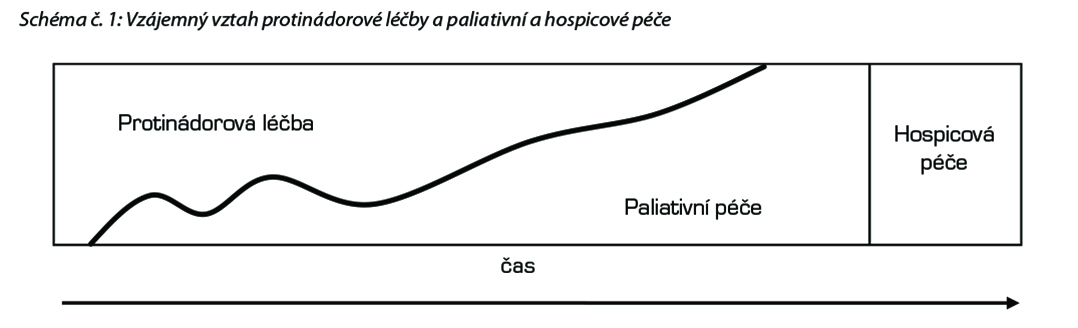
Dle doporučení ASCO a NCCN by komplexní paliativní péče měla být dostupná všem pacientům s pokročilým onemocněním současně se všemi modalitami protinádorové léčby zaměřenými na ovlivnění nádorové nemoci a na prodloužení přežití. V situaci, když byly možnosti protinádorové a život prodlužující léčby vyčerpány nebo si je pacient nepřeje, se paliativní péče stává hlavním léčebným přístupem. Vzájemný vztah nekurativní protinádorové léčby a paliativní péče v managementu pacientů s pokročilým onemocněním znázorňuje schéma č. 1.
Schéma č. 1: Vzájemný vztah protinádorové léčby a paliativní a hospicové péče
Obecná a specializovaná paliativní péče
Z hlediska komplexnosti se paliativní péče dělí na obecnou a specializovanou. Obecnou paliativní péči poskytuje v rámci své rutinní klinické práce ošetřující onkolog a ostatní zdravotníci. Specializovaná paliativní péče je poskytovaná lékařem specialistou v oboru paliativní medicína (paliatrem) a multiprofesním týmem (sestra, sociální pracovník, psychoterapeut, kaplan). Specializovaná paliativní péče může mít formu ambulance paliativní medicíny, konziliárního týmu paliativní péče, lůžkového oddělení paliativní péče nebo mobilní specializované paliativní péče. Paliativní péče poskytovaná pacientům v terminálním stádiu bývá označována jako péče hospicová.
Paliativní péče je součástí komplexní onkologické péče
• Včasné zapojení paliativní péče do komplexní onkologické péče má významný vliv na kvalitu ale i délku života.
• U všech onkologických pacientů je třeba aktivně zjišťovat potřebu paliativní péče (viz Identifikace pacientů s potřebou paliativní péče).
• Za zajištění náležité paliativní péče je zodpovědný ošetřující lékař-onkolog. Podle komplexnosti pacientových potřeb by měl onkolog rozhodnout, zda je pro pacienta dostatečná obecná paliativní péče nebo vyžaduje jednorázovou konzultaci nebo pravidelnou specializovanou paliativní péči.
• Ošetřující lékař onkolog by se měl podílet na zajištění paliativní péče i v situaci, kdy byly možnosti protinádorové léčby vyčerpány nebo ji pacient odmítl. Komplexní onkologická centra (KOC) by měla pacientům zajistit dostupnost specializované paliativní péče v rámci KOC a rozvíjet spolupráci s ostatními poskytovateli obecné a specializované paliativní péče na místní a regionální úrovni (např. lůžkové a mobilní hospice).
Identifikace pacientů s potřebou paliativní péče
Potřebu paliativní péče je třeba předpokládat u pacientů s pokročilým onemocněním v následujících klinických situacích:
1. obtížně zvládnutelné tělesné symptomy,
2. závažný psychický distres,
3. výrazné interní a psychiatrické komorbidity,
4. pacient odmítá protinádorovou léčbu a žádá výhradně symptomatickou paliativní péči,
5. opakované akutní ambulantní kontroly nebo hospitalizace pro komplikace pokročilého onemocnění,
6. předpokládaná prognóza přežití ≤ 1 rok,
7. specifické skupiny pacientů – mladí do 50 let a senioři nad 80 let.
Indikátory limitované prognózy
• druhý a vyšší relaps u pacienta léčeného nekurativní (paliativní) systémovou léčbou,
• metastatické onemocnění u nádorů rezistentních na systémovou léčbu,
• špatný celkový stav: ECOG≥3 nebo KI≤50%,
• mozkové a meningeální metastázy,
• recidivující hyperkalcémie,
• recidivující delirantní stavy,
• syndrom maligní střevní obstrukce,
• syndrom míšní komprese,
• progredující kachexie, pokles albuminu (25 g/l) a celkové bílkoviny,
• recidivující maligní výpotky (ascites, fluidothorax).
Cíle onkologické péče u pacientů s limitovanou prognózou
• Stav pacienta s předpokládanou prognózou kratší než 12 měsíců je třeba považovat za specifický klinický kontext, který je obecně označován jako závěr života (end of life). Ošetřující lékař by měl pacienta přiměřeným způsobem informovat o dalším předpokládaném průběhu onemocnění a společně s ním stanovit priority a cíle další léčby a péče. Významným cílem se stává udržení dobré kvality života.
• Před zahájením nekurativní (paliativní) systémové protinádorové léčby je pacienta třeba otevřeně informovat (na základě publikovaných studií a dostupné evidence), jaký může mít léčba vliv na délku a kvalitu života ve srovnání s komplexní symptomatickou paliativní péčí. Z hlediska prognózy přežití je užitečné pracovat se třemi kategoriemi: předpokládaná prognóza v řádu let, měsíců, týdnů, dnů. .
• V případě předpokládané prognózy délky přežití v řádu týdnů obvykle není pokračování v protinádorové léčbě pro pacienta prospěšné. Výlučným cílem léčby a péče by se mělo stát zmírnění symptomů a zajištění celkového komfortu v závěru života.
• U pacientů s předpokládanou prognózou přežití v řádu týdnů až několik měsíců je vhodné pacienty aktivně informovat o možnostech specializované paliativní péče (např. ambulance paliativní medicíny, mobilní nebo lůžkový hospic, oddělení paliativní péče atd.).
• Ošetřující lékař by měl pravidelně hodnotit způsob pacientovy adaptace na závažné onemocnění a otevřenou komunikací by měl podporovat adaptivní strategie zvládání nemoci. Současně by měl u pacienta pravidelně hodnotit přítomnost psychických symptomů např.:
– úzkosti, deprese, poruch spánku a deliria a aktivně je léčit s využitím nefarmakologických a farmakologických postupů
(viz Úzkost, Deprese, Delirium).
• U pacienta by mělo být provedeno komplexní zhodnocení sociální situace a sociálních potřeb a plán paliativní péče by měl tyto potřeby efektivně řešit.
• U každého pacienta by mělo být provedeno zhodnocení jeho spirituálních potřeb a role spirituální dimenze při zvládání závažného onemocnění. Plán paliativní péče musí tyto potřeby zohledňovat a s potenciálem duchovní dimenze pracovat.
Plán paliativní péče
U pacientů s ukončenou protinádorovou léčbou (v režimu symptomatické paliativní péče) je třeba společně s pacientem a jeho blízkými nově pojmenovat cíle péče a tomu odpovídající plán péče. Plán musí vycházet z hodnot a preferencí pacienta a současně zohledňovat reálně dosažitelné možnosti a cíle. Plán péče by měl řešit následující oblasti:
• Řešení aktuálních symptomů a klinických potíží .
• Učení, kdo bude pacienta nadále pravidelně sledovat (např. zda ošetřující onkolog, praktický lékař nebo ambulance paliativní medicíny).
• Jednoznačné určení, na koho se může pacient obracet v případě akutních obtíží a zhoršení stavu.
• Aktuální organizační zajištění péče (možnosti a limity pacientovy rodiny, využití externích služeb: pečovatelská služba, domácí péče, odlehčovací služby) a zajištění v případě budoucího zhoršení stavu.
• Plán zapojení domácí nebo lůžkové hospicové péče v závěru života
• Možnosti sociální podpory -např. příspěvek na péči, dlouhodobé ošetřovné, možnost zapůjčení pomůcek
• Plán využití život prodlužujících léčebných postupů v závěru života, které pro pacienty obvykle nejsou prospěšné (např.KPR, intubace, umělá plicní ventilace, přiklad do intenzivní péče, hemodialýza atd.) Preference ohledně nezahájení nebo odstoupení od těchto léčebných modalit je s pacienty vhodné dokumentovat formou tzv. dříve vysloveného přání. Formulování
cílů paliativní péče a plánu péče provádí obvykle multiprofesní tým paliativní péče. V případě jeho nedostupnosti jej tvoří ošetřující onkolog s ostatními podpůrnými profesemi (např. sociální zdravotník, psycholog)
Management nejčastějších symptomů pokročilého onemocnění
Nejčastějšími symptomy pokročilého onkologického onemocnění jsou bolest, dušnost, anorexie/kachexie, nevolnost, zvracení, celková slabost a únava, úzkost, delirium a deprese.
1. Bolest
Viz kapitola 32. Farmakoterapie nádorové bolesti.
2. Dušnost
Dušnost je subjektivní pocit nedostatku vzduchu a obtížného dýchání. Intenzita dušnosti nemusí korelovat s objektivními parametry ventilace ani pO2 a pCO2. Vyskytuje se u 40–70 % pacientů s pokročilým nádorovým onemocněním.
Nejčastější příčiny
• Akutní: plicní embolie, infekce, levostranná kardiální dekompenzace, pneumothorax, úzkost.
• Chronické: obstrukce dýchacích cest nádorem, pleurální výpotek, redukce funkčního parenchymu plic (např. atelektáza, mnohočetné metastázy, karcinomatózní lymfangoitida), anémie, slabost a únava dýchacích svalů při pokročilé kachexii.
Terapie – obecné principy
• Hledat příčinu a kauzálně řešit (chemoterapie nebo/a radioterapie u senzitivních nádorů, zavedení bronchiálního stentu, ošetření laserem, léčba infekce, úprava medikace, punkce/drenáž výpotku, terapie LMWH).
• V případě námahové dušnosti je důležitou součástí edukace pacienta, jak využít životní potenciál i s výrazným tělesným omezením (prioritizace aktivit, přiměřená zátěž, zajištění vhodných pomůcek: např. koncentrátor kyslíku, invalidní vozík atd.).
Nefarmakologická léčba
• V případě hyposaturace O2 lze aplikovat O2 nosními brýlemi nebo maskou.
Farmakologická léčba
1. Opioidy
• Čistí agonisté μ receptorů (morfin, fentanyl, hydromorfon) mají při mírnění dušnosti podobný účinek. Nejvíce zkušeností je s morfinem.
• Morfin snižuje nadměrné respirační úsilí a podstatně snižuje ventilační reakce na hypoxii a hyperkapnii a také úzkost.
• Morfin nezpůsobuje retenci CO2 nebo klinicky významnou depresi dechového centra, pokud je správně dávkován.
Dávkování:
• U pacientů, kteří dosud opioidy neužívají Morfin 2,5–5 mg s. c. nebo 5-10 mg p. o. 3–4 denně.
• U pacientů na chronické terapii opioidy pro bolest: navýšit denní dávku o 20–30 %. nebo k zavedené dávce přidat morfin 10 mg p.o. 3–4× denně.
2. Benzodiazepiny
• Podáme k zmírnění úzkosti spojená s dušností (preparáty a dávkování viz Úzkost).
• U pacientů v terminální fázi s refrakterní dušností a úzkostí někdy přistupujeme k tzv. paliativní farmakologické sedaci: kontinuální infuzi midazolamu 20–100 mg/24 h s.c. nebo i.v. Dávku titrujeme do dosažení dechového komfortu. Problematika paliativní sedace a podmínky pro její bezpečné a legální provedení je uvedena v samostatném odstavci.
3. Kortikosteroidy
Podáváme tam, kde předpokládáme bronchokonstrikci, edém kolem nádoru nebo karcinomatosní lymfangoitidu. Obvyklé počáteční dávky jsou:
• Dexamethason 8–16 mg s.c./ i.v nebo p.o.
• Methylprednisolon 40 mg i.v., 16–32 mg p.o.
• Prednison 20–40 mg p.o.
Podání kortikoidů by mělo mít vždy charakter časově ohraničeného terapeutického pokusu. Při dosažení klinického zlepšení dávku postupně snižujeme na nejnižší ještě účinnou dávku. Pokud není zřetelný klinický efekt do 7 dní od zahájení, léčbu kortikoidy ukončíme.
4. Bronchodilatancia
U pacientů s prokázanou CHOPN je třeba optimálně nastavit bronchodilatační léčbu. Standardem je užití LABA (long acting beta 2 agonists, např.formoterol, salmeterol) nebo LAMA (long acting muscarinic antagonists, např.aklidinium, glykopyrronium) nebo kombinovaná léčba LABA/LAMA. U pacientů s častými exacerbacemi a s fenotypovým překryvem s astma bronchiale (AB) jsou podávány inhalační kortikoidy.
U pacientů s anamnézou nikotinismu, s klinickým nálezem bronchospasmu (bez formálního průkazu CHOPN nebo AB) lze provést terapuetický pokus s krátkodobě působícími bronchodilatancii
Beta 2 – sympatomimetika
• Salbutamol 100–200 μg inhalačně – možné opakovat
• Fenoterol 50–100 μg inhalačně 2–4× denně
Anticholinergika
• Ipratropiumbromid 20–40 μg inhalačně 2–4× denně
5. Methylxantiny
• Aminophyllin 240 mg i.v. 1–3× denně;
• Theophyllin 100–400 mg p.o. 2× denně
6. Mukolytika
Přítomné obtížné vykašlávání a/nebo poslechový nález svědčící pro přítomnost hlenu v dýchacích cestcáh
• Acetylcysteinum 200–400 mg p.o. 3× denně
• Erdostein 300 mg p.o. 2–3× denně
• Ambroxol 30 mg p.o. 3× denně, 15–22 mg inhalačně 2× denně
7. Diuretika
Je přítomná retence tekutin nebo kardiální selhávání
• Furosemid 20–120 mg i.v., nebo 20–125 mg 1–2× denně p.o. (nejlépe ráno)
• Furosemid inhalačně (20–40 mg/ během 10–15 minut nebulačním setem) prokázal významné snížení dušnosti a zlepšení
objektivních ventilačních parametrů u pacientů s těžkou exacerbací CHOPN, astma bronchiale ale také u dušnosti pacientů v terminálních stádiích onkologických chorob
8. Anticholinergika
Chrčivé dýchání v terminální fázi
• Butylskopolamin (Buscopan) 20–40 mg s.c. , i.v. 3–4× denně snižuje tvorbu bronchiální sekrece
3. Anorexia kachexie
Syndrom nádorové anorexie a kachexie (CACS) je komplexní syndrom charakterizovaný nechutenstvím a progresivní, nedobrovol nou ztrátou hmotnosti a zhoršením funkčního stavu. , CACS zpravidla není odstranitelný pouze konvenční nutriční podporou. Nádorová anorexie a kachexie komplikuje protinádorovou léčbu, snižuje kvalitu života a celkové přežití. Přibližně 25−30 % onkologických pacientů umírá v souvislosti s kachexií, nikoliv na progresi nebo komplikace nádorového onemocnění. Incidence je nejvyšší u nádorů horní části gastrointestinálního traktu (jícen, žaludek, pankreas), nádorů v oblasti hlavy a krku a u karcinomu plic. Obecně je CACS přítomen u 70−90 % pacientů s pokročilými nádory.
Terapie
Nutriční podporu je třeba zasadit do kontextu celkového léčebného plánu. S pacientem a jeho blízkými je třeba na základě klinického stavu, předpokládané prognózy přežití a pacientových přání a preferencí pojmenovat cíle další léčby a péče. Indikaci dietních opatření, enterální a parenterální výživy je třeba posoudit právě s ohledem na cíle péče. Indikace jednotlivých forem nutriční podpory jsou zpracovány v kapitole 28. Snažíme se ovlivnit možné vyvolávající příčiny:
• Časný pocit sytosti – metoclopramid 10 mg 3× denně p.o.
• Xerostomie – dostatek tekutin, umělé sliny, magistraliter přípravky s pilokarpinem.
• Dysgeusie – anestetika do dutiny ústní (např. Procain gel, Lidocain sprej).
• Mucositida – antiseptické roztoky (např. Caphosol, Gelclair).
• Soor – antimykotika (flukonazol, itraconazol, magistraliter přípravky s nystatinem, clotrimazol).
• Deprese – , antidepresiva, např. mirtazapin 15–30 mg p.o.
• Bolest – viz kapitola 32 Farmakoterapie nádorové bolesti.
Nefarmakologická intervence
• Zrušit neúčelná dietní opatření.
• Jíst po malých porcích 6–8× denně.
• Upravit konzistenci stravy podle typu převažujících obtíží, zlepšit atraktivitu jídla.
• Omezit intenzivní vůně teplé stravy při přípravě a konzumaci.
• Jíst v klidu, pomalu nejlépe ve společnosti blízkých nebo personálu.
• Udržet přiměřenou fyzickou aktivitu během dne.
Farmakoterapie k ovlivnění chuti k jídlu
Kortikosteroidy: rychlý nástup účinku během 2–3 dní, efekt přetrvává 4–6 týdnů, poté obvykle klesá. Léčba anorexie má vždy charakter terapeutického pokusu. Pokud po nasazení níže uvedených dávek nedojde během 3–5 dnů ke klinicky významnému zlepšení, kortikoidy vysazujeme. Při dlouhodobém užité je doporučována deeskalace na nejnižší ještě účinnou dávku. Obvyklé počáteční dávky:
• Dexamethason 4–8 mg denně p.o.
• Prednison 20–40 mg denně.
Megestrolacetát: 500–800 mg (3–5 tbl. nebo 15–20 ml orální soluce) denně v ranních a dopoledních hodinách, vede ke zlepšení apetitu u 70 % nemocných, neprodlužuje ale přežití a zvyšuje riziko tromembolických komplikací. Účinek na apetit je dlouhodobý. U pacientů s delší prognózou přežití (v řádu měsíců až let) by měl mít přednost před kortikoidy. Mirtazapin 7,5–30 mg večer p.o. (výhodný zejm. u pac. s poruchami spánku, nevolností, úzkostí).
Terapie anorexie u pacientů v terminálním stadiu (prognóza dny–několik týdnů)
• Pacient obvykle nemá hlad ani žízeň. Při volbě diety se řídíme zcela pacientovými preferencemi. Neplatí žádná dietní omezení.
• Nutná citlivá komunikace s pacientem a rodinou: nepřítomnost hladu a žízně je přirozeným projevem umírání a sondová enterální ani parenterální výživa nemají významný vliv na délku ani kvalitu života. Umírající pacient není schopen dodané živiny utilizovat.
• Vhodné je podávání tekutin po lžičkách, pokud má pacient pocit žízně.
• Někdy lze zvážit bazální parenterální hydrataci (500–1000 ml fyziologického roztoku) podávaného i.v. nebo s.c. (hypodermoklýza).
• Péče o dutinu ústní čištění a svlažování má významný vliv na pocit celkového komfortu.
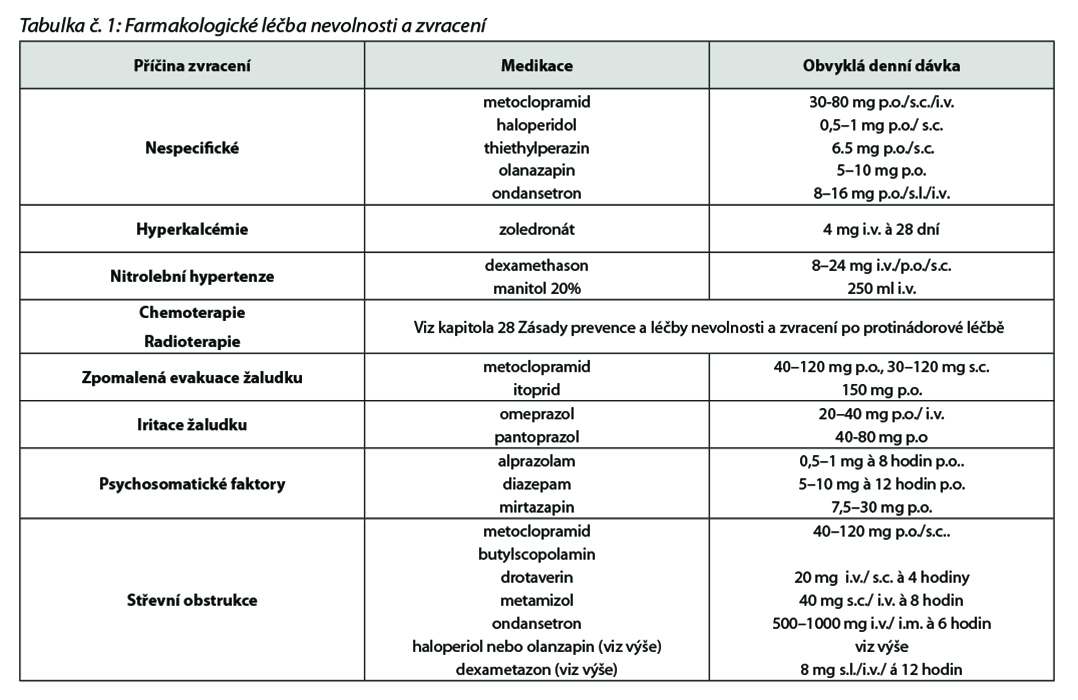
Nevolnost a zvracení
Nejčastější příčiny
• Gastrointestinální – střevní obstrukce, zpomalená evakuace žaludku, tenzní ascites.
• Metabolické – hyperkalcémie, renální selhání.
• Nitrolební hypertenze – metastatické postižení mozku.
• Toxicita léků – opioidy, antibiotika, antimykotika, NSAID, dioxin.
• Komplikace léčby – radioterapie, chemoterapie.
• Algický syndrom.
• Psychosomatické faktory – úzkost, strach.
Management – obecné principy
Hledat příčinu a kauzálně řešit.
Nefarmakologická terapie
• Vyhýbat se intenzivním vůním a pachům.
• Jíst často a menší porce, poloha vsedě, volný oděv netěsnící na krku a břiše.
• Omezit tučná, smažená a kořeněná jídla.
Farmakologická terapie
viz tabulka č. 1
ZÁCPA
Zácpa je definována jako nepravidelné, obtížné a bolestivé vyprazdňování tuhé stolice. Často je spojena s pocitem plnosti, nadýmáním, nechutenstvím, diskomfortem v dutině břišní, v pánvi a konečníku. Je přítomna až u 50 % hospitalizovaných pacientů s pokročilým nádorovým onemocněním.
Terapie
• Nejlepší léčbou je prevence.
• Režimová opatření (dostatek vlákniny ve stravě, dostatek tekutin, přiměřený pohyb).
• Revize pravidelné medikace. Zácpu mohou působit např. opioidy, setrony, beta blokátory, spasmolytika.
Farmakoterapie (projímadla)
Osmotická projímadla: neresorbovatelná, osmoticky aktivní léčiva váží v lumen střeva vodu a stimulují sliznici k sekreci vody a elektrolytů. Nutné podávat s dostatečným množstvím tekutin.
• Laktuloza 10–20 ml 2–3× denně, CAVE flatulence nevolnost, křeče v břiše u 20 % pacientů.
• MgSO4 1 polévková lžíce (2–4 g) do 100 ml vody denně p.o., CAVE průjem s následným minerálovým rozvratem, neužívat dlouhodobě.
• Macrogol (Forlax) – 1 sáček (10 g) do 100 ml vody 1 až 3 × denně.
Stimulační projímadla: Stimulují myenterickou pleteň ve střevě, aktivují peristaltiku.
• List senny Čaj s listu senny 1 šálek na noc
• Bisakodyl 5–10 mg p.o. , p.r. 1× denně večer.
• Pikosulfát sodný 5 mg p.o. 1× denně večer.
Změkčovadla stolice k rektální aplikaci
• Glycerinový čípek
• HVLP Klysma salinické
Specifické postupy v léčbě zácpy navozené opioidy
• Naloxegol – periferní antagonista opioidních receptorů, který neprostupuje přes hematoencefalickou bariéru. Doporučené dávkování: 1 tbl. à 25 mg denně.
• Rotace z původního opioidu na ekvianalgetickou dávku kombinovaného preparátu oxycodon a naloxon.
Léčba rezistentní zácpy
• Aplikace olivového oleje 10–15 cm do konečníku cestou katetru, ponechat několik hodin. Kombinace osmotických a stimulačních laxativ a rektálních projímadel. Pokud není efekt, je třeba zvážit podání rektálního nálevu.
Manuální vybavení stolice
• V případě obturace konečníku tuhou stolicí je někdy třeba provést manuální vybavení stolice.
• Procedura bývá pro pacienty velmi nepříjemná. Je proto vhodné provedení v analgosedaci (morfin 10 mg, midazolam 2–5 mg).
Únava, celková slabost
Prevalence únavy a slabosti kolísá podle typu a pokročilosti nádorového onemocnění a jeho léčby mezi 60–96 %. Na vzniku únavy se obvykle současně podílí více faktorů.
Terapie
Řešení vyvolávajících faktorů musí odpovídat aktuálnímu stavu a prognóze pacienta.
• Zaměřujeme se na adekvátní léčbu bolesti, emočního distresu, deprese, výživy, anémie.
• Druhým krokem jsou specifické nefarmakologické a farmakologické intervence, podpora pacienta, aby šetřil s energií cestou prioritizace aktivit, střídáním aktivity a odpočinku, rozptýlení pomocí zálib a strukturovaných denních aktivit. Příznivý efekt prokázala pravidelná tělesná aktivita (procházky, rozcvičky, cvičení na rotopedu atd.) a to rovněž u pacientů s velmi pokročilým onemocněním.
Farmakoterapie zahrnuje antidepresiva a nízké dávky kortikoidů. Efekt kortikoidů (dexametazon 4–8 mg/den) je komplexní a je spojen se zlepšením příjmu potravy a zmírnění kachexie. Při delším užívání kortikoidů (≥ 1 měsíc) nabývají na významu jejich nežádoucí účinky (především slabost dolních končetin při steroidní myopathii). Několik studií prokázalo přínos psychostimulancií, především methylfenidátu (Ritalin) v dávce 10–30 mg denně na celkový pocit energie a výkonnosti.
Poruchy spánku
U pacientů s pokročilým onemocněním je etiologie poruch spánku většinou multifaktoriální. Nejdříve třeba individuálně stanovit, zda délka a kvalita spánku představují pro pacienta a jeho blízké problém, který je třeba řešit. Základním krokem v terapii nespavosti je odstranění vyvolávající/zhoršující příčiny. Může se jednat např. o bolest, svědění, dušnost, strach, úzkost a depresi. Spánek může být nepříznivě ovlivňován medikací (např. kortikoidy, hormonální léčba, kofein, teofylin) nebo syndromy z odnětí (např. hypnotika, benzodiazepiny, opioidy, alkohol, nikotin).
Nefarmakologická léčba
• Nefarmakologická léčba zahrnuje 3 základní přístupy – spánkovou hygienu, kontrolu stimulů a spánkovou restrikci. Nezbytná je léčby všech rušivých nočních stimulů (např. bolest, dušnost, svědění). Spánková restrikce znamená snahu o minimalizaci pobytu na lůžku a spánku v denní době. Velmi významný efekt na nespavost prokázala pravidelná denní fyzická aktivita. Je však vždy nutné zohlednit aktuální možnosti pacienta.
Farmakoterapie
• U pacientů s prognózou týdnů až měsíců jsou nejčastěji používaná nebenzodiazepinová hypnotika nebo benzodiazepiny. Užití sedativních antidepresiv (mirtazapin, amitriptylin) a antipsychotik (olanzapin, quetiapin, melperon) je vyhrazeno rezistentním stavům, dále v případě že je pacienti potřebují ještě z jiného důvodu (deprese, bolest, delirium)
Psychické poruchy u pacientů s pokročilým onemocněním
Smutek, zklamání, strach a obavy jsou častými reakcemi pacientů s nevyléčitelným nádorovým onemocněním. U části pacientů dochází k rozvoji poruchy adaptace, úzkosti a deprese. Základem úspěšné prevence a terapie psychických poruch je získání důvěry pacienta a otevřená a podpůrná komunikace.
Úzkost
Nefarmakologická léčba
• Je třeba pacientovi pomoci zmírnit obavy a strach pramenící z neadekvátních úvah a myšlenek. Důležité je pravdivé informování s empatickým a postupným dávkováním nepříznivých informací. Verbální uklidňování, nepřináší většinou zmírnění úzkosti. U některých vysoce úzkostných pacientů může situaci ještě zhoršit. Efektivnější strategií je naslouchání, akceptace pacientových obav a strachu a ujištění o naší připravenosti jeho potíže řešit.
• Pro pacienta může být velmi přínosný kontakt s psychologem a pracovníkem spirituální péče (kaplan, pastorační asistent).
• V případě, že tyto strategie nevedou ke zlepšení, je vhodné intervenovat farmakologicky.
Farmakoterapie
• U pacientů s předpokládanou prognózou přežití v řádu měsíců jako první volbu antidepresiva ze skupiny SSRI. Zpočátku je vhodné podávat současně malou dávku benzodiazepinů do doby nastoupení účinku antidepresiv (4–6 týdnů). Pacientovi je třeba vysvětlit roli benzodiazepinů, tak aby nedošlo k jejich zvyšování a následnému abúzu.
• U pacientů s velmi pokročilým onemocněním s prognózou v řádu týdnů jsou v léčbě úzkosti indikovány benzodiazepiny.
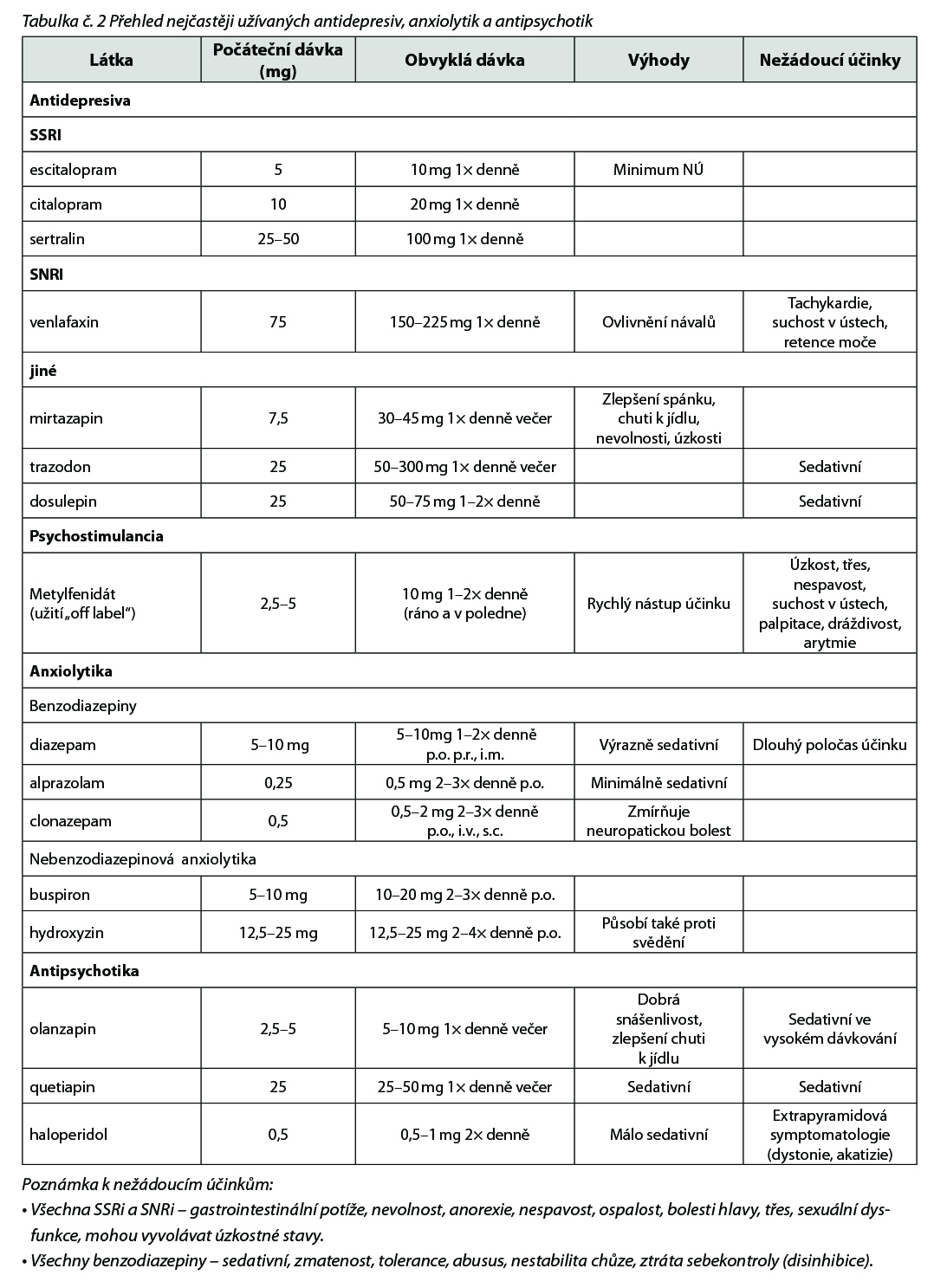
Deprese
Deprese je definována jako přetrvávající smutek, špatná nálada nebo anhedonie (ztráta zájmu a radosti), které trvají alespoň 2 týdny a jsou přítomny některé z následujících symptomů: spánkové poruchy, ztráta chuti k jídlu nebo hubnutí, psychomotorický útlum nebo neklid, únava nebo ztráta energie, pocity bezcennosti a viny, snížená schopnost koncentrace
a myšlení, rekurentní myšlenky na smrt a sebevražedné myšlenky.
Základním screeningovým dotazem je otázka: „Cítíte se depresivní?“. Aktivně se ptáme na hlavní příznaky deprese a anamnézu deprese. Snažíme se získat informace od rodinných příslušníků a blízkých o pacientově náladě a chování v domácím prostředí. Naproti obecnému mínění a přesvědčení lékařů je deprese léčitelná i v terminálních fázích choroby. Pro úspěšnou léčbu deprese je nutná kontrola vyvolávajících a zhoršujících symptomů (bolest, nevolnost, zácpa, dušnost atd.).
Farmakoterapie
• Přehled možností farmakoterapie deprese je uveden v tabulce 4. Farmakoterapii deprese obvykle zahajuje onkolog. Odeslání k psychiatrovi je indikované v případě přítomnosti psychotické symptomatologie, poruchy osobnosti, demence a dále u pacientů s anamnézou lékové a drogové závislosti. Léčbou první volby jsou obvykle inhibitory zpětného vychytávání serotoninu (SSRI). Léčbu zahajujeme obvykle s poloviční dávkou a po týdnu přecházíme na terapeutickou dávku. Pokud je po 1 měsíci léčby účinek pouze částečný, lze dávku zvýšit. Pokud není efekt po vice než 8 týdnech, změníme za jiný preparát. Pokud není dostatečný efekt ani po 2 po sobě jdoucích preparátech, je vhodné konzultovat psychiatra.
• Role psychoterapie je komplementární k farmakoterapii a současné využití obou strategií zvyšuje celkovou léčebnou účinnost.
Delirium
Delirium je charakterizované náhle vzniklou poruchou vědomí, pozornosti, kognice a vnímání, které se mění během dne. Delirium dělíme na hyperaktivní, hypoaktivní a smíšené. Hypoaktivní je charakterizované psychomotorickým útlumem, letargií a sníženým vnímáním okolí. Hyperaktivní delirium se projevuje neklidem, agitovaností, halucinacemi, bludy a zvýšenou bdělostí. Klinický obraz zahrnuje neuropsychiatrické, neurologické a fyzické projevy a symptomy. Prevalence deliria u pacientů s nádory je v rozmezí 10–30 % hospitalizovaných pacientů a roste až k 85 % u terminálních stavů.
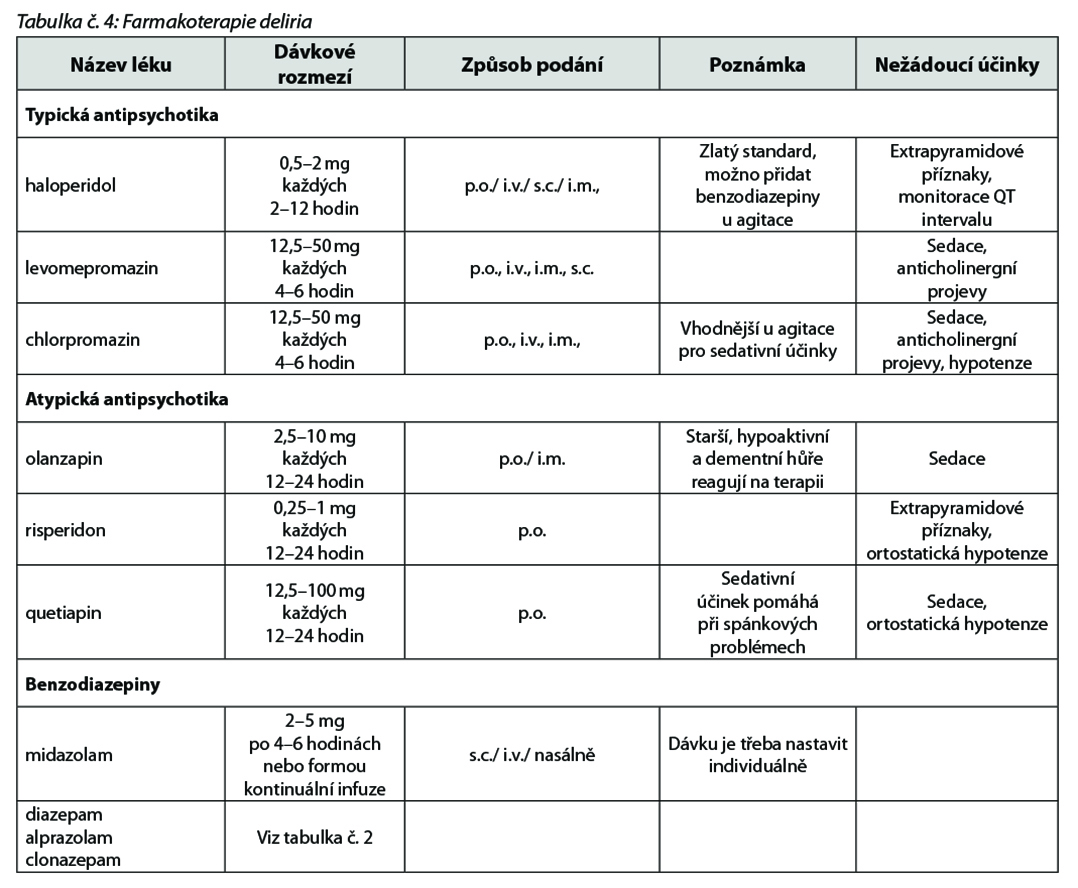
Terapie
Léčba deliria paralelně zahrnuje odstranění vyvolávající/zhoršující příčiny a kontrolu průvodní symptomatologie nefarmakologickými (viz. tabulka č. 3) a farmakologickými postupy (viz tabulka č. 4). Cílem léčby je obnovení výchozího psychického stavu: pacient při vědomí, klidný, bdělý, bez bolestí, kognitivně bez omezení, bez psychotických projevů a koherentně komunikující s okolím. U pacientů s refrakterním neklidem a pacientů v terminálním stavu bývá nezbytnou součástí léčby celková sedace.
Možnosti farmakologické léčby shrnuje tabulka č. 7. Jako první linie léčby jsou doporučována antipsychotika. Mezi nimi zůstává stále zlatým standardem haloperidol. V poslední době jsou stále časteji užívána novější antipsychotika (např. olanzapin, quetiapin, která byla při porovnání s haloperidolem stejně účinná, ale lépe tolerovaná. Dávky haloperidolu nad 5mg/den vedly k většímu výskytu extrapyramidových příznaků a dysforie. Pokud je delirium provázené výraznou úzkostí a agitací, je vhodné doplnit antipsychotika benzodiazepiny (clonazepam nebo midazolam).

Péče o pacienta v terminálním stavu
Jako terminální stav (umírání) označujeme situaci, kdy dochází k nevratnému selhávání jedné nebo více funkčních soustav, které očekávatelně vyústí v úmrtí pacienta v časovém horizontu hodin až dnů. Skutečnost, že se pacient nachází v terminálním stavu vytváří specifický klinický a etický kontext.
Cílem péče o umírajícího pacienta je mírnění nepříjemných tělesných projevů nemoci a dosažení maximálního možného pohodlí (komfortu).
Všechny diagnostické a léčebné postupy by měly být přehodnoceny, zda bezprostředně přispívají ke komfortu pacienta. Postupy, které ke komfortu nepřispívají, by měly být ukončeny. Léčebné postupy bez přímého vlivu na komfort, které však vedou k oddálení smrti (např. antibiotika, parenterální hydratace a výživa, hemodialýza, umělá plicní ventilace) ve skutečnosti často pouze uměle prodlužují proces umírání a zvyšují utrpení pacienta i jeho rodiny. Jejich nasazení/ ukončení je třeba individuálně rozhodnout.
S ohledem na předpokládaný vývoj onemocnění je vhodné s pacientem a s jeho svolením také s jeho blízkými hovořit o možných komplikacích a možnostech využití specifických život prodlužujících léčebných postupů. Přání a preference pacienta je třeba respektovat. Pokud již pacient není schopen vyjádřit svou aktuální vůli ohledně rozsahu léčebné péče a má platné dříve vyslovené přání, je toto třeba respektovat.
Pokud si pacient přeje (nebo dříve vyslovil přání), aby péče probíhala v domácím prostředí, je třeba toto přání zohlednit. Pokud je pacient v terminálním stavu v lůžkovém zařízení, je třeba umožnit v maximální možné míře přítomnost pacientových blízkých u lůžka.
U všech umírajících pacientů musí být pravidelně hodnocena a mírněna bolest, dušnost, úzkost a delirium.
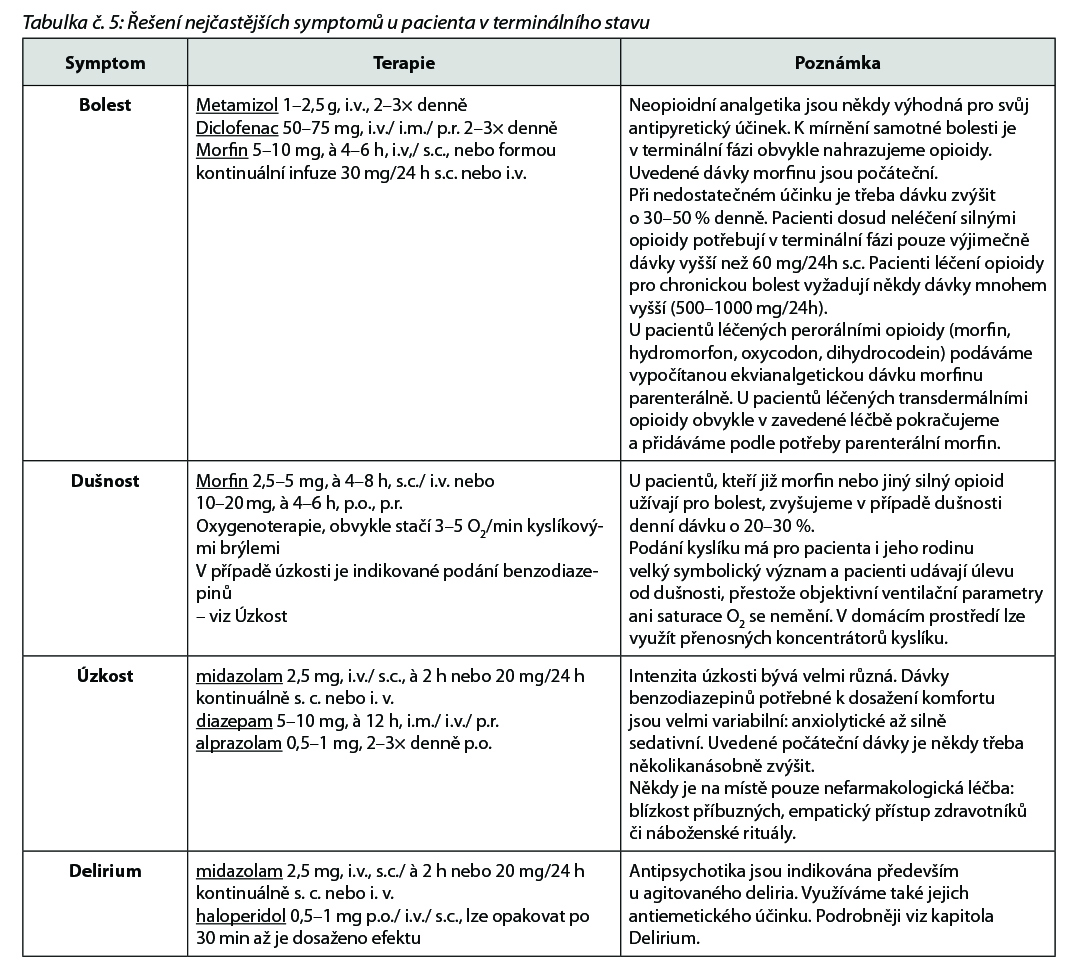
Paliativní sedace u pacientů v terminálním stavu
Jako paliativní sedaci (PS) označujeme farmakologické utlumení pacienta s cílem zmírnit refrakterní diskomfort při umírání. Hloubka navozené sedace je vždy individuální a závisí na intenzitě symptomů a celkovém klinickém kontextu. U některých pacientů je třeba pacienta utlumit až do hloubky soporu-komatu.
• Nejčastější indikací PS jsou refrakterní dušnost, úzkost, agitované delirium. Bolest lze většinou účinně zmírnit bez nutnosti výrazného ovlivnění stavu vědomí.
• K zajištění PS používáme nejčastěji kontinuální podání midazolamu (10–200 mg/24h i.v./s.c.), někdy současně s morfinem (10–100 mg/24g i.v./s.c.), pokud je přítomna bolest nebo dušnost. V nemocničním prostředí pak lze užít také propofol. Při selhání midazolamu v domácím prostředí je možné použít phenobarbital (úvodní dávka 200 mg i.v., následována kontinuální infuzí 900–1600 mg/24 hodin s.c.). Tlumení pacienta samotnou eskalací dávky morfinu je klinicky a eticky nesprávné.
• S pacientem a jeho blízkými by měla být možnost paliativní farmakologické sedace otevřeně diskutována. Před jejím zahájením je potřeba kvalifikovaně zhodnotit, zda není diskomfort pacienta řešitelný jiným způsobem. Rozhovor o zahájení paliativní sedace je jednou z typických indikací pro konzilium specializované paliativní péče.
• PS by měla být využívána jako skutečně krajní možnost u pacientů, u kterých významný diskomfort přetrvává i přes komplexní paliativní péči. Je nezbytné, aby rozhodování o aplikaci PS na daném pracovišti probíhala vždy v rámci strukturovaného procesu (protokolu), který by zohlednil všechny relevantní klinické, etické, právní a komunikační aspekty.
Literatura:
- Ferrell BR, Temel JS, Temin S, et al. Integration of palliative care into standard oncology care: American Society of Clinical Oncology clinical practice guideline
update. J Clin Oncol. 2017;35:96-112. - NCCN Guidelines, Palliative Care, version 1.2022. www.nccn.org.
- ESMO Clinical Practice Guidelines for the Management of Refractory Symptoms at the End of Life and the Use of Palliative Sedation. Ann Oncol (2014) 25
(suppl 3): 143-152. - Sláma O., Kabelka L. (eds.) Paliativní medicína pro praxi. 3.přepracované a rozšířené vyd. Praha: Galén, 2022. 320 s.





