12.1. Obecná doporučení před zahájením systémové terapie
Neoadjuvantní a adjuvantní terapie
Před zahájením terapie by měl být další postup diskutován v rámci multidisciplinárního týmu. Rozhodnutí o konkrétním léčebném postupu je založeno na podtypu karcinomu prsu, rozsahu onemocnění, předpokládané citlivosti k léčbě, benefitu terapie, možných rizicích s léčbou spojených, celkovém stavu pacienta, komorbiditách a preferencích pacienta. Obecná léčebná doporučení jsou uvedena v Tab. 1.
Adjuvantní léčba by měla být zahájena do 3–6 týdnů od provedení operačního výkonu, u triple negativního karcinomu prsu (TNBC) do 4 týdnů. Hormonální léčba (HT) by měla být použita u všech pacientek s expresí hormonálních receptorů (HR).
Indikace podání chemoterapie (CHT) u luminálních B HER2 negativních karcinomů je individuální, vychází z rozsahu onemocnění, jeho biologického chování a rizika relapsu. V indikovaných případech lze použít genomické testy k upřesnění prognózy onemocnění a predikci benefitu systémové terapie. Adjuvantní HT je součástí léčby všech pacientek s luminálním HER2 negativním karcinomem, pokud není jednoznačný důvod k jejímu vynechání. U vysoce rizikových pacientek je podávána kombinace HT a abemaciklibu, u pacientek s germinální BRCA1/2 mutací lze v indikovaných případech zařadit léčbu olaparibem. Premenopauzální pacientky, u kterých jsou podávána LHRH analoga lze léčit jako postmenopauzální. Pacientky s HER2 pozitivním karcinomem by měly být léčeny kombinací CHT a anti-HER2 terapie.
Pacientky s TNBC by měly být ve většině případů léčeny CHT. V indikovaných případech lze použít kombinaci CHT a imunoterapie. Pacientky s pozitivitou estrogenového (ER) a/nebo progesteronového receptoru (PR) do 10 % by měly být léčeny jako pacientky s TNBC. V případě nádorů ER-/PR+/HER2- by mělo být vyžádáno druhé čtení ke zhodnocení stavu HR. U pacientek s germinální mutací BRCA1/2 lze v indikovaných případech zařadit léčbu olaparibem.
Na přítomnost germinální mutace BRCA1/2 jakožto prediktivního markeru by měly být testovány všechny pacientky s HER2 negativním karcinomem prsu splňující kritéria pro adjuvantní léčbu olaparibem.
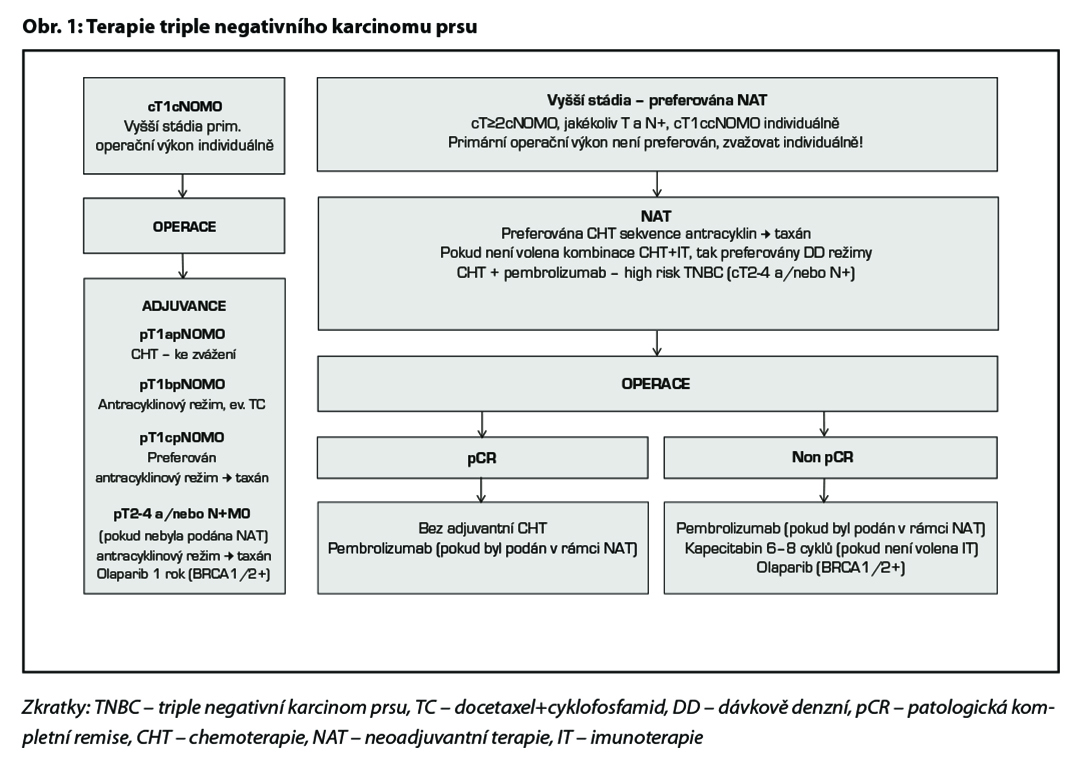
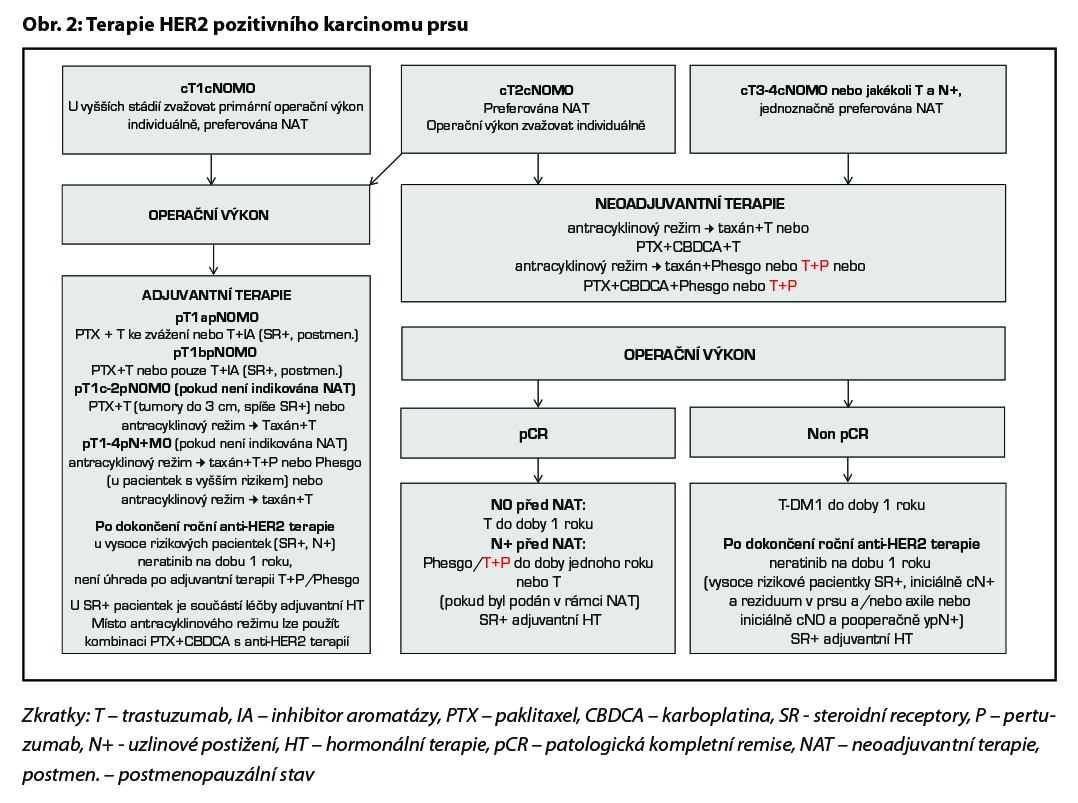
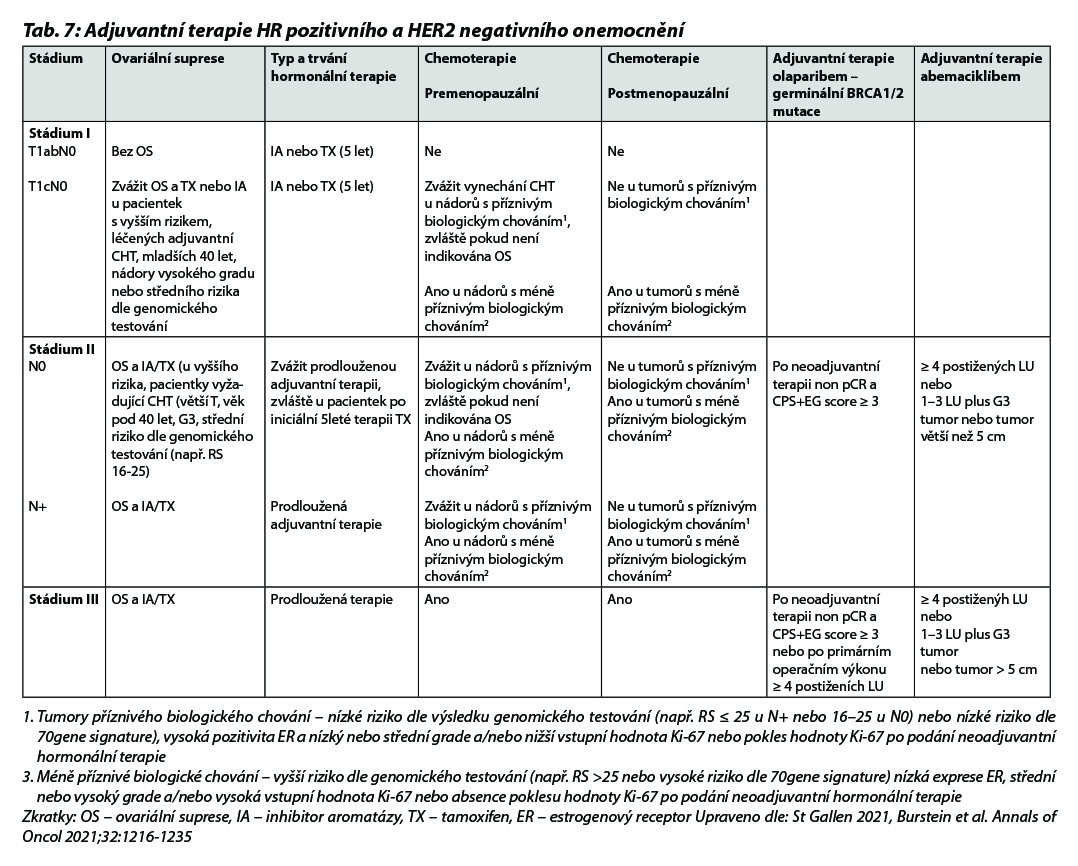
Doporučení léčebných postupů v rámci (neo)adjuvantní terapie u jednotlivých podtypů je shrnuto v Tab. 7, na Obr. 1 a Obr. 2.
Gravidní pacientky
Léčba gravidních pacientek a pacientek v laktaci je značně specifická, náleží do onkologických center se zkušeností s touto problematikou. Na základě výsledků klinické studie POSITIVE lze u pacientek s časným HR pozitivním karcinomem prsu akceptovat přerušení adjuvantní HT (optimálně po 2 letech užívání) s cílem těhotenství a po porodu pokračovat v plánované adjuvantní HT.
Prezervace ovariální funkce
Onkologická léčba může mít negativní dopad na fertilitu, s pacientkou by před léčbou měla být tato problematika diskutována. Pacientkám zvažujícím těhotenství po dokončení onkologické léčby lze nabídnout prezervaci ovariální funkce pomocí kryoprezervace embryí nebo oocytů ve spolupráci s IVF centrem, popř. je další možností podání LH-RH analog v průběhu systémové CHT nebo imunoterapie (podle studie POEMS – goserelin 3,6 mg s. c. týden před zahájením CHT, po celou dobu podávání CHT a 2 týdny po ukončení CHT).
Geriatrické pacientky
Léčba této skupiny pacientek se řídí stejnými pravidly jako terapie pacientek mladších. Vhodné je zvažovat i v adjuvanci úvodní redukci dávek CHT s ohledem na sníženou hepatální a renální clerance a dle tolerance v následujících cyklech dávky CHT při dobré toleranci navýšit. Preferovány jsou v adjuvanci kombinační režimy. Při indikaci rozsahu adjuvantní terapie je vhodné zvážit očekávanou délku života s ohledem na interkurence pacientů. Lze využít např. Charlson comorbidity index (CCI). https://www.mdcalc.com/calc/3917/charlson-comorbidity-index-cci
Muži
Muži, u kterých byl diagnostikován karcinom prsu, by měli být léčeni dle léčebných doporučení pro karcinom prsu u žen.

12.2 Neoadjuvantní a adjuvantní systémová terapie
12.2.1 Neoadjuvantní systémová terapie
Neoadjuvantní terapie je vhodná u pacientek, u kterých lze očekávat odpověď na CHT/cílenou terapii/imunoterapii (nádory s nízkými nebo negativními HR, s vysokým gradem, karcinomy s vysokým Ki- 67, HER2+, TNBC). Dále je neoadjuvantní terapie volena u pacientek s lokálně pokročilým inoperabilním onemocněním, u pacientek s inflamatorním karcinomem prsu a u pacientek, u kterých lze v případě regrese postižení provést prs záchovný výkon a/nebo menší operační výkon v axile (cílená axilární disekce).
Podání neoadjuvantní terapie umožní:
• provedení parciálního operačního výkonu,
• dosažení operability původně inoperabilního nálezu,
• zisk důležitých prognostických informací dle efektivity neoadjuvantní léčby,
• poskytnutí času pro genetické testování,
• možné naplánování rekonstrukční operace,
• redukce rozsahu operačního výkonu v axile (při původní N+ při regresi nálezu provedení pouze cílené axilární disekce místo disekce axily),
• v případě TNBC a HER2 pozitivního karcinomu je dosažení patologické kompletní remise (pCR) po neoadjuvantní terapii signifikantně spojeno s lepší prognózou onemocnění (nižší četnost relapsů onemocnění a lepší celkové přežívání pacientek).
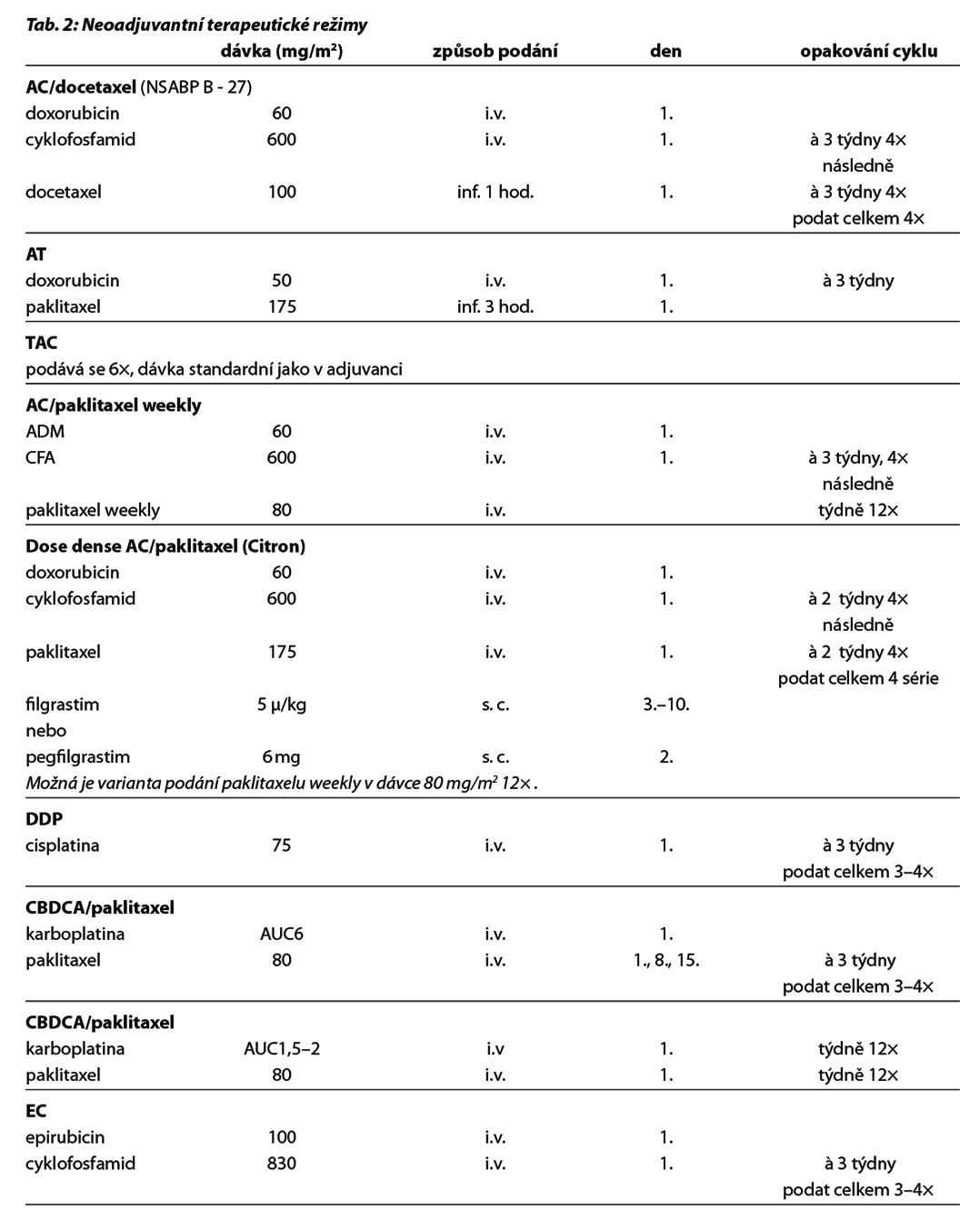
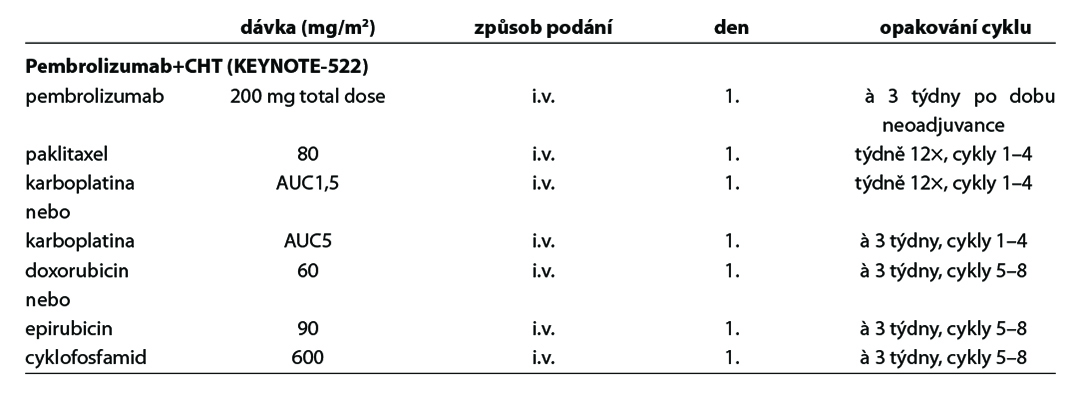
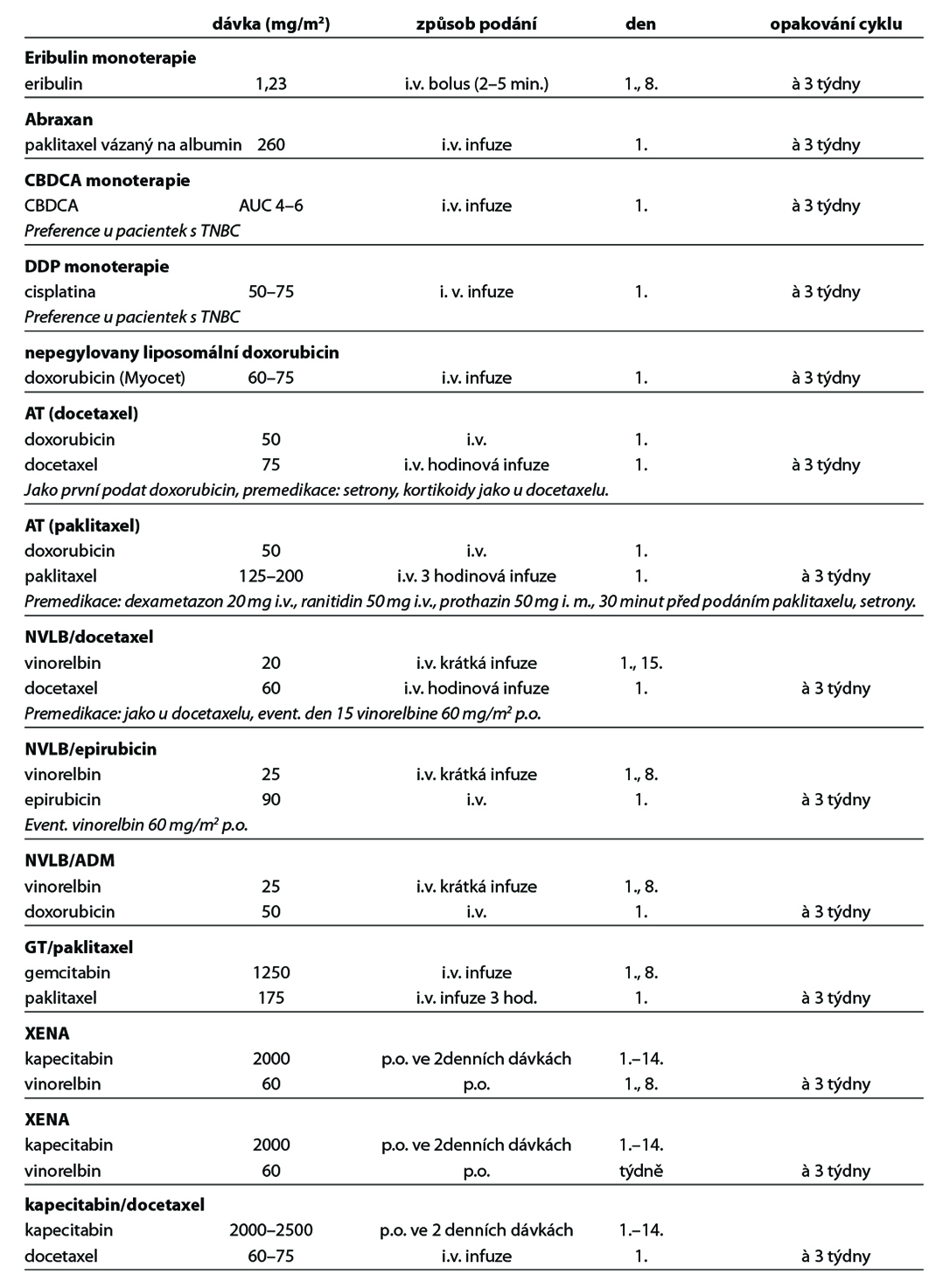
Před zahájením neoadjuvantní terapie je, v případě plánovaného prs záchovného výkonu nebo cílené axilární disekce, nutné zavedení klipu do nádoru v prsu a do bioptované axilární uzliny. Preferováno je podání dose-dense režimů. U většiny pacientek je volena sekvence antracyklinového režimu a následně taxánu. U pacientek s kontraindikací antracyklinu lze volit kombinaci taxánu a cyklofosfamidu, u pacientek s TNBC je možná i kombinace paklitaxelu s karboplatinou. Doporučuje se podat nejméně 6 cyklů CHT v rozmezí 4 až 6 měsíců. Veškerá plánovaná CHT by měla být podána před operací. U high-risk pacientek s TNBC ( cT2-4 a/nebo N+) je v rámci neoadjuvantní terapie indikováno podaní kombinace CHT a imunoterapie dle výsledků studie KEYNOTE-522. Tato léčba zvyšuje pravděpodobnost dosažení pCR a zlepšuje dlouhodobé parametry léčebné odpovědi (EFS). U pacientek s HER2 pozitivním karcinomem je standardem kombinace CHT a duální anti-HER2 terapie. Neoadjuvantní HT lze zvažovat u pacientek, u kterých není indikována neoadjuvantní ani adjuvantní CHT, a u kterých lze očekávat odpověď na HT (nádory s pozitivními HR, s nízkým gradem, s nízkým proliferačním indexem Ki67). U premenopauzálních pacientek je preferována kombinace ovariální suprese (OFS)+IA, u postmenopauzálních pacientek terapie inhibitorem aromatázy (IA). Doporučená doba podávání je 6–8 měsíců. Neoadjuvantní režimy jsou uvedeny v Tab. 2.
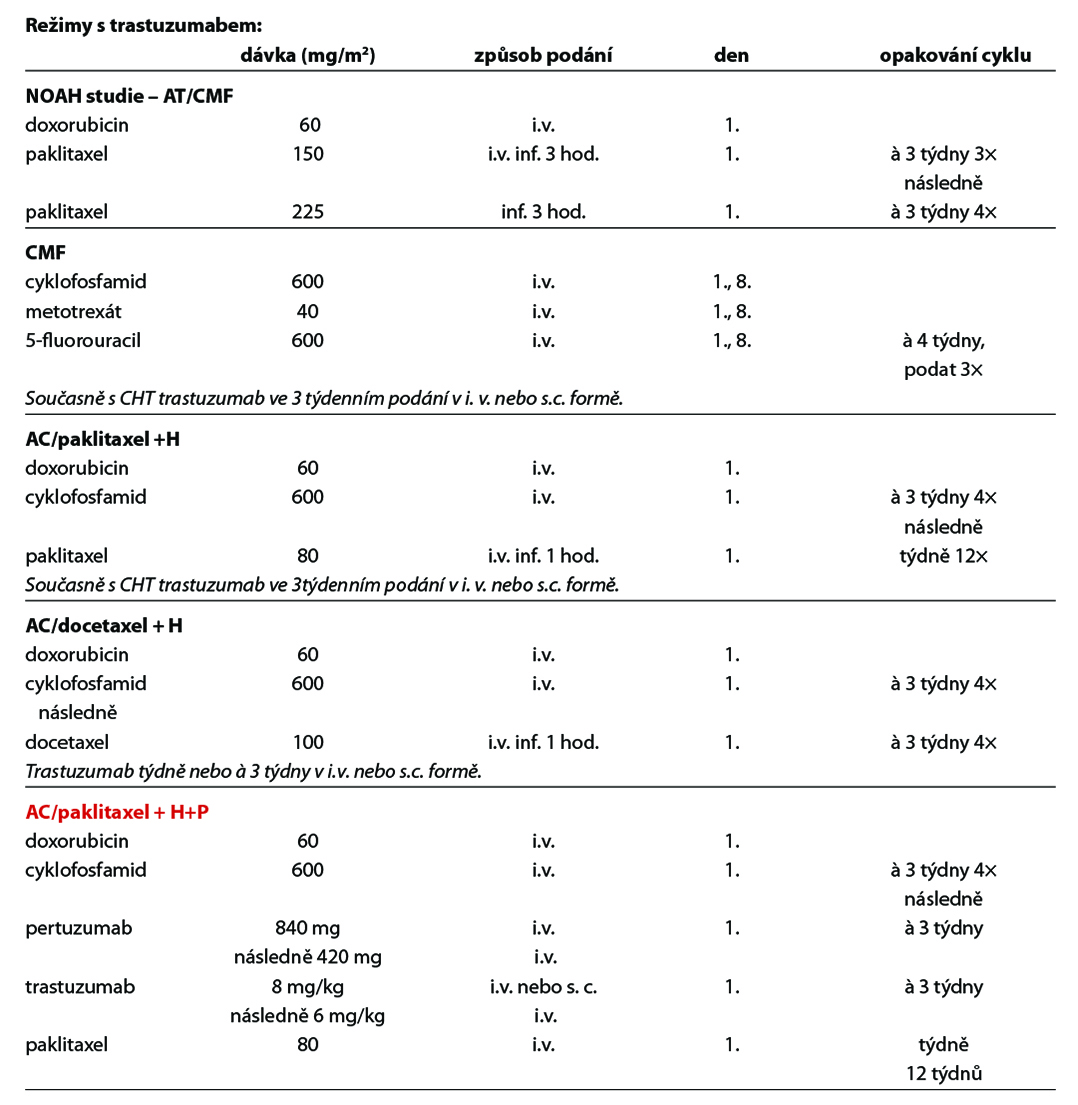
12.2.2 Adjuvantní systémová terapie
12.2.2.1 Adjuvantní chemoterapie
Adjuvantní CHT dle závěrů ze St. Gallen 2023 by měla být zvažována u TNBC, HER2 pozitivních nádorů a u nádorů luminálního typu, které jsou specifikovány níže. Adjuvantní terapie by zpravidla měla být zahájena do 3–6 týdnů po operačním výkonu, u TNBC do 4 týdnů.
A – u luminálního A podtypu karcinomu prsu je CHT doporučována při postižení 4 a více axilárních lymfatických uzlin a u nádorů prsu velikosti T3 a více.
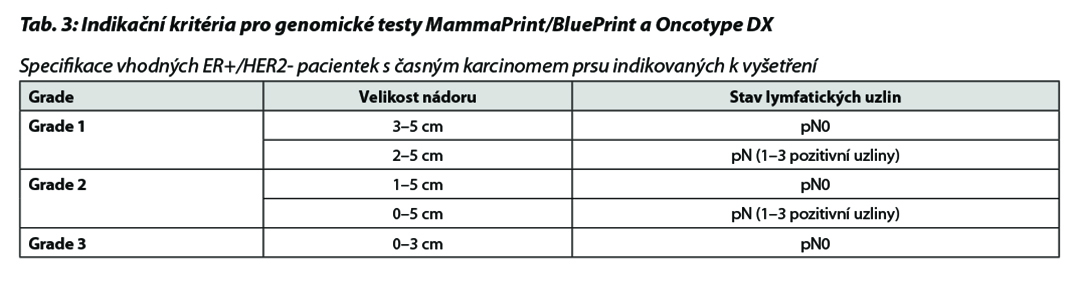
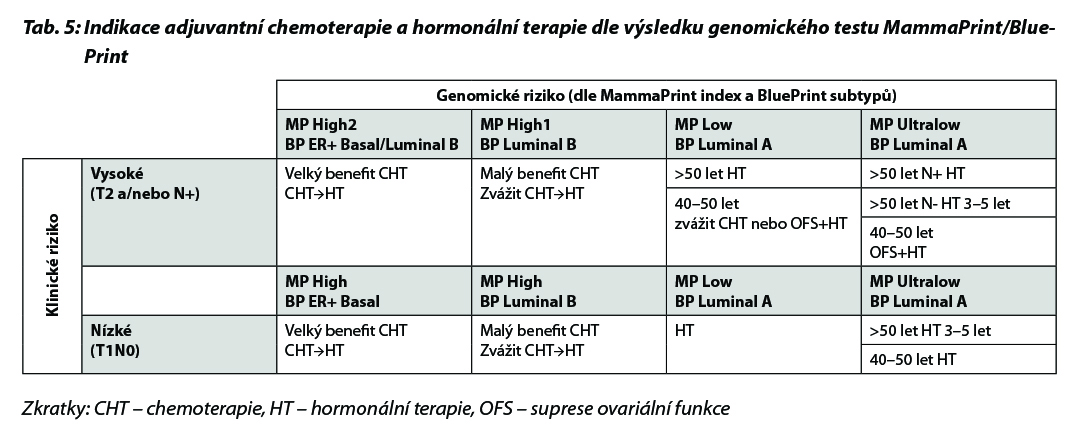
B – u nádorů luminálních B HER2 negativních není podání CHT nezbytné u všech pacientek. Indikace CHT vychází z rozsahu postižení v prsu a ev. axile a biologického chování tumoru (exprese HR, hodnota proliferačního indexu Ki-67, nádorový grade a histologický typ onemocnění). U pacientek s malým rozsahem onemocnění lze podat pouze 4 série CHT. Přidání taxanů by mělo být zvažováno u více extenzivního onemocnění. V případě nejasného benefitu adjuvantní CHT je indikováno došetření pomocí multigenového testu (MammaPrint/BluePrint nebo Oncotype DX), aby nedošlo k nadléčení pacientek. Vyšetření je indikováno multidisciplinárním týmem v KOC. V případě nemožnosti provedení genomického testování lze použít jako surogátní marker hodnotu proliferačního indexu Ki-67. Pacientky s hodnotou Ki-67 ≤ 5 % by neměly být léčeny adjuvantní CHT, pacientky s hodnotou Ki-67 ≥ 30 % by měly být adjuvantní CHT léčeny. Jako pomocný nástroj k určení rizika recidivy nemoci a přínosu jednotlivých adjuvantních léčebných modalit (CHT, hormonoterapie) je možné použít kalkulátor rizika, např. Adjuvant Breast Cancer Tool, https://breast.predict.nhs.uk/tool. Multigenové testy jsou v ČR hrazeny při splnění podmínek uvedených v Tab. 3. Indikace konkrétního postupu v rámci adjuvantní terapie dle výsledku multigenového testování je znázorněna v Tab. 4 a Tab. 5.

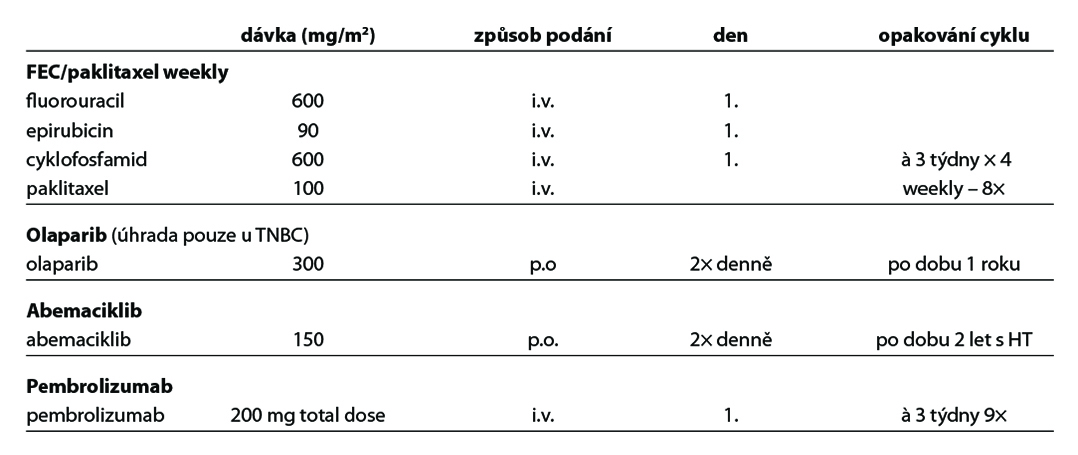
C – u triple negativních nádorů by měla být adjuvantní CHT založena na antracyklinech a taxanech. U nádorů nízkého rizika lze zvážit podání pouze antracyklinového režimu (např. AC) nebo TC. U high risk pacientek léčených kombinací CHT + pembrolizumab v rámci neoadjuvantní terapie je indikováno pokračování pembrolizumabem v monoterapii po dobu 27 týdnů (9 cyklů à 3 týdny) bez ohledu na efekt neoadjuvantní terapie. V individuálních případech (toxicita léčby) lze u pacientek s pCR adjuvantní terapii pembrolizumabem nepodat. U pacientek s germinální mutací BRCA1/2 je možné podat v rámci adjuvantní léčby v indikovaných případech olaparib na dobu 1 roku (pacientky s reziduálním postižením po neoadjuvantní terapii nebo pacientky s ≥pT2N0 nebo pN+ po primárním operačním výkonu a adjuvantní CHT). Adjuvantní CHT lze vynechat u nízce rizikových tumorů (sekretorický, adenoidně cystický karcinom).
Doporučený léčebný postup u pacientek s TNBC je na Obr. 1.
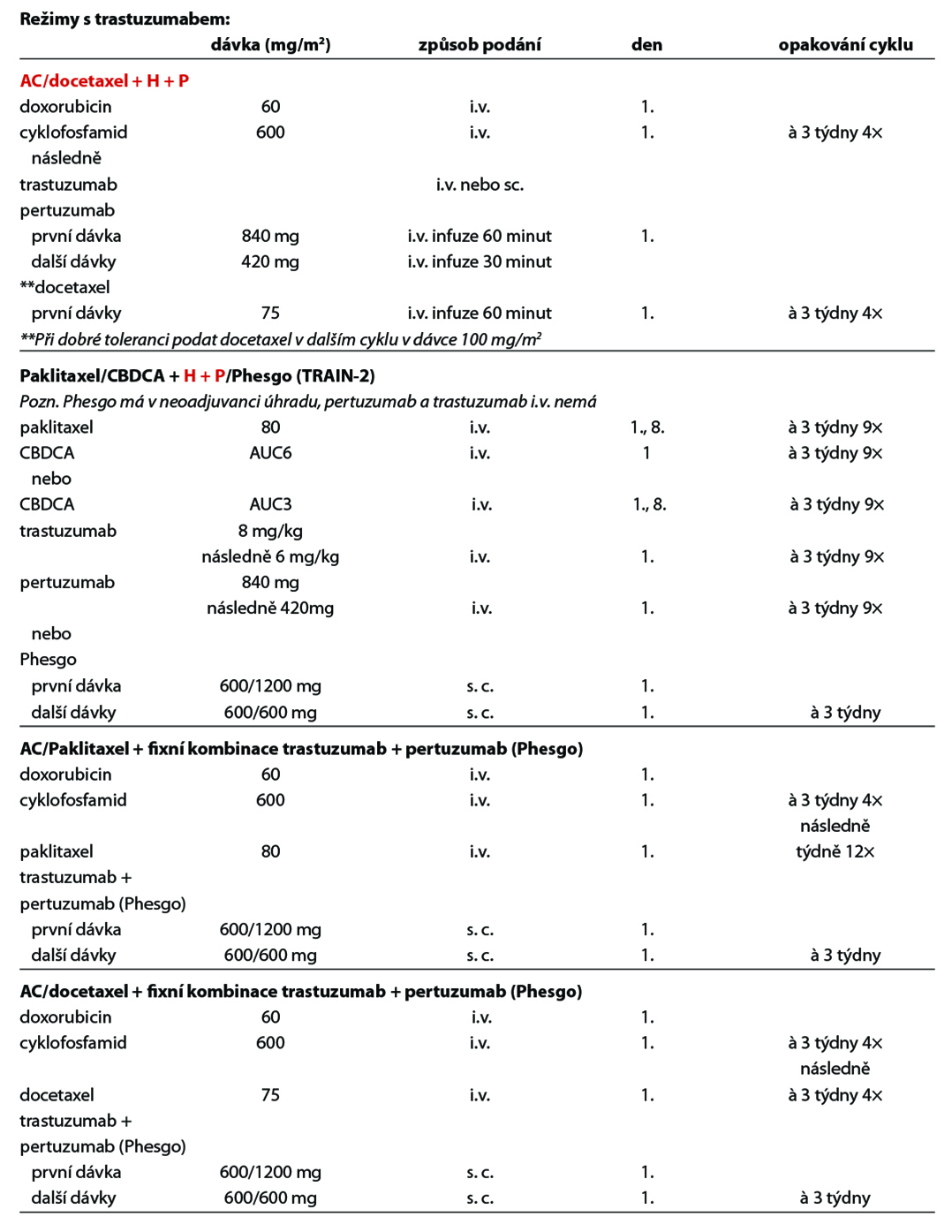
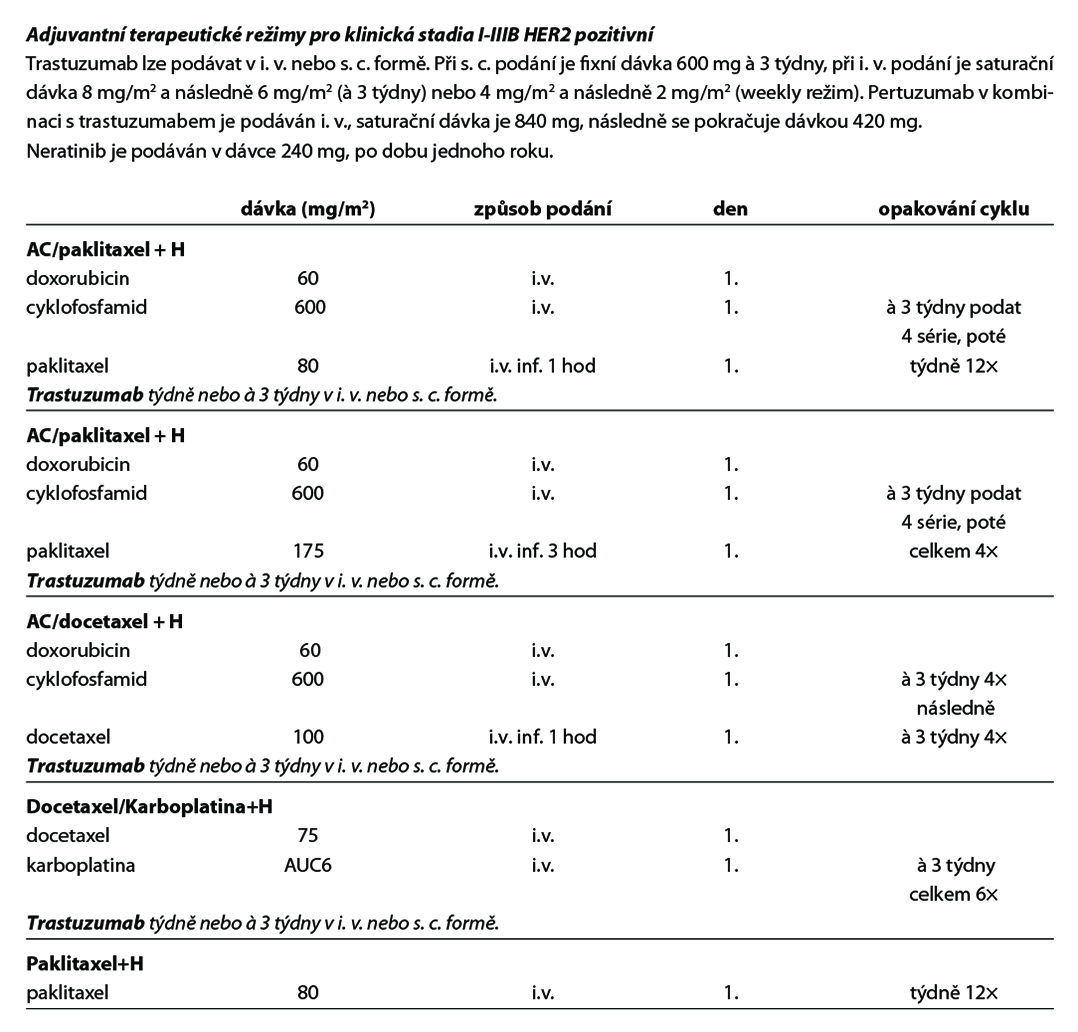
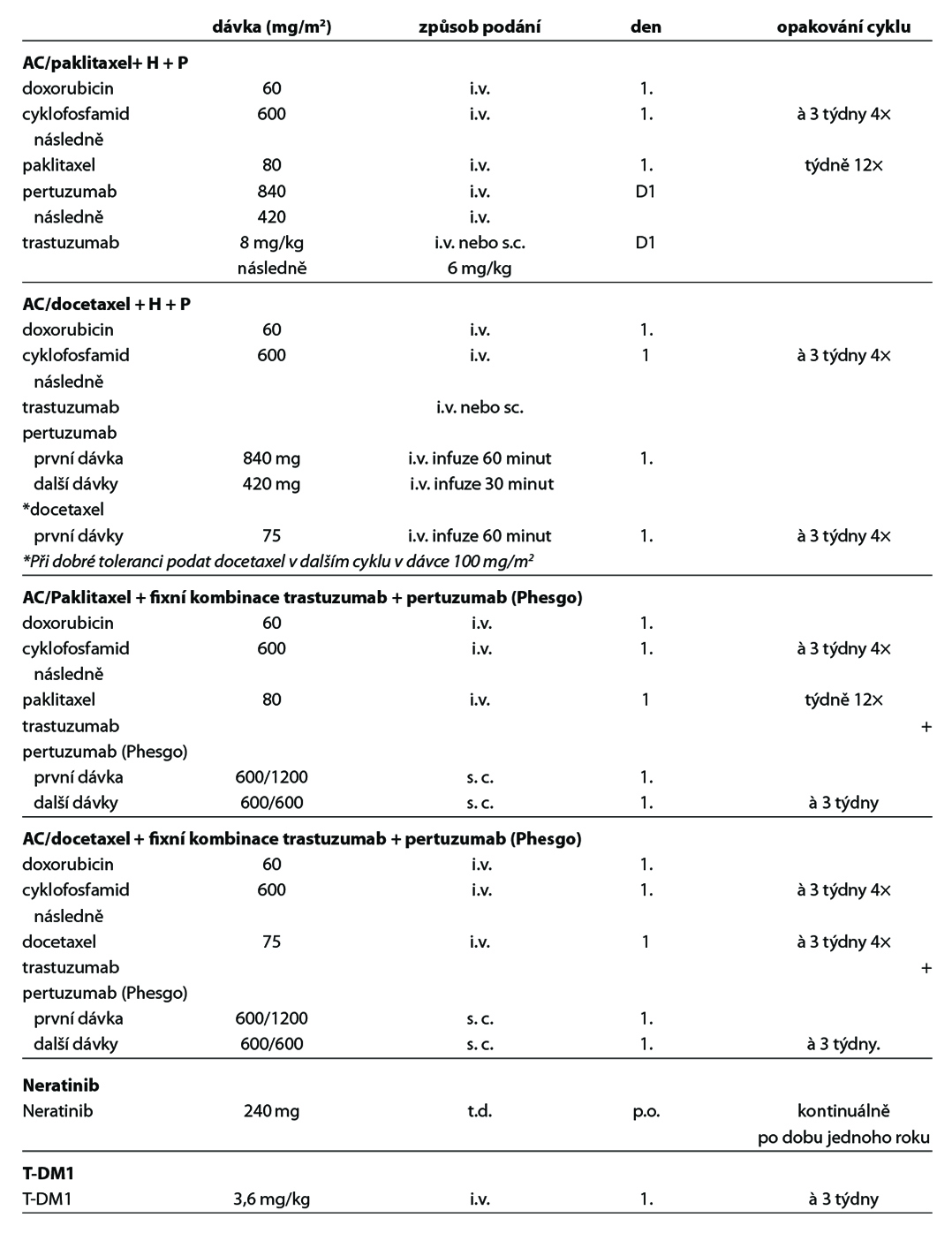
D – v případě HER2 pozitivních tumorů by adjuvantní terapie měla být založena na kombinaci CHT a anti-HER2 terapie. Anti-HER2 terapie je indikována a hrazena pouze u pacientek s HER2 pozitivitou (IHC 3+, IHC 2+ s ověřenou amplifikací dle ISH) na základě vyšetření akreditované laboratoře. Duální anti-HER2 terapie je hrazena u pacientek s uzlinovým postižením po primárním operačním výkonu. Alternativou k i. v. podání duální anti-HER2 terapie je podání této kombinace podkožně. Pacientky s reziduálním postižením po neoadjuvantní terapii by měly být léčeny t-DM1. U rizikových HR+ pacientek s uzlinovým postižením lze po primárním operačním výkonu nebo po neoadjuvantní terapii s reziduálním postižením (v prsu a/nebo uzlině) pokračovat po dokončení adjuvantní anti-HER2 terapie prodlouženou sekvenční terapií neratinibem na dobu 1 roku (není stanovena úhrada po adjuvantní duální anti-HER2 terapii). Standardní délka podávání anti-HER2 terapie je 1 rok, u pacientek s nižším rizikem relapsu, komorbiditami nebo s vyšším rizikem kardiotoxicity lze individuálně zkrátit podávání anti-HER2 terapie na 6 měsíců. Součástí anti-HER2 terapie je pravidelná monitorace kardiálních parametrů. U pacientek s expresí HR je indikována adjuvantní HT – TX, u postmenopauzálních
pacientek je preferován IA. U pacientek s pozitivními HR, které jsou léčené v adjuvanci t-DM1 by měla být adjuvantní HT podávána konkomitantně. Adjuvantní radioterapii lze indikovat buď konkomitantně s t-DM1, nebo sekvenčně – nejdříve adjuvantní radioterapie, po skončení adjuvantní t-DM1.
Doporučený postup terapie u HER2 pozitivních pacientek je na Obr. 2.
Obecná doporučení pro adjuvantní chemoterapii
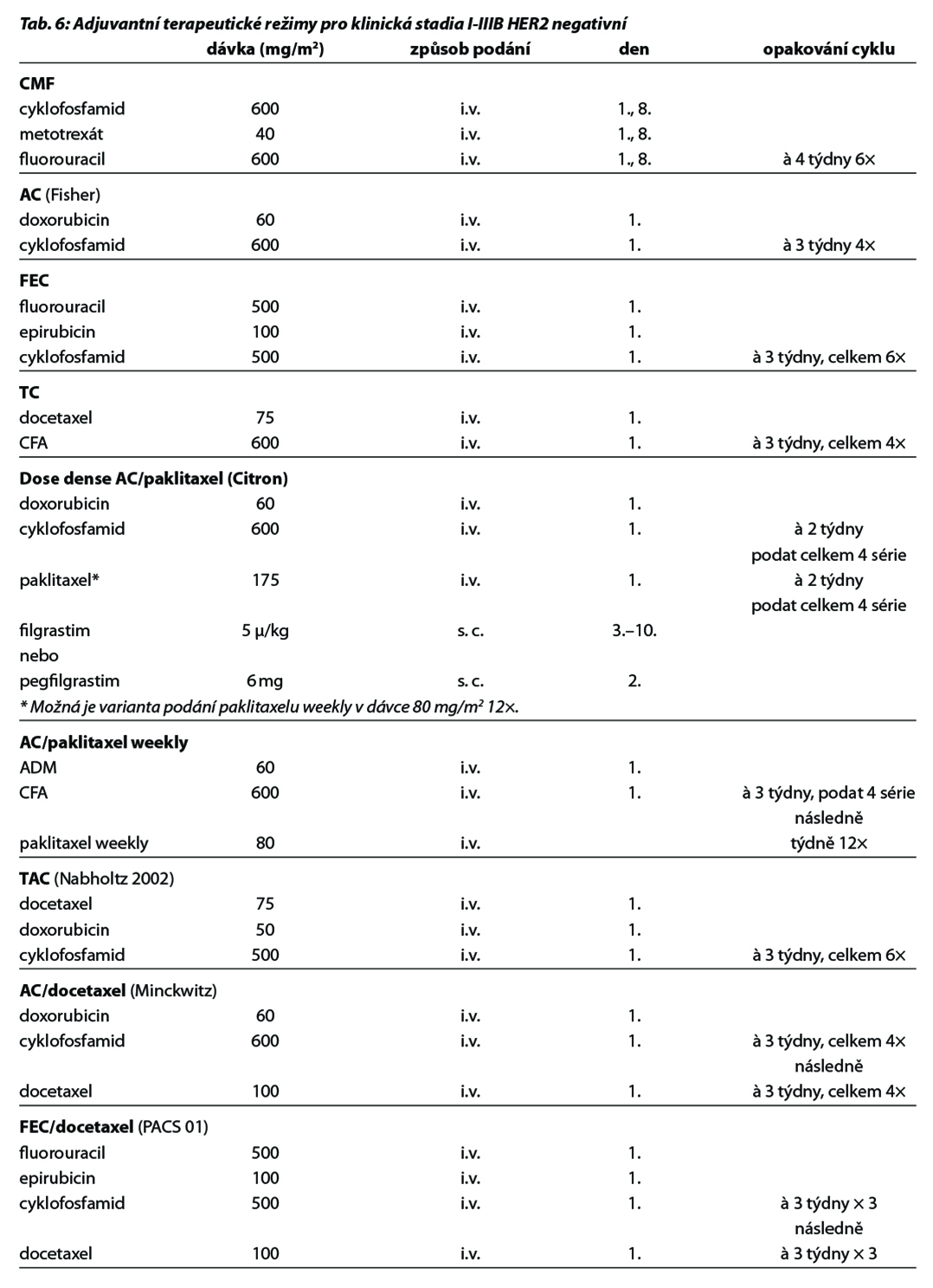
Nejčastěji používanými režimy jsou režimy založené na antracyklinech a taxanech, u selektovaných pacientek lze použít i režim CMF. Použití 4 cyklů AC je považováno za stejně efektivní jako použití 6 cyklů FEC100 u pacientek s N0 postižením (NSABP B36). Použití 4 cyklů AC je považováno za stejně efektivní jako 6 cyklů CMF. Přidání taxanu zvyšuje efektivitu CHT bez ohledu na N status, věk pacientek, velikost tumoru, grade nebo expresi HR. Režim s taxánem bez antracyklinů (4× TC) lze použít jako alternativu režimu 4× AC. CHT se doporučuje podávat 12–24 týdnů s ohledem na individuální riziko pacientky a dle vybraného režimu. V současné době je preferováno podání režimu AC v dose denzním schématu nejenom u TNBC a HER2 pozitivních nádorů, ale i u nádorů luminálních. V případě podání dose-dense režimu je nutné pacientku zajistit G-CSF.
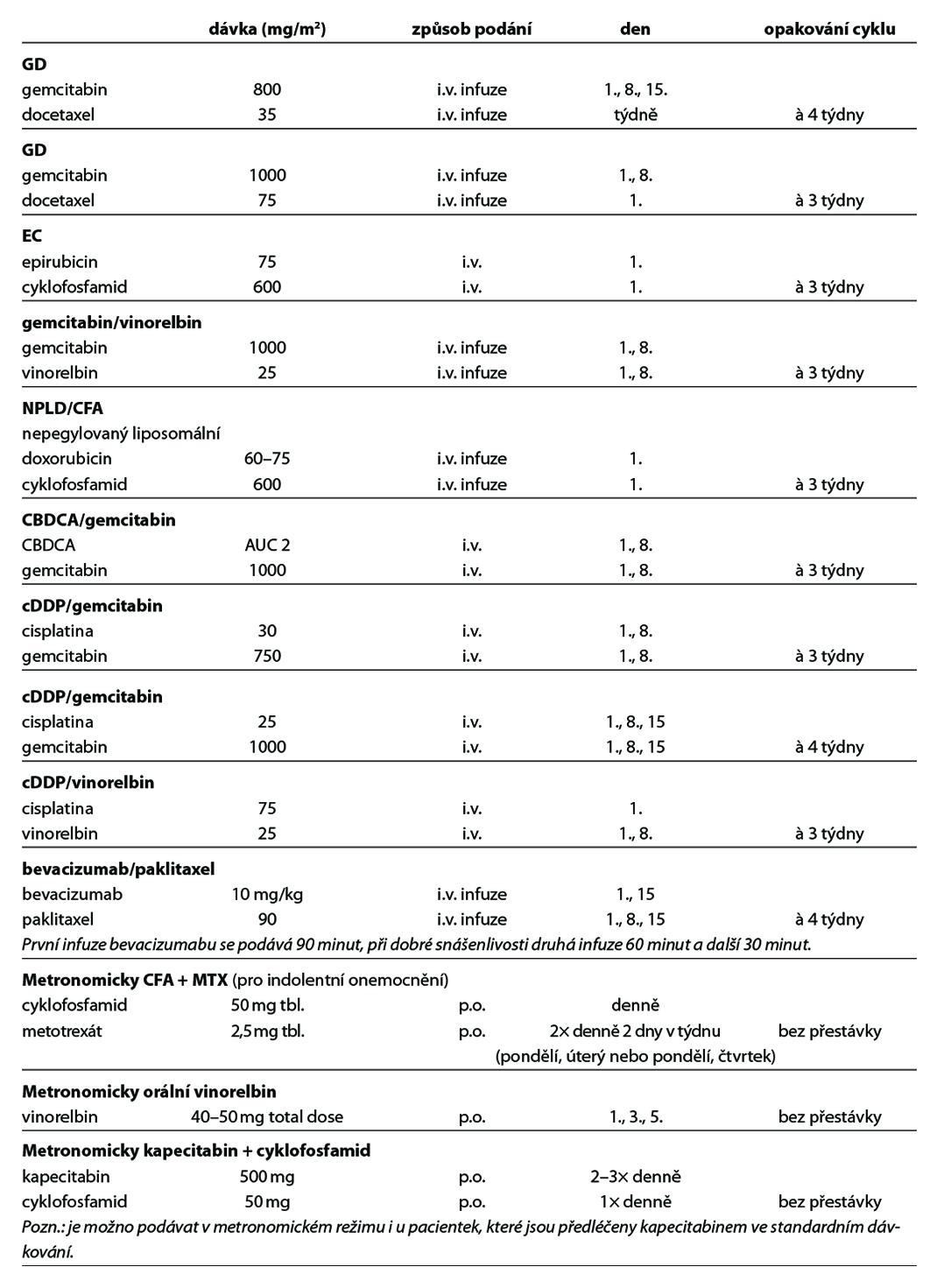
Nejčastější kombinace cytostatik jsou uvedeny v Tab. 5. Taxany v adjuvantní léčbě je možné podat v následujících kombinacích: AC-T (doxorubicin, cyklofosfamid 4×, paklitaxel 4× à 21 dní, preferovaný paklitaxel weekly 12×), v kombinaci AC-D (ADM, CFA 4×, následně docetaxel 4× vše à 21 dní), TAC (docetaxel, doxorubicin, cyklofosfamid 6×), 4–6× TC (docetaxel,
cyklofosfamid), v režimu 4× FEC 100 – paklitaxel weekly 100 mg/m2 8× nebo v režimu – 3× FEC 100 a 3× docetaxel (PACS 01). Benefit adjuvantního podání bisfosfonátů je prokázán u postmenopauzálních pacientek s časným karcinomem prsu klinického stádi II a III, nezávisle na expresi hormonálních receptrů a uzlinového postižení. Terapie bisfosfonáty snižuje
riziko relapsu onemocnění a vzniku osteoporózy.
12.2.2.2 Adjuvantní hormonální terapie
Pre- nebo perimenopauzální pacientky by měly být léčeny dle současných doporučení ESMO/ASCO/ a St. Gallen 2023:
Všechny pacientky s pozitivitou HR by měly být léčeny adjuvantní HT. U pacientek s nízkým rizikem relapsu je standardem léčby TX v dávce 20 mg/den po dobu 5 let. V případě vyššího rizika relapsu je indikována OFS v kombinaci s TX (ve studii SOFT zlepšení DFS a OS) nebo IA (absolutní rozdíl v 8 letech u nemocných s vysokým rizikem relapsu >15 % při srovnání
s léčbou samotným TX). Největší absolutní benefit z přidání OFS mají pacientky mladší 35 let, a nemocné léčené adjuvantní CHT. Klinicky signifikantní benefit z podání IA vs TX pro celkové přežití mají dle dlouhodobých dat kominované analýzy studií SOFT + TEXT (12letý follow-up) pacientky vysokého klinického rizika (ženy mladší 35 let, s nádory > 2 cm
a grade 3 tumory). K identifikaci žen, které budou mít z eskalace léčby prospěch, je možné využít výpočet tzv. kompozitního rizika z tradičních prognostických znaků (tj. věk pacientky, velikost nádoru, grade, stav lymfatických uzlin, exprese HR a Ki67) po zadání do kalkulátoru, odečet benefitu OFS resp kombinace OFS + IA proti samotnému TX z grafu je možný zde: https://rconnect.dfci.harvard.edu/CompositeRiskSTEPP/.
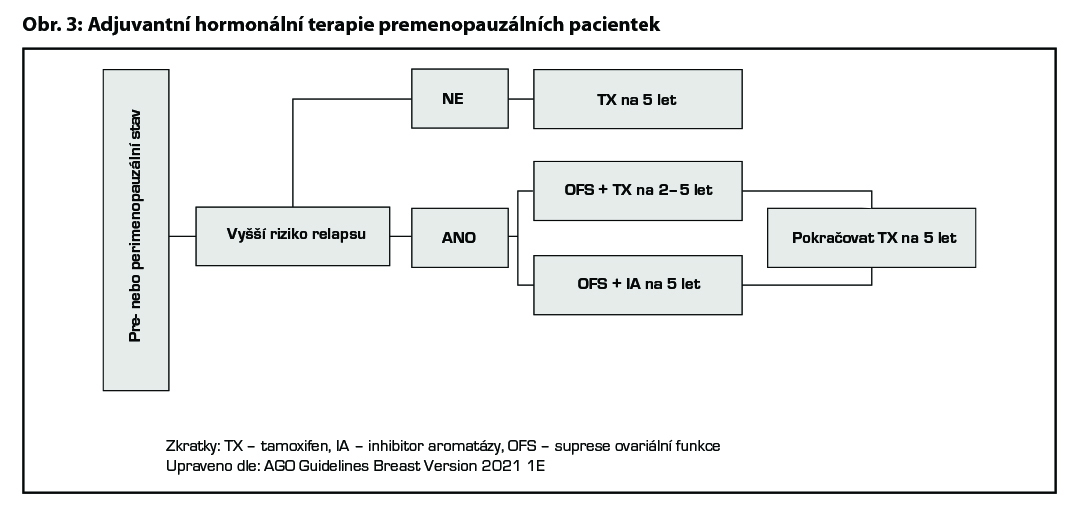
Premenopauzální pacientky s vyšším rizikem relapsu by měly být léčeny TX až 10 let (benefit v parametru OS u pacientek s uzlinovým postižením). U žen, které se staly během 5 let užívání TX trvale postmenopauzálními, by měl být zvážen switch na IA (benefit v OS). U pacientek léčených CHT, u kterých dojde k obnově menstruace (během prvního roku až 2 let po CHT), by mělo být zváženo přidání OFS k hormonoterapii. U žen mladších 35 let, jejichž onemocnění nevyžaduje podání adjuvantní CHT, je význam OFS nejasný, ale vzhledem k horší prognóze luminálních karcinomů v této věkové skupině je doporučeno podání nejefektivnější HT (HT + OFS). Mladé ženy s karcinomem prsu ve stádiu I nebo II, které nemohou užívat TX (z důvodu kontraindikací nebo závažných nežádoucích účinků), mohou být léčeny samotným LH-RH agonistou, oophorektomií nebo kombinací IA + LH-RH agonista. Podání IA bez OFS je u premenopauzálních žen kontraindikováno. U nemocných léčených OFS mají být monitorovány hladiny estradiolu, v případě nedostatečné suprese by měly být použity alternativní strategie (oophorektomie nebo samotný TX). Optimální délka OFS není známa, ačkoliv v recentních studiích byla standardem doba 5 let, obvyklá doba je 2–5 let. V případě, že je OFS indikována, měl by být použit goserelin 3,6 mg sc. 1× za 28 dní nebo je možno použít triptorelin v dávce 3 mg 1× za 28 dní (v této indikaci není hrazen). Je nutno mít na paměti, že u části pacientek LH-RH analoga nejsou účinná (ve studii SOFT mělo během prvního roku léčby 17 % pacientek trvale vyšší hodnoty estradiolu, než byl definovaný limit). Při terapii LH-RH analogy i při terapii s TX je vhodná pravidelná monitorace kostní denzity a krevního tlaku. Současné podávání inhibitorů CYP2D6 a TX není vhodné. U pacientek s germinální mutací BRCA1/2 lze v indikovaných případech (pacientky s reziduálním postižením po neoadjuvantní terapii s CPS + EG score ≥ 3 nebo pacientky s postižením ≥ 4 lymfatických uzlin po primárním operačním výkonu) zařadit adjuvantní léčbu olaparibem na dobu jednoho roku (studie OlympiA). V indikovaných případech lze u vysoce rizikových pacientek (pacientky s postižením ≥ 4 lymfatických uzlin nebo pacientky s postižením 1–3 lymfatických uzlin a G3 tumorem a/ nebo tumorem > 5 cm) podat kombinaci HT a abemaciklibu na dobu 2 let (studie MonarchE). U pacientek s germinální mutaci BRCA1/2, které splňují kritéria pro podání olaparibu i abemaciklibu, lze zvážit podání obou preparátů sekvenčně (adjuvantní podání olaparibu v kombinaci s HT, následně abemaciklib). Pro tento postup není stanovena úhrada. Indikace adjuvantní HT uvádí přehledně Tab. 7, možná schémata HT jsou zobrazena na Obr. 3.
Postmenopauzální pacientky
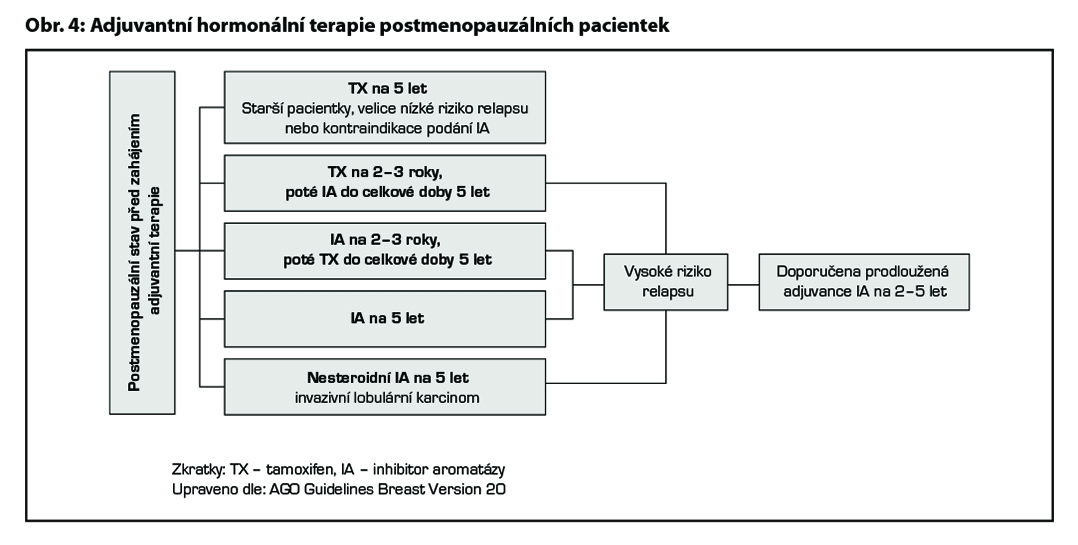
Definice menopauzy dle NCCN 2022: předchozí bilaterální ovarektomie, věk ≥60 let, věk <60 let a amenorea ≥12 měsíců za předpokladu, že není podávána CHT, TX nebo OFS a hladiny estradiolu a FSH jsou postmenopauzální. U žen mladších 60 let, léčených TX, pokud je estradiol a FSH v postmenopauzálním rozmezí. IA ve srovnání s TX přinášejí pacientkám asi 4% absolutní benefit v parametru DFS (pro upfront podání, switch po 2–3 letech léčby TX a prodlouženou léčbu po 5 letech TX), OS benefit je nesignifikantní (1–2 %). Podání IA déle než 5 let má význam pouze pro selektovanou skupinu nemocných s vyšším rizikem pozdního relapsu (velké tumory, pozitivní uzliny). Optimální trvání a režim HT není dosud znám. Léčbu doporučujeme podle individuálního rizika relapsu, komorbidit, profilu nežádoucích účinků a přání pacientky. Pacientky léčené TX nemají současně užívat inhibitory enzymu CYP2D6. V případě léčby IA má být monitorována kostní denzita (DEXA), zajištěn dostatečný přívod vápníku a vitamínu D. V případě použití IA u pacientek, které byly před CHT premenopauzální, je doporučována pravidelná monitorace hladin estradiolu a FSH, hlavně u pacientek mladších 45 let. Obdobně jako u premenopauzálních pacientek, tak i u postmenopauzálních, vysoce rizikových pacientek, lze v případě splnění indikačních kritérií podat do kombinace s IA abemaciklib, u pacientek s BRCA1/2 mutací lze zvážit podání olaparibu.
Indikace a možné režimy adjuvantní HT uvádí v přehledu Tab. 7 a Obr. 4.
Adjuvantní bisfosfonáty: postmenopauzální pacientky středního a vysokého rizika (kyselina zoledronová 4 mg iv. 1× za 6 měsíců po dobu 3–5 let nebo klodronát 1200 mg denně perorálně 2–3 roky).
12.3 Stadium IV – metastatické onemocnění
Obecná doporučení léčby metastatického onemocnění
V případě prvního relapsu onemocnění zvažovat provedení biopsie z metastatické léze k ověření subtypu karcinomu prsu (stanovení ER, PR, HER2 statusu, Ki67) a vyšetření prediktivních markerů – gBRCA mutace, somatická mutace PI3CA, ESR1 mutace, exprese PD-L1.
Systémová terapie metastatického onemocnění je léčebným standardem, ale v určitých případech (oligometastatické onemocnění, ovlivnění symptomů) může být doplněna lokoregionální terapií (chirurgické metody, RT, RFA…).
V případě smíšené léčebné odpovědi je vhodné vzít v úvahu heterogenitu nádorového onemocnění a zvážit provedení rebiopsie (histologické vyšetření, individuálně provedení NGS).
U metastatického onemocnění je možné použít již dříve účinného léčebný režim (rechallenge).
Provedení NGS zvažovat v případě, že výsledek vyšetření může ovlivnit další léčebný postup. Vyšetření je indikováno multidisciplinárním týmem v KOC (MTB – Molecular tumor board).
Oligometastatické onemocnění
U nemocných s de novo metastatickým onemocněním (stádium IV v době diagnózy) operace prsu nezlepšuje celkové přežití (OS). Oligometastatické onemocnění (1, maximálně 2 MTS léze) má být léčeno multimodálně. V závěru léčby má být použita další, definitivní léčba v místě metastatického onemocnění (operace, radioterapie). Je doporučeno histologické ověření takové léze biopsií. V případě 3 a více metastatických ložisek má být onemocnění léčeno podle standardů pro pokročilé onemocnění, se zařazením lokální léčby dle symptomů.
12.3.1 Léky ovlivňující metabolismus kosti (BMA – bone modifying agents)
• bisfosfonáty (klodronát, ibandronát, zoledronát, pamidronát),
• monoklonální protilátka denosumab.
Indikovány při zjištění osteolytických, osteoblastických nebo smíšených metastáz do osového skeletu (dg. dle radiologických metod – RTG, CT, MRI).
Všechny pacientky by měly mít vyšetřenu dutinu ústní a případné dentální zákroky by měly být provedeny před zahájením terapie BMA.
Z důvodu zvyšující se incidence osteonekrózy čelisti při dlouhodobém podávání některých bisfosfonátů je u těchto nutno zvážit benefit terapie trvající déle než 2 roky. Dle nových dat lze bisfosfonát již iniciálně podávat 1× za 3 měsíce. Denosumab je podáván 1× za 4–6 týdnů (data bezpečnosti na dobu 5 let).
12.3.2 Terapie metastatického HR+/HER2 negativního karcinomu prsu:
Definice hormonální rezistence:
Primární hormonální rezistence: k progresi onemocnění dojde v prvních 2 letech podávání adjuvantní HT nebo do 6 měsíců podání první linie HT u metastatického onemocnění.
Sekundární (získaná) hormonální rezistence: k progresi onemocnění dojde po více jak 2 letech podávání adjuvantní HT nebo do 12 měsíců od ukončení adjuvantní HT nebo za více jak 6 měsíců od zahájení úvodní HT pro metastatický karcinom prsu.
Premenopauzální pacientky jsou léčeny stejně jako postmenopauzální pacientky. Je nutné provést OFS nebo ablaci. Možné metody ablace (suprese): chirurgická bilaterální adnexektomie, podání LH-RH analog, radiační kastrace.
Výběr úvodní linie u luminálního MBC je závislý na typu a délce adjuvantní HT, DFI, rozsahu postižení, biologickému věku pacientky, PS, potřebě rychlé kontroly nemoci, preferencím pacientky, na sociálně-ekonomických a psychologických faktorech, na spolupráci pacientky.
První linie léčby:
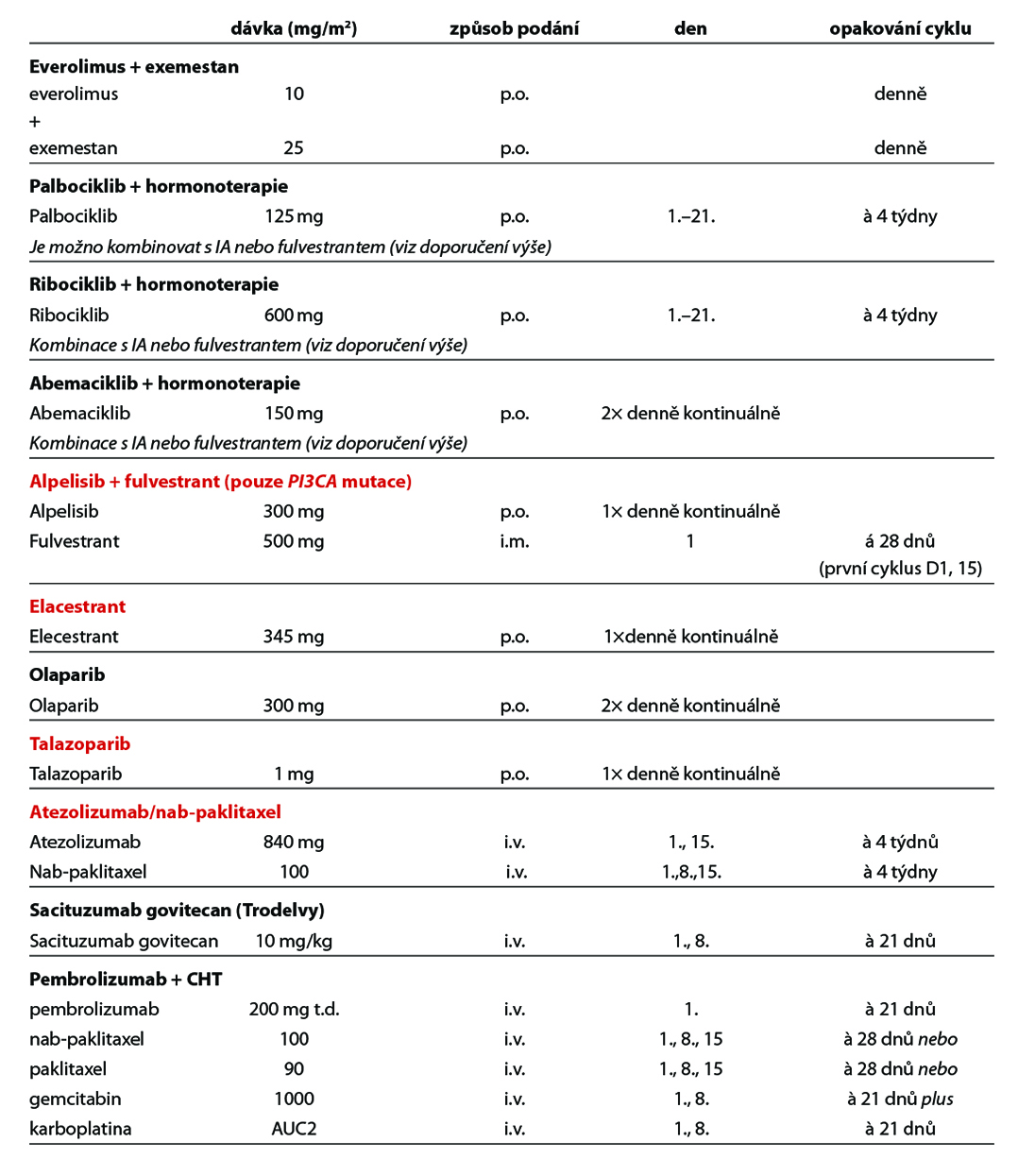
Kombinace HT a inhibitoru CDK 4/6 je standardní léčebnou modalitou. Použít lze kombinaci IA + inhibitoru CDK 4/6, popř. fulvestrant + inhibitor CDK 4/6 – volba kombinace dle parametrů viz výše. Z inhibitorů CDK 4/6 lze volit abemaciklib, palbociklib nebo ribociklib.
Lze také podat pouze HT samotnou – IA, TX nebo fulvestrant (hrazen pouze u pacientek nepředléčených HT a bez viscerálních MTS) a to u skupiny pacientek se závažnými komorbiditami nebo při špatném PS, při non-compliance pacientky. U pacientek s viscerální krizí je lékem volby paliativní CHT, v případě hrozící viscerální krize lze však volit kombinaci IA + ribociklibu (studie RIGHT Choice).
Druhá linie léčby:
Po selhání kombinace HT+ inhibitor CDK 4/6 – vhodné stanovit BRCA status, popř. PIK3CA a ESR1 mutační stav.
Optimální sekvence 2. a dalších linií není jednoznačně známá, záleží na výběru předchozí HT v neo/adjuvanci, kombinaci
v 1. linii, trvání efektu předchozí HT, rozsahu onemocnění, preferencích pacientky.
Léčebné možnosti jsou:
- fulvestran + CDK4/6i (pokud nebyl podán v rámci I. linie),
- exemestan + everolimus,
- v případě PIK3CA mutace kombinace alpelisib + fulvestrant,
- v případě BRCA1/2 mutace PARP inhibitor – olaparib (úhrada pouze pro pacientky nevhodné k další HT a nepředléčené CHT pro metastatické onemocnění) nebo talazoparib,
- v případě ESR1 mutace elacestrant
- monoterapie – fulvestrant, TX,
- CHT – preferována u pacientek s hrozícím orgánovým selháním.
Třetí a další linie léčby:
U pacientek s hormonálně sensitivním onemocněním je vhodné pokračovat v HT lékem, který doposud nebyl použit. U nádorů hormonálně rezistentních je preferována CHT – v monoterapii, preference kombinované CHT pouze při výrazných klinických symptomech a hrozícímu orgánového selhání. Z cytostatik lze volit antracyklin, taxan, kapecitabin, eribulin, vinorelbin, gemcitabin – sekvence jednotlivých cytostatik dle NÚL, předléčení, PS, compliance, preference pacientky. U pacientek s již limitovanými léčebnými možnostmi lze provést NGS vyšetření, ideálně z aktuálně provedené biopsie. Cílem je detekovat genovou alteraci, kterou lze léčebně ovlivnit. Terapii lze podat na základě doporučení MTB (molekulárního tumor boardu), úhradu je nutno následně řešit přes paragraf 16.
U pacientek s HR+/HER2 low karcinomem (IHC 1+ nebo 2+ bez amplifikace HER2 genu dle ISH/FISH) je možné podání trastuzumabu deruxtekanu u pacientek předléčených minimálně jedním režimem CHT pro metastatické onemocnění, nebo u kterých došlo k recidivě onemocnění během adjuvantní CHT nebo do 6 měsíců od jejího ukončení. V této indikaci není stanovena úhrada.
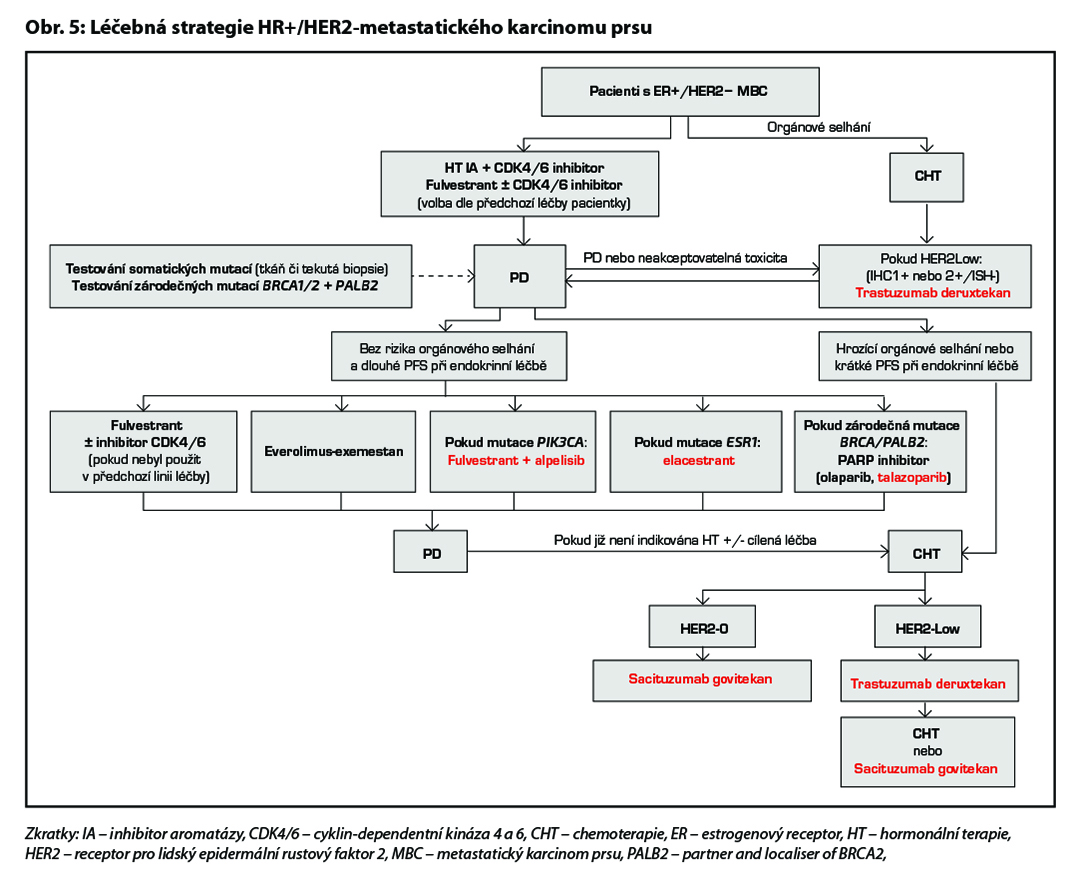
U pacientek HR+/HER2 0 dle IHC, které v rámci předchozí léčby podstoupily HT a alespoň dvě další systémové terapie pro pokročilé onemocnění, je možná terapie sacituzumabem govitecanem. Pro tuto indikaci není stanovena úhrada. Léčebná strategie HR+/HER2 negativního metastatického karcinomu prsu je zobrazena na Obr. 5.
PARP – poly(ADP-ribóza) polymeráza, PD – progrese onemocnění, PIK3CA – katalytická alfa podjednotka phosphatidylinositol-4,5-biphosphonate 3-kinázy
Upraveno dle ESMO MBC guidelines: Gennari et al, Ann Oncol 2021 + ESMO living guidelines: https://www.esmo.org/living-guidelines/esmo-metastatic-breast-cancer-living-guideline
12.3.3 Terapie metastatického HER2 pozitivního karcinomu prsu
Všechny pacientky s HER2 pozitivním metastatickým karcinomem prsu by měly být léčeny anti-HER2 léčbou. Výjimkou jsou pouze ty pacientky, u kterých je anti-HER2 léčba kontraindikována. Po selhání první linie anti-HER2 léčby by měla být pacientce nabídnuty další linie anti-HER2 léčby (kontinuální anti-HER2 blokáda je zásadní k dosažení dlouhodobé kontroly
onemocnění). U pacientek s diseminovaným HER2 pozitivním karcinomem prsu, které dosáhly CR, není jednoznačně stanovena optimální délka trvání anti-HER2 léčby po dosažení CR. Léčba je dlouhodobá, s přihlédnutím k benefitu a možným komplikacím.
První linie léčby
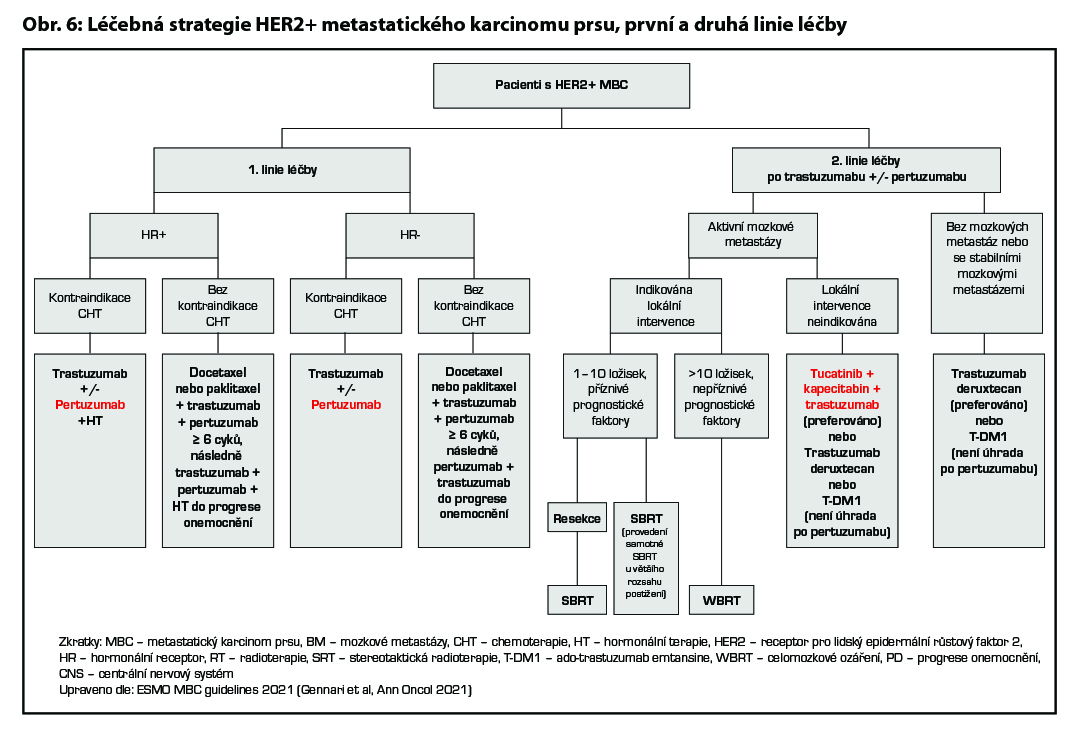
Nejefektivnější léčbou v 1. linii je kombinace taxánu a duální anti-HER2 terapie (trastuzumab + pertuzumab). Pokud má pacientka kontraindikaci k taxanům, lze použit vinorelbin nebo kapecitabin (pro kombinaci s kapecitabinem není úhrada). Po ukončení alespoň 6 cyklů konkomitantní léčby s CHT by měly být pacientky léčené udržovací léčbou trastuzumab + pertuzumab až do progrese onemocnění. U pacientek s HR+ přidat HT, u premenopauzálních pacientek v kombinaci s OFS. U pacientek s relapsem onemocnění v průběhu neo-/adjuvantní terapie nebo s relapsem do 6 měsíců od ukončení adjuvantní terapie (trastuzumab, duální anti-HER2 terapie, T-DM1) je nejefektivnějším preparátem 1. linie léčby trastuzumab deruxtekan (T-DXd). U pacientek s kontraindikací k CHT lze použít samotný trastuzumab, u pacientek s pozitivitou HR lze podat kombinaci trastuzumab + HT. Samotná HT není rutinně doporučená, pouze u pacientek s kontraindikací k anti HER2 léčbě.
Druhá linie léčby
Nejefektivnějším preparátem v rámci 2. linie po progresi onemocnění na kombinaci taxán + trastuzumab/pertuzumab je T-DXd (DESTINY-Breast03). Pokud byly pacientky léčeny v rámci I. linie T-DXd, lze jim ve 2. linii nabídnout kombinaci trastuzumab + kapecitabin + tukatinib, hlavně u pacientek s aktivním mozkovým postižením (v této indikaci není stanovena úhrada).
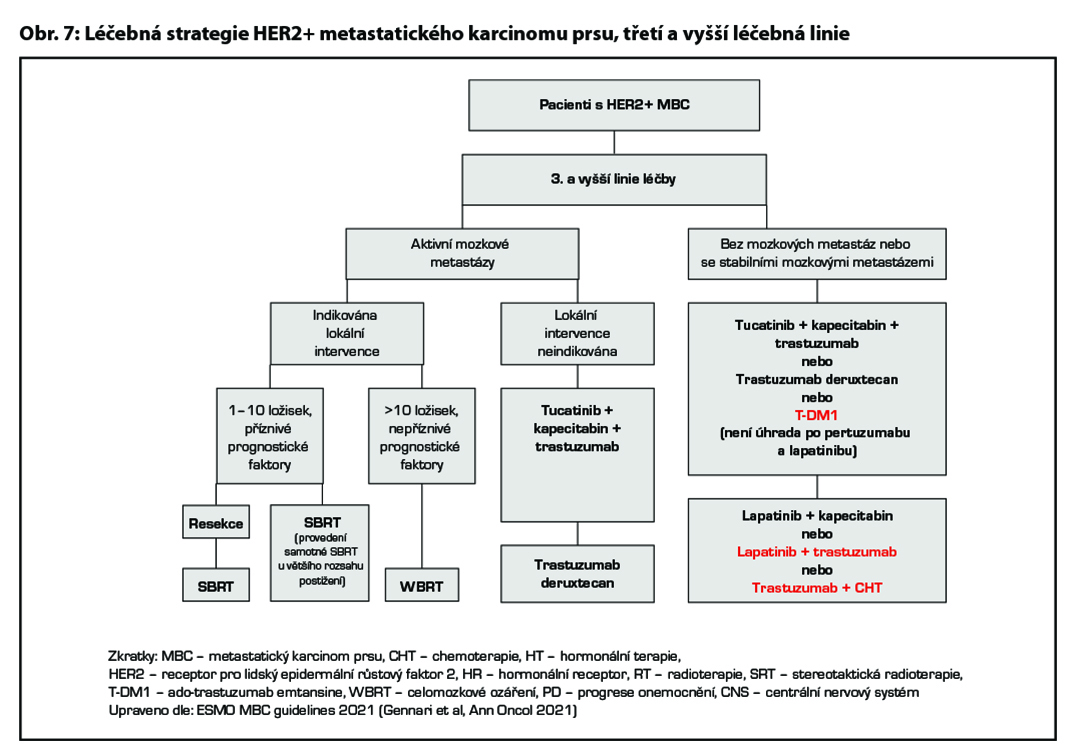
Třetí a další linie léčby
Volba terapie ve třetí a vyšších liniích léčby vždy závisí na léčbě v liniích předchozích, celkovém stavu pacientky i toxicitě předchozí léčby. Lze volit (dle předchozí léčby a přítomnosti aktivních mozkových metastáz) mezi léčbou kombinací tucatinib-kapecitabin-trastuzumab, trastuzumab deruxtekanem, T-DM1 (nemá úhradu po pertuzumabu a lapatinibu), případně pak lapatinib v kombinaci s kapecitabinem, lapatinibem v kombinaci s trastuzumabem (není úhrada) či kombinací trastuzumabu s CHT. Léčebná strategie metastatického HER2 pozitivního karcinomu prsu je zobrazena na Obr. 6 a Obr. 7.
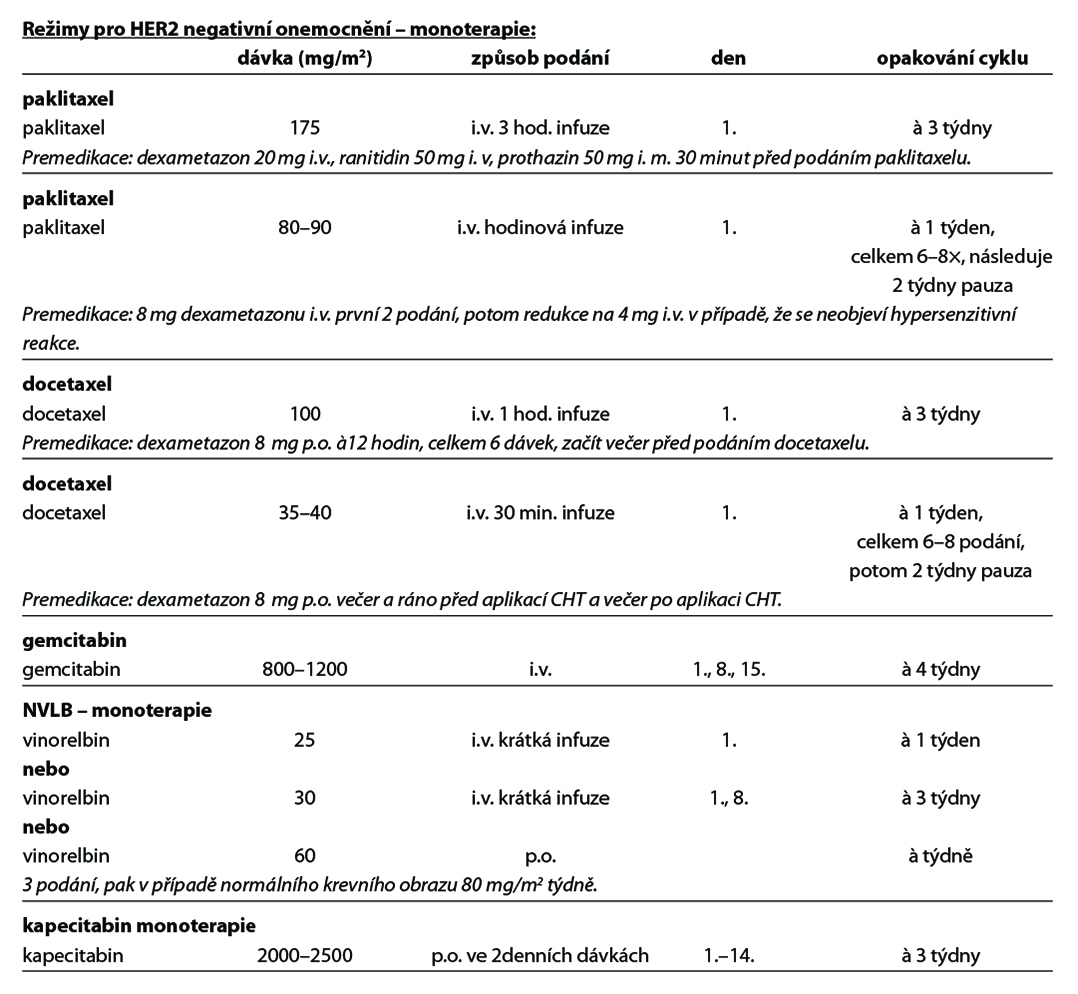
12.3.4 Terapie metastatického triple negativního karcinomu prsu
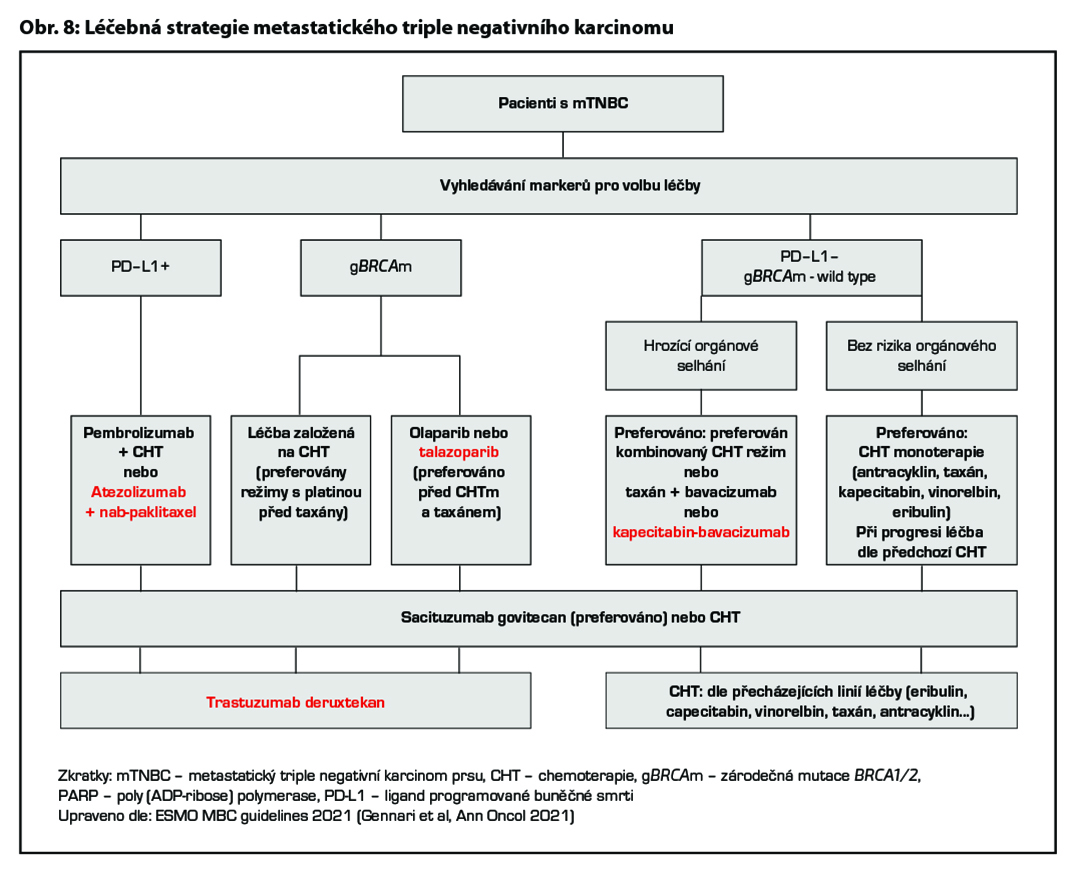
Terapie metastatického TNBC je dlouhodobě založena na CHT, nově je však vhodné zvažovat optimální léčebnou strategii na základě výsledku vyšetření prediktivních markerů. U pacientek s pozitivitou PD-L1 je indikováno podání kombinace imunoterapie (atezolizumab nebo pembrolizumab) a CHT, přičemž musí být splněna indikační kritéria pro pozitivitu PDL1 (pro atezolizumab ≥1 % dle Ventana SP142, nebo CPS ≥10 pro pem- brolizumab). Pacientky se zárodečnou mutací BRCA1 nebo BRCA2 jsou vhodné k léčbě PARP inhibitory za podmínky, že byly léčeny CHT s antracykliny a taxany v rámci neoadjuvantní nebo adjuvantní terapie, pokud tato terapie není kontraindikována a nebyly léčeny CHT pro metastatické onemocnění. Pokud je u této skupiny volena CHT, je vhodné zvážit podání platinového derivátu. U pacientek PD-L1 negativních s absencí zárodečné mutace BRCA1 nebo BRCA2 je léčba založena na CHT. U pacientek v dobrém klinickém stavu, s rychle progredujícím onemocněním a hrozícím orgánovým selháním lze volit kombinovaný chemoterapeutický režim s cílem dosažení co nejrychlejší léčebné odpovědi. U ostatních pacientek je vhodná léčba monoterapií. Konkrétní chemoterapeutický režim je volen dle klinického stavu pacientky, předchozí léčby a její efektivity. Při progresi onemocnění
je preferováno podání sacituzumabu govitecanu v rámci II. linie léčby. Při progresi onemocnění po II. linii léčby lze při dobrém klinickém stavu pacientky a léčebné odpovědi na předcházející linie pokračovat další linií paliativní CHT.
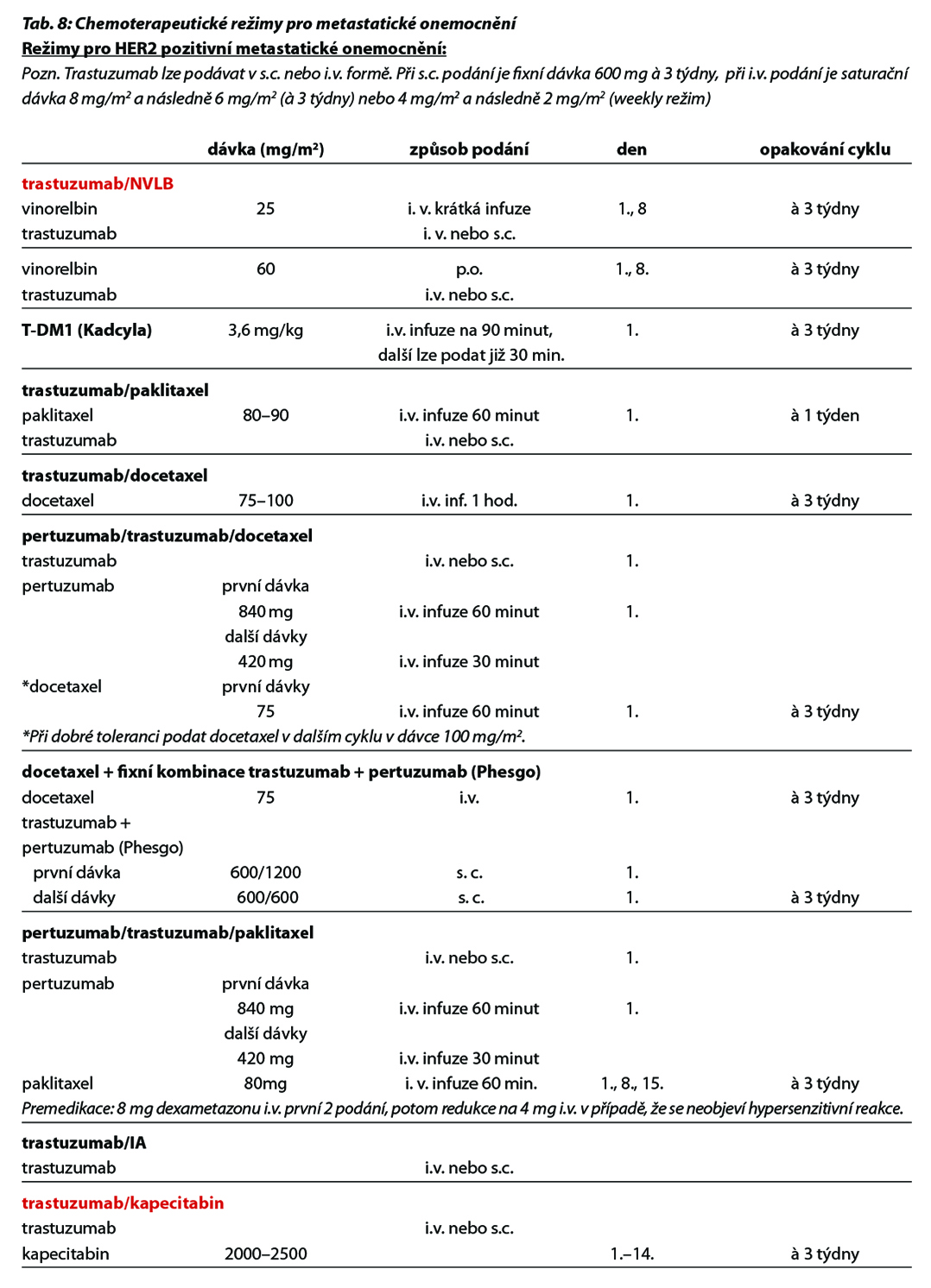
U pacientek s HER2 low karcinomem prsu (HER2 1+ nebo 2+ dle IHC bez amplifikace HER2 genu dle ISH), které podstoupily CHT v režimu pro metastazující karcinom, nebo u nichž došlo k recidivě onemocnění během adjuvantní CHT nebo do 6 měsíců od jejího ukončení, lze zvážit podání trastuzumabu deruxtekanu. Pro tuto indikaci není stanovena úhrada. Obecné doporučení pro léčbu metastatického triple negativního karcinomu prsu je zobrazeno na Obr. 8. Přehled režimů, které lze použít v rámci léčby metastatického karcinomu prsu, je uveden v Tab. 8.

12.4. Terapie karcinomu prsu u mužů
Terapie je analogií léčby karcinomu prsu u žen. Každý pacient by měl být indikován ke genetickému testování.
Časný karcinom prsu u mužů
U časného karcinomu prsu je terapie stejně jako u žen indikována na základě fenotypu nádoru. Adjuvantní CHT je indikována stejně jako u ženského karcinomu prsu. Adjuvantní HER2 blokáda je indikována stejně jako u ženského karcinomu prsu. V adjuvantní HT je preferován TX. Délka standardně na 5 let. U pacientů, kteří dobře HT tolerují a mají vysoké riziko relapsu onemocnění lze pokračovat v podávání TX do celkové doby 10 let. Možno je zvolit i IA, ale ten by měl být vždy podáván současně s LH-RH analogy. U mužů by neměly být podávány bisfosfonáty v adjuvantní indikaci redukce relapsu onemocnění.
Metastatický karcinom prsu u mužů
U HR+/HER2 – nádorů je indikována HT +- s podáním inhibitoru CDK4/6. Lze podat palbociklib a ribociklib, pro tyto preparáty jsou k dispozici data, pro ribociklib není stanovena úhrada, plabociklib je hrazen u mužů s mBC v dávce 125 mg a 100 mg. Dále je možno podat TX, fulvestrant a IA s LH-RH analogy v sekvencích stejně jako u ženského karcinomu prsu. Cílená terapie podle HR, HER2 statutu, PDL-1 statutu, mutace v PIK3CA a mutace v BRCA1/2 by měla mít stejné indikace a kombinace stejně jako je tomu u ženského karcinomu prsu: Potřeba je vždy ale kontrola, zda je úhrada i pro muže s nádorem prsu, většinově tomu tak není.
12.5 Doporučení pro follow-up pacientek po léčbě pro karcinom prsu stádia I-III
Klinické vyšetření jedou za 3–4 měsíce během prvních 2 let (každých 6 měsíců u pacientek s nízkým rizikem relapsu nebo DCIS), každých 6–8 měsíců 3.–5. rok (interval dle rizika relapsu). Bilaterální MG jednou za rok, s doplněním UZ nebo MRI dle potřeby. Provedení UZ zvážit hlavně u pacientek s lobulárním karcinomem prsu. U asymptomatických pacientek nejsou další vyšetření (biochemie, nádorové markery, RTG plic, UZ jater, CT, PET/CT) doporučena. Pravidelné vyšetření kostní denzity u pacientek léčených IA nebo OFS. Vhodné pacientky nabádat ke zdravému životnímu stylu (pravidelné cvičení, kontrola váhy). HRT by u pacientek po terapii pro karcinom prsu neměla být indikována. U pacientek po bilat. mastektomii (s/bez rekonstrukce) není pravidlené vyšetřování pomocí zobrazovacích metod indikováno.
Literatura:
- Gennari, A., André, F., Barrios, C. H., Cortes, J., De Azambuja, E., DeMichele, A., ... & Harbeck, N. (2021). ESMO Clinical Practice Guideline for the diagnosis,
staging and treatment of patients with metastatic breast cancer. Annals of oncology, 32(12), 1475-1495. - Balic, M., Thomssen, C., Gnant, M., & Harbeck, N. (2023). St. Gallen/Vienna 2023: Optimization of Treatment for Patients with Primary Breast Cancer–A Brief
Summary of the Consensus Discussion. Breast Care, 18(3), 213-222. - Gradishar, W. J., Moran, M. S., Abraham, J., Abramson, V., Aft, R., Agnese, D., ... & Kumar, R. (2023). NCCN Guidelines® Insights: Breast Cancer, Version 4.2023:
Featured Updates to the NCCN Guidelines. Journal of the National Comprehensive Cancer Network, 21(6), 594-608. - Allison, K. H., Hammond, M. E. H., Dowsett, M., McKernin, S. E., Carey, L. A., Fitzgibbons, P. L., ... & Wolff, A. C. (2020). Estrogen and progesterone receptor
testing in breast cancer: ASCO/CAP guideline update. - Wolff, A. C., Hammond, M. E. H., Allison, K. H., Harvey, B. E., Mangu, P. B., Bartlett, J. M., ... & Dowsett, M. (2018). Human epidermal growth factor receptor
2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline focused update. Archives of
pathology & laboratory medicine, 142(11), 1364-1382. - NCCN Guidelines Breast Cancer, ver. 1.2024, https://www.nccn.org/login?ReturnURL=https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf





