17.1 Epiteliální nádory
Následující doporučení odpovídají konsenzuálním guidelines ESMO-ESGO.
Každá pacientka s epiteliálním zhoubným nádorem vaječníků, tuby nebo peritonea je indikována ke genetické konzultaci a analýze germinálních a optimálně i somatických mutací genů BRCA1 a BRCA2. Seznam pracovišť klinické genetiky je dostupný na webu Společnosti lékařské genetiky ČLS JEP (www.slg.cz).
Chirurgický staging a chirurgická léčba by měla být prováděna s cílem optimální cytoredukce nádorových hmot. Přítomnost nádorového rezidua po chirurgické léčbě je nejvýznamnějším negativním prognostickým faktorem.
Podmínkou potencionálně kurativní chemoterapie je performance status ECOG 0, 1, 2, předpokládaná délka života více než 6 měsíců, interkurentní onemocnění umožňující dodržet kurativní dávku chemoterapie.
17.1.1 Primární léčba
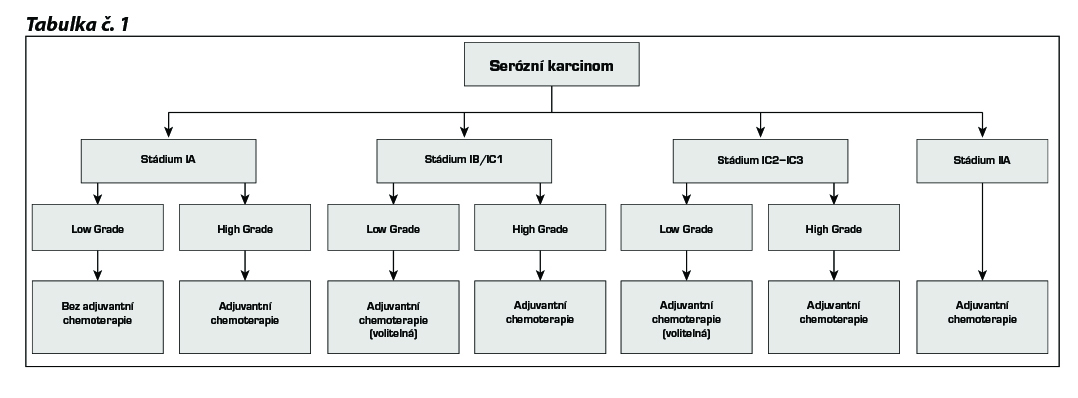
17.1.1.1 Stádium lA low grade
dispenzarizace bez adjuvantní chemoterapie (za podmínek úplné stagingové operace včetně systematické pánevní a
paraaortální lymfedenektomie)
17.1.1.2 Stadium lB a IC1, IC2, IC3 low grade – aplikace chemoterapie volitelná (3–6 cyklů)
paklitaxel + CBDCA (ev. alternativní režimy)
17.1.1.3 Stadium lA, IB, high grade – indikována aplikace chemoterapie (3–6 cyklů)
paklitaxel + CBDCA (ev. alternativní režimy)
17.1.1.4 Stadium IC1, IC2 a IC3 – high grade – indikována adjuvantní chemoterapie (3–6 cyklů)
paklitaxel + CBDCA (ev. alternativní režimy)
Neoadjuvantní chemoterapie je indikována u pacientek ve špatném celkovém stavu, u kterých není aktuálně možný rozsáhlý operační výkon a u pokročilých stadií onemocnění, u kterých je na základě zobrazovacích vyšetření malá pravděpodobnost dosažení optimálního debulkingu (žádné makroskopické reziduum nádoru na konci operačního výkonu).
Rozhodnutí o operačním výkonu (interval debulking surgery – IDS) nutno zvažovat po 3–4 cyklech.
17.1.1.5 Stadium II, III, IV bez ohledu na grade a histologický typ
Paklitaxel + CBDCA (ev. alternativní režimy), 6–9 cyklů. Ve stádiu IV nebo ve stádiu III s pooperačním reziduem nádoru větším než 1cm3 je indikováno doplnění kombinace o bevacizumab od 1. nebo 2. pooperačního cyklu (zahájení aplikace nejdříve 4 týdny po operaci), aplikace bevacizumabu do progrese onemocnění či neakceptovatelné toxicity nebo maximálně po celkovou dobu 12 měsíců. U III. stadia lze použít IP chemoterapii v případě rezidua menšího než 1 cm3 (intraperitoneální chemoterapie není vhodná u pacientek s operačními výkony na střevě v rámci primární cytoredukční operace).
Tato léčba by měla být prováděna na pracovištích, která mají s tímto přístupem zkušenosti
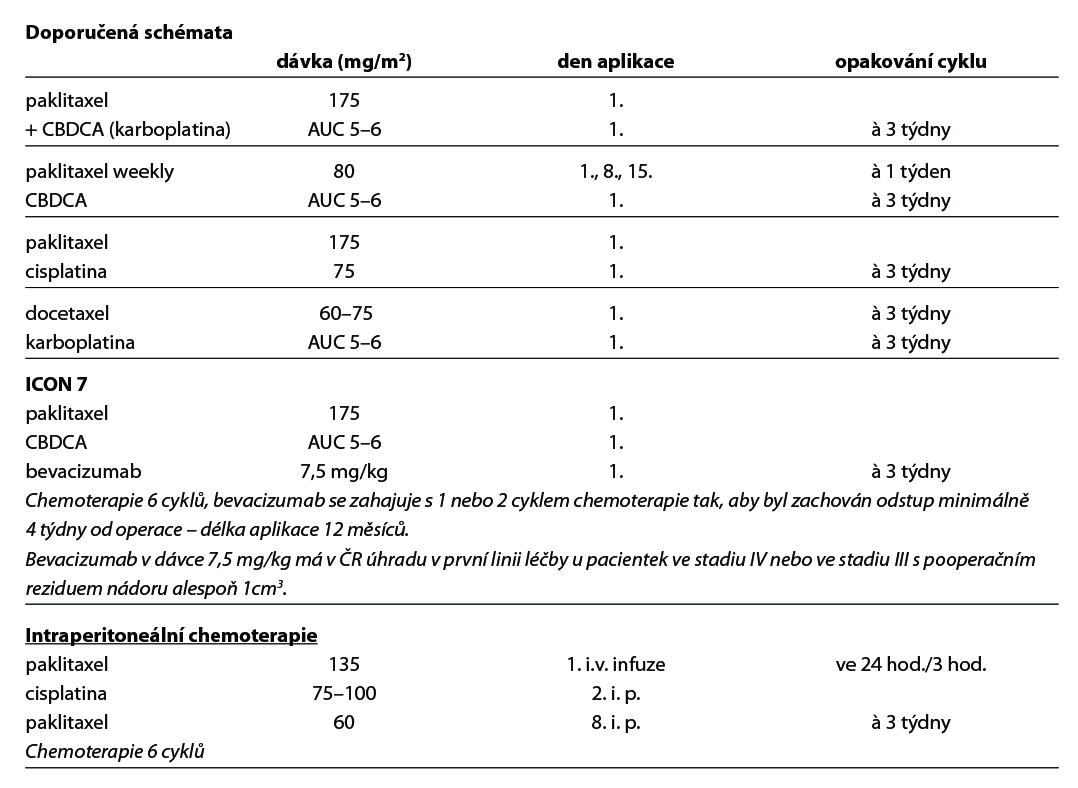
Hypertermická intraperitoneální chemoterapie ( HIPEC) není standardem léčby ovariálního karcinomu. Podrobně viz kapitola 39. Cytoredukční chirurgie a HIPEC.
U pacientek starších 70 let nebo ve špatném celkovém stavu či s četnými a závažnými komorbiditami má být upřednostněn kombinovaný weekly režim, event. redukce dávek před monoterapií platinovým derivátem. Kombinovaný režim s karboplatinou je standardem léčby v první linii.
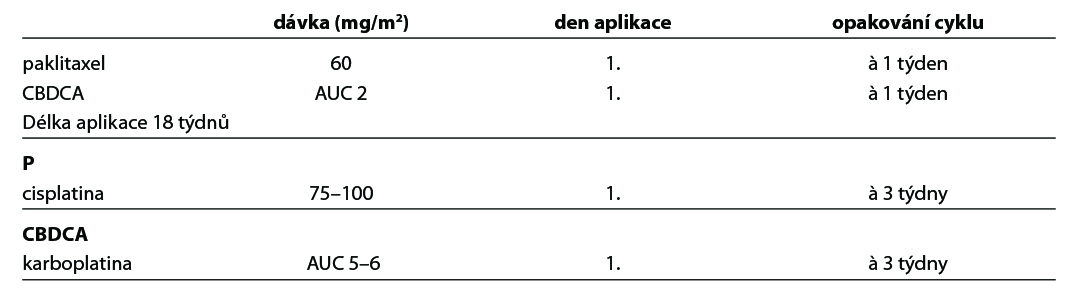
17.1.2 Chemoterapie jako součást léčby recidivujícího a progredujícího onemocnění
17.1.2.1 Pacientky, u nichž není předpoklad odpovědi na léčbu platinovým derivátem
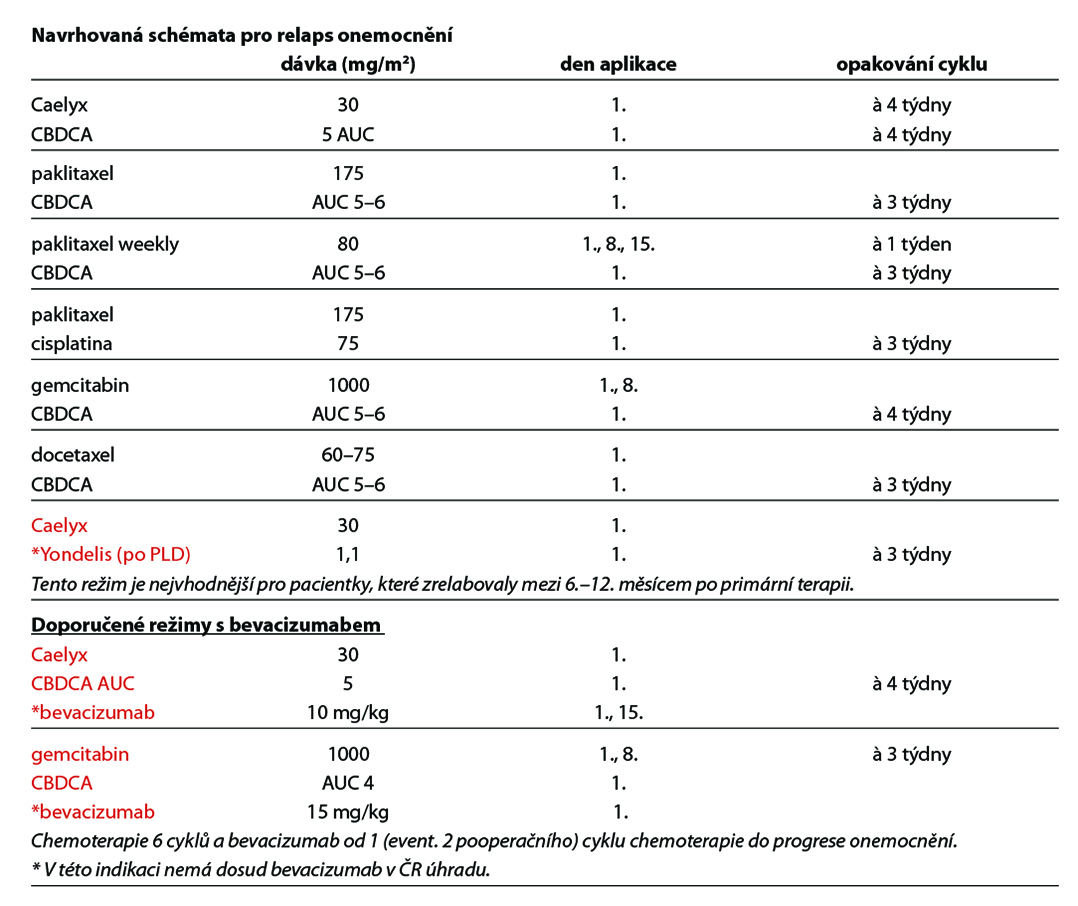
Zpravidla pacientky, u nichž je recidiva nebo progrese onemocnění diagnostikována v kratším časovém odstupu od předchozí linie s platinovým derivátem, nejčastěji v intervalu kratším než 6 měsíců, nebo pacientky progredující na léčbě platinovým derivátem. Ve II. a dalších linií lze doporučit léčbu monoterapií nebo kombinaci s bevacizumabem. Chirurgický vstup má pouze paliativní záměr – např. ileózní stav, atd. V této skupině pacientek lze předpokládat přibližně stejnou pravděpodobnost odpovědi na chemoterapii u všech používaných agens. U vybraných pacientek lze očekávat největší benefit při kombinaci s bevacizumabem. Bevacizumab lze kombinovat s paklitaxelem, topotekanem nebo pegylovaným liposomálním doxorubicinem, nejvhodnější je kombinace s paklitaxelem. Bevacizumab je v této indikaci hrazen pacientkám, které nebyly léčeny více než dvěma předchozími liniemi chemoterapie.

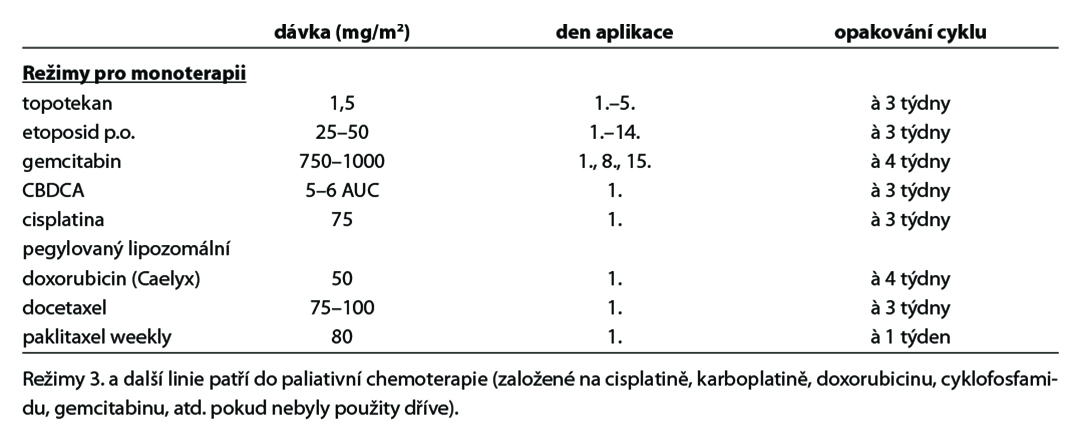
Doporučené režimy u pacientek předléčených bevacizumabem, nebo režimy vyšších linií
A/ gemcitabine 800 mg/m2 i.v. v týdenním režimu (weekly)
B/ etoposide 50 mg/m2 p.o. 10–14 dnů se 14 denní pauzou (perorální etoposid není t.č. v ČR dostupný)
C/ liposomální doxorubicin 50 mg/m2 i.v. (interval 28 dnů)
D/ doxorubicin 50 mg/m2 i.v. (interval 28 dnů)
E/ docetaxel 100 mg/m2 i.v. (interval 21 dnů)
F/ paklitaxel 80mg/m2 i.v. v týdenním režimu (weekly)
G/ topotecan 1,5 mg/m2 i.v. 1.–5. den (interval 28 dnů)
17.1.2.2 Pacientky, u nichž je předpoklad odpovědi na léčbu platinovým derivátem
Zpravidla pacientky, u nichž je diagnostikována recidiva/progrese onemocnění po době delší než 6 měsíců od ukončení předchozí linie chemoterapie s platinovým derivátem. Sekundární debulking je doporučovaný při relapsu onemocnění minimálně po 6 měsících od primární léčby (1. recidiva onemocnění), preferovaným postupem je však provedení debulkingu v případě progrese po 12 a více měsících. Prospektivní randomizovaná studie fáze III (AGO DESKTOP III/ENGOT ov20) prokázala benefit sekundárního debulkingu při dosažení nulového pooperačního rezidua (prodloužení PFS i OS). Nejvhodnější k operaci je solitární recidiva u pacientek v dobrém celkovém stavu. Pozitivní tzv. AGO skóre (ECOG PS 0, ascites ≤500 ml, R0 při primární operaci) predikuje dosažení nulového nádorového rezidua s pravděpodobností až 75 % (záleží na zkušenosti pracoviště). U žen s dobrým výkonnostním stavem a/nebo chirurgicky odstraněnou recidivou je chemoterapie potencionálně kurativní. Chemoterapie má potenciál dosažení dlouhodobé remise.
Při rozhodování o typu chemoterapie je nutno zvažovat kvalitu života s ohledem na další toxicitu léčby. Kombinovaná chemoterapie založená na platinovém derivátu v této skupině dosahuje lepších výsledků než monoterapie. Preferovaným režimem je na základě prospektivních randomizovaných studií fáze III kombinace CBDCA + pegylovaný liposomalní doxorubicin (CALYPSO) + bevacizumab (AGO-OVAR2.21/ENGOT ov-18). U pacientek dosud neléčených antiangiogenní léčbou je možná kombinace karboplatina/gemcitabin/bevacizumab.
Možné kombinace cytostatik jsou založeny na kombinaci s platinovým derivátem, 6 až 8 cyklů. U vybraných pacientek s recidivujícím onemocněním a TFI <6 měsíců může být znovu zvažován i platinový derivát („platinum based re- -challenge“), pokud není známa kontraindikace nebo pacientka nemá refrakterní, rezistentní onemocnění (progrese během nebo časná symptomatická progrese po jejím ukončení).
17.1.3 Terapie inhibitory PARP
Každá pacientka s epiteliálním ovariálním karcinomem bez ohledu na věk, histotyp a rodinnou anamnézu je indikována k vyšetření germinálních (gBRCA), optimálně i somatických (sBRCA) mutací genů BRCA1 a BRCA2.
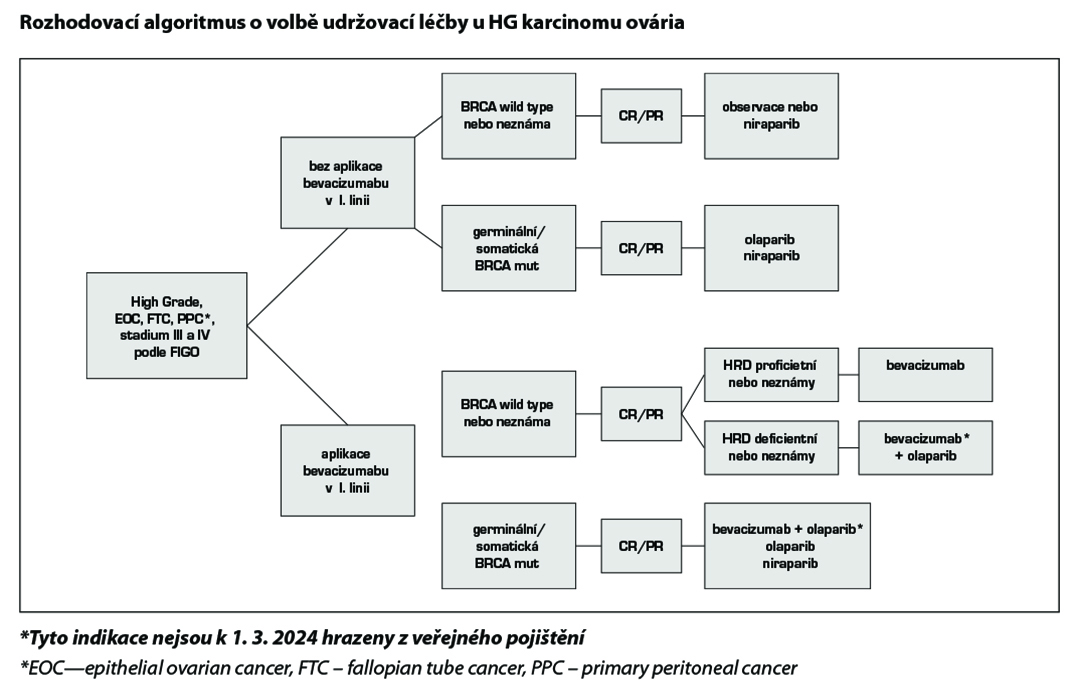
Každá pacientka s pokročilým high-grade serózním nebo high-grade endometroidním karcinomem ovaria, která nemá progresi onemocnění po dokončení chemoterapie po primární nebo intervalové debulkingové operaci by měla být léčena PARP inhibitory v udržovací léčbě.
Oba aktuálně dostupné PARP inhibitory (olaparib a niraparib) prokázaly účinnost u pacientek s germinální i somatickou mutací genů BRCA1/2, niraparib má k dispozici data účinnosti i v neselektované populaci pacientek. Léčbu olaparibem je nutné zahájit do 8 týdnů od ukončení chemoterapie a trvá do netolerovatelné toxicity, progrese onemocnění, nebo maximálně po dobu 2 let. Léčbu niraparibem je nutné zahájit do 12 týdnů od ukončení chemoterapie a trvá do netolerovatelné toxicity, progrese onemocnění, nebo maximálně po dobu 3 let. Oba přípravky mají mírně odlišný profil toxicity, dosud nejsou k dispozici komparativní studie obou preparátů.
17.1.3.1 Maintenance terapie olaparibem
Přípravek Lynparza je indikován:
– v monoterapii k udržovací léčbě dospělých pacientek s relabujícím high grade serózním epiteliálním karcinomem vaječníku, vejcovodu, nebo primárně peritoneálním tumorem ve II. a vyšší linii s mutací BRCA (zárodečnou a/nebo somatickou) citlivým na léčbu platinou, u nichž došlo k relapsu onemocnění a které odpovídají (úplně nebo částečně) na chemoterapii založenou na platině. Přípravek Lynparza je hrazen z veřejného zdravotního pojištění. Léčba olaparibem má být zahájena nejpozději 8 týdnu po podání poslední série chemoterapie s platinovým derivátem.

– k udržovací léčbě u nově diagnostikovaných pacientek s pokročilým (stádium FIGO III, FIGO IV) high-grade serózním či endometroidním epiteliálním karcinomem vaječníku, tuby a primárním peritoneálním tumorem, které po chemoterapii na bázi platiny dosáhly odpověď charakteru PR nebo CR . V registrační studii (SOLO1) byly pacientky léčeny tabletami olaparibu v dávce 300 mg 2× denně. Jedná se o pacientky nepředléčené bevacizumabem, ve stavu výkonnosti 0-1 dle ECOG. Léčba olaparibem je hrazena do progrese onemocnění nebo neakceptovatelné toxicity. U pacientek s přetrvávající kompletní remisí je úhrada navíc omezena vyčerpáním dvou let léčby, po dvou letech mohou v léčbě pokračovat pouze pacientky s reziduálním onemocněním (přetrvávající parciální remisí).

Lynparza v kombinaci s bevacizumabem je indikována pro:
udržovací léčbu pacientek s pokročilým high–grade epiteliálním karcinomem vaječníků, vejcovodu nebo primárním peritoneálním karcinomem (FIGO III a IV), které dosáhly odpověď (úplnou nebo částečnou) po dokončení první linie chemoterapie na bázi platiny, a které mají potvrzený deficit homologní rekombinace (HRD) definovaný buď mutací BRCA 1, BRCA 2 a/nebo genomovou nestabilitou.

Dle aktuálních ESMO guidelines je doporučeno testování genomické nestability (HRD), neboť pomocí tohoto testu lze identifikovat podskupinu pacientek, které mají nemutovaný typ genu BRCA, avšak mohou mít prospěch z léčby inhibitorem PARP. Nemocné s pozitivitou HRD a objektivní odpovědí na prvoliniovou chemoterapii na bázi platiny s bevacizumabem nebo bez něj by měly podstoupit udržovací léčbu inhibitorem PARP, a to buď olaparibem v kombinaci s bevacizumabem (pokud byl podáván zároveň s chemoterapií v 1. linii) nebo niraparibem v monoterapii.
* V současnosti v ČR není k dispozici běžně dostupný, ze zdravotního pojištění hrazený, validovaný test pro stanovení HRD.
** V ČR není bevacizumab v dávce 15 mg/kg v kombinaci s olaparibem (studie PAOLA-1) v této indikaci hrazený ze zdravotního pojištění, v případě indikace je nutné schválení zdravotní pojišťovnou.
17.1.3.2 Maintenance terapie niraparibem
Přípravek Zejula je indikován bez ohledu na mutační statut (tzn. i u gBRCA nebo sBRCA negativních pacientek):
– jako monoterapie k udržovací léčbě dospělých pacientek s pokročilým high grade serózním či endometroidním epiteliálním karcinomem vaječníků (stadia FIGO III a IV), vejcovodů nebo primárním karcinomem peritonea, které odpovídají (úplná nebo částečná odpověď) po dokončení první linie chemoterapie založené na platině. Jedná se o pacientky nepředléčéné bevacizumabem ve výkonnostním stavu PS 0-1. Udržovací terapie by měla být zahájena do 12 týdnů od poslední aplikace chemoterapie. Terapie je hrazena do progrese onemocnění nebo neakceptovatelné toxicity a maximální délka terapie jsou 3 roky (36 měsíců).

– jako monoterapie k udržovací léčbě dospělých pacientek s rekurentním na léčbu platinou senzitivním high-grade serózním epiteliálním karcinomem vaječníků, vejcovodů nebo primárním karcinomem peritonea, které odpovídají (úplná nebo částečná odpověď) na chemoterapii založenou na platině.
Finální analýza dat registrační studie NOVA však neuvádí benefit OS ve skupině pacientek bez defektu homologní rekombinace (resp. bez mutací genů BRCA1 a BRCA2). Na základě těchto dat doporučila FDA stáhnout indikaci pro wtBRCA pacientky. V evropské registraci a SPC však tato indikace zůstává. Udržovací léčbu niraparibem v této indikaci u wtBRCA pacientek je tak třeba volit s ohledem na očekávaný benefit a případné schválení úhrady.

17.2 Ostatní epiteliální ovariální ZN
17.2.1 Chemoterapie jako součást primární léčby
Po chirurgické léčbě neepiteliálních ovariálních ZN nutno považovat primární chemoterapii za kurativní. Následující doporučení odpovídajíj konsenzuálním guidelines ESMO-ESGO.
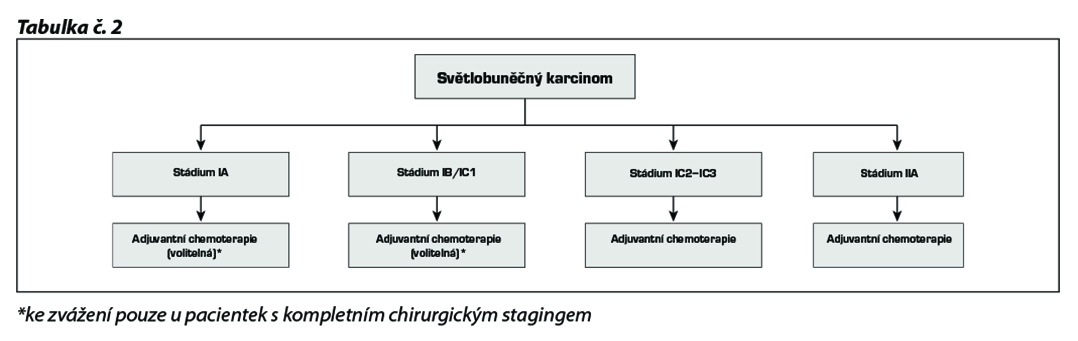
17.2.1.1 Clear cell karcinomy ovaria
Po kompletním chirurgickém stagingu či radikální operaci je další terapie shodná s high grade epiteliálními karcinomy ovaria.
17.2.1.2 Karcinosarkom (Maligní smíšený Mulleriánský tumor)
Po kompletním chirurgickém stagingu či radikální operaci je další terapie shodná s high-grade epiteliálními karcinomy ovaria.
Dále lze použít chemoterapeutické režimy: DDP/IFO, CBDCA/IFO, IFO/paklitaxel.
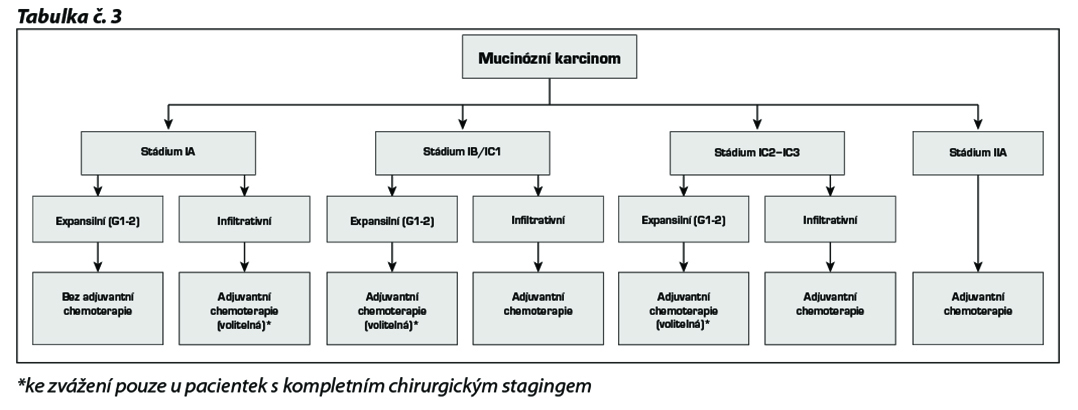
17.2.1.3 Mucinózní karcinom
U tohoto karcinomu by mělo být v rámci stagingových vyšetření provedeno došetření GIT-u (GFS, koloskopie) a stanovení hladiny CEA. U tohoto histotypu je možné kromě chemoterapie platinový derivát / taxan zvážit i chemoterapii režimem FOLFOX nebo XELOX.
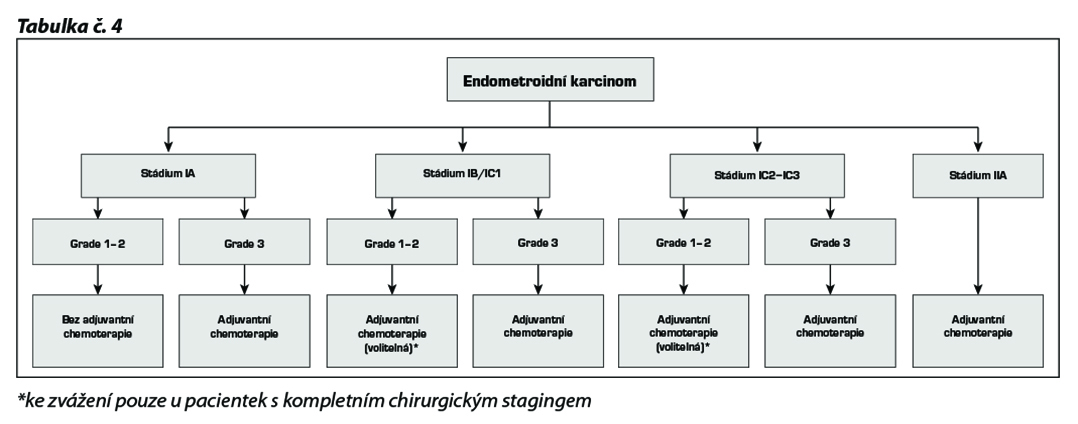
17.2.1.4 Low grade serózní /endometroidní karcinom
U této histologie lze kromě chemoterapie, která je shodná s režimy používanými u high-grade ovariálních karcinomů, zvážit v případě low grade karcinomů i hormonoterapii – inhibitory aromatázy (anastrozol, letrozol, exemestan), leuprolid acetátem či tamoxifenem. Pro pacientky s recidivujícím progredujícím low grade serózním karcinomem je po selhání chemoterapie na bázi platiny účinný MEK inhibitor trametinib (v dávce 2 mg p.o./24 hod).
V ČR nemá t. č. úhradu.
17.3. Neepiteliální ovariální ZN
17.3.1.1 Germinální ZN
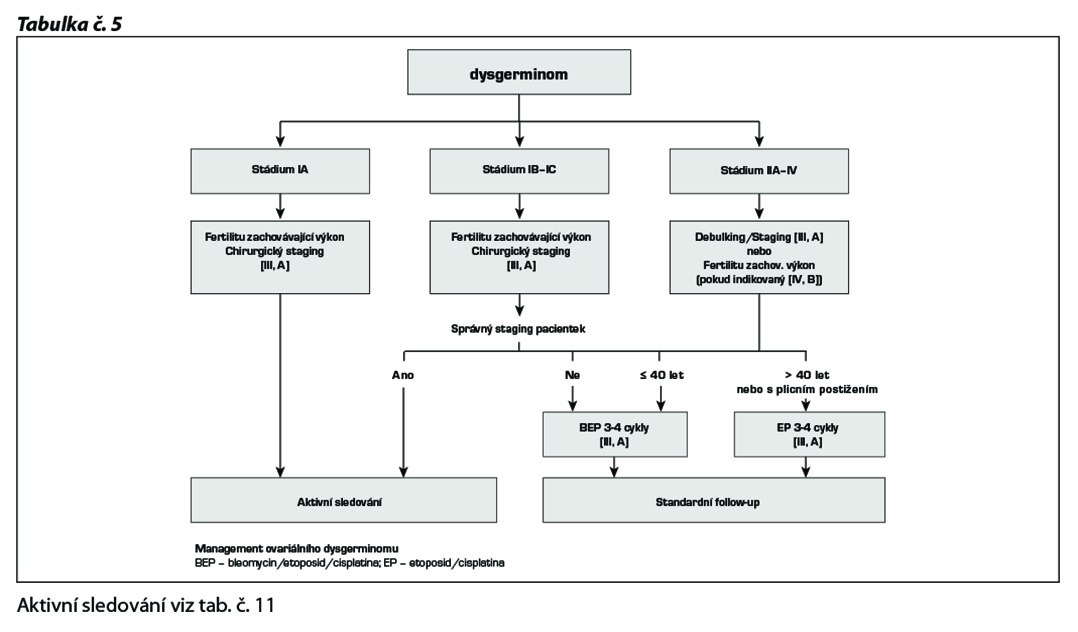
Management terapie dysgerminomu
Management terapie nezralého teratomu

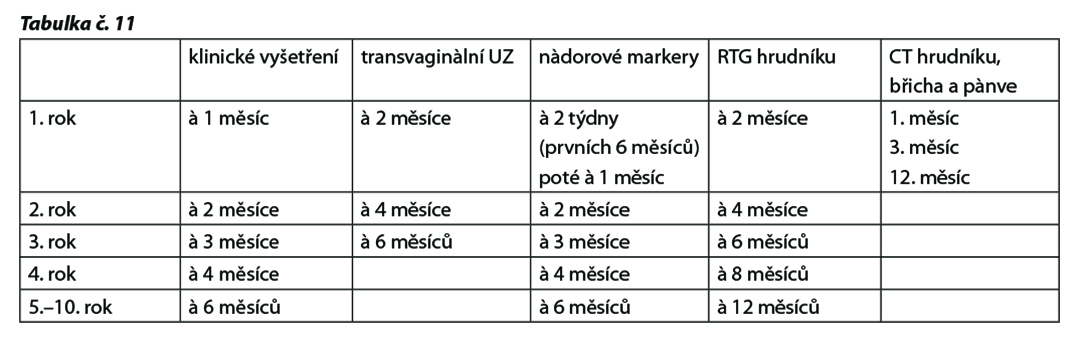
Aktivní sledování viz tab. č. 11
Adjuvantní chemoterapie ve stádiu IA grade 2 a 3 a ve stádiu IB a IC zůstává kontroverzní.
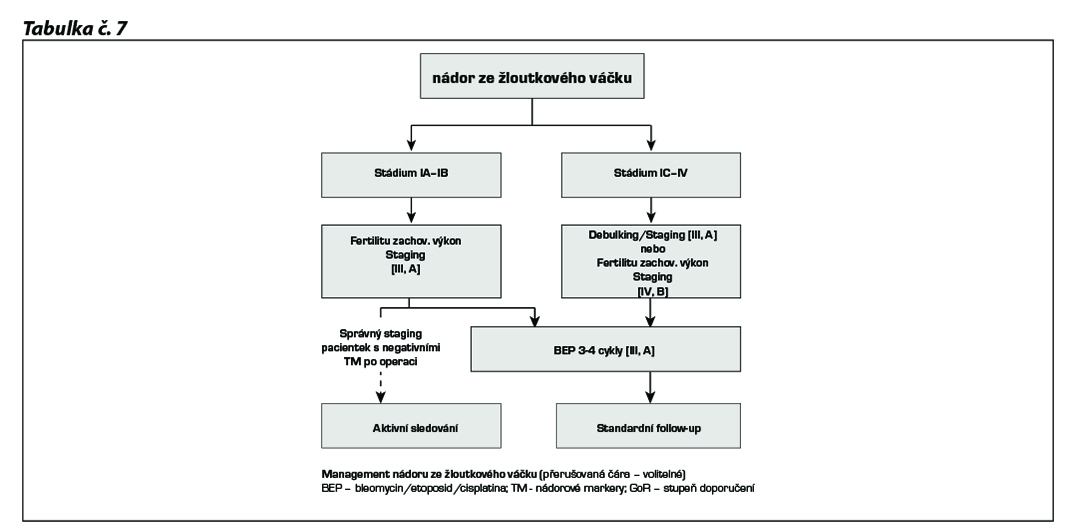
Management tumoru ze žloutkového váčku
Aktivní sledování viz tab. č. 11
U yolk-sac tumorů ve stádiu IA - IB lze zvážit aktivní sledování v případě kompletního stagingu a při negativních pooperačních tumorových markerech (hladina AFP), ale tento přístup není univerzálně akceptovaný a je nutné ho diskutovat s pacientkou.
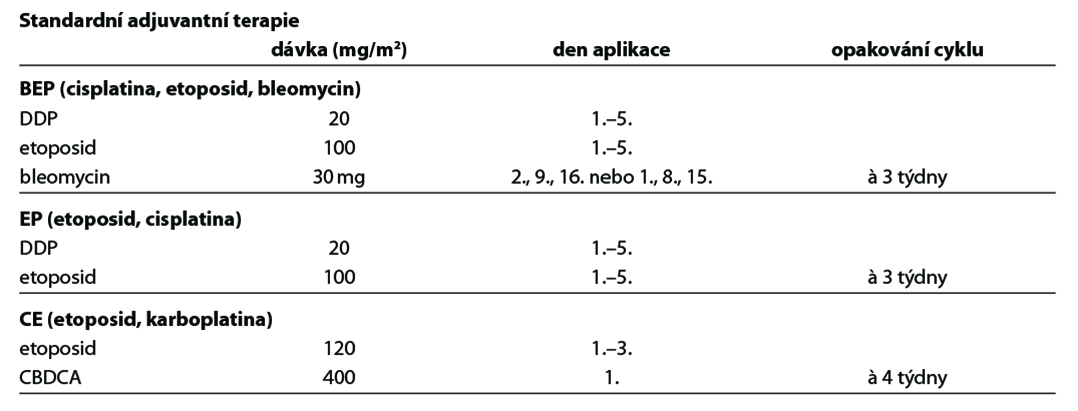
Nejčastěji používanou kombinovanou chemoterapií u germinálních tumorů je 5denní BEP.
Neexistuje standardní doporučení pro rekurentní onemocnění, zejména „salvage“ terapii. Lze zvážit léčbu jako u testikulárních a/nebo extragonadálních germinálních nádorů [režimy na bázi cisplatiny, ifosfamidu, paklitaxelu: VeIP (vinblastin, IFO, DDP), TIP (paklitaxel, IFO, DDP), VAC (vinkristin, daktinomycin, cyklofosfamid), paklitaxel/gemcitabin, paklitaxel/CBDCA, docetaxel/CBDCA, paklitaxel/IFO]. Pacientky s platina-refrakterním a rezistentním onemocněním mají při recidivě horší prognózu.
17.3.1.2. Nádory ze zárodečných pruhů a stromatu gonád
Management granulosa cell tumorů
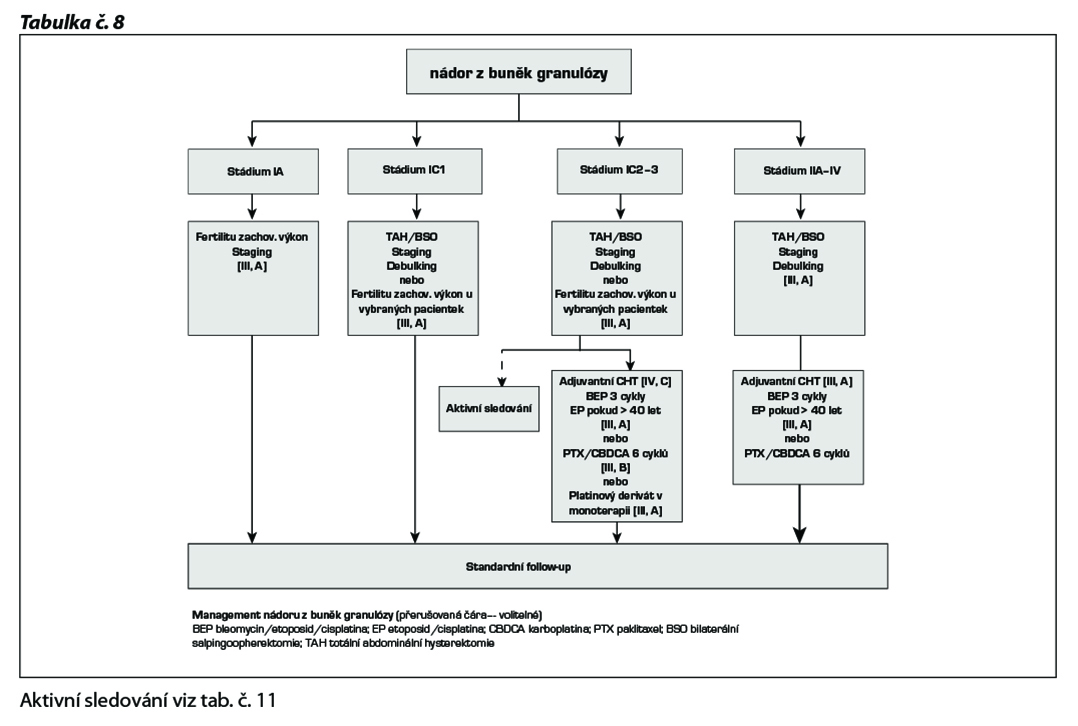
Nejčastěji používané režimy:
• BEP (cisplatina, etoposid, bleomycin), EP (cisplatina, etoposid)
• Paklitaxel/CBDCA (akceptovatelná alternativa režimu BEP/EP)
• CAP (cyklofosfamid, doxorubicin, cisplatina) nebo
• platinový derivát v monoterapii
Bleomycin by neměl být aplikovaný u pacientek starších 40 let nebo u těch, které mají již existující plicní onemocnění.
Další alternativní režimy :
• BIP (cisplatina, ifosfamid, bleomycin)
• paklitaxel / IFO, paklitaxel / gemcitabin
V této indikaci lze v případě recidivy onemocnění u pacientek zvážit i hormonoterapii IA ( letrozol, anastrozol), tamoxifen, leuprolin acetát (GnRH analog). V rámci klinických studií je popisovaný i efekt bevacizumabu.
Poznámka: cisplatinu lze v kombinacích nahradit CBDCA v odpovídající dávce.
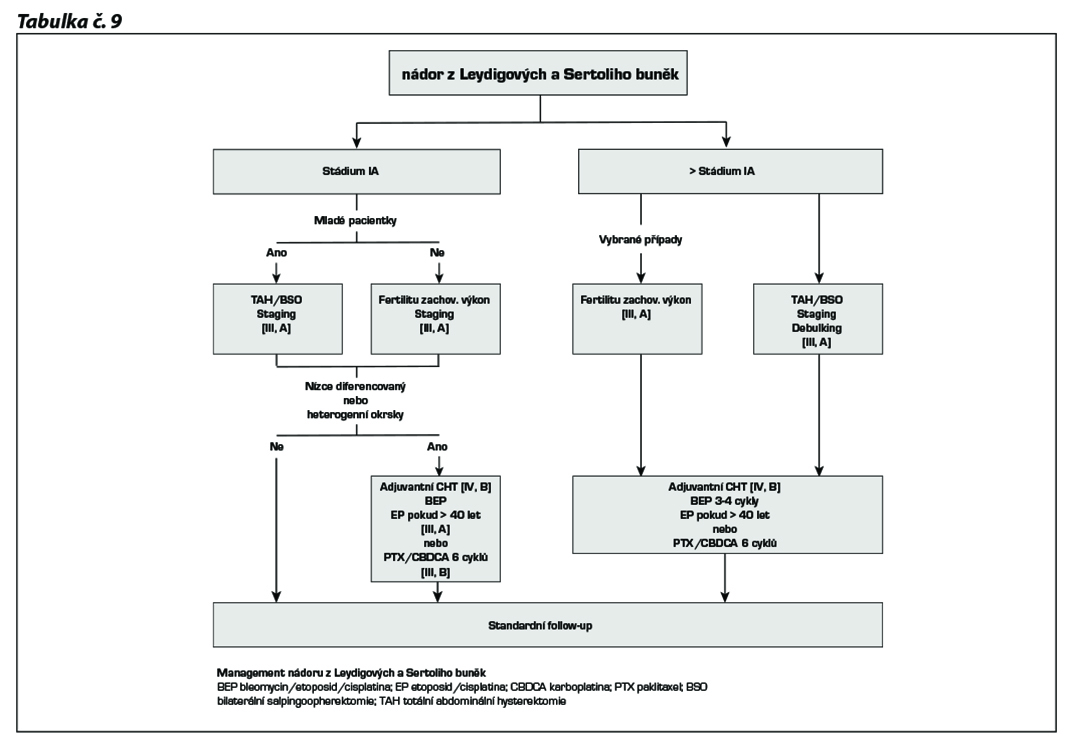
Management tumorů ovaria z Leydigových a Sertoliho buněk
Management malobuněčného karcinomu ovaria hyperkalcemického typu
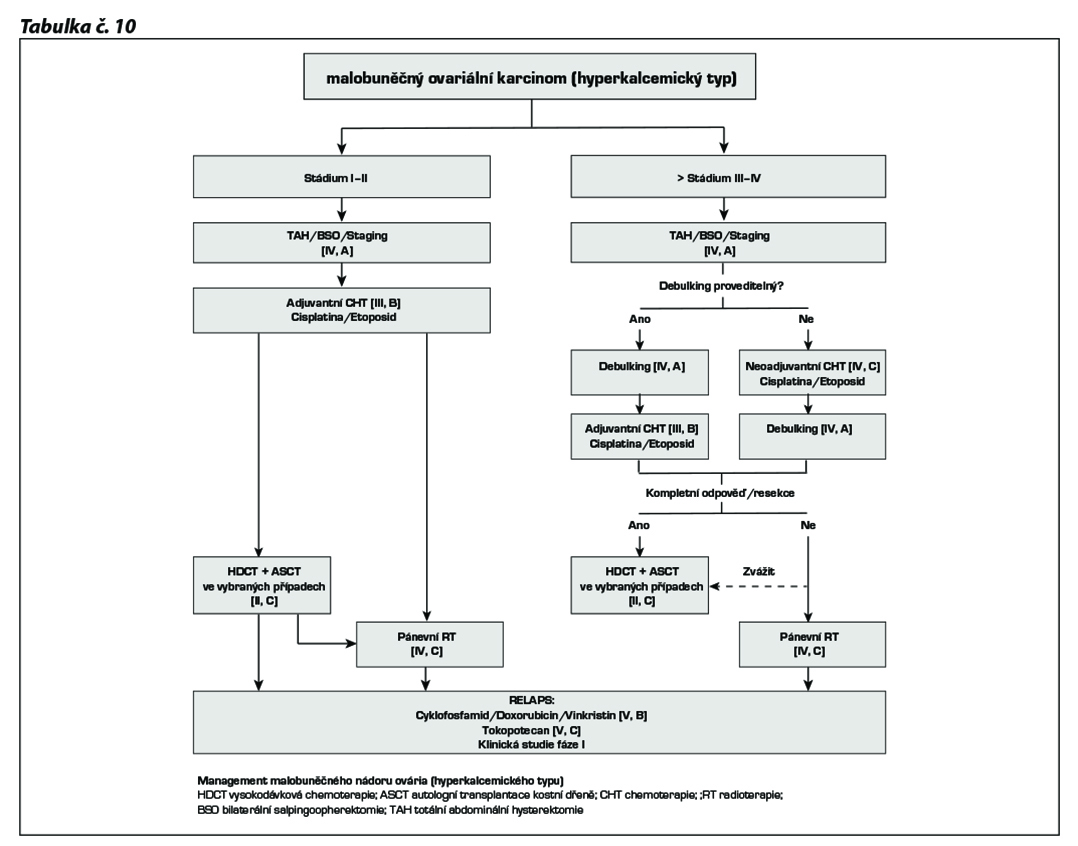
U pacientek, které dosáhly CR po operaci a/nebo chemoterapii je autologní transplantace podpořená high dose chemoterapií spojená s lepším přežíváním. Režimy používané u relabujícího onemocnění zahrnují cyclofosfamid/doxorubicin/vincristin a studie potvrdily i aktivitu CBDCA, paklitaxelu a topotecanu. Jedná se o raritní diagnózu, aktuálně se v rámci terapie používají i PD-L1 inhibitory v kombinaci s chemoterapií.
Aktivní sledování
Literatura:
- Colombo N et al. ESMO-ESGO consensus conference recommendations on ovarian cancer: pathology and molecular biology, early and advanced stages,
borderline tumours and recurrent disease. Annals of Oncology 2019; 30:672-705. - Du Bois A et al. Randomized phase III study to evaluate the impact of secondary cytoreductive surgery in recurrent ovarian cancer: Final analysis of AGO
DESKTOP III/ENGOT-ov20. J Clin Oncol. 2020;38 (15_suppl):6000. - Pfisterer et al. HYPERLINK “https://pubmed.ncbi.nlm.nih.gov/32305099/” Bevacizumab and platinum-based combinations for recurrent ovarian cancer: a
randomised, open-label, phase 3 trial. Lancet Oncol. 2020 May;21(5):699-709. - Wagner U et al. Final overall survival results of phase III GCIG CALYPSO trial of pegylated liposomal doxorubicin and carboplatin vs paclitaxel and carboplatin
in platinum-sensitive ovarian cancer patients - Burger RA et al. Incorporation of Bevacizumab in the Primary Treatment of Ovarian Cancer. N Engl J Med 2011; 365: 2473-83.
- Peren TJ et al. Phase 3 Trial of Bevacizumab in Ovarian Cancer. N Engl J Med 2011; 365: 2484-96.
3. Aghajanian C, et al. OCEANS: a randomized, double-blind, placebo-controlled phase III trial of chemotherapy with or without bevacizumab in patients with
platinum-sensitive recurrent epithelial ovarian, primary peritoneal, or fallopian tube cancer. J Clin Oncol. 2012 Jun 10;30(17):2039-45. (OCEANS). - Parmar MK, Ledermann JA, Colombo N, et al. Paclitaxel plus platinum-based chemotherapy versus conventional platinum-based chemotherapy in women
with relapsed ovarian cancer: the ICON4/AGO-OVAR-2.2 trial. Lancet 2003;361:2099-2106. - Katsumata N, Yasuda M, Takahashi F, et al. Dose-dense paclitaxel once a week in combination with carboplatin every 3 weeks for advanced ovarian cancer:
a phase 3, open-label, randomised controlled trial. Lancet 2009;374:1331-1338. - Strauss HG, Henze A, Teichmann A, et al. Phase II trial of docetaxel and carboplatin in recurrent platinum-sensitive ovarian, peritoneal and tubal cancer.
Gynecol Oncol 2007;104:612-616. - Pfisterer J, Plante M, Vergote I, et al. Gemcitabine plus carboplatin compared with carboplatin in patients with platinum-sensitive recurrent ovarian cancer:
an intergroup trial of the AGO-OVAR, the NCIC CTG, and the EORTC GCG. J Clin Oncol 2006;24:4699-4707. - Pujade-Lauraine E, Wagner U, Aavall-Lundqvist E, et al. Pegylated liposomal doxorubicin and carboplatin compared with paclitaxel and carboplatin for
patients with platinum-sensitive ovarian cancer in late relapse. J Clin Oncol 2010;28:3323-3329. - Rose PG. Gemcitabine reverses platinum resistance in platinum-resistant ovarian and peritoneal carcinoma. Int J Gynecol Cancer 2005;15:18-22.
- Rose PG, Blessing JA, Ball HG, et al. A phase II study of docetaxel in paclitaxel-resistant ovarian and peritoneal carcinoma: a Gynecologic Oncology Group
study. Gynecol Oncol 2003;88:130-135. - Rose PG, Blessing JA, Mayer AR, Homesley HD. Prolonged oral etoposide as second-line therapy for platinum-resistant and platinum-sensitive ovarian carcinoma:
a Gynecologic Oncology Group study. J Clin Oncol 1998;16:405-410. - Mutch DG, Orlando M, Goss T, et al. Randomized phase III trial of gemcitabine compared with pegylated liposomal doxorubicin in patients with platinum-
resistant ovarian cancer. J Clin Oncol 2007;25:2811-2818. - Ferrandina G, Ludovisi M, Lorusso D, et al. Phase III trial of gemcitabine compared with pegylated liposomal doxorubicin in progressive or recurrent ovarian
cancer. J Clin Oncol 2008;26:890-896. - Markman M, Blessing J, Rubin SC, et al. Phase II trial of weekly paclitaxel (80 mg/m) in platinum and paclitaxel-resistant ovarian and primary peritoneal
cancers: a Gynecologic Oncology Group study. Gynecol Oncol 2006;101:436-440. - Gordon AN, Tonda M, Sun S, Rackoff W. Long-term survival advantage for women treated with pegylated liposomal doxorubicin compared with topotecan
in a phase 3 randomized study of recurrent and refractory epithelial ovarian cancer. Gynecol Oncol 2004;95:1-8. - Sehouli J, Stengel D, Harter P, et al. Topotecan weekly versus conventional 5-day schedule in patients with platinum-resistant ovarian cancer: A randomized
multicenter phase II trial of the North-Eastern German Society of Gynecological Oncology Ovarian Cancer Study Group. J Clin Oncol 2011;29:242-248. - Vergote I, González-Martín A, Ray-Coquard I, et al; European experts’ consensus group. European experts consensus: BRCA/homologous recombination
deficiency testing in first-line ovarian cancer. Ann Oncol. 2021 Dec 1:S0923-7534(21)04828-6. doi: 10.1016/j.annonc.2021.11.013. Epub ahead of print.
PMID: 34861371. - Colombo N, Ledermann JA; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Updated treatment recommendations for
newly diagnosed epithelial ovarian carcinoma from the ESMO Clinical Practice Guidelines. Ann Oncol. 2021 Oct;32(10):1300-1303. doi: 10.1016/j.annonc.
2021.07.004. Epub 2021 Jul 21. PMID: 34293462. - Schwameis R, Chiva L, Harter P. There is no role for hyperthermic intraperitoneal chemotherapy (HIPEC) in ovarian cancer. Int J Gynecol Cancer. 2022 Apr
4;32(4):578. doi: 10.1136/ijgc-2022-003348. PMID: 35121632. - NCCN Guidelines, version 1.2023
- Baert T, Ferrero A, Sehouli J, O‘Donnell DM, González-Martín A, Joly F, van der Velden J, Blecharz P, Tan DSP, Querleu D, Colombo N, du Bois A, Ledermann
JA. The systemic treatment of recurrent ovarian cancer revisited. Ann Oncol. 2021 Jun;32(6):710-725. doi: 10.1016/j.annonc.2021.02.015. Epub 2021 Mar 3.
PMID: 33675937. - Miller RE, Leary A, Scott CL, Serra V, Lord CJ, Bowtell D, Chang DK, Garsed DW, Jonkers J, Ledermann JA, Nik-Zainal S, Ray-Coquard I, Shah SP, Matias-Guiu
X, Swisher EM, Yates LR. ESMO recommendations on predictive biomarker testing for homologous recombination deficiency and PARP inhibitor benefit in
ovarian cancer. Ann Oncol. 2020 Dec;31(12):1606-1622. doi: 10.1016/j.annonc.2020.08.2102. Epub 2020 Sep 28. PMID: 33004253.
26. Gershenson DM, Miller A, Brady WE, Paul J, Carty K, Rodgers W, Millan D, Coleman RL, Moore KN, Banerjee S, Connolly K, Secord AA, O‘Malley DM, Dorigo
O, Gaillard S, Gabra H, Slomovitz B, Hanjani P, Farley J, Churchman M, Ewing A, Hollis RL, Herrington CS, Huang HQ, Wenzel L, Gourley C. Trametinib versus
standard of care in patients with recurrent low-grade serous ovarian cancer (GOG 281/LOGS): an international, randomised, open-label, multicentre, phase
2/3 trial. Lancet. 2022 Feb 5;399(10324):541-553. doi: 10.1016/S0140-6736(21)02175-9. PMID: 35123694; PMCID: PMC8819271.





