Zde uvedená velmi stručná doporučení jsou výtahem z doporučení „Diagnostické a léčebné postupy u nemocných s maligními lymfomy“, která vypracovala a průběžně aktualizuje Kooperativní lymfomová skupina – nejnovější aktualizovaná verze je k dispozici z ledna 2023. Je doporučeno orientovat se zejména podle nich. Dostupná jsou v elektronické podobě na www stránkách: www.lymphoma.cz.
Péče o nemocné s lymfomy probíhá na řadě pracovišť, ale ve své komplexnosti je soustředěna do center intenzivní hematologické péče – CIHP (viz tabulka níže). Vzhledem k tomu, že některé postupy a léčebné prostředky jsou dostupné jen v těchto centrech a současně probíhá řada klinických studií, z nichž mohou mít nemocní významný prospěch, je doporučeno každého nemocného konzultovat v některém z CIHP. Stručný přehled studií je rovněž uveden na www.lymphoma.cz. U každého nemocného musí být diagnóza stanovena na základě histologického vyšetření reprezentativního vzorku tkáně na specializovaném patologickém pracovišti a je naléhavě doporučeno histologicky ověřit i relaps onemocnění tam, kde je to možné. U každého pacienta je nutné určit klinické stádium (dle CT, CT/PET, trepanobiopsie a další), další rizikové faktory (zejména LDH, beta2 mikroglobulin, stav zdatnosti pacienta dle WHO a další) a stanovit prognostické riziko. V případě stanovování rozsahu onemocnění se postupuje podle platných mezinárodních doporučení, která jsou upravena konsensem Kooperativní lymfomové skupiny (viz www.lymphoma.cz).
Vzhledem k tomu, že systém úhrady celé řady léků je poměrně dynamický a některé indikace jsou mimo SPC indikace nebo některé léky zatím nemají stanovenou úhradu, vyjadřuje toto doporučení vždy aktuální stav. Nutno ale hlídat aktuální způsob úhrady u každého léku. Tyto léky jsou v textu označeny (*), ale aktuální stav úhrady je vždy k dispozici na www.sukl.cz. V červnu 2022 byl časopisecky publikován návrh změn pro novou, 5. edici klasifikace WHO (WHO 5) s předpokladem vydání knižní verze na přelomu roků 2022 a 2023. Současně však skupina autorů pod hlavičkou Clinical Advisory Committee (CAC) vydala svůj návrh nové klasifikace pod poněkud sporným názvem International Consensus Classification (ICC), která se od WHO 5 v řadě případů liší. Výbor Kooperativní lymfomové skupiny se dohodl, že nádory budou přednostně klasifikovány podle WHO 5. Pro zatím blíže neurčené přechodné období však výbor patologům silně doporučuje, aby v případě diskrepance mezi označením nádoru dle WHO 5 a dle původní 4. revidované verzi klasifikace WHO (WHO 4R) uváděli v poznámce i starší název. V jednotlivých případech může být výhodou i případné znění podle ICC. Detaily jsou uvedeny v nových guidelines KLS 2023.
27.1 Hodgkinův lymfom – C81
Všichni pacienti mají být léčeni podle léčebných protokolů nebo v klinických studiích (konzultace s CIHP). Do léčby nově vstupuje PET řízená terapie – hodnocení dle Deauville skóre (DS) dle interim PET vyšetření. Za PET negativní se považuje DS 1-3, PET pozitivní pak DS 4+5.
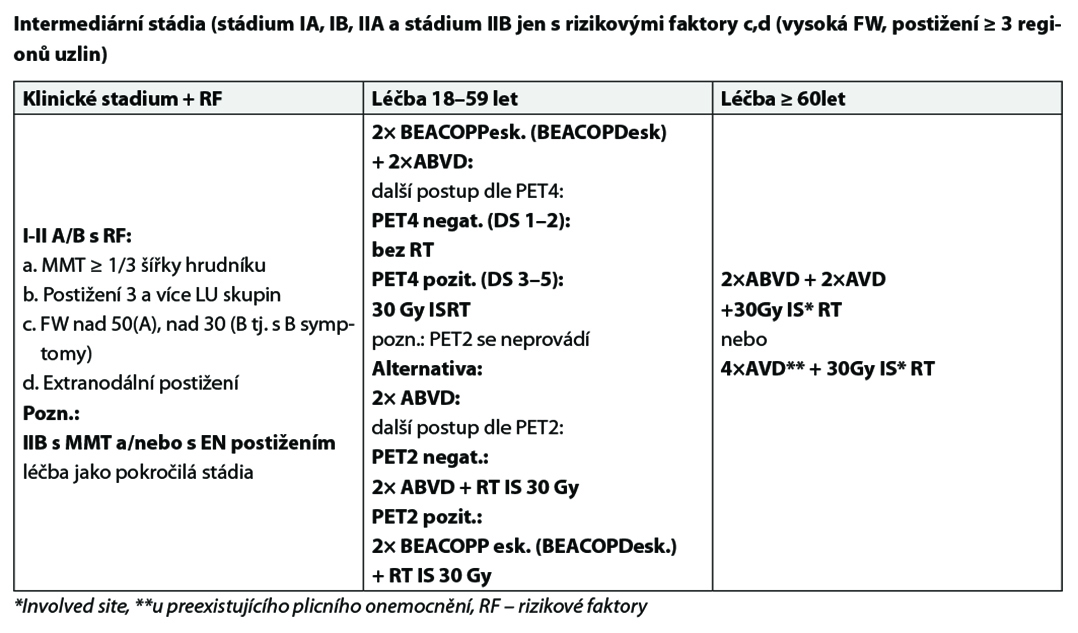
RF – rizikové faktory pro časná, intermediární a pokročilá stádia (dle DHSG – Německá studijní skupina pro Hodgkinův lymfom):
a) masivní mediastinální tumor (MMT) ≥ 1/3 maximálního rozměru hrudníku
b) extranodální postižení (E)
c) sedimentace erytrocytů ≥ 50/hod. (bez přítomnosti B symptomů), ≥ 30/hod. (pokud přítomen některý z B – symptomů)
d) ≥ 3 skupiny postižených uzlinových oblastí
27.1.1 Principy léčby 1. linie

– Protonová vs fotonová radioterapie: dle doporučení radioterapeuta, resp. KOC s ohledem na riziko kardiotoxicity a plicní toxicity.
– U PET2 pozit. pacientů po 2 cyklech ABVD je možné zvážit eskalaci na 2 cykly BEACOPP eskal + 30 Gy ISRT (viz EORTC studie).

Protonová vs fotonová radioterapie – dle doporučení radioterapeuta, resp. KOC s ohledem na riziko kardiotoxicity a plicní toxicity
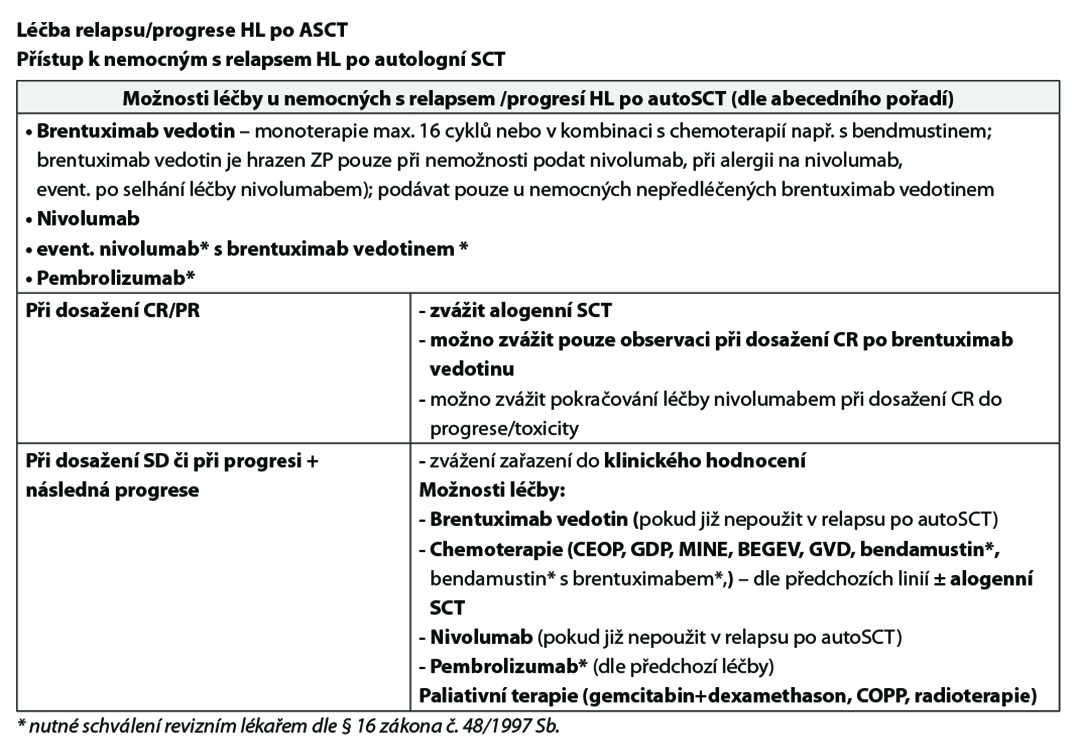
27.1.2 Principy léčby relapsů:


Rizikové faktory pro konsolidaci brentuximab vedotinem:
- Nemocní s časným relapsem< 12 měsíců nebo refrakterní vůči první linii léčby nebo
- Nejlepší odpověď PR nebo SD na poslední záchrannou terapii dle vyšetření CT a/nebo PET nebo
- Extranodální onemocnění u relapsu před ASCT nebo
- B symptomy u relapsu před ASCT nebo
- Dvě nebo více předchozích záchranných terapií
27.1.3. Hodgkinův lymfom s lymfocytární predominancí – léčba
NLPHL – léčba relapsu/refrakterního onemocnění
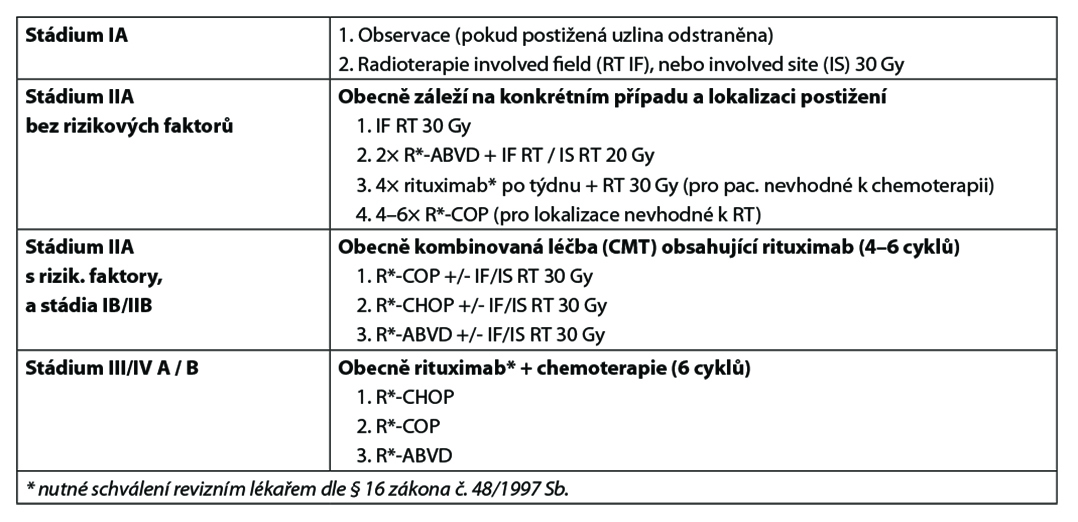
Principy léčby: volba léčby závisí na rozsahu a časnosti relapsu
- observace (asymptomatičtí pacienti, vysoké riziko onkologické léčby)
- radioterapie 30 Gy
- rituximab* v monoterapii (4 dávky v týdenních odstupech) s následnou udržovací léčbou rituximabem* každých 6 měsíců po dobu 2 let
- rituximab* v kombinaci s chemoterapií (R-COP, R-CHOP, R-ABVD) – dle režimu použitého v předchozí linii
- rituximab* + bendamustin*
- konvenční záchranná chemoterapie se směřováním k vysokodávkované chemoterapii + autologní SCT (při opakovaném relapsu, časném relapsu, podezření na transformaci)
NLPHL – transformace do DLBCL
- R*-CHOP (pokud R*-CHOP nebo R*-ABVD nebyl podán v předchozích liniích léčby)
- Pokud byl podán R*-CHOP v předchozích liniích léčby: R*-ICE nebo podobný platinový režim (např. R*-DHAP) podávaný u relabovaného DLBCL s následnou vysokodávkovanou chemoterapií + ASCT.
* nutné schválení revizním lékařem dle § 16 zákona č. 48/1997 Sb
27.2 Folikulární lymfomy – C82
Vzhledem k možnosti léčit některé nemocné novými metodami je doporučeno každého nemocného v období diagnózy nebo relapsu konzultovat v CIHP.
27.2.1 Základní diagnostické a prognostické principy
Nutné přesné histologické vyšetření; folikulární lymfom grade 3b je léčen již jako difúzní B-velkobuněčný lymfom. Určení klinických stádií dle Ann-Arbor klasifikace.
Určení rizika dle FLIPI (mezinárodní prognostický index pro folikulární lymfomy)
Rizikové faktory:
• věk > 60 let
• stádium III–IV
• LDH > normu
• 5 a více postižených oblastí uzlin
• hemoglobin < 120 g/l
Počet rizikových faktorů
• 0–1 nízké riziko
• 2 střední riziko
• 3–5 vysoké riziko
FLIPI 2 index:
• věk > 60 let
• beta-2 mikroglobulin > normu
• postižení kostní dřeně
• masa lymfomu > 6 cm
• hemoglobin < 120 g/l
Počet rizikových faktorů
• 0 nízké riziko
• 1–2 střední riziko
• 3–5 vysoké riziko
PRIMA – PI prognostický index
– nízké riziko: bez postižení kostní dřeně a B-2 mikroglobulin ≤ 3 mg/l,
– střední riziko: postižení kostní dřeně ale B-2 mikroglobulin ≤ 3 mg/l,
– vysoké riziko: B-2 mikroglobulin > 3 mg/l.
GELF kritéria pro zahájení léčby imunochemoterapií
• B – příznaky (teploty neinfekčního původu nebo profuzní noční pocení nebo výrazné hubnutí)
• cytopenie z útlaku kostní dřeně
• bulky masa lymfomu > 7 cm
• symptomatická splenomegalie
• postižení 3 a více oblastí uzlin > 3 cm
• lymfomem indukované výpotky
• poškození orgánu nebo systému při útlaku lymfomem
27.2.2 Léčebný přístup k nově diagnostikovanému onemocnění

U mladších pacientů s nepříznivými prognostickými faktory nebo při dosažení pouze parciální remise po imunochemoterapii je kromě udržovací léčby rituximabem na zvážení pokračování léčby (další imunochemoterapie, rituximab + lenalidomid*, vysokodávkovaná léčba a autologní transplantace kmenových buněk).
27.2.3 Léčba relapsu nebo léčba při nedosažení odpovědi v 1. linii
V případě relapsu je doporučený nový odběr uzliny a histologická verifikace z důvodu možnosti transformace do agresivnějšího typu lymfomu. Zvážit zařazení pacienta do klinické studie, kontaktovat CIHP. Při výběru léčby je nutné zohlednit stav nemocného, rozsah relapsu, dobu trvání předchozí léčebné odpovědi, věk a cíle a přání pacienta.
Možné přístupy:
• rituximab + chemoterapie (CHOP, bendamustine*, COP) – dle volby chemoterapie v 1. linii
• rituximab + ICE, ESAP, DHAP, chlorambucil a další
• bendamustin + obinutuzumab (u rituximab refrakterních nemocných) s následnou udržovací léčbou obinutuzumabem po 2M po dobu 2 let
• CAR-T terapie tisacelem* (pro 3+ linii) nebo axicelem* (pro 4+ linii)
• Mosunetuzumab* (pro 3+ linii)
• u mladších nemocných s časným relapsem nebo rozsáhlým postižením zvážit záchrannou terapii (platinový režim) s následnou vysokodávkovanou léčbou a autologní transplantací
• lenalidomid* + rituximab – režim R2
• idelalisib* (u refrakterních nemocných s relapsem po minimálně 2 liniích léčby)
• u mladších nemocných s relapsem po autologní transplantaci nebo chemorezistentním onemocněním zvážit alogenní transplantaci
• radioterapie
* nutné schválení revizním lékařem dle § 16 zákona č. 48/1997 Sb
Udržovací léčba: u pacientů s částečnou (PR) nebo kompletní (CR) léčebnou odpovědí na léčbu relapsu je indikována následná udržovací léčba rituximabem (1× po 3 měsících) do progrese onemocnění nebo maximálně po dobu 2 let.
27.3 Difúzní nehodgkinův lymfom – C83
Tato skupina zahrnuje biologicky odlišné jednotky, vyžadující specifický přístup:
• difúzní B-velkobuněčný lymfom (nejčastější typ lymfomu) – DLBCL
• lymfom z plášťových buněk (MCL)
• lymfoblastický lymfom (LBL)
• Burkittův lymfom (BL)
• lymfom z malých lymfocytů (SLL)
• B-lymfomy z buněk marginální zóny typu MALT
27.3.1 Difúzní B-velkobuněčný lymfom DLBCL – C83.3, C83.4
Zahrnuje tyto podjednotky dle WHO klasifikace:
• DLBCL, NOS (jinak nespecifikovaný):
- DLBCL subtypy podle anatomického místa (primární CNS lymfom, primární kožní DLBCL -leg type, intravaskulární velkobuněčný B lymfom)
- T/HRLBCL (T-buněčný/bohatý na histiocyty velkobuněčný B lymfom)
- EBV positivní DLBCL
• DLBCL spojený s chronickým zánětem
• Primární mediastinální velkobuněčný B lymfom
• Intravaskulární velkobuněčný B lymfom
• ALK pozitivní velkobuněčný B lymfom
• Plasmablastový B lymfom
• Primární lymfom s výpotky
• Velkobuněčný B lymfom rostoucí v HHV-8 multicentrické Castlemanově nemoci
• High-grade B-lymfom s přestavbami MYC a BCL2 anebo BCL6
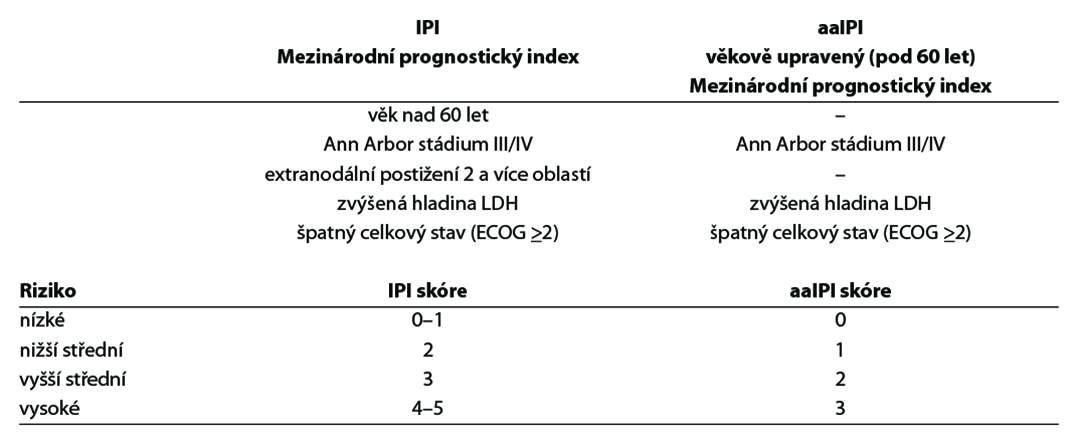
Určení rizika dle IPI (mezinárodní prognostický index) nebo aaIPI (věkově upravený mezinárodní prognostický index pro pacienty do 60 let), existují ještě další prognostické indexy (revised IPI, elderly IPI, atd.), ale v praxi se stále nejčastěji uvádí IPI.
27.3.1.1 Principy léčby 1. linie
Zvážit zařazení pacienta do klinických studií – kontaktovat CIHP.
Základem léčby 8 dávek rituximabu a 6-8 cyklů chemoterapie s antracykliny CHOP 21 (nebo jiný podobný režim obsahující antracyklin, např. DA-EPOCH-R, CHOEP, MegaCHOP atd.).
U nemocných s IPI 3-5 je standardní terapie Pola-R-CHP.
U mladších nemocných s vyšším rizikem (aaIPI 2–3) je možné zvážit intenzifikaci léčby a konsolidací vysokodávkovanou terapií.
Mladší pacienti (do 65 let – vždy nutno zvážit biologický věk)
• u pacientů s IPI 0, bez bulk tumoru: 4× R-CHOP + 2×R
• u ostatních pacientů s nízkým rizikem (aaIPI 0-1): 8 dávek rituximabu a 6 cyklů CHOP 21 nebo jiný podobný režim obsahující antracyklin
• u pacientů s vyšším středním a vysokým rizikem (aaIPI 2–3) – vždy kontaktovat CIHP ohledně intenzifikace léčby s ASCT; mimo studii je standardem 8 dávek rituximabu + 6 cyklů chemoterapie CHOP 21 nebo jiný podobný režim obsahující antracyklin, (R-CHOEP, DA-EPOCH-R, PACEBO/IVAM nebo R-MegaCHOP – ten je doporučován jen u mladších pacientů
do věku 45 let)
• 6× Pola*- R-CHP (u pacientů s DLBLC a IPI 3-5)
• u pacientů s lokalizovaným onemocněním (st.I,II) možno zvážit: 3× R-CHOP + RT IF
• v případě nedosažení CR s přítomností PET pozitivního rezidua zvážit konsolidační RT nebo konsolidační léčbu 2. linie.
• Ve vybraných případech s lokální reziduální PET pozitivitou je možná jen RT na oblast rezidua.
• Ozáření na iniciální bulk nutno zvážit v případě se spornou PET negativitou a omezenými možnostmi následné léčby event. relapsu.
• Při jakékoli odpovědí horší než CR a u pacientů nevhodných k radioterapii je indikováno podání CAR-T terapie nebo záchranná terapie s HDT a ASCT (indikace dle biologického věku nemocného).
• Axicel je určen k léčbě dospělých pacientů s difuzním velkobuněčným B-lymfomem (DLBCL) a s„high-grade“ B-buněčným lymfomem (HGBL), který relabuje do 12 měsíců po dokončení chemoimunoterapie první linie nebo je na ni refrakterní.
Starší pacienti (nad 65 let)
• 8 dávek rituximabu a 6–8 cyklů chemoterapie s antracykliny (např. CHOP 21); při zhodnocení klinického stavu
• 6× Pola*- R-CHP (u pacientů s DLBLC a IPI 3-5)
• nad 80 let možné podat R-miniCHOP (redukovaná varianta R-CHOP)
• při kontraindikaci antracyklinů zvážit podání etoposidu (R-CEOP) nebo režim bez antracyklinů (R-COP)
• u pacientů s lokalizovaným onemocněním (st.I,II) možno zvážit: 3xR-CHOP + RT IF
• doplňující radioterapii vždy zvážit v případě iniciálního bulky onemocnění nebo PET pozitivního nebo PET sporného rezidua
Obecné:
• V případě vysokého rizika CNS relapsu (CNS IPI skóre 4 a více) je na zvážení podání vysokodávkovaného metotrexátu v rámci indukční terapie (2×) nebo po jejím skončení. V současné době není zcela evidentní, že jakákoliv forma CNS profylaxe (IV nebo i.th.) přináší jednoznačný benefit. Rozhodnutí je na individuální bázi.
Primární mediastinální B lymfom – léčba 1. linie: 6× DA-EPOCH-R, event. 6× R-CHOP nebo R-CHOEP + RT v případě PET pozitivního rezidua; zvážit vždy RT v případě PET nejasného rezidua.
Primární CNS lymfom – DLBCL: základem léčby je vysokodávkovaný methotrexát s rituximabem, v kombinaci s cytosin- -arabinosidem, event. v kombinace s thiotepou +- radioterapie (protokol MATRIX) +- ASCT; event. MTX v kombinaci s prokarbazinem a vincristinem (protokol R-MPV) +- radioterapie. U mladších pacientů možno zvážit konsolidaci autologní
transplantací; nutno vždy kontaktovat CIHP.
27.3.1.2 Principy léčby relapsů
Nutno kontaktovat CIHP a zvážit zařazení pacienta do klinických studií.

• Axicel je určen k léčbě dospělých pacientů s difuzním velkobuněčným B-lymfomem (DLBCL) a s „high-grade“ B-buněčným lymfomem (HGBL), který relabuje do 12 měsíců po dokončení chemoimunoterapie první linie nebo je na ni refrakterní.
• V dalších liniích je možné použít režim polatuzumab vedotin+BR, gemcitabinové režimy (např. R-GEMOx), event. lenalidomid*.
• U nemocných s chemosenzitivním relapsem po CAR-T nebo po autoSCT lze zvážit alogenní transplantaci.
• V případě relabovaného/refrakterního primárního mediastinálního B-lymfomu po min.2 liniích léčby je možné zvážení terapie pembrolizumabem*, event. CAR-T terapie axicelem (pokud již nebyla použita ve 2. linii).

• V případě relapsu po CAR-T terapii lze zvážit použití glofitamabu*, epcoritamabu*, loncastuximab tesirinu*, tafasitamabu + lenalidomidu*, event.imunochemoterapie (Pola-BR, R-GEMOx atd.)
• V případě relabovaného/refrakterního primárního mediastinálního B-lymfomu je možné zvážení terapie pembrolizumabem nebo CAR-T terapie axicelem.
27.3.2 Lymfom z plášťových buněk (MCL)
27.3.2.1 Lymfom z plášťových buněk (MCL) – léčba 1.linie
Pacienti schopní vysokodávkované terapie
Indukce + udržovací terapie
• intenzifikované režimy založené na anthracyklinech s implementací vysokodávkovaného cytarabinu (v některých případech i methotrexátu či platinových derivátů), vždy v kombinaci s rituximabem
• udržovací léčba rituximabem po 2–3M po dobu 3 let je standardní po všech indukčních režimech při dosažení CR/PR
Možnosti léčby intenzivní chemoterapie
• R-maxi-CHOP/R-HD-Ara-C = Nordický protokol
• R-maxi-CHOP/R-DHAOX
• R-CHOP / R-DHAP = protokol European MCL Network
• R-CHOP + ibrutinib*/R-DHAP + rituximab maintenance + ibrutinib* maintenance
• R-hyper-CVAD/R-HD-MTX-Ara-C = MD Anderson Cancer Centre protokol
Konsolidace
Pouze v případě dosažení objektivně měřitelné odpovědi – CR, PR
• vysokodávkovaná terapie (např. BEAM) následovaná autologní transplantací kostní dřeně (ASCT)
Pacienti schopní jen středně intenzivní chemoterapie (R-CHOP-like)
Obvykle pacienti do 75–80 let bez limitujících komorbidit či mladší pacienti s limitujícími komorbiditami.
Indukce + udržovací léčba
• režimy založené na antracyklinech (samotné či s implementací vysokodávkovaného cytarabinu, HDAC) nebo režimy založené na bendamustinu, vždy v kombinaci s rituximabem
• udržovací léčba rituximabem po 2–3 M po dobu 3 let je standardní po všech indukčních režimech po dosažení CR/PR
Režimy:
• alternace R-CHOP a R-HD-AraC (cytarabin 2 g/m2 D1 + D2, 3+3 cykly)
• alternace R-CHOP a R-DHAOX-edlerly (cytarabin 2 g/m2)
• 6–8× R-CHOP či R-COEP (v případě kardiální komorbidity) (6-8 cyklů terapie)
• 6× R-bendamustin (v ČR v 1. linii terapii v praxi standardně nepoužíváno z důvodu chybění úhrady bendamustinu)
• R-Bendamustin + ibrutinib* + rituximab maintenance + ibrutinib* maintenance
• 6× R-BAC500 (v ČR v 1. linii terapii v praxi standardně nepoužíváno z důvodu chybění úhrady bendamustinu)
• 6–8× VR-CAP (v ČR v 1. linii terapii v praxi standardně nepoužíváno z důvodu chybění úhrady bortezomibu)
Pacienti nevhodní k středně dávkované terapii (typu R-CHOP-like)
Obvykle pacienti nad 75–80 let či mladší pacienti v případě výrazných komorbidit.
Indukce + udržovací léčba
• režimy založené na alkylačních látkách v kombinaci s rituximabem ve vybraných případech monoterapie inhibitorem Brutonovy tyrozin-kinázy – ibrutinibem*
• udržovací léčba rituximabem po 2-3M po dobu 3 let je standardní po všech indukčních režimech při dosažení CR/PR
Režimy:
• R-COP
• R-chlorambucil
• Ibrutinib
• R-bendamustin (s redukcí bendamustinu na 50–70 mg/m2)
Pacienti neschopní žádné chemoterapie
Z důvodu vysokého věku či závažných komorbidit
Režimy:
• Rituximab v monoterapii či v kombinaci s kortikoidy (dexamethazon)
• Ibrutinib
• monoterapie kortikoidy (dexamethazon)
• lokální radioterapie 30–40 Gy
27.3.2.1 Lymfom z plášťových buněk (MCL) – relaps onemocnění
Vždy kontaktovat CIHP; u mladších pacientů zvážit možnost záchranné chemoterapie s konsolidací autologní nebo alogenní transplantací. Z dalších režimů: ibrutinib**, bendamustin* + rituximab, R-B*AC, cytosin-arabinosid +- rituximab, bortezomibové režimy atd.; Zvážit klinické studie, event. venetoclax*, lenalidomide*. U starších pacientů volíme obdobnou léčbu dle tolerability. V případě selhání 2 linií terapie včetně BTKi a při odpovídajícím stavu nemocného je na indikována terapie CAR-T (viz níže).
* podléhá zatím individuálnímu schválení pojišťovnou přes §16 zákona o veřejném zdravotním pojištění (48/1997 Sb.).
** Aktuálně je ibrutinib hrazen u všech pacientů, kteří absolvují alespoň jednu linii terapie a zrelabují do 2 let od dosažení léčebné odpovědi a zároveň nejsou kandidáty vysokodávkované léčby a alogenní transplantace kostní dřeně (u nemocných s pozdním relapsem MCL> 24M tedy hrazen není).
Brexucel (brexucaptagene autoleucel)
Přípravek brexucel (Tecartus) je indikován k léčbě dospělých pacientů s relabujícím nebo refrakterním lymfomem z plášťových buněk (MCL) po dvou či více liniích systémové léčby, které zahrnovaly léčbu inhibitorem Brutonovy tyrosinkinázy (BTK).
27.3.3 Lymfoblastový lymfom
Léčba jako u akutní lymfoblastové leukémie (ALL), pacienta nutno předat do péče CIHP.
27.3.4 Burkittův lymfom
Pacienta nutno předat do péče CIHP.
Základem léčby je rituximab + intenzivní chemoterapie (R – CODOX-M/IVAC, R- HyperCVAD, R - DA–EPOCH, protokol dle GMALL s rituximabem).
27.3.5 Lymfom z malých lymfocytů (SLL/CLL)
Lymfom z malých lymfocytů/chronická lymfotocytární leukémie (SLL/CLL)
Charakteristika jednotky1,2
• Dle WHO klasifikace lymfoidních malignit tvoří SLL společnou jednotku s chronickou lymfocytární leukémií (CLL).
SLL se liší od CLL pouze kritériem B-lymfocytózy > 5 × 109/l v periferní krvi u CLL.3
• Pokud je v rámci SLL přítomna cytopenie způsobená infiltrací kostní dřeně, mělo by onemocnění být podle posledních doporučení IWCLL 2018 považováno za CLL bez ohledu na počet lymfocytů v periferní krvi.4
• SLL představuje 3 až 10 % NHL. Věkový medián je kolem 65 let. Zhruba 75 % nemocných má postiženou kostní dřeň v době diagnózy. Častá bývá také generalizovaná lymfadenopatie a splenomegalie.5
• Diagnóza je stanovena na základě typické histologie a imunohistochemie v mízní uzlině či imunofenotypu v kostní dřeni, ev. periferní krvi. Nádorové lymfocyty exprimují typickou kombinaci antigenů CD5, CD19 a CD23.6
• Vzhledem k poměrně častému výskytu autoimunitní hemolytické anémie u SLL/CLL je vhodné během úvodních vyšetření provést Coombsův test a stanovit ukazatele hemolýzy (bilirubin, haptoglobin, LDH).
• Před každou linií léčby je doporučováno provést vyšetření chromozomálních abnormalit pomocí FISH, zejména deleci 17p a analýzu mutací TP53. V případě, že není přítomen cirkulující klon v periferní krvi, lze toto vyšetření provést z aspirátu kostní dřeně, případně z biopsie lymfatické uzliny.
SLL/CLL – terapie
Nejprve je nutno zvážit, zda je vůbec léčba indikována. Významnou část nemocných se SLL lze sledovat bez léčby (postup „watch & wait“). Principy léčby jsou shodné pro SLL i CLL.
K indikacím pro zahájení léčby je možno využít kritéria International Workshop on Chronic Lymphocytic Leukemia (IWCLL) z roku 2018. Léčba je indikována, pokud je onemocnění klinicky aktivní a je tedy splněna alespoň jedna z těchto podmínek:
• progredující či masivní lymfadenopatie
• progredující či masivní splenomegalie
• rozvoj či zhoršení anémie/trombocytopenie
• autoimunitní hemolytická anémie či trombocytopenie nereagující na kortikoterapii či jinou standardní léčbu
• systémové příznaky:
- neinfekční horečky > 38 ºC trvající déle než 2 týdny
- noční pocení trvající déle než 1 měsíc
- jinak nevysvětlené hubnutí (o více než 10 % hmotnosti za 6 měsíců)
- výrazná únava znemožňující vykonávat zaměstnání či běžné činnosti
Při rozhodování o výběru léčby je vhodné přihlédnout k následujícím zásadním faktorům:
• faktory týkající se nemocného: biologický věk, celkový stav nemocného a přidružená onemocnění – hodnotíme dle výkonnostního stavu dle ECOG, počtu a závažnosti komorbidit, případně s použitím některých skórovacích systémů (např. Cumulative Illness Rating Score – CIRS).7 Funkci ledvin je vhodné posoudit pomocí vypočtené clearance kreatininu, např. dle Cockcroft-Gaultovy rovnice.
• faktory se vztahem k SLL: rozsah, přítomnost masivní lymfadenopatie, přítomnost autoimunitních komplikací (autoimunitní hemolytická anémie, autoimunitní trombocytopenie).
Léčba 1. linie
• Pacienti bez delece/mutace TP53.
• V současné době je pouze na základě omezených úhradových kritérií v ČR považována za hlavní léčebnou možnost
u nemocných v dobrém stavu, bez závažných komorbidit a s normální funkcí ledvin chemoimunoterapie FCR (fludarabin, cyklofosfamid, rituximab). Dlouhodobé remise lze ale očekávat jen u nemocných s mutovaným stavem IGHV. Dávka rituximabu v režimu FCR je od 2. cyklu 500 mg/m2.8
• U nemocných s významnými komorbiditami (např. skóre komorbidit CIRS >6) či clearance kreatininu <70 ml/min., kteří tedy nejsou vhodní k léčbě plnodávkovaným protokolem FCR, je hlavní hrazenou léčebnou možností venetoklax + obinutuzumab.9 Tento režim lze použít i pro pacienty bez významných komorbidit, kde ale t. č. není stanovena úhrada.
• Další možnosti léčby:
- obinutuzumab + chlorambucil u pacientů s výraznými komorbiditami a horším výkonnostním stavem (ECOG >1), u kterých nejsou t.č. hrazené cílené léky, a to především v případě mutovaného stavu IGHV
- ibrutinib + venetoklax10,11
- akalabrutinib+-obinutuzumab, ibrutinib a zanubrutinib12,13,14,15
- RCD (rituximab, cyklofosfamid, dexametazon) či obdobné režimy s vysokodávkovanými kortikoidy (zejména pokud je progrese CLL spojena s autoimunitní hemolytickou anémií či imunitní trombocytopenií)
- bendamustin + rituximab lze u některých pacientů zvážit jako alternativu FCR (≥ 65 let věku), ale jeho využití je v současné době u CLL již velmi limitované
- u těžce komorbidních nemocných, u kterých lze očekávat krátké přežití z důvodu přidružených onemocnění, je cílem léčby ovlivnění symptomů CLL s minimem nežádoucích účinků, lze využít např. rituximab + chlorambucil, nízkodávkovaný chlorambucil v monoterapii, nízkodávkovaný cyklofosfamid v monoterapii či nízkodávkovanou kortikoterapii.
• Pacienti s delecí 17p a/nebo mutací TP53
• Preferována je kontinuální léčba inhibitorem Brutonovy tyrozinkinázy (BTK), tj. akalabrutinib, ibrutinib nebo zanubrutinib.
Zejména u pacientů s vyšším kardiovaskulárním rizikem by měly být preferovány BTK inhibitory 2. generace
(akalabrutinib, zanubrutinib).
• Další možnosti léčby:
- venetoklax + obinutuzumab16
- ibrutinib + venetoklax17
Léčba relapsu SLL/CLL
Hlavní léčebné možnosti (dle abecedy):
• Akalabrutinib18,19
• Ibrutinib20,21
• Idelalisib + rituximab22
• Venetoklax + rituximab23,24
• Zanubrutinib25
• Volba vhodného léčebného režimu je opět dána celkovým stavem, komorbiditami, věkem pacienta a přítomností delece 17p/mutace TP53. Kromě toho je zásadní, jakou pacient dostal předchozí terapii, jaká byla odpověď a délka jejího trvání.
• V případě přítomnosti delece 17p a/nebo mutace TP53 je stejně jako v první linii preferována kontinuální léčba kovalentním inhibitorem BTK (akalabrutinib, ibrutinib, zanubrutinib), pokud pacient nebyl některým z těchto inhibitorů již předléčen.
• V případě časově omezené cílené terapie, tj. u režimů s venetoklaxem, není v současné době jednoznačně stanovena minimální délka trvání odpovědi, po které lze režim s venetoklaxem zopakovat. Lze předpokládat, že by trvání odpovědi mělo být alespoň 1–2 roky. Při kratší odpovědi či refrakterní chorobě jsou hlavní možností léčby kovalentní BTK inhibitory.
• V případě ukončení předchozí terapie kovalentním BTK inhibitorem z důvodu nežádoucích účinků, lze zvážit terapii alternativním kovalentním BTK inhibitorem.
• V případě ukončení předchozí terapie kovalentním BTK inhibitorem z důvodu progrese, je hlavní léčebnou možností venetoklax + rituximab.
• Kontinuální terapii venetoklaxem v monoterapii lze zvážit u pacientů po selhání léčby BCR inhibitory, a to zejména v případě přítomnosti delece 17p a/nebo mutace TP53.26
• Kombinaci idelalisib + rituximab lze využít při nevhodnosti terapie BTK inhibitory či venetoklaxem, případně při předléčenosti těmito preparáty.
• Mezi další možnosti léčby patří v některých případech režim RCD (zejména při současné autoimunitní cytopenii), případně výjimečně alemtuzumab.27
• Nemocní s vysoce rizikovým SLL s nepříznivým klinickým průběhem ve věku do cca 65 let a v dobrém celkovém stavu by měli být zvažování k provedení alogenní transplantace krvetvorných buněk.
• Autologní transplantace nemá v léčbě SLL opodstatnění. Výjimkou je léčba Richterovy transformace (Richterův syndrom – RS) do DLBCL či Hodgkinova lymfomu, kde je možno autologní transplantaci zvažovat v rámci léčby RS.
Poznámky:
- Morrison WH, Hoppe RT, Weiss LM et al. Small lymphocytic lymphoma. J Clin Oncol. 1989;7(5):598-606
- Zelenetz AD, Gordon LI, Wierda WG et al. Chronic lymphocytic leukemia/small lymphocytic lymphoma, version 1.2015. J Natl Compr Canc Netw. 2015;
13(3):326-62 - Tsimberidou AM, Wen S, O‘Brien S et al. Assessment of chronic lymphocytic leukemia and small lymphocytic lymphoma by absolute lymphocyte counts in
2,126 patients: 20 years of experience at the University of Texas M.D. Anderson Cancer Center. J Clin Oncol. 2007;25(29):4648-56 - Hallek M, Cheson BD, Catovsky D et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of
CLL. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood. 2018; 131(25):2745-2760 - A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin‘s lymphoma. The Non-Hodgkin‘s Lymphoma Classification
Project. Blood. 1997;89(11):3909-18 - RAWSTRON AC, KREUZER K-A, SOOSAPILLA A, et al. Reproducible diagnosis of Chronic Lymphocytic Leukemia by flow cytometry: an European Research
Initiative on CLL (ERIC); European Society for Clinical Cell Analysis (ESCCA) harmonisation project. Cytometry B Clin Cytom. 2018 Jan;94(1):121-128. - Salvi F, Miller MD, Grilli A et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly
patients. J Am Geriatr Soc. 2008;56(10):1926-31 - Hallek M, Fischer K, Fingerle-Rowson G et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia:
a randomised, open-label, phase 3 trial. Lancet. 2010;376:1164-74 - EICHHORST B, NIEMANN CU, KATER AP, et al. First-Line Venetoclax Combinations in Chronic Lymphocytic Leukemia. N. Engl. J. Med. 2023;388(19):1739–1754.
- TAM CS, ALLAN JN, SIDDIQI T, et al. Fixed-duration ibrutinib plus venetoclax for first-line treatment of CLL: primary analysis of the CAPTIVATE FD cohort.
Blood. 2022;139(22):3278–3289. - Není t.č. stanovena úhrada, nutné schválení revizním lékařem.
- SHARMAN JP, EGYED M, JURCZAK W, et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzmab for treatment-naive chronic
lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet 2020;395(10232):1278–1291. - BURGER JA, BARR PM, ROBAK T, et al. Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the
phase 3 RESONATE-2 study. Leukemia. 2020;34(3):787–798. - TAM CS, BROWN JR, KAHLl BS, et al. Zanubrutinib versus bendamustine and rituximab in untreated chronic lymphocytic leukaemia and small lymphocytic
lymphoma (SEQUOIA): a randomised, controlled, phase 3 trial. Lancet. Oncol. 2022;23(8):1031–1043. - U pacientů bez delece 17p/mutace TP53 není t.č. stanovena úhrada BTK inhibitorů v první linii, nutné schválení revizním lékařem.
- T.č. je stanovena úhrada pouze u pacientů s komorbiditami, v důsledku kterých nemohou podstoupit léčbu na bázi fludarabinu v plné dávce.
- Není t.č. stanovena úhrada, nutné schválení revizním lékařem.
- Ghia P et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory
Chronic Lymphocytic Leukemia J Clin Oncol 2020 Sep 1;38(25):2849-2861 - BYRD JC, HILLMEN P, GHIA P, et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase
III Trial. J. Clin. Oncol. 2021;39(31):3441–3452. - Byrd JC, Brown JR, O‘Brien S et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014;371:213-223
- BYRD JC, HILLMEN P, O’BRIEN S, et al. Long-term follow-up of the RESONATE phase 3 trial of ibrutinib vs ofatumumab. Blood. 2019;133(19):2031–2042.
- Furman RR, Sharman JP, Coutre SE et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014;370:997-1007
- Seymour JF, Kipps TJ, Eichhorst B et al. Venetoclax-Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. New Engl J Med. 2018;378(12):1107-
20 - KATER AP, WU JQ, KIPPS T, et al. Venetoclax plus rituximab in relapsed chronic lymphocytic leukemia: 4-year results and evaluation of impact of genomic
complexity and gene mutations from the MURANO phase III study. J. Clin. Oncol. 2020;38(34):4042–4054. - BROWN JR, EICHHORST B, HILLMEN P, et al. Zanubrutinib or Ibrutinib in Relapsed or Refractory Chronic Lymphocytic Leukemia. N. Engl. J. Med.
2023;388(4):319–332. - Venetoklax v monoterapii nemá t.č. stanovenou úhradu ze zdravotního pojištění.
- Alemtuzumab není pro léčbu CLL registrován, je dostupný v ČR v rámci specifického léčebného programu.
27.3.6 B-lymfomy z buněk marginální zóny typu MALT
Chirurgický zákrok provádět z diagnostické indikace (nikoliv kurativní). Základem je imunochemoterapie (CHOP, COP, bendamustine*,chlorambucil) + rituximab*, event. radioterapie IF.
U Helicobacter pylori pozitivního MALT lymfomu žaludku nutná ATB eradikace HP infekce, v časných případech je možné použít jen tuto ATB terapii
* Rituximab má úhradu v léčbě lymfomu marginální zóny typu MALT u pacientů relabujících po (nebo nevhodných pro) lokální terapii; v ostatních případech podléhá zatím individuálnímu schválení pojišťovnou dle §16 zákona o veřejném zdravotním pojištění (48/1997 Sb.).
27.3.7 Lymfoplasmocytární lymfom s IgM monoklonální komponentou (Waldenstromova makroglobulinémie)
U asymptomatických nemocných bez přitomnosti velké nádorové masy (bulky postižení, cytopenie) je indikováno sledování (watch and wait).
V případě indikace je terapie založena na rituximabu a chemoterapii (např. R-CD, R-CP, R-Bendamustine event. další).
V případě relapsu je délky trvání první remise možné terapii buď opakovat případně zvolnit jiný režim. V relapsu onemocnění u nemocných s přítomnou somatickou mutací MYD88 265P (90% nemocných) je velmi účinným lékem ibrutinib*.
* podléhá zatím individuálnímu schválení pojišťovnou přes §16 zákona o veřejném zdravotním pojištění (48/1997 Sb.).
27.4 Lymfom ze zralých T/NK buněk C84
• Mycosis fungoides C84.0
• Sézaryho syndrom C84.1
• Lymfoepiteloidní lymfom C84.3
• T-buněčný lymfom‚ periferní‚ jinde neklasifikovaný C84.4
• Jiné lymfomy ze zralých T/NK-buněk C84.5
• Anaplastický lymfom z velkých buněk‚ ALK-pozitivní C84.6
• Anaplastický lymfom z velkých buněk‚ ALK-negativní C84.7
• Kožní T-buněčný lymfom‚ NS C84.8
• Lymfom ze zralých T/NK-buněk‚ NS C84.9
Terapeutické rozhodování by vzhledem k vzácnosti výskytu těchto lymfomů mělo být konzultováno s CIHP disponujícím všemi terapeutickými možnostmi, včetně transplantačních a klinických studií.
27.4.1 Principy léčby systémových periferních T-lymfomů
Vždy nutno zvážit zařazení pacienta do klinické studie – kontaktovat CIHP.
• U CD30+ nemocných s PTCL je indikována chemoterapie s antracyklinem a brentuximab vedotinem: 6–8× CHP+BV (event. u mladších pacientů CHEP+BV)
• u mladších pacientů je možné zvážit jako konsolidaci léčby1.linie vysokodávkovanou terapii s autologní transplantací krvetvorných buněk
• při selhání léčby (nedosažení kompletní remise nebo relaps onemocnění) vždy zvážit u mladších nemocných alogenní transplantaci
• v relapsu onemocnění: chemoterapie na bázi platinových derivátů v kombinaci s gemcitabinem či vysokodávkovaným cytarabinem (např. GDP, ICE, ESAP, GiFOX, bendamustine* atd.)
• brentuximab vedotin* je současně indikován k léčbě dospělých pacientů s relabujícím nebo refrakterním systémovým anaplastickým velkobuněčným lymfomem
• brentuximab vedotin* lze zvážit také v relapsu u CD30+ pacientů s ostatními formami PTCL (2. a další relaps)
• romidepsin*- u pacientů s relabujícím nebo refrakterním PTCL (2. a další relaps), event. pralatrexate*, lenalidomid*
* podléhá zatím individuálnímu schválení pojišťovnou přes paragraf 16 zákona o veřejném zdravotním pojištění (48/1997 Sb.).
27.4.2 Primární kožní T lymfomy: Mycosis fungoides, Sézary syndrom
27.4.2.1 Principy léčby mycosis fungoides
Léčba se řídí klinickým stádiem dle TNMB klasifikace ISCL/EORTC 2007 a rizikovými faktory.
Cíle léčby jsou úleva od symptomů, redukce nádorového objemu a oddálení progrese onemocnění.
Vzhledem k vzácnosti výskytu by léčba měla být konzultovaná a vedená pracovištěm se zkušenostmi s léčbou (vybraná dermatologická centra, CIHP).
Systémová protinádorová léčba včetně biologické léčby je poskytována v CIHP.
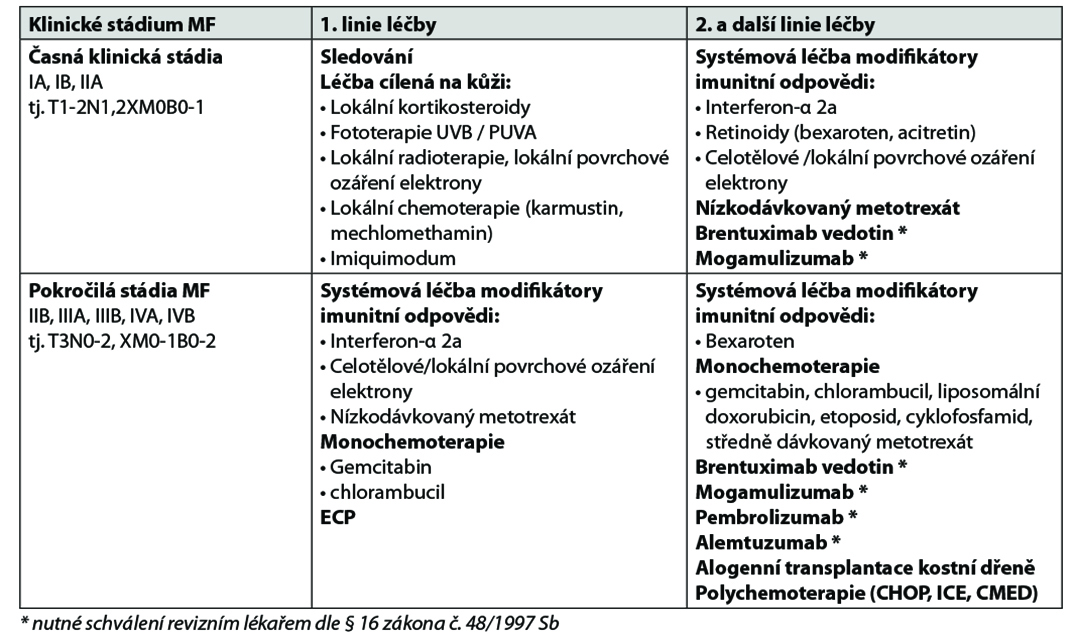
Poznámky k terapii:
• Systémová léčba modifikátory imunitní odpovědi může být kombinovaná s léčbou cílenou na kůži nebo se systémovou léčbou (nízkodávkovaným metotrexátem).
• Bexaroten je dle SPC indikovaný pro 2. linii léčby po předchozí jedné systémové léčbě; v ČR je v současné době preskripce vázaná na dermatologická centra.
• Extrakorporální fotoferéza (ECP) je indikovaná u erytrodermických forem MF, samotná nebo v kombinaci s léčbou cílenou na kůži nebo se systémovou léčbou.
• Liposomální doxorubicin v monoterapii.
• Brentuximab vedotin* je indikován v léčbě 2. linie u CD30+ primárních kožních lymfomů.
• Mogamulizumab* je podle SPC indikovaný v 2. linii léčby.
• Alemtuzumab* je indikovaný hlavně u krevního postižení (B2: atypické Sézaryho buňky ≥ 1000/μl).
• Povrchové ozáření elektrony (celotělové, lokální): konvenční dávka elektronovým svazkem o energii 6–9 MeV (v závislosti na hloubce kožního postižení) je 30–36 Gy aplikovaná během 8–10 týdnů v režimu cyklů s ozářením v tzv. nástavách. Na „poddávkované“ oblasti (perineum, plantární povrchy, vnitřní stehna, inframamární oblasti, +/- skalp) se podává boost; nízkodávkované režimy (10–12 Gy) mají lepší toxický profil, kratší délku léčby, možnost opakovaných aplikací u progredujících/relabujících MF.
• Polychemoterapie (CHOP, CHOP-like) je indikovaná pouze s paliativním cílem péče.
• ICE nebo CMED může být použit také jako „přemosťující“ léčba k navození CR/PR před alogenní transplantaci krvetvorných buněk.
• Autologní transplantace není u MF indikovaná (je zatížena téměř 100 % rizikem časného relapsu do 6 měs.). U všech nemocných do 65 let věku s pokročilým stádiem MF (s nebo bez rizikových faktorů) je po selhání dvou liniích systémové terapie nutné zvážit indikaci alogenní transplantace krvetvorných buněk s nemyeloablativním přípravným režimem s redukovanou intenzitou. Pacienta konzultovat s transplantačním centrem.
27.4.2.2 Principy léčby Sézaryho syndromu
Léčba by měla probíhat v CIHP, na pracovišti se zkušenostmi s léčbou. V léčbě je nutné se vyhnout imusupresivním léčivým přípravkům (kortikosteroidy, cyklosporin atd.), tzv. imunitní systém šetřící přístup. Podpůrná léčba (pruritu příp. bolesti, primární antimikrobní profylaxe, péče o kůži) je nedílnou součástí léčby.

• Extrakorporální fotoferéza (ECP), samostatná nebo kombinovaná se systémovou imunomodulační léčbou (interferon, bexaroten) je léčbou volby 1. linie léčby.
• Systémová léčba modifikátory imunitní odpovědi může být samotná nebo kombinovaná mezi sebou (interferon + bexaroten) anebo kombinovaná se systémovou cytotoxickou léčbou (nízkodávkovaným metotrexátem).
• Systémová imunomodulační léčba může být samotná (v monoterapii) nebo kombinovaná (interferon + bexaroten).
• Bexaroten je dle SPC indikovaný pro 2. linii léčby po předchozí jedné systémové léčbě, preskripce je v současné době v ČR vázaná na vybraná dermatologická centra.
• Mogamulizumab je podle SPC indikovaný v 2. linii léčby.
• Alemtuzumab samostatně nebo v kombinaci s ECP.
• Polychemoterapie je indikovaná s paliativním cílem péče a nebo jako „přemosťující“ léčba před alogenní transplantací krvetvorných buněk.
• U všech nemocných do 65 let věku je nutné zvážit indikaci alogenní transplantace krvetvorných buněk s nemyeloablativním přípravným režimem s redukovanou intenzitou. Případ konzultovat s transplantačním centrem.
27.5 Non-Hodgkinův lymfom, jiných a neurčených typů (C85), lymfom z T/NK buněk, jiné určené typy (C86)
• Mimouzlinový NK/T-buněčný lymfom‚ nosní typ C86.0
• T-buněčný lymfom jater a sleziny C86.1
• T-buněčný lymfom s enteropatií (střevní) C86.2
• Podkožní T-buněčný lymfom napodobující panikulitidu C86.3
• Blastický NK-buněčný lymfom C86.4
• Angioimunoblastický T-buněčný lymfom C86.5
• Primární kožní T-buněčné proliferace, CD30-pozitivní C86.6
Terapeutické rozhodování by vzhledem k vzácnosti výskytu těchto lymfomů mělo být konzultováno s CIHP disponujícím všemi léčebnými možnostmi.
27.6 Vybrané informace k cílené léčbě
Cílem níže uvedeného přehledu je shrnout aktuální postavení nových molekul v léčbě lymfomů. Přehled odkazuje na aktuální stav z hlediska registrace a schválení léků. Aktuální stav z hlediska registrace a úhrady nutno sledovat na stánkách SÚKL. Uvedené informace představují stav k 1. 1. 2023.
Na tomto místě je nutno podotknout, že ošetřující lékař může, pokud není léčivý přípravek distribuován nebo není v oběhu léčivý přípravek potřebných terapeutických vlastností, použít registrovaný léčivý přípravek způsobem, který není v souladu se souhrnem údajů o přípravku, je-li však takový způsob dostatečně odůvodněn vědeckými poznatky. Za stejných podmínek může použít i neregistrovaný léčivý přípravek. Poskytovatel zdravotních služeb odpovídá podle právních předpisů za škodu na zdraví nebo za usmrcení člověka, ke kterým došlo v důsledku použití neregistrovaného léčivého přípravku nebo použití registrovaného léčivého přípravku způsobem uvedeným výše.

Rituximab
Rituximab je indikován:
• v léčbě folikulárního lymfomu III. a IV. klinického stadia nebo u rizikových nemocných II. klinického stádia (dle GELF kritérií), kde je indikována protinádorová terapie, a to v první linii a v relapsu po předchozí protinádorové terapii.
• jako udržovací léčba folikulárního lymfomu v případě odpovědi na indukční léčbu: u pacientů s dosud neléčeným folikulárním lymfomem, aplikace jednou za 2 měsíce, u pacientů s relabovaným/refrakterním folikulárním lymfomem,
aplikace jednou za 3 měsíce. Udržovací léčba je hrazena do progrese onemocnění nebo nejdéle po dobu dvou let. • v léčbě difúzního velkobuněčného nehodgkinského maligního lymfomu B řady CD 20+ v kombinaci s režimem typu CHOP (z důvodu toxicity je možné snížení dávek či vynechání některé složky kombinovaného režimu), u relabujícího onemocnění též v kombinaci s dalšími chemoterapeutickými režimy (konkrétně s režimy R-DHAP, R-ICE, R-GDP).
• v léčbě primárního difuzního B-velkobuněčného lymfomu CNS v kombinaci s chemoterapií, jež ve svém schématu obsahuje vysoké dávky metotrexátu.
• v léčbě chronické lymfatické leukémie a lymfomu z malých lymfocytů (CLL/SLL) v kombinaci s chemoterapií, v časném relapsu onemocnění též v kombinaci s idelalisibem.
• v léčbě lymfomu z plášťových buněk, a to v indukční terapii v kombinaci s chemoterapií v první linii i v léčbě pozdního relapsu; dále v udržovací terapii po předchozím dosažení parciální či kompletní remise jednou za 2–3 měsíce podobu 3 let či do progrese onemocnění (co nastane dříve).
• V léčbě lymfomu marginální zóny typu MALT u pacientů relabujících po (nebo nevhodných pro) lokální terapii.
• v první linii léčby Burkittova lymfomu v kombinaci s chemoterapií.
• v první linii léčby CD20+ akutní lymfoblastové leukémie/lymfoblastového lymfomu z B buněk v kombinaci s chemoterapií.
• v léčbě Waldenströmovy makroglobulinémie v kombinaci s chemoterapií.
• v léčbě 1. linie u nemocných s FL ve stádiu I a II v monoterapii (4 cykly) či v kombinaci s radioterapií či chemoterapií (maximálně 8 cyklů); v léčbě prvního a dalšího relapsu u nemocných ve stádiu I. a II. v monoterapii (4 cykly) či v kombinaci s radioterapií či chemoterapií (maximálně 8 cyklů)
• k terapii relapsu Burkittova lymfomu v kombinaci s chemoterapií (maximálně 6 cyklů)
• k léčbě relapsu lymfoblastového B-buněčného CD20+ lymfomu / lymfoblastové B-buněčné CD20+ leukémie - v kombinaci s chemoterapií (maximálně 6 cyklů)
• k léčbě CD20+ Hodgkinova lymfomu typu modulární lymfocytární predominance - v 1. linii léčby v kombinaci s chemoterapií (maximálně 8 cyklů) a k léčbě relapsu v kombinaci s chemoterapií (maximálně 6 cyklů), popřípadě v monoterapii u pozdních relapsů s malou nádorovou masou
• k léčbě CD20+ potransplantačních lymfoproliferativních onemocnění
Brentuximab vedotin
Brentuximab vedotin je indikován pro:
• 1. linii léčby dospělých pacientů s CD30-pozitivním periferním T lymfomem v kombinaci s cyklofosfamidem, doxorubicinem a prednisonem. Jedná se o pacienty o stavu výkonnosti 0-1 dle ECOG. Brentuximab je hrazen do progrese onemocnění, projevů nepřijatelné toxicity nebo do vyčerpání maximálního počtu 8 cyklů kombinační chemoterapie dle toho, co nastane dříve.
• léčbu dospělých pacientů ve stavu výkonnosti 0-1 dle ECOG s CD30+ Hodgkinovým lymfomem (HL) relabujícím nebo refrakterním po autologní transplantaci kmenových buněk (ASCT). Jedná se se výhradně o pacienty s relabujícím/refrakterním onemocněním po podání nivolumabu nebo o pacienty, kterým z důvodu profilu toxicity nebo kontraindikace nivolumab nelze podat. Pacienti nesmějí být předléčeni brentuximab vedotinem. Léčba je hrazena nejdéle do progrese onemocnění, nepřijatelné toxicity nebo do vyčerpání maximálního počtu 16 infuzí (cyklů), co nastane dříve.
• léčbu dospělých pacientů s klasickým (CD30-pozitivním) Hodgkinovým lymfomem s vysokým rizikem relapsu po provedené vysokodávkové chemoterapii s následnou ASCT. Jedná se o nemocné ve velmi dobrém stavu výkonnosti (ECOG 0-1), kteří v minulosti nebyli léčeni anti-CD30 terapií brentuximab vedotinem. Vysoké riziko relapsu je definováno jako přítomnost alespoň dvou z následujících rizikových faktorů: - nemocní s časným relapsem do 12 měsíců od ukončení předchozí terapie, nebo nemocní refrakterní vůči první linii léčby, - nejlepší odpovědí na poslední záchrannou terapii dle vyšetření CT a/nebo PET u nich byla parciální odpověď (PR) nebo stabilizace onemocnění (SD), - extranodální onemocnění u relapsu před ASCT, - B symptomy u relapsu před ASCT, - dvě nebo více předchozích záchranných terapií. Léčba je hrazena do progrese onemocnění, do vyčerpání 16 cyklů (tj. 16 infuzí) terapie, či do projevů nepřijatelné toxicity dle toho, co nastane dříve.
• léčbu dospělých pacientů s dosud neléčeným CD30+ Hodgkinovým lymfomem (HL) stadia IV v kombinaci s doxorubicinem, vinblastinem a dakarbazinem (AVD).
• léčbu dospělých pacientů s CD30+ refrakterním nebo relabujícím Hodgkinovým lymfomem po nejméně dvou předchozích terapiích v případech, kdy ASCT ani kombinovaná chemoterapie nepředstavují léčebnou možnost. Jedná se o pacienty ve velmi dobrém stavu výkonnosti (ECOG 0 - 1), kteří nesmějí být předléčeni brentuximab vedotinem. Léčba je hrazena do progrese onemocnění, do vyčerpání 16 cyklů (tj. 16 infuzí) terapie, či do projevů nepřijatelné toxicity dle toho, co nastane dříve.
• léčbu dospělých pacientů s relabujícím nebo refrakterním sALCL.
• léčbu dospělých pacientů s CD30+ kožním T-buněčným lymfomem po nejméně jedné předchozí systémové terapii .
• Brentuximab vedotin prokázal efektivitu u nemocných s relabujícím primárním mediastinálním lymfomem, v kombinaci s nivolumabem.
Ibrutinib
Ibrutinib je indikován:
• u pacientů o stavu výkonnosti 0-1 dle ECOG s CLL/SLL, kteří splňují alespoň jedno z následujících kritérií: a) jsou refrakterní na poslední léčbu; b) došlo u nich k relapsu do 24 měsíců po ukončení předcházející léčby; c) došlo u nich k relapsu a nejsou vhodní na chemoimunoterapii; d) je u nich prokázaná mutace TP53 nebo del17p.
• u nemocných s relabujícím nebo refrakterním lymfomem z plášťových při relapsu do 24M od poslední terapie a nemožnosti provést alogenní transplantaci.
• v monoterapii k léčbě dospělých pacientů s Waldenströmovou makroglobulinemií, kteří již podstoupili alespoň jednu předchozí terapii, nebo v první linii u pacientů, u nichž není vhodná chemoimunoterapie. V kombinaci s rituximabem je indikován k léčbě dospělých pacientů s WM.
• existují klinická data o jeho účinnosti i u nemocných s jinými typy lymfomů, např. non-GC subtypem DLBCL nebo MZL
Lenalidomid
Lenalidomid je indikován:
• v monoterapii k léčbě relapsu dospělých pacientů s lymfomem z plášťových buněk.
• v kombinaci s rituximabem u nemocných s relapsem FL.
• Existují klinická data o jeho účinnosti i u nemocných s jinými typy lymfomů, např. non-GC subtypem DLBCL nebo relabujícím MZL.
Romidepsin
Romidepsin je indikován:
• v monoterapii k léčbě dospělých pacientů s relabujícím/refrakterním kožním T-lymfomem a periferním T-lymfomem, kteří obdrželi minimálně 1 systémovou terapii.
Bendamustine
Bendamustine je indikován:
• u pacientů s folikulárním lymfomem v rámci léčby 1. linie u pokročilého onemocnění st. III a IV, v kombinaci s rituximabem.
• u nemocných se SLL/CLL v 1. linii léčby, v kombinaci s rituximabem – při nevhodnosti režimu s fludarabinem.
• v kombinaci s obinutuzumabem u skupiny rituximab refrakterních nemocných s folikulárním lymfomem v relapsu onemocnění.
• u nemocných v relapsu FL nebo SLL/CLL.
• u pacientů s lymfomem z plášťových buněk, marginální zóny nebo lymfomu typu LPL či Waldenströmovy makroglobulinémie.
• u nemocných s relapsem Hodgkinova lymfomu.
• existují data o efektivitě bendamustinu u nemocných s relapsem PTCL.
Obinutuzumab
Obinutuzumab je indikován:
• v kombinaci s chlorambucilem u starších, komorbidních nemocných s lymfomem typu SLL/CLL, kteří mají kontraindikaci podání fludarabinového režimu.
• v kombinaci s bendamustinem u pacientů s rituximab refrakterním folikulárním lymfomem; u pacientů, kde bylo touto léčbou dosaženo CR nebo PR, je indikována udržovací léčba obinutuzumabem po 2M po dobu 2 let.
• v kombinaci s chemoterapií (CHOP, COP, bendamustin) v první linii léčby nemocných s folikulárním lymfomem středního a vysokého rizika dle FLIPI (2-5) s následnou udržovací léčbou při dosažení CR/PR po indukční léčbě.
• v kombinaci s venetoclaxem k léčbě dospělých pacientů s dříve neléčenou chronickou lymfocytární leukémií (CLL) a s komorbiditami, v důsledku kterých nemohou podstoupit léčbu na bázi fludarabinu v plné dávce. Jedná se o pacienty o stavu výkonnosti 0-1 dle ECOG. Přípravek je hrazen do vyčerpání 12 cyklů terapie nebo do progrese onemocnění či výskytu nepřijatelné toxicity, dle toho, co nastane dříve.
• Existují data o efektivitě obinutuzumabu v kombinaci s lenalidomidem u nemocných v relapsu FL.
Venetoclax
Venetoklax je indikován:
• v kombinaci s rituximabem u dospělých pacientů s relabující nebo refrakterní chronickou lymfocytární leukémií (CLL) o stavu výkonnosti 0-1 dle ECOG, kteří splňují alespoň jedno z následujících kritérií: (a) jsou refrakterní na poslední léčbu; (b) došlo u nich k relapsu do 24 měsíců po ukončení předcházející léčby; (c) došlo u nich k relapsu a nejsou vhodní na
chemoimunoterapii; (d) je u nich prokázaná mutace TP53 nebo del17p.
• v kombinaci s obinutuzumabem k léčbě dospělých pacientů s dříve neléčenou chronickou lymfocytární leukémií (CLL) a s komorbiditami, v důsledku kterých nemohou podstoupit léčbu na bázi fludarabinu v plné dávce. Jedná se o pacienty o stavu výkonnosti 0-1 dle ECOG. Přípravek je hrazen do vyčerpání 12 cyklů terapie nebo do progrese onemocnění či výskytu nepřijatelné toxicity, dle toho, co nastane dříve.
• v monoterapii pro léčbu pacientů s CLL/SLL, u kterých selhala léčba inhibitorem dráhy B-buněčného receptoru.
• Venetoclax prokázal svoji efektivitu i u nemocných s relapsem MCL a FL.
Nivolumab
Nivolumab je indikován:
• k léčbě relabujícího nebo rezistentního klasického Hodgkinova 1) po autologní transplantaci kmenových buněk a po ní následující léčbě brentuximab vedotinem, 2) po autologní transplantaci kmenových buněk u pacientů dosud brentuximab vedotinem nepředléčených.
• Existují data o efektivitě nivolumabu v kombinaci s brentuximab vedotinem u nemocných s relabujícím primárním mediastálnálním B lymfomem.
Pembrolizumab
Pembrolizumab je indikován:
• pro nemocné s relabujícím/refrakterním Hogkinským lymfomem, u nichž selhala ASCT a brentuximab vedotin nebo u kterých není ASCT vhodná a brentuximab vedotin selhal.
• U nemocných s relabujícím primárním mediastinálním B-lymfomem.
Bortezomib
Bortezomib je indikován:
• v léčbě relapsu lymfomu z plášťových buněk v kombinaci s rituximabem (případně též dexametazonem) u pacientů nevhodných k intenzivní chemoterapii s následnou alogenní transplantací.
• kombinaci s rituximabem, cyklofosfamidem, doxorubicinem a prednisonem k léčbě dospělých pacientů s dosud neléčeným lymfomem z plášťových buněk, u kterých není vhodná transplantace hematopoetických kmenových buněk.
• Bortezomib dále prokázal klinickou efektivitu u nemocných s relabující Waldenstromovou makroglobulinémií.
Akalabrutinib
Akalabrutinib je indikován:
• u dospělých pacientů o stavu výkonnosti 0-1 dle ECOG s chronickou lymfocytární leukémií (CLL), kteří splňují alespoň jedno z následujících kritérií: (a) jsou refrakterní na poslední léčbu; (b) došlo u nich k relapsu do 24 měsíců po ukončení předcházející léčby; (c) došlo u nich k relapsu a nejsou vhodní na chemoimunoterapii; (d) je u nich prokázaná mutace TP53 nebo del17p. Přípravek je hrazen do progrese onemocnění nebo projevů nepřijatelné toxicity.
• u pacientů s relabujícím nebo refrakterním lymfomem z plášťových buněk
• v monoterapii nebo v kombinaci s obinutuzumabem k léčbě dospělých pacientů s dříve neléčenou chronickou lymfocytární leukemií (CLL/SLL).
Polatuzumab vedotin
Polatuzumab vedotin je indikován:
• v kombinaci s bendamustinem a rituximabem k léčbě dospělých s relabujícím / refrakterním difúzním velkobuněčným B-lymfomem (DLBCL), pro které není vhodná transplantace hematopoetických kmenových buněk a kteří nejsou vhodní k léčbě některým z uvedených platinových režimů (konkrétně R-ICE, R-GDP nebo R-DHAP) s ohledem na celkový stav nebo předléčenost (platinovými režimy). Léčba je hrazena do progrese onemocnění, maximálně do vyčerpání 6 cyklů terapie.
• v léčbě pacientů s nově diagnostikovaným DLBCL IPI 2-5, a to v kombinaci Pola-R-CHP.
27.7. Doporučení pro léčbu CAR-T lymfocyty u pacientů s nehodgkinovým lymfomy
V současné době jsou v EU registrovány 3 přípravky obsahující CAR-T lymfocyty pro terapii lymfomů:
• tisagenlecleucel (Kymriah®, Novartis)
• axicabtagen ciloleucel (axicel, Yescarta®, Gilead/Kite)
• brexucaptagene autoleucel (brexucel, Tecartus®, Gilead/Kite)
Všechny přípravky jsou individuálně připravované preparáty autologních T-lymfocytů s vneseným chimerickým antigenním receptorem. Odlišnosti jsou v indikacích a zejména v logistice přípravy a podání. Léčba CAR-T lymfocyty je možná pouze v centrech, která jsou certifikována farmaceutickou společností k podání příslušného preparátu. Pro aktualizované informace o certifikovaných léčebných centrech odkazujeme na webové stránky www.lymphoma.cz.
Úhrada terapie pomocí CAR-T lymfocytů je v režimu léků „N“ – vázáno na hospitalizaci; doporučujeme nechat schválit revizním lékařem dle § 16 zákona č. 48/1997 Sb.
Tisacel (tisagenlecleucel)
Indikace k podání:
• Relabující/refrakterní systémový difuzní velkobuněčný B-lymfom (DLBCL, včetně B-lymfomů blíže neurčených s dvojí přestavbou c-myc/bcl-2 nebo bcl-6 a včetně DLBCL transformovaných z původně folikulárního lymfomu), po dvou či více liniích systémové léčby.
• Relabující/refrakterní folikulární lymfom (FL), po dvou nebo více liniích systémové léčby.
Logistika přípravy a podání:
• Pro výrobu LPMTKymriah® jsou odesílány zamražené periferní mononukleární buňky (PBMC), získané nestimulovanou aferézou.
• Mezi odběrem PBMC a podáním Kymriah® je možno podat překlenující („bridging“) terapii (např. chemoterapii, RT, rituximab).
• Před podáním Kymriah® je aplikován lymfodepleční režim: fludarabin s cyklofosfamidem nebo bendamustin. Přípravek se podává 2–14 dní po ukončení lymfodeplečního režimu.
• Lymfodepleční režim je nutno podávat v akreditovaném léčebném centru a je možno ho zahájit až poté, co dojde k fyzickému ověření dostupnosti přípravku Kymriah®
• Přípravek Kymriah® je možno podat i bez lymfodepleční chemoterapie, pokud je počet leukocytů <1×109/l v průběhu 1 týdne před podáním.
Axicel (axicaptagene ciloleucel)
Indikace k podání:
• K léčbě dospělých pacientů s difuzním velkobuněčným B-lymfomem (DLBCL) a s „high-grade“ B-buněčným lymfomem (HGBL), který relabuje do 12 měsíců po dokončení chemoimunoterapie první linie nebo je na ni refrakterní”
• Relabující/refrakterní systémový difuzní velkobuněčný B-lymfom (DLBCL včetně B-lymfomů blíže neurčených s dvojí přestavbou c-myc/bcl-2 nebo bcl-6 a včetně DLBCL transformovaných z původně folikulárního lymfomu), po dvou či více liniích systémové léčby.
• Relabující/refrakterní primární mediastinální B-lymfom (PMBL), po dvou či více liniích systémové léčby.
• Relabující/refrakterní folikulární lymfom (FL), po třech či více liních systémové léčby
Logistika přípravy a podání:
• Pro výrobu LPMT Yescarta® jsou odesílány čerstvé periferní mononukleární buňky, získané nestimulovanou aferézou.
• Před podáním Yescarta® je aplikován lymfodepleční režim: fludarabin s cyklofosfamidem (dávky jsou odlišné než u lymfodeplečního FC před podáním Kymriah®). Přípravek se podává 48 hod po ukončení lymfodeplečního režimu.
• Lymfodepleční režim je nutno podávat v akreditovaném léčebném centru a je možno ho zahájit až poté, co dojde k fyzickému ověření dostupnosti přípravku Yescarta®.
Brexucel (brexucaptagene autoleucel)
Indikace k podání:
• relabující nebo refrakterní lymfomem z plášťových buněk (MCL) po dvou či více liniích systémové léčby, které zahrnovaly
léčbu inhibitorem Brutonovy tyrosinkinázy (BTK).
Logistika přípravy a podání:
• Pro výrobu LPMT Tecartusa® jsou odesílány čerstvé periferní mononukleární buňky, získané nestimulovanou aferézou.
• Před podáním Tecartus ® je aplikován lymfodepleční režim: fludarabin s cyklofosfamidem.
• Přípravek se podává 48 hodin po ukončení lymfodeplečního režimu.
• Lymfodepleční režim je nutno podávat v akreditovaném léčebném centru a je možno ho zahájit až poté, co dojde k fyzickému
ověření dostupnosti přípravku Tecartus®.
Liso-cel (lisokabtagen maraleucel)
Indikace k podání:
• Relabující nebo refrakterní difuzní velkobuněčný lymfom (DLBCL) po dvou nebo více liniích systémové léčby.
• Relabující nebo refrakterní primární mediastinální lymfom (PMBCL) po dvou nebo více liniích systémové léčby.
• Relabující nebo refrakterní folikulární lymfom grade 3B (FL3B) po dvou nebo více liniích systémové léčby.
Logistika přípravy a podání:
• Pro léčbu pomocí LPMT Breyanzi® není v ČR zatím akreditované žádné centrum.
27.8. Sledování nemocných po léčbě lymfomů
Obecná pravidla pro sledování po léčbě
Pacienty po léčbě lymfomu dlouhodobě dispenzarizujeme pro riziko vzniku relapsu/progrese onemocnění a pro monitoraci pozdních následků terapie.
Frekvence kontrol po léčbě závisí na:
• histologickém subtypu lymfomu – kurabilní /agresivní/ lymfomy vs. nekurabilní /indolentní/ lymfomy
• typu léčby (primoterapie vs. terapie relapsu/progrese onemocnění)
• kvalitě dosažené léčebné odpovědi
Klinické a laboratorní kontroly:
• anamnéza,
• fyzikální vyšetření,
• laboratorní vyšetření (krevní obraz + diferenciální rozpočet leukocytů), u NHL se sleduje hodnota LDH, u HL sedimentace (FW) a hodnota C-reaktivního proteinu.
Možný relaps/progresi monitorujeme pomocí zobrazovacích vyšetření, kde typ a frekvence provádění jsou závislé na typu lymfomu a dosažené léčebné odpovědi. Ve studiích je načasování kontrolních zobrazovacích vyšetření určeno protokolem.
Monitorace relapsu/progrese dominuje u indolentních lymfomů, sledování projevů pozdní toxicity léčby se dostává do popředí u kurabilních agresivních lymfomů.
27.8.1. Kurabilní lymfomy
Nejčastěji HL a DLBCL (pravděpodobnost relapsu v dlouhodobějším časovém horizontu se snižuje)
Klinické a laboratorní kontroly:
• po dosažení CR 4× ročně à 3 měsíce po dobu prvních 2 let, dále à 6 měsíců do 4. roku, následně 1× ročně dlouhodobě. Dle lokální praxe pracoviště je na zvážení kontrola nemoci pomocí RTG hrudníku a UZ břicha. Nedoporučuje se provádění PET/CT vyšetření pro možnost falešně pozitivních výsledků PET vyšetření (až 20 %). PET/CT je indikováno především při obtížích nemocného suspektních z relapsu/progrese onemocnění.
27.8.2 Nekurabilní lymfomy
Nejčastěji indolentní lymfomy (FL, SLL, MZL), z agresivnějších zejména MCL (vyšší riziko relapsu a pravděpodobnost relapsu se zvyšuje v čase).
Klinické a laboratorní kontroly:
• po lokální radioterapii: à 6 měsíců první 2 roky, následně 1× ročně
• po systémové chemoterapii: à 3–4 měsíce první 2 roky, à 6 měsíců do 5. roku, poté 1× ročně dlouhodobě
• frekvence kontrol se určuje v závislosti na kvalitě dosažené léčebné odpovědi a dle přítomnosti rizikových faktorů
Zobrazovací vyšetření se provádí ke zhodnocení léčebné odpovědi po ukončení indukční terapie (CT či PET/CT), dále většinou v šestiměsíčních intervalech po dobu 1 roku a po ukončení udržovací léčby (nejčastěji CT vyšetření).
Ve fázi sledování je nemoc dále kontrolována nejčastěji pomocí UZ vyšetření (periferní uzliny, vyšetření břicha) a RTG vyšetření hrudníku dle lokální praxe – většinou 1× za 12 měsíců do 5. roku, poté již jen při podezření na relaps/progresi lymfomu. V případě přítomnosti asymptomatické reziduální masy po terapii je provedení zobrazovacích vyšetření po léčbě indikováno v intervalech dle obtíží nemocného, dle uvážení klinika a dle lokální praxe pracoviště, aby byla včas zachycena event. progrese onemocnění. Obecně lze ale říci, že přínos použití zobrazovacích vyšetření je z dlouhodobého časového horizontu sporný. Vyšetření PET/CT se nedoporučuje. Toto vyšetření je indikováno ve výjimečných případech, např. v případě PET avidního rezidua po léčbě ke kontrole aktivity nemoci v čase.
27.9 Léčebné režimy
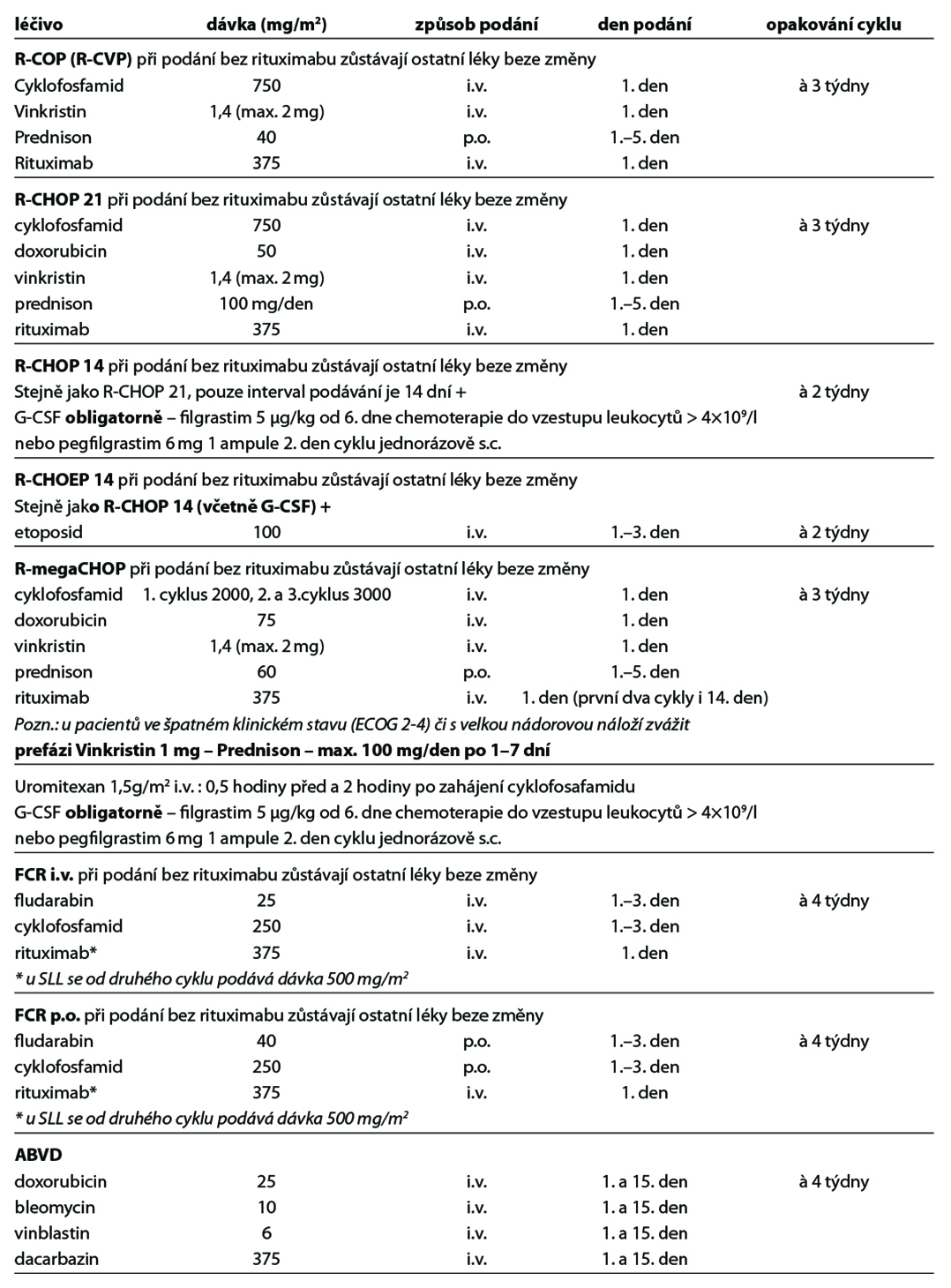
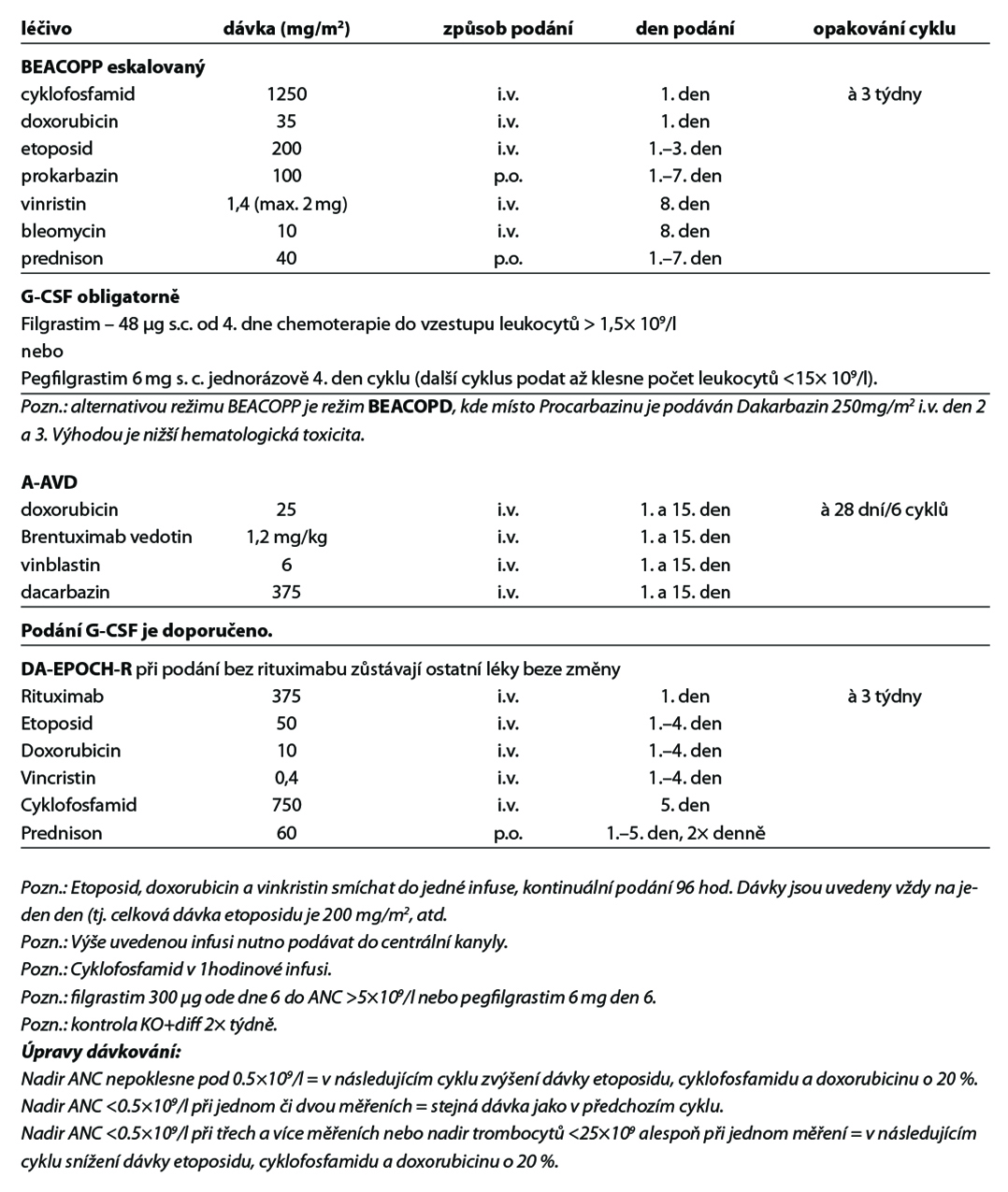
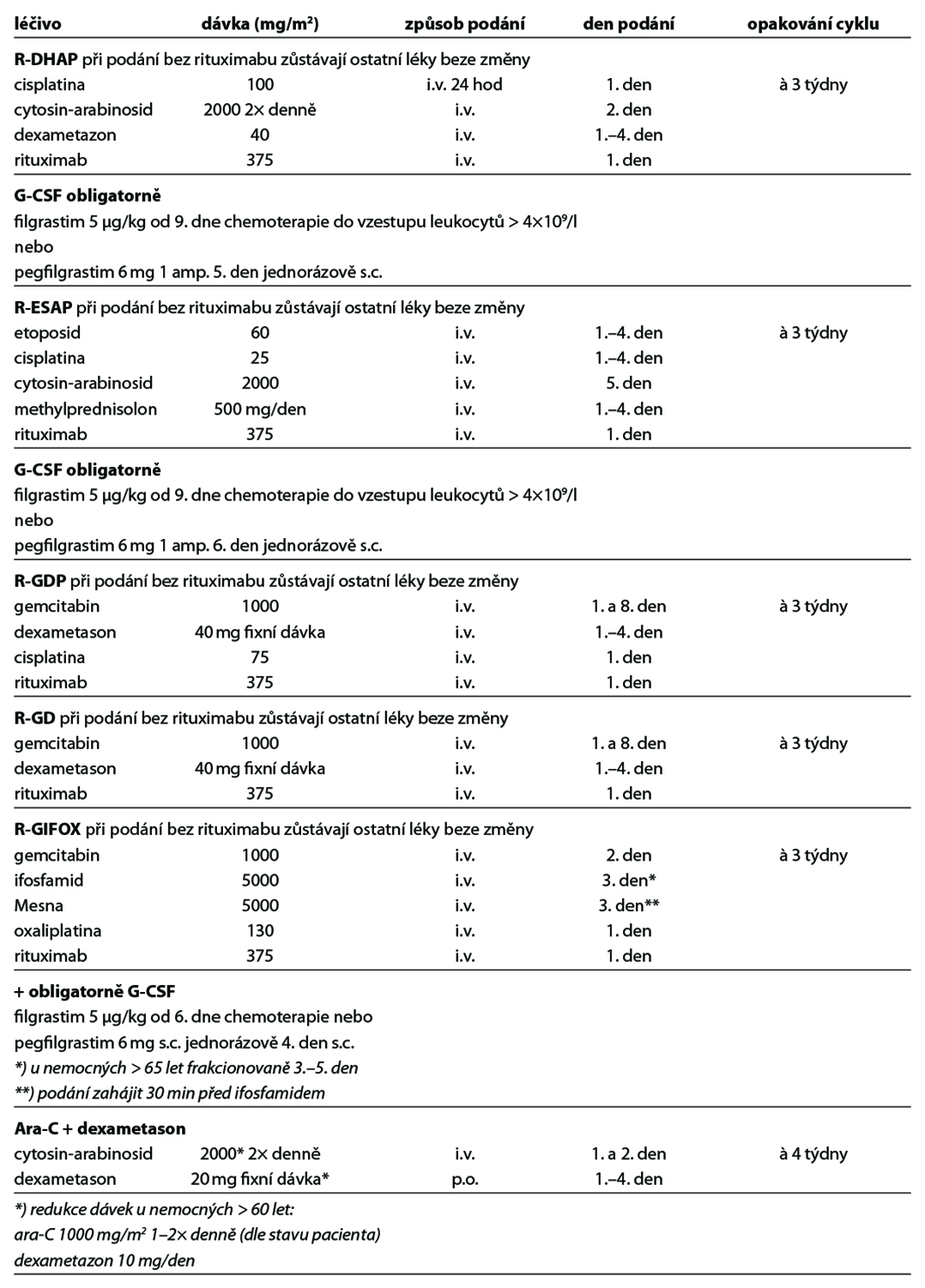
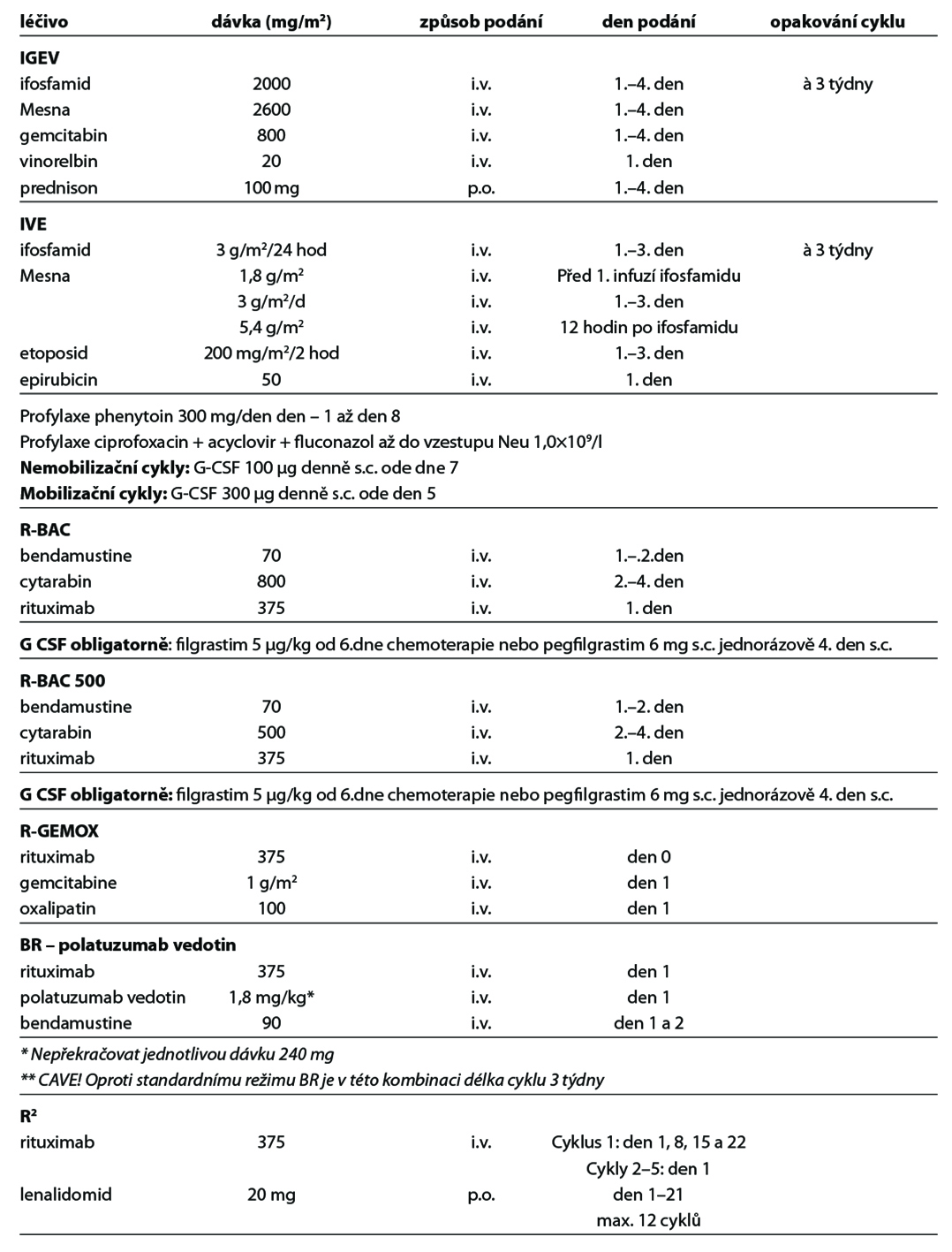
Níže uvedené cytostatické režimy zahrnují nejčastěji používané režimy v 1. linii a v relapsu onemocnění. Kompletní přehled režimů je uveden na stránkách www.lymphoma.cz v rámci aktuálních doporučení KLS pro léčbu lymfomů. Použití G-CSF se řídí platnými EORTC doporučeními.
27.9.1. Standardní chemoterapie
Obecné poznámky
• podání chemoterapie a imunoterapie vychází ze standardních doporučení výrobců léků k jejich přípravě, ředění a způsobu aplikace
• v přehledu léčebných schémat je uvedena pouze dávka léku a způsob aplikace
• při podání dose-denzních nebo dose-intenzivních režimů je podání G-CSF povinné
• u ostatních režimů se řídí podání G-CSF v rámci primární profylaxe EORTC doporučeními (doporučováno u režimů s rizikem febrilní neutropenie > 20 %)
• pegylovaný G-CSF (pegfilgrastim) lze použít k urychlení regenerace u intenzivních nestimulačních režimů – pro stimulaci kmenových buněk nutno podávat filgrastim
• dávky cytostatik jsou standardně uvedeny v mg/m2


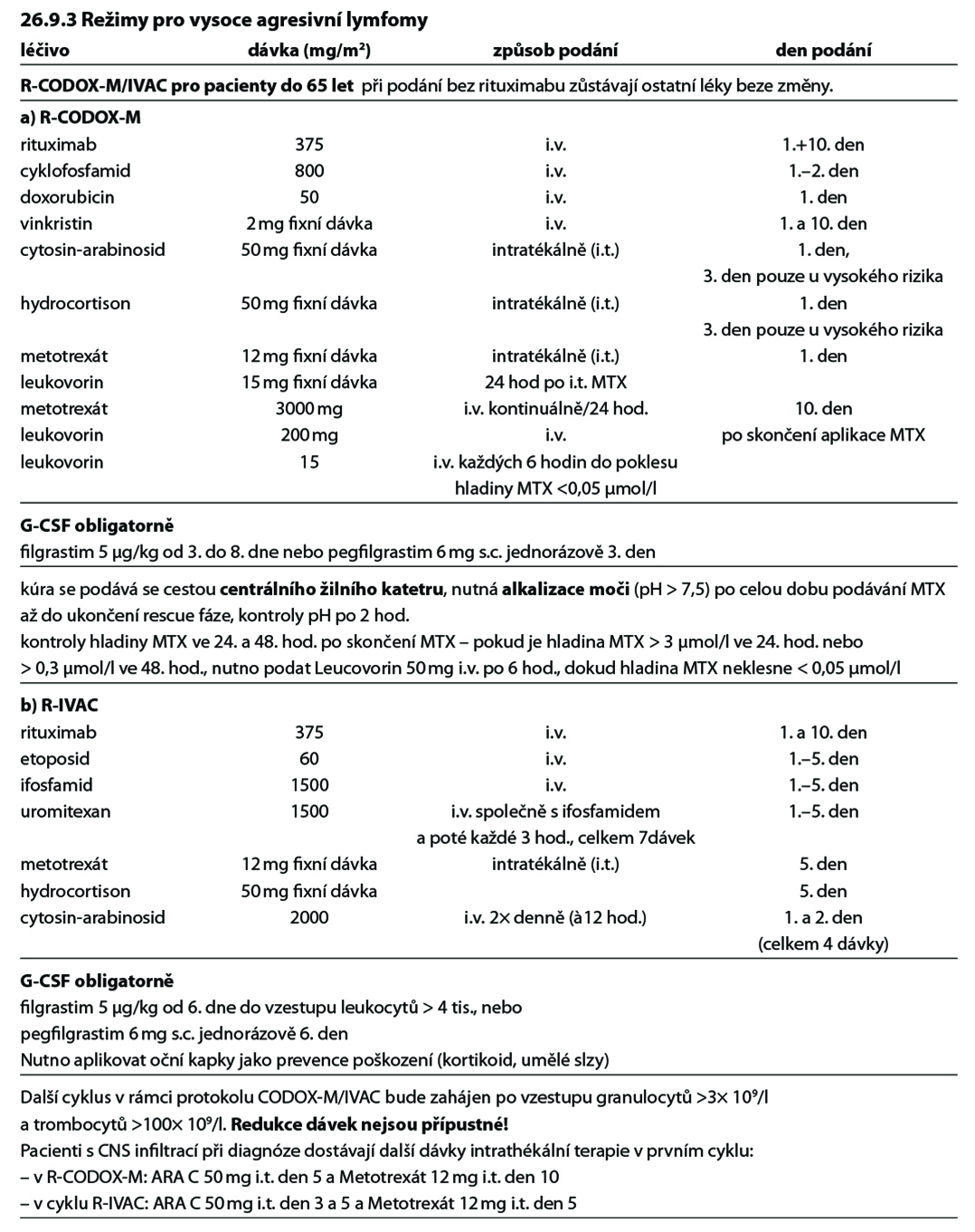

Poznámky k léčbě Burkittova lymfomu
• i.v. hydratace, alkalizace moči, allopurinol, bikarbonát sodný,
• podává se cestou centrálního žilního katetru,
• Rituximab celkem 8 dávek podaných v prvních 4 cyklech léčby,
• CNS profylaxe – MTX i.t. 12 mg den 2 a AraC 100 mg i.t. den 7 nebo 8 každého cyklu
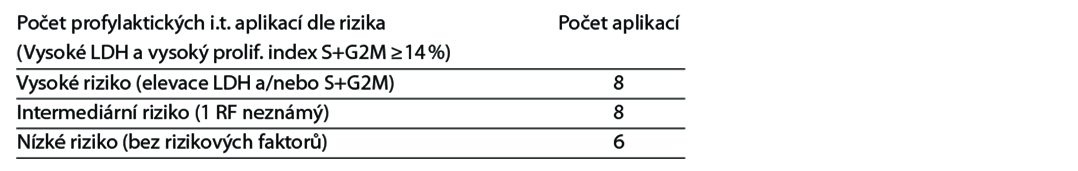
• další cyklus zahájit při leuko > 3000 a trombo > 50 tis.,
• další cyklus à 21 dní, nebo dříve pokud je KO zreparován (od 14. dne) při leukocytech > 3000 a trombocytech > 50 tis.,
• redukce AraC na 1 g/m2 u pacientů > 60 let, při kreatininu > 132 μmol/l či hladině metotrexátu >20 μmol/l na konci 24hodinové infúze,
• redukce vincristinu na 1 mg i.v. při hladině bilirubinu >2 mg/dl, nebo při perif. neuropatii gr. 2+,
• redukce doxorubicinu na 50 % při bilirubinu >2–3 mg/dl, redukce doxorubicinu o 75 % při bilirubinu >5 mg/dL,
• redukce MTX na 50 % při clearance kreatininu 10–50 ml/min. a při pleurálních výpotcích nebo ascitu,
• profylakticky se RT neaplikuje, pouze z indikace intrakraniální masy (odstup od i.t. a systémového MTX minimálně 2 týdny),
• profylaxe: Biseptol 2× 1 tbl 3× týdně od začátku terapie, acyklovir, zvážit ciprofloxacin v průběhu prvních dvou cyklů, flukonazol.
Poznámky k léčbě lymfoblastového lymfomu
• celkem 8 cyklů léčby à 21dní, nebo dříve pokud KO umožňuje (od 14. dne),
• CNS profylaxe: při CNS postižení jako u Burkittova lymfomu, jinak 8 dávek (střídavě MTX a AraC),
• aktinoterapie mediastina: 30 Gy (15 frakcí a 2 Gy) bez ohledu na to, zda je v mediastinu reziduum.
Udržovací terapie POMP
• Prednison 200 mg p.o. denně den 1–5, Vincristin i.v. 2 mg den 1, Methotrexát 20 mg/m2 p.o. nebo i.v. v jediné dávce 1× týdně, 6-Merkaptopurin 50 mg 3× denně, cykly à 28 dní, podání v měsících 1–5, 8–17, 20–30, s 6–MP se nesmí podávat Milurit,
• úprava dávek udržovací medikace: granulocyty kolem 1×109/l, trombocyty > 40×109/l, bilirubin < 30 μmol/l, ALT, AST < 4násobek normy,
• profylaxe: Biseptol 2×1 tbl 3× týdně od začátku terapie do skončení udržovací léčby, acyklovir, zvážit ciprofloxacin v průběhu prvních dvou cyklů.
Intenzifikace
• HyperCVAD v měsících 6 a 18
• Rituximab 375 mg/m2 i.v. dny 1 a 11 ( pokud CD20 ≥ 20%)
• Metotrexát 100 mg/m2 i.v. den 1, 1× týdně, 4× v měsících 7 a 19
• L-asparagináza 20 000 IU i.v. den 1, 1× týdně, 4× v měsících 7 a 19
27.9.4 Režimy pro CNS lymfomy
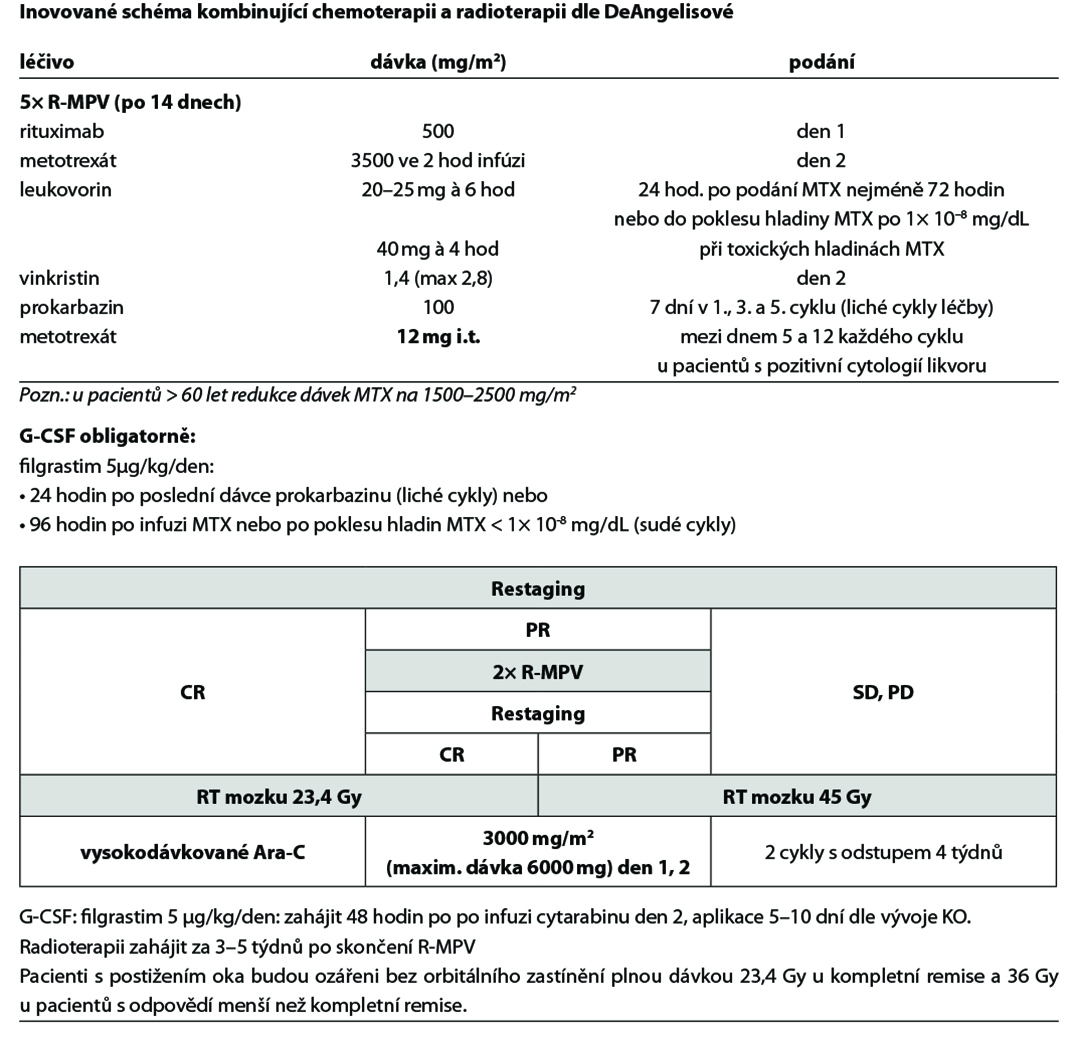
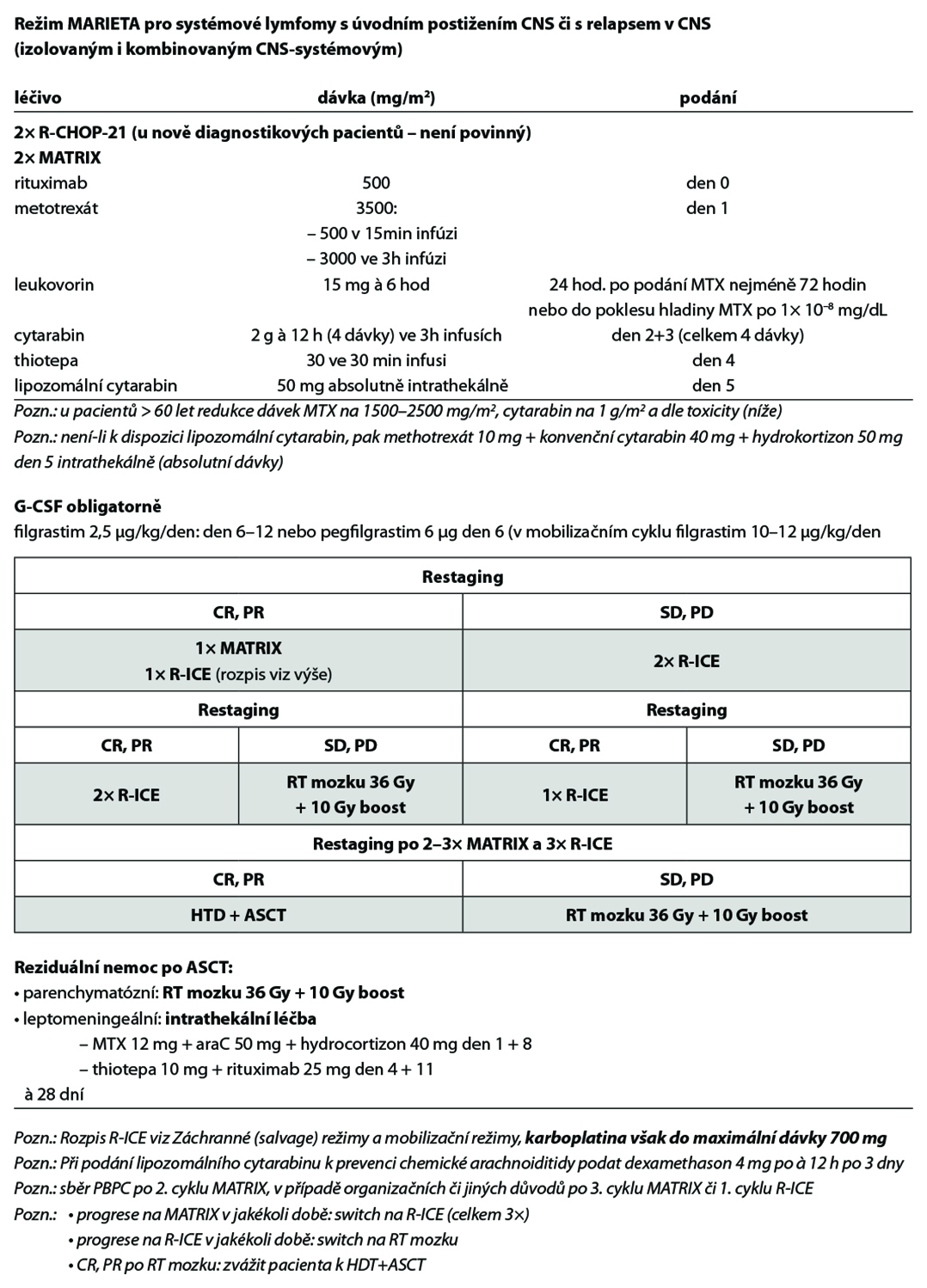

Modifikace režimu MARIETTA dle toxicity:
1. Hematologická toxicita: pouze v případě grade IV (neutrofily <500/mm3, trombocyty pod 25 000/mm3) a pouze v případě, že je tato komplikována infekcí:
• redukce dávky AraC či ifosfamidu o 25 % vůči předchozímu cyklu.
2. Jiná toxicita:
Seznam Center intenzivní hematologické péče (CIHP):
1. I. interní klinika VFN, U nemocnice 2, Praha 2
2. Interní hematologická klinika FNKV, Šrobárova 50, Praha 10
3. ÚHKT Praha, U nemocnice 1, Praha 2
4. Hematoonkologické oddělení, FN Plzeň, Alej Svobody 80, Plzeň
5. IV.interní hematologická klinika, FNHK, Sokolská 581, Hradec Králové 5
6. Interní hematoonkologická klinika, FN Brno-Bohunice, Jihlavská 20, Brno
7. Klinika hematoonkologie, Fakultní nemocnice Ostrava, 17. listopadu 1790, Ostrava Poruba
8. Hemato-onkologická klinika FN Olomouc, I. P. Pavlova 6, Olomouc
Certifikovaná centra pro podání CAR-T terapie
Interní hematologická a onkologická klinika, Fakultní nemocnice Brno,
Jihlavská 20, 625 00 Brno
Certifikace pro preparáty: axicel, tisacel, brexucel
Vedoucí lékař CAR-T programu: MUDr. František Folber
Telefon: 532 23 3573
e-mail: Folber.frantisek@fnbrno.cz
Oddělení klinické hematologie, IV. Interní hematologická klinika, Fakultní nemocnice a LF UK Hradec Králové
Sokolská 581, 500 05 Hradec Králové,
Fax: 495 832 011
Certifikace pro preparáty: axicel, tisacel, brexucel
Vedoucí lékař CAR-T programu: doc. MUDr. D. Belada Ph.D.
Telefon: 495 832 159, e-mail: david.belada@fnhk.cz
I. Interní klinika, Všeobecná fakultní nemocnice v Praze
U nemocnice 2, 128 00 Praha 2
Certifikace pro preparáty: axicel, tisacel, brexucel
Vedoucí lékař CAR-T programu: MUDr. K. Polgárová, Ph.D.
Telefon: 224 962 555, e-mail: kamila.polgarova@vfn.cz
Hemato-onkologické oddělení, Fakultní nemocnice Plzeň
Alej Svobody 80, 304 60 Plzeň,
Fax: 377 103 719, 377 104 623
Certifikace pro preparáty: tisacel
Vedoucí lékař CAR-T programu: doc. MUDr. D. Lysák
Telefon: 377 103 722, e-mail: lysak@fnplzen.cz
Ústav hematologie a krevní transfuze
U nemocnice 1, 128 20 Praha 2
Certifikace pro preparáty: axicel, tisacel, brexucel
Vedoucí lékař CAR-T programu: MUDr. Robert Pytlík
e-mail: Robert.pytlik@uhkt.cz
Klinika hematoonkologie, Fakultní nemocnice Ostrava
17. listopadu 1790, 708 52 Ostrava Poruba
fax: +420 597 374 156
Certifikace pro preparáty:tisacel
Vedoucí lékař CAR-T programu: MUDr. J. Mihályová
Telefon. 597 372 151, 597 374 567, e-mail: jana.mihalyova@fno.cz
Hematoonkologická klinika, Fakultní nemocnice Olomouc
I.P. Pavlova 6, 775 20 Olomouc
Fax: 585 428 102
Certifikace pro preparáty: tisacel
Vedoucí lékař CAR-T programu: doc. MUDr. Tomáš Szotkowski, Ph. D
Telefon: 588 442 849, e-mail: tomas.szotkowski@fnol.cz
Literatura:
1. www.hematology.cz/cervena-kniha-lecebne-postupy-v-hematologii/
2. www.hematology.cz/wp-content/uploads/2023/12/15-Maligni_lymfomy-verze-01-2023.pdf





