Rozhodnutí o terapeutickém postupu by mělo být provedeno multidisciplinárním týmem. Primární léčba je založena na lokalizaci a rozsahu nádoru, histologickém typu, komorbiditách/PS pacienta. Doporučené léčebné postupy jsou kategorie 1, není-li uvedeno jinak.
Endoskopická léčba a radikální chirurgický výkon by měly probíhat ve specializovaných (high volume) centrech. Doporučení pro endoskopickou léčbu premaligních a časných maligních lézí jícnu jsou zpracovány a dostupné na https://www.endoskopiste.cz/wp-content/uploads/2021/06/barrett-guidelines.pdf
Chirurgická léčba
Chirurgická resekční léčba má kurativní potenciál, tento se ale plně uplatňuje pouze ve velmi časných stádiích nemoci, většina pacientů relabuje, proto je chirurgie součástí multimodalitní léčby a chirurgický výkon je vždy konsultován v multidisciplinárním týmu. Chirurgická resekce (gastrektomie) může být parciální (distální, proximální, segmentální, lokální), subtotální či totální. O rozsahu resekce rozhoduje velikost nádoru, jeho lokalizace, stadium onemocnění, nádorová histopatologie, ale také celkový stav pacienta. Standardním typem resekčního výkonu je subtotální gastrektomie v případě distálního typu nádoru a totální gastrektomie u orálněji lokalizovaných karcinomů. U vybraných typů proximálních nádorů, resp. nádorů kardioezofageálního přechodu (Siewert 3 popřípadě 2) je možné zvážit proximální gastrektomii. U lokálně pokročilých nádorů žaludku a distálního jícnu je možná (výjimečně) ezofagogastrektomie. Dle posledních ESMO doporučení (ve shodě s poslední verzí Japonské asociace pro karcinom žaludku) by v případě expanzivního typu nádorového růstu (včetně intestinálních histotypů) měl být proximální okraj resekce lokalizován nejméně 3 cm od okraje nádoru, v případě infiltrativního růstu (špatně kohezivní/diffuzní typ nádoru) nejméně 5 cm. Nelze-li tyto parametry naplnit, je doporučeno vyšetření resekční linie v celé tloušťce „na zmrzlo“ (k potvrzení R0 resekce)
Nedílnou součástí operačního výkonu je lymfadenektomie, standardním výkonem je D2 lymfadenektomie (v případě T1 nádorů je možná D1+), zvláště v lokálně pokročilejších stadiích přináší benefit v délce přežívání a přesnějším stagingu nádorového onemocnění ve srovnání s D1 resekcí. Ve speciálních případech (lokální šíření nádoru) je možné zvážit extenzi lymfadenektomie v některém z D3 kompartmentů, tento postup ale není standardem. U nádorů s lokálním šířením bez známek generalizace je možná přidružená orgánová resekce (slezina, slinivka, játra), morbidita rozšířených resekcí je ovšem vyšší proti standardnímu výkonu.
V určitých (symptomatických) případech může být po indukční léčbě indikována gastrektomie současně s oligometastatickým postižením, dlouhodobý efekt je však nejistý. Rovněž nadějně se jeví efekt gastrektomie, cytoredukční chirurgie a HIPEC u limitované formy peritoneálního metastatického postižení, jednoznačné důkazy pro dlouhodobý efekt uvedených postupů zatím nejsou k dispozici.
Standardem v operativě žaludku zatím zůstává operace z laparotomického přístupu, je však možný i laparoskopický přístup, častěji při distální resekci žaludku, v rukách zkušeného laparoskopického chirurga je možná i totální gastrektomie s D2 lymfadenektomií s dlouhodobými výsledky srovnatelnými s otevřenou operací. Velmi perspektivní se jeví robotická chirurgie gastrektomie, ve východní Asii je již plně etablována, je ale frekventována již i v EU (Německo), v ČR se začíná rozvíjet. Miniinvazivní výkony je možné kombinovat s částečně otevřeným přístupem (hybridní operace).
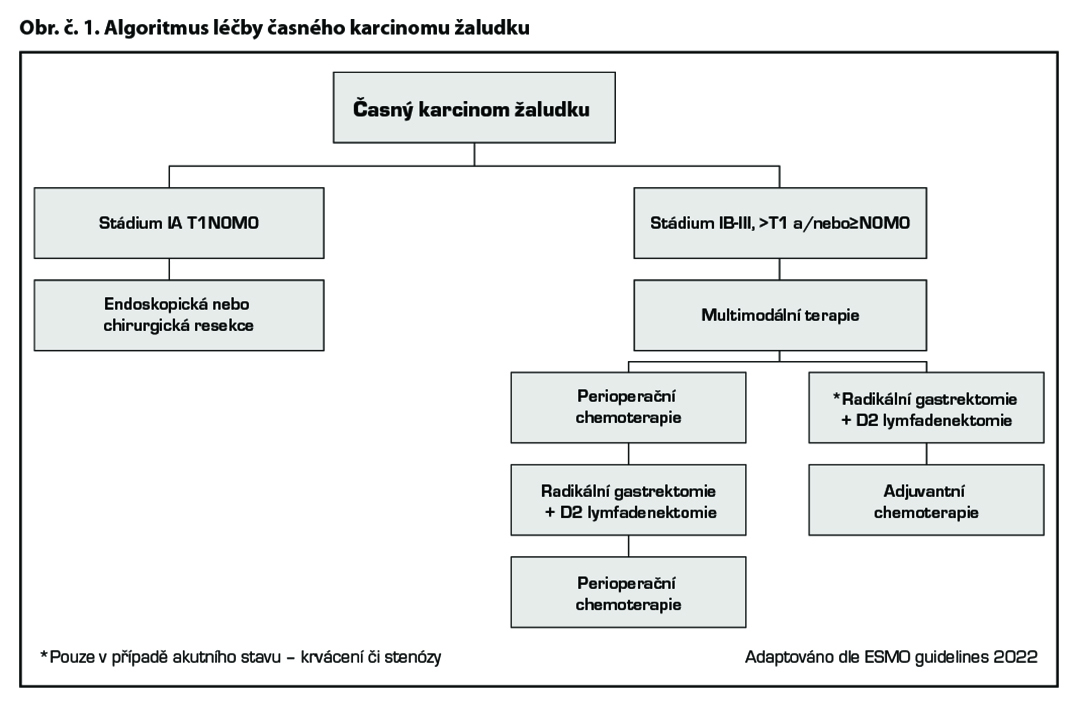
Tis, T1a
– primární léčba je endoskopická, případně chirurgická.
T1b N0, M0
– primární léčba je chirurgická.
Klinické stádium ≥IB-III (>T1, a/nebo ≥N0 M0), potenciálně resekabilní karcinom žaludku a gastroesofageální junkce
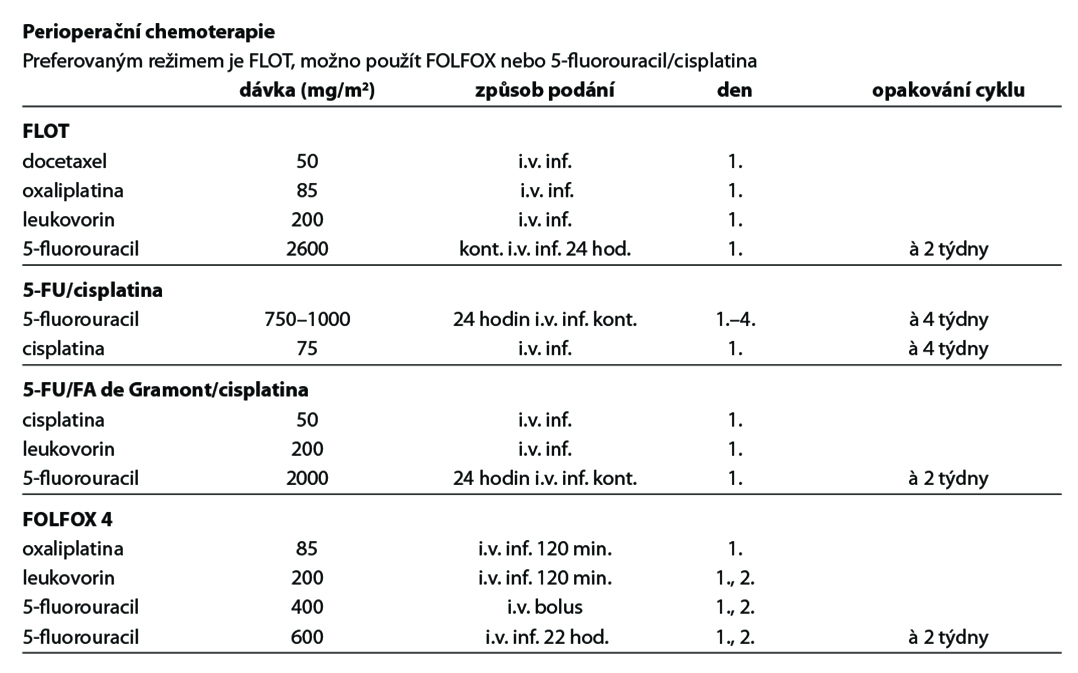
Perioperační chemoterapie
- Prodlužuje celkové přežití pacientů a je standardním léčebným postupem,
- efekt perioperační chemoterapie na bázi 5-fluorouracilu a cisplatiny/oxaliplatiny prokazují výsledky několika randomizovaných studií fáze III (studie MAGIC, EORTC 40954, ACCORD, FLOT4),
- režim FLOT zlepšil ve studii AIO celkové přežití pacientů s lokálně pokročilým onemocněním a je preferovaným standardem perioperační léčby (OS 50 vs 35 měsíců, HR 0,77, 95 % CI: 0,630,94, p = 0,12); pro starší pacienty s komorbiditami je alternativou dvojkombinace 5-fluorouracilu s oxaliplatinou,
- infuzní fluorouracil a kapecitabin jsou v použití rovnocenné stejně jako cisplatina s oxaliplatinou. S ohledem na toxicitu bolusového fluorouracilu se doporučuje jeho náhrada infuzním fluorouracilem či kapecitabinem.
- primární chirurgický výkon by měl být indikován jenom ve zvláštních případech jako je krvácející nádor a obstrukce způsobená tumorem.
chemoradioterapie po radikální operaci,
- studie f.III CRITICS srovnávala perioperační chemoterapii s předoperační chemoterapií a pooperační chemoradioterapií. Přidání pooperační radioterapie neprodloužilo celkové přežití pacientů po D1 lymfadenektomii,
- podobně po D2 lymfadenektomii nepřináší adjuvantní chemoradioterapie prodloužení celkového přežití a pacienti by měli být léčení perioperační chemoterapií – výsledky studie f. III ARTIST 1,2.
- adjuvantní chemoradioterapie není indikována u pacientů, kteří podstoupili adekvátní chirurgický výkon s R0 resekcí, avšak v případě nedostatečného chirurgického výkonu (nedostatečná lymfadenektomie či R1 resekce) je možné dle studie INT0116 zvážit adjuvantní radioterapii s využitím fluorouracilu a leukovorinu (studie Intergroup update po 10 letech, ASCO 2009 prokázala zlepšení OS (HR=1,32) a DFS (HR=1,51) (2A).
Adjuvantní chemoterapie
- asijská studie f.III CLASSIC , prokázala u klinického stádia II-IIIB – po radikální resekci včetně D2 lymfadenektomie, že adjuvantní chemoterapie (oxaliplatina + kapecitabinXELOX 8 cyklů), signifikantně prodlužuje medián OS a DFS (2A), data u evropské populace jsou limitovaná, dle metaanalýzy z roku 2010 přináší adjuvantní chemoterapie benefit v OS 6 % (HR 0,82, 95 % CI 0,76 – 0,90; P< 0,001).
Adjuvantní imunoterapie u adenokarcinomu GEJ
Ve studii CheckMate 577 prodloužila adjuvantní imunoterapie nivolumabem dobu do relapsu onemocnění pacientů (DFS) s karcinomem jícnu a GEJ, kteří byli léčeni neoadjuvantní konkomitantní chemoradioterapií s následnou operací a nedosáhli kompletní remise.
Pacienti s MSI high nádory léčeni radikální resekcí mají lepší prognózu ve srovnání s non- MSI tumory, a proto se adjuvantní chemoterapie nejeví přínosnou. Tato data byla získána z retrospektivní analýzy prospektivních randomizovaných studií fáze III.
Perioperační léčba u dMMR/MSI-H adenokarcinomů: prospektivní studie fáze II, a to francouzská NEONIPIGA (ipilimumab/ nivolumab), italská INFINITY(tremelimumab/durvalumab), dokladovaly u pacientů s lokálně pokročilým primárně operabilním dMMR/MSI-H adenokarcinomem GEJ/žaludku léčených samotnou neoadjuvantní imunoterapií dosažení patologické kompletní remise (pCR) až v 60 % případů (pT0N0). Podobně data ze studie fáze II DANTE ověřila přínos kombinace FLOT a atezolizumab. Léčba checkpoint inhibitory nabízí u této skupiny pacientů možnost orgán záchovného postupu. Všichni pacienti s lokálně pokročilým adenokarcinomem by měli být testováni na dMMR/MSI-H stav a v případě deficitu/instability konzultováni cestou multidisciplinárního týmu. Léčba checkpoint inhibitory v této indikaci však není hrazena a postup by měl být individuální.
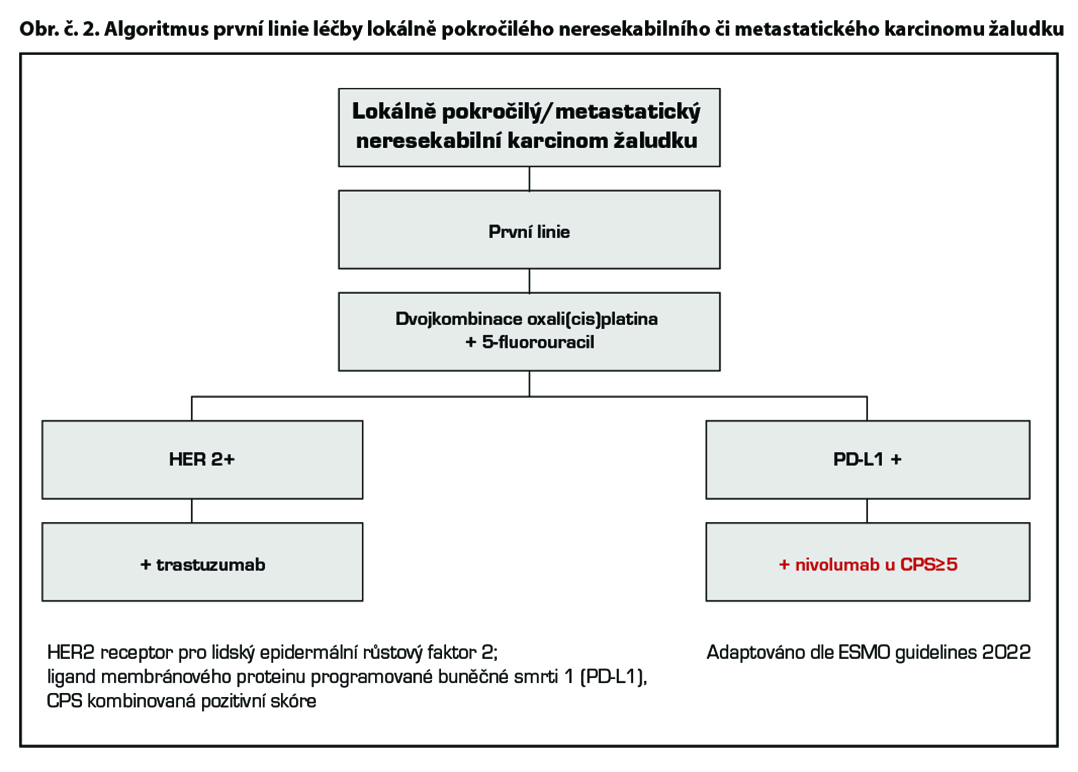
Lokálně pokročilé neresekabilní či metastatické onemocnění
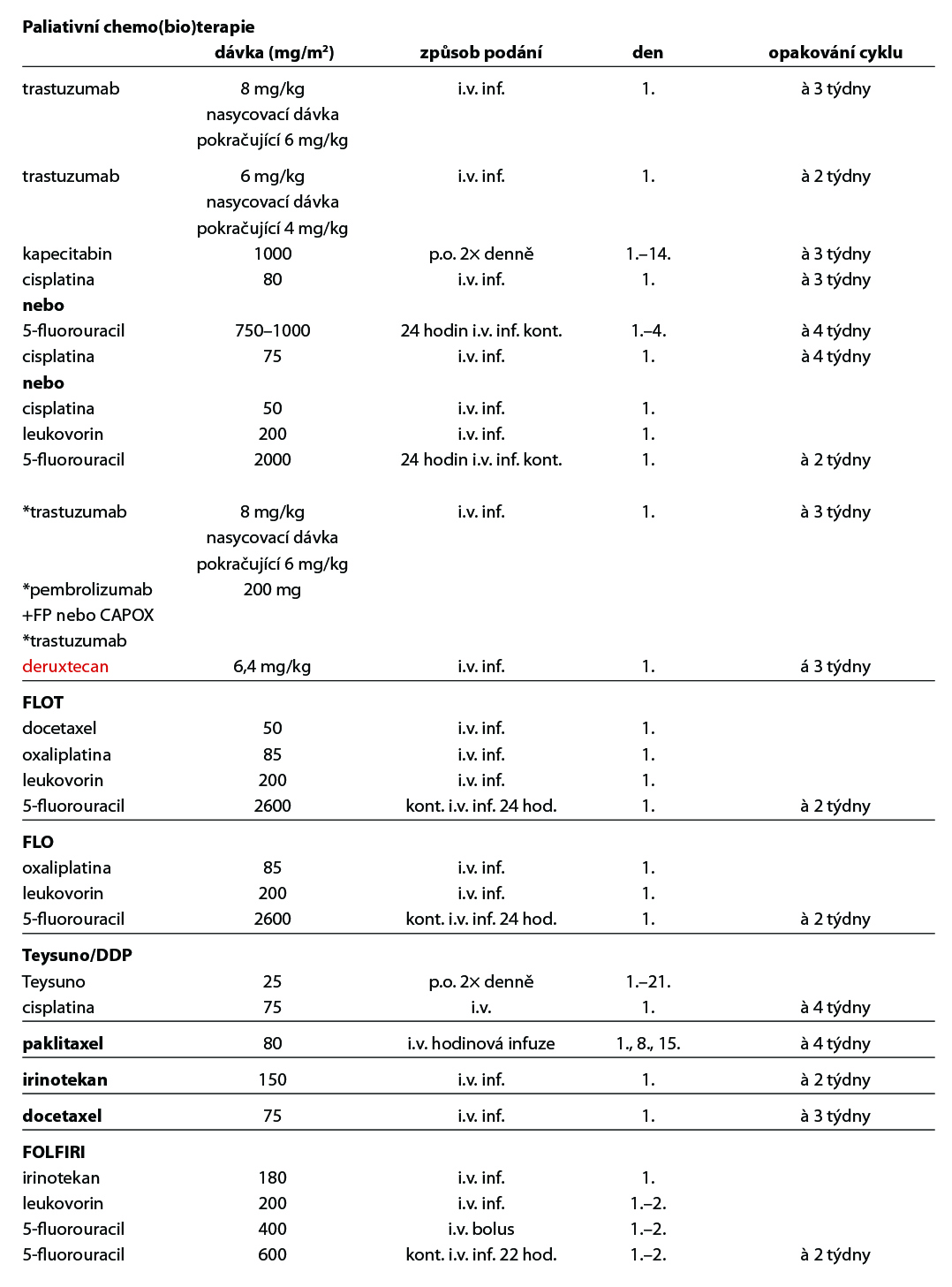
Paliativní chemoterapie
zlepšuje kvalitu života a OS ve srovnání s BSC. Single agent chemoterapie nemá vliv na přežívání. Preferovaná je dvojkombinace na bázi fluoropyrimidinu a platinového derivátu. Cisplatina i oxaliplatina stejně jako infuzní fluorouracil a kapecitabin jsou volně zaměnitelné, přičemž oxaliplatina je preferována pro lepší toleranci zvláště u starších pacientů. Z dalších cytostatik je možno použít paklitaxel, docetaxel a irinotekan. Preferuje se účast v klinické studii.
Chemoterapie 1. linie
Základním chemoterapeutickým režimem je kombinace založená na fluoropyrimidinu a platinovém derivátu, režim FOLFOX, případně režim s cisplatinou. Režim DCF je nejtoxičtějším režimem, a proto není standardně doporučován. V praxi se proto používají jeho modifikace, jednou z nich je režim FLOT (2A) Je rezervován pro pacienty ve výborném výkonnostním a nutričním stavu, kde je nutno dosáhnou rychlé kontroly onemocnění/symptomů, případně operability oligometastatického onemocnění (2A). Kapecitabin – efektivita a dobrá tolerance byla prokázána ve studiích fáze III (REAL2 a ML17032). Metaanalýza prokázala superioritu v přežívání ve srovnání s kontinuálním fluorouracilem. Ve studii REAL2 byla prokázána také srovnatelná účinnost režimů ECF, ECX, EOX, EOF. Kombinace s oxaliplatinou EOX vs ECF přináší prodloužení OS (11,2 vs 9,9 měs, HR 0,80, 95 % CI 0,660,97, p = 0,02), substituce oxaliplatinou vede ke snížení počtu trombembolických příhod. Kombinace FLO vs FLP neprokázala prodloužení OS, ale signifikantně nižší toxicitu a ve skupině pacientů nad 65 let vyšší RR, PFS a prodloužení OS. Režim s redukovanou dávkou oxaliplatiny na 60 % byl ve skupině starších a křehkých pacientů léčených pro inoperabilní lokálně pokročilý či metastatický gastroezofageální karcinom lépe tolerován se srovnatelným dosaženým efektem – výsledky studie GO2.
Teysuno (S1) je perorální složený přípravek obsahující tegafur, gimeracil a oteracil. Byl vyvinut a v praxi je již roky rutinně používán v Asii, převážně v Japonsku jak v adjuvanci, tak v paliativním podání. V Evropě jeho účinnost prokázala studie f. III FLAGS, na jejímž základě je i registrován a má úhradu k podání v I. linii paliativní chemoterapie v kombinaci s cisplatinou (2B). Pro příznivý toxický profil je vhodnou alternativou k fluorouracilu či kapecitabinu v případě kardiální, slizniční toxicity či hand and foot syndromu.
Irinotekan – efektivita a dobrá tolerance byla prokázána ve dvou studiích, recentněji ve francouzské studii fáze III (French Intergroup Study)byl režim FOLFIRI (2A) srovnáván s režimem ECF. Medián TTF byl signifikantně delší v rameni s FOLFIRI (5,1 vs 4,2 měs, p=0,008), režim FOLFIRI byl také lépe tolerován, i když medián PFS a OS byl srovnatelný. FOLFIRI je léčebnou alternativou k platinovému režimu v první linii metastatického onemocnění.
Cílená léčba 1. linie
Trastuzumab v kombinaci s kapecitabinem nebo fluorouracilem a cisplatinou (1) je indikován k léčbě pacientů s HER2- pozitivním metastazujícím adenokarcinomem žaludku nebo gastroesofageálního spojení, kteří dosud nebyli léčeni pro metastazující onemocnění. V případě kontraindikace je možno použít režim s oxaliplatinou. Všichni pacienti musí mít validní laboratorní metodou v referenční laboratoří prokázanou HER2+ a výsledek IHC2+ potvrzen pozitivním výsledkem SISH nebo FISH. Trastuzumab byl u této podskupiny pacientů zaregistrován na základě výsledků klinické studie ToGA. Trastuzumab je indikován v nasycovací dávce 8 mg/kg a pokračující 6 mg/kg v případě třítýdenního podání, a v dávce 6 mg/kg a pokračující 4 mg/kg v případě 2týdenní aplikace. V případě průkazu amplifikace a nepředléčenosti trastuzumabem v 1. linii je možné trastuzumab aplikovat i v 2. linii*.
Léčba HER2 pozitivního a PD-L1 pozitivního (CPS≥1) neresekabilního nebo metastatického adenokarcinomu GEJ a žaludku
Ve studii fáze III KEYNOTE-811 vedlo přidání *pembrolizumabu k trastuzumabu a chemoterapii k zlepšení celkové odpovědi na léčbu (ORR) na 74,4 % oproti 51,9 %; P = 0,00006 ve srovnání se samotným trastuzumabem-CHT. Kombinace pembrolizumab- trastuzumab-CHT prodloužila i mPFS na 10,8 měsíce oproti 7,2 měsíce (P = 0,0001) a OS 20,5 měsíce oproti 15,6 měsíce (P = 0,0143) u pacientů s HER2 pozitivními nádory a PD-L1 CPS ≥1. Tato kombinace je schválena FDA a EMA. U HER2 pozitivních adenokarcinomů GEJ a žaludku je po progresi po předchozí léčbě režimem založeném na trastuzumabu indikován *trastuzumab deruxtekan (T-DXd). Ve studii Destiny-Gastric01 u asijské populace bylo celkové přežití delší s trastuzumab deruxtekanem než s chemoterapií (medián 12,5 vs. 8,4 měsíce; poměr rizik pro úmrtí, 0,59; 95% CI, 0,39 až 0,88; P = 0,01). Podobně i u západní populace prokázal T-DXd klinickou účinnost a zvládnutelný bezpečnostní profil u HER2+ neresekovatelného/metastatického onemocnění po selhání na předchozí léčbě trastuzumabem a byl v této indikaci recentně schválen EMA.
*O úhradě přípravku ze zdravotního pojištění nebylo v této indikaci k 1. 3. 2024 rozhodnuto.
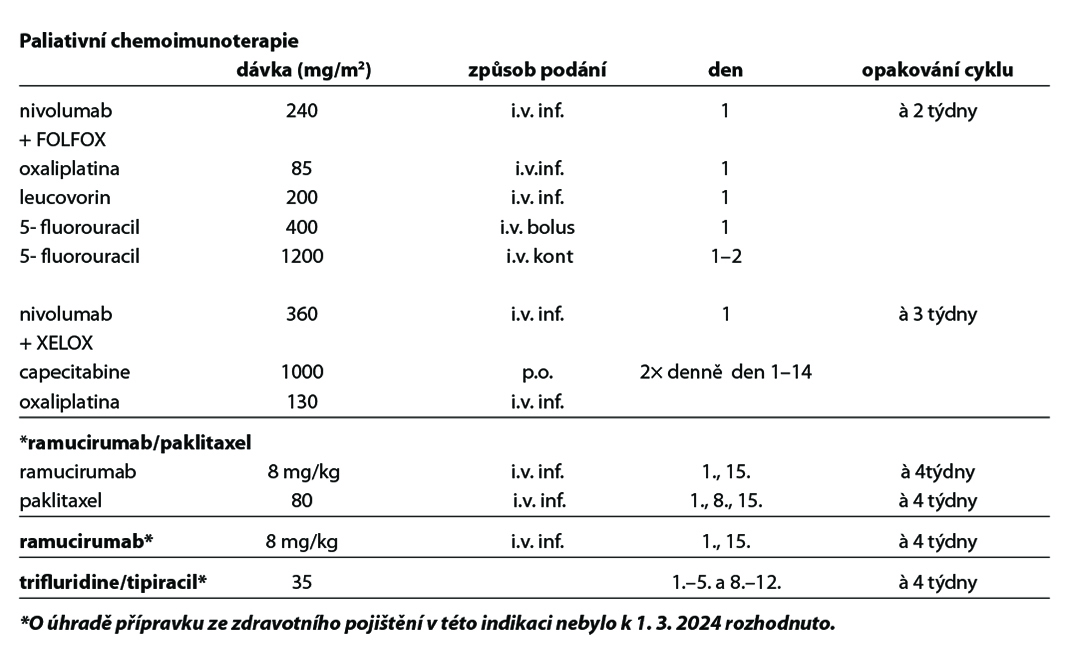
Chemoimunoterapie 1. linie
Studie CheckMate 649 hodnotila efekt kombinace nivolumab + režim s fluoropyrimidinem a oxaliplatinou u nepředléčených pacientů s neresekabilním nebo metastatickým HER 2 negativním adenokarcinomem žaludku, GEJ a jícnu. Ve studii CheckMate 649 dosáhli pacienti s PD-L1 expresí CPS ≥ 5 lepší léčebné odpovědi, PFS a celkového přežití v rameni s nivolumabem.
Kombinace fluoropyrimidinu a oxaliplatiny s nivolumabem je léčebným standardem pro pacienty s PD-L1 expresi CPS≥5 s dosaženým mediánem OS 14,4 versus 11,1 měsíce, HR 0,71 [98,4% CI 0,59–0,86]; p<0,0001. Podobně, recentně publikovaná studie fáze 3 KEYNOTE-859 prokázala statisticky významné zlepšení přežití u pacientů léčených režimem pembrolizumab* plus chemoterapie fluoropyrimidinem a platinou oproti režimu chemoterapie/placebo v první linii léčby u HER2 negativního, lokálně pokročilého, neresekovatelného nebo metastazujícího adenokarcinomu žaludku nebo gastroezofageálního spojení. V populaci PD-L1 CPS ≥1 byl medián OS 13,0 měsíce (95% CI 11,6-14,2) pro pembrolizumab-CHT oproti 11,4 měsíce (95% CI 10,5-12,0) pro placebo-CHT (HR 0,74, 95% CI 0,65-0,84; P <0,0001). V populaci PD-L1 CPS≥10 byl medián OS 15,7 měsíce (95% CI 13,8-19,3) u pembrolizumabu-ChT oproti 11,8 měsíce (95% CI 10,3-12,7) u placebo-ChT (HR 0,65, 95% CI 0,53-0,79; P <0,0001).
Pacienti s MSI-high adenokarcinomem žaludku dosáhli vyšší odpovědi, ale i dlouhodobého léčebného efektu při léčbě anti-PD-1 monoterapií.
Retrospektivní analýza randomizovaných studií fáze III (KEYNOTE-062, CheckMate-649, JAVELIN Gastric 100 and KEYNOTE- 061) zahrnující 2545 pacientů se zhodnoceným MSI stavem, z čehož 123 (4,8 %) mělo MSI-high karcinomy, publikovala HR pro celkové přežití (OS) při léčbě založené na anti-PD-1 0,34 (95% CI: 0,21-0,54) pro MSI-nádory versus 0,85 [95% confidence interval (CI): 0,71-1,00] pro mikrosatelitně stabilní nádory. Prospektivní data ze studie Keynote 158 (pembrolizumab*) a ze studie NO LIMIT (ipilimumab/nivolumab*) potvrdila účinnost a možnost dosažení dlouhodobé remise při použití imunoterapie u metastatického onemocnění a pacienti s tumory MSI high/dMMR jsou kandidáty léčby *imunoterapií.
*O úhradě přípravku ze zdravotního pojištění nebylo v této indikaci k 1. 3. 2024 rozhodnuto.
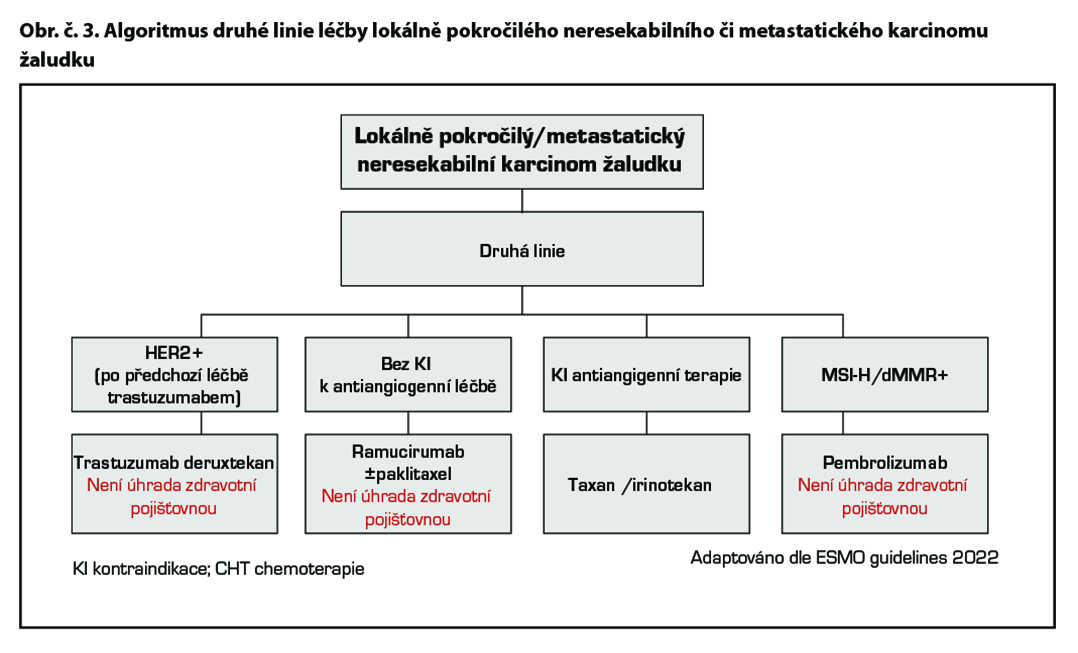
Chemoterapie 2. linie
Standardem je terapie irinotekanem, paklitaxelem či docetaxelem (1). Režim FOLFIRI je možno použít u pacientů v dobrém stavu – data jsou extrapolována z první linie.
Cílená léčba 2. linie
Ramucirumab* je lidská monoklonální protilátka proti VEGFR2 receptoru vedoucí k blokádě vazby ligandů VEGF A, VEGF B a aktivací molekulární cesty k inhibici angiogeneze. Ramucirumab* je indikován v kombinaci s paklitaxelem k léčbě dospělých pacientů s pokročilým karcinomem žaludku nebo adenokarcinomem gastroesofageální junkce s progresí choroby po předchozí chemoterapii platinou a fluoropyrimidinem. Ramucirumab* v monoterapii je indikován ve stejné indikaci u pacientů, u kterých není vhodná léčba v kombinaci s paklitaxelem. Studie fáze III REGARD prokázala hraniční efekt monoterapie versus placebo v léčbě druhé linie metastatického karcinomu žaludku a GEJ. Medián OS byl 5,2 v 3,8 (p = 0,047). Kombinace paklitaxelu s ramucirumabem prodloužila medián OS 9,6 versus 7,4M (p< 0,0001) při mediánu follow up 7,9M. (1) Na základě těchto studií je ramucirumab (CYRAMZA) od 12/2014 registrován EMA v této indikaci.
*O úhradě přípravku ze zdravotního pojištění nebylo v této indikaci k 1. 3. 2024 rozhodnuto.
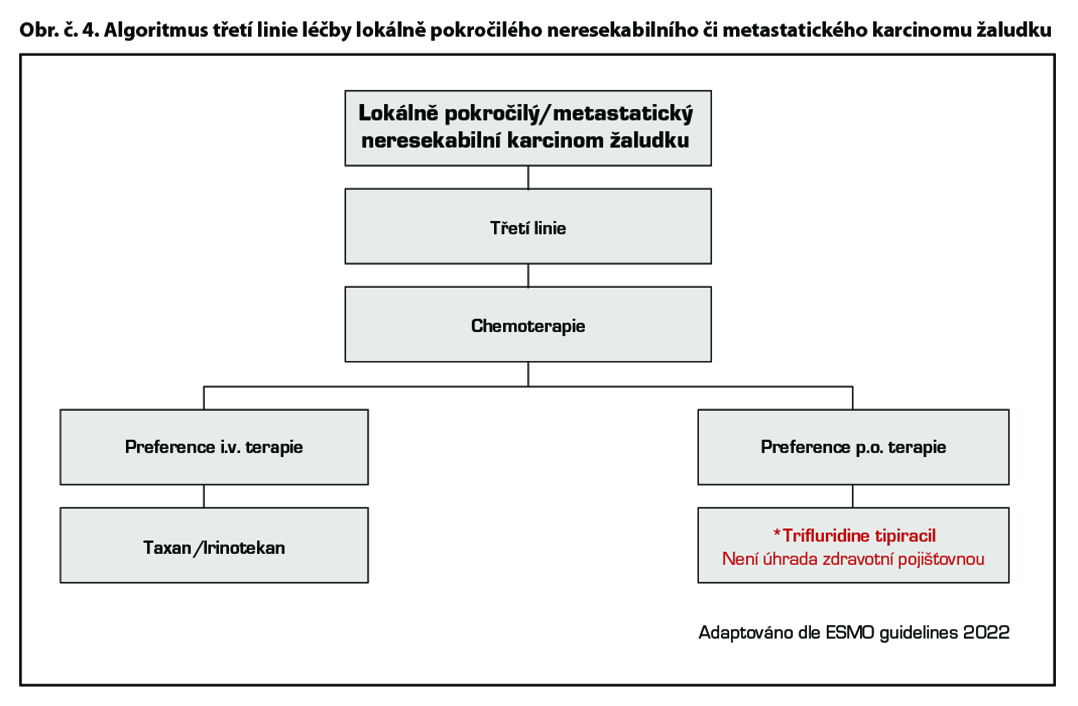
Chemoterapie 3. a vyšší linie
Trifluridine/tipiracil* je cytostatická kombinace antimetabolitu trifluridinu a inhibitoru thymidinfosforylázy tipiracilu, jehož účinnost a bezpečnost byla zhodnocena studií III. fáze (TAGS) u pacientů s metastazujícím karcinomem žaludku (včetně adenokarcinomu gastroesofageální junkce), kteří byli dříve léčeni alespoň dvěma režimy systémové terapie pro pokročilé stádium onemocnění zahrnující chemoterapii založenou na fluoropyrimidinu, platině a buď taxanu nebo irinotekanu, spolu s odpovídající terapií anti HER2. Trifluridine/tipiracil vedl ke statisticky signifikantnímu zlepšení OS (medián OS 5,7 měsíce vs 3,6 měsíce v rameni s placebem; HR 0,69 (95 % CI: 0,56, 0,85; p = 0,0003)).
Pacienti, u nichž byla diagnostikována fúze NTRK genu jsou kandidáty terapie NTRK inhibitory entrektinibem* a larotrektinibem*.
*O úhradě přípravku ze zdravotního pojištění nebylo v této indikaci k 1. 3. 2024 rozhodnuto.
Prediktivní vyšetření
U všech pacientů s adenokarcinomem GEJ a žaludku je doporučeno vyšetřit HER 2 a MSI-H/MMR-D před stanovením strategie léčby, v (neo)adjuvantním záměru před zahájením chemoterapie.
Ve IV. klinickém stadiu je doporučeno před zahájením 1. linie systémové léčby vyšetřit i PD-L expresi.
Hodnocení PD-L exprese se liší dle histologického typu a použitého checkpoint inhibitoru. U adenokarcinomu je indikací k léčbě nivolumabem CPS≥5.
V individuálních případech lze u pacientů ve IV. klinickém stadiu vyšetřit fúze NTRK (možnost terapie larotrektinibem a entrektinibem) a u pacientů v dobrém stavu při vyčerpání možností standartní léčby testování NGS a vyšetření TMB. Dále je doporučováno vyšetření DPYD k predikci toxicity chemoterapie fluoropyrimidiny.

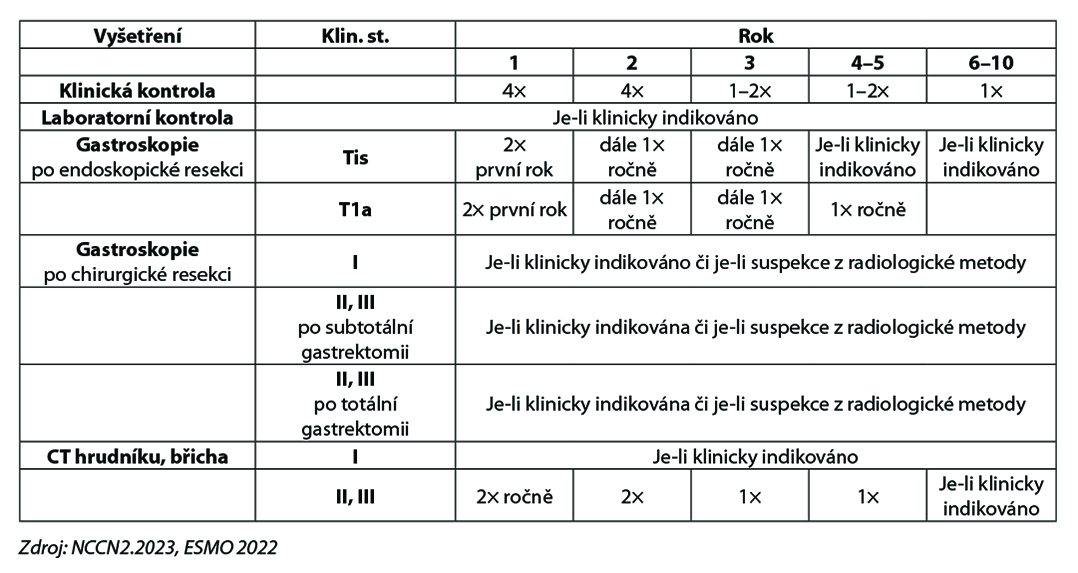
Karcinom žaludku – follow up po kurativní léčbě
Všichni pacienti by měli být sledováni systematicky, nicméně konsensus pro standardní follow- up neexistuje. Naše doporučení vychází z evropských(ESMO) a amerických(NCCN) guidelines.
PET/CT a gastroskopie po totální gastrektomii může být součástí follow-up, je-li klinické podezření na recidivu/relaps onemocnění
- u všech pacientů zvážit nutnost nutriční podpory
- po totální gastrektomii, případně i po subtotálním výkonu je indikována monitorace hladiny B12 a železa a případná substituce, je-li diagnostikována nedostatečná hladina
Literatura:
- Hall PS, et al. Optimazing therapy for frail and elderly patients(pts) with advanced gastroesophageal cancer(GOAC):The GO2 phase III trial, J Clin Oncol
2019; 37:4006 - Janjigian YY, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal
adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021 Jul 3;398(10294):27-40 - Janjigian, Yelena Y., et al. “The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer.” Nature 600.7890 (2021): 727-730
- Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer. 2021 Jan;24(1):1-21. doi: 10.1007/
s10120-020-01042-y. Epub 2020 Feb 14. PMID: 32060757; PMCID: PMC7790804. - Lordick F, et al. ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Oct;33(10):1005-1020. doi: 10.1016/j.annonc.
2022.07.004. Epub 2022 Jul 29. PMID: 35914639. - NCCN Guidelines-v.2.2023. Gastric Cancer.





