11.1 Zhoubný melanom kůže (C43)
11.1.1 Chirurgická léčba primárního melanomu
Základní léčebnou metodou je chirurgická excize podezřelé léze, která probíhá ve dvou dobách. První excize se provede s tenkým lemem 1–3 mm zdravé kůže. Rozsah druhé, již radikální excize, je při potvrzení maligního melanomu určen hloubkou invaze dle Breslowa. U melanomu in situ je doporučován celkový rozsah chirurgického bezpečnostního lemu 0,5 cm, při melanomu s Breslow do 2 mm má být provedena excize s lemem 1 cm zdravé kůže (pT1 a pT2), při melanomu s Breslow nad 2 mm se doporučuje excize s lemem 2 cm (pT3 a pT4). U akrolentiginózního melanomu prstu se po histologické verifikaci provádí amputace v sousední falanze. Samozřejmě se setkáváme s případy, kdy není rozsah výkonu kvůli lokalizaci melanomu proveditelný a vyžaduje individuální přístup.
U melanomů s Breslow < 0,8 mm s ulcerací nebo s Breslow 0,8–1,0 mm s/bez ulcerace (pT1b) by se měla zvážit v rámci druhé radikalizující operace i biopsie sentinelové lymfatické uzliny (SLNB) k vyloučení mikroskopické regionální diseminace. U melanomu s Breslow nad 1,0 mm by měla být SLNB prováděna automaticky. Výjimkou může být vyšší věk (nad 80 let), četné komorbidity, ECOG PS 2. Disekce regionální uzlinové oblasti se při mikroskopickém postižení sentinelové uzliny dnes téměř neprovádí, zvyšuje morbiditu a nemá vliv na délku celkového přežití (studie 3. fáze MSLT II a DeCOG-SLT). Individuálně ji lze zvážit u vysoce rizikových pacientů s cílem zvýšit lokální kontrolu onemocnění (např. extrakapsulární šíření, postižení více uzlin). Naopak v případě makroskopického postižení regionálních uzlin (hmatné nebo patologické uzliny na zobrazovací metodě) je uzlinová disekce stále standardním léčebným postupem. Chirurgická léčba má být dále zvážena při řešení lokoregionálních relapsů a individuálně posouzena u vzdáleného oligometastatického onemocnění. U pacientů, u nichž je radikální chirurgický výkon kontraindikován nebo není pro lokalizaci možný (např. větší plochá ložiska melanomu v obličeji), lze zvážit kurativní radioterapii. Radioterapii lze podat také adjuvantně u pacientů s vyšším
rizikem regionálního relapsu po disekci postižených uzlin (např. při extrakapsulární invazi). Tato indikace je ale vysoce individuální, zvláště v době účinné systémové léčby.
11.1.2 Adjuvantní systémová léčba
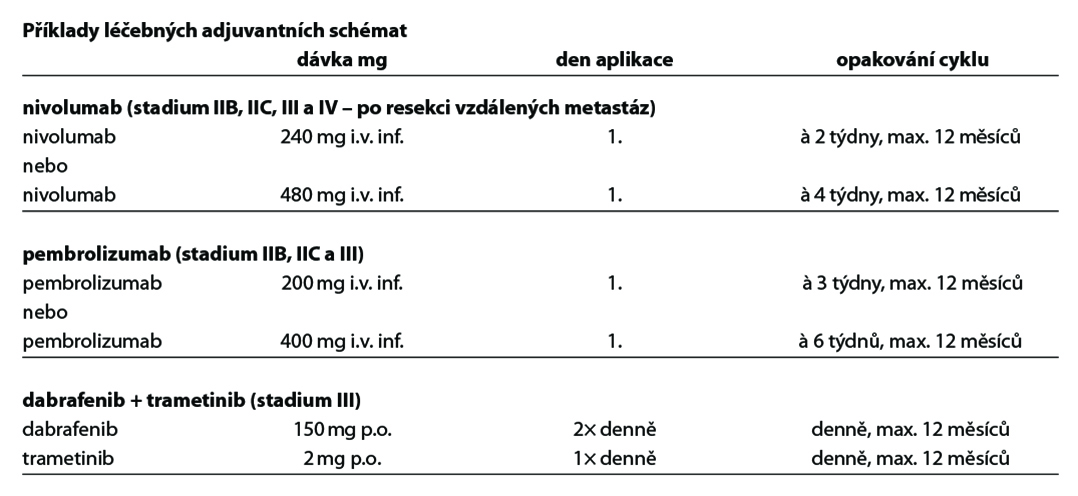
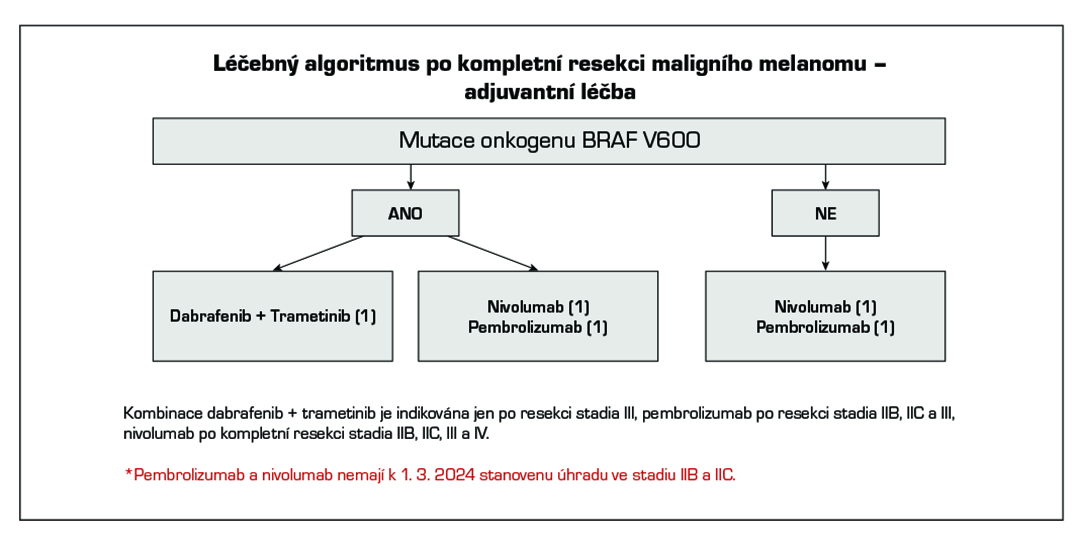
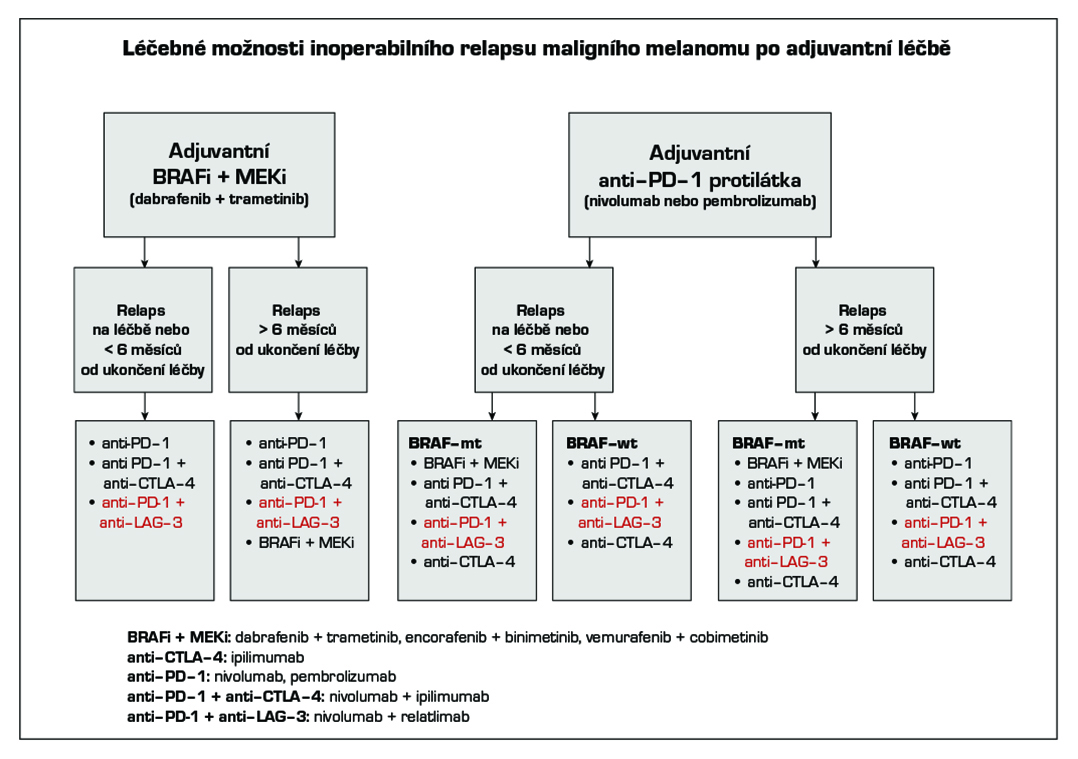
V adjuvantní léčbě maligního melanomu je standardem cílená léčba s kombinací BRAF a MEK inhibitoru a imunoterapie s checkpoint inhibitory. Z cílené léčby má aktuálně u pacientů s mutací onkogenu BRAF V600 registraci kombinace dabrafenib + trametinib (1). U moderní imunoterapie mají registraci v adjuvantní léčbě anti-PD-1 protilátky nivolumab (1) a pembrolizumab (1). Kombinace dabrafenib + trametinib je indikována k adjuvantní léčbě u pacientů po kompletní resekci u III. stadia, pembrolizumab po kompletní resekci u stadia IIB, IIC a III, nivolumab po kompletní resekci u stadia IIB, IIC, III a IV. Délka trvání adjuvantní léčby je maximálně 12 měsíců. U pacientů stadia IIIA dle AJCC-8 s velikostí mikrometastázy v sentinelové uzlině do 1 mm lze doporučit pouze dispenzarizaci. Riziko relapsu onemocnění je u této skupiny menší než u stadia IIB a IIC. Optimální léčba relapsu v případě selhání adjuvantní léčby je předmětem studií. Významnou roli při rozhodování hraje časová souvislost mezi vznikem relapsu a adjuvantní léčbou, viz algoritmus níže. V situaci, kdy není stanovena úhrada léčby z pojištění nebo pacient nebude indikován k léčbě z jiných důvodů (pravidla úhrady, medicínské důvody) je dnes nejvhodnějším postupem u nemocných po radikální operaci zařazení do klinické studie s novými léky.
11.1.3 Neoadjuvantní léčba
Neoadjuvantní cílená léčba nebo imunoterapie u melanomu není zatím indikována.
11.1.4 Systémová terapie u pokročilého maligního melanomu (inoperabilní stadium III a IV)
Standardem léčby pokročilého maligního melanomu je cílená léčba (u nemocných s mutací onkogenu BRAF V600) a moderní imunoterapie s checkpoint inhibitory. Na rozdíl od cytotoxické chemoterapie bylo v randomizovaných klinických studiích u těchto léků prokázáno prodloužení celkového přežití. Kombinace BRAF inhibitorů a MEK inhibitorů (dabrafenib + trametinib, encorafenib + binimetinib, vemurafenib + cobimetinib) je účinnější než monoterapie s BRAF inhibitory. Účinnost moderní imunoterapie je nezávislá na stavu mutace onkogenu BRAF. Protilátky proti PD-1 receptoru (nivolumab, pembrolizumab) prokázaly vyšší efektivitu a nižší toxicitu ve srovnání s ipilimumabem. Kombinace nivolumab + ipilimumab je účinnější než ipilimumab v monoterapii a podle deskriptivní analýzy má lepší výsledky než samotný nivolumab, je však zatížena vyšší toxicitou. Kombinace nivolumab + relatlimab (anti-LAG-3 protilátka) je účinnější než samotný nivolumab, s jen mírným navýšením toxicity.
Extrakutánní melanomy patří mezi vzácné diagnózy. Nicméně dostupná data a to především u slizničních melanomů ukazují lepší účinnost moderní imunoterapie s checkpoint inhibitory ve srovnání s chemoterapií. Proto by imunoterapie měla být zvažována i u těchto nádorů, podobně jako v případě metastatického kožního melanomu.
Pro dospělé pacienty s neresekovatelným melanomem s regionálními nebo vzdálenými metastázami (stadium IIIB, IIIC a IVM1a) bez postižení kostí, mozku, plic nebo jiného viscerálního postižení je v EU k intralezionální aplikaci (kožní, podkožní, uzlinové léze) registrován přípravek Imlygic (T-VEC); v ČR však zatím nemá stanovenu úhradu a není toho času dostupný.
ČOS: Stupně evidence a doporučení
Stupeň 1 Založeno na vysokém stupni důkazů, jednotné doporučení ČOS, že léčba je vhodná.
Stupeň 2A Založeno na nižším stupni důkazů, jednotné doporučení ČOS, že léčba je vhodná.
Stupeň 2B Založeno na nižším stupni důkazů, doporučení ČOS, že léčba je vhodná.
Stupeň 3 Založeno na jakémkoliv stupni důkazů, v rámci ČOS není shoda o vhodnosti léčby.
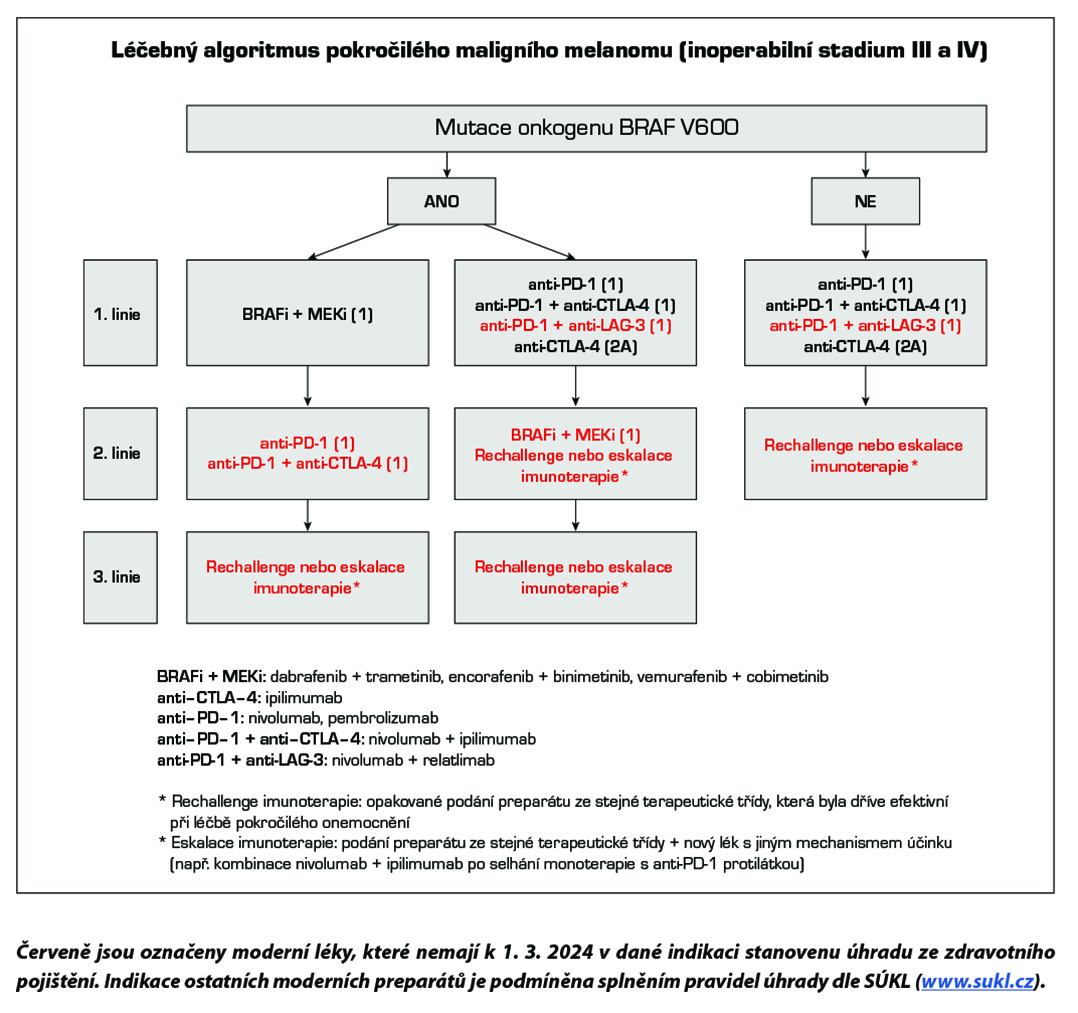
Chemoterapie je indikována jen v případech, kdy není vhodná cílená léčba nebo moderní imunoterapie s checkpoint inhibitory (medicínské důvody, indikační omezení úhrady dle SÚKL) nebo jsou jejich možnosti vyčerpány. Neexistují důkazy o účinnosti chemoterapie po selhání cílené léčby a moderní imunoterapie s checkpoint inhibitory.
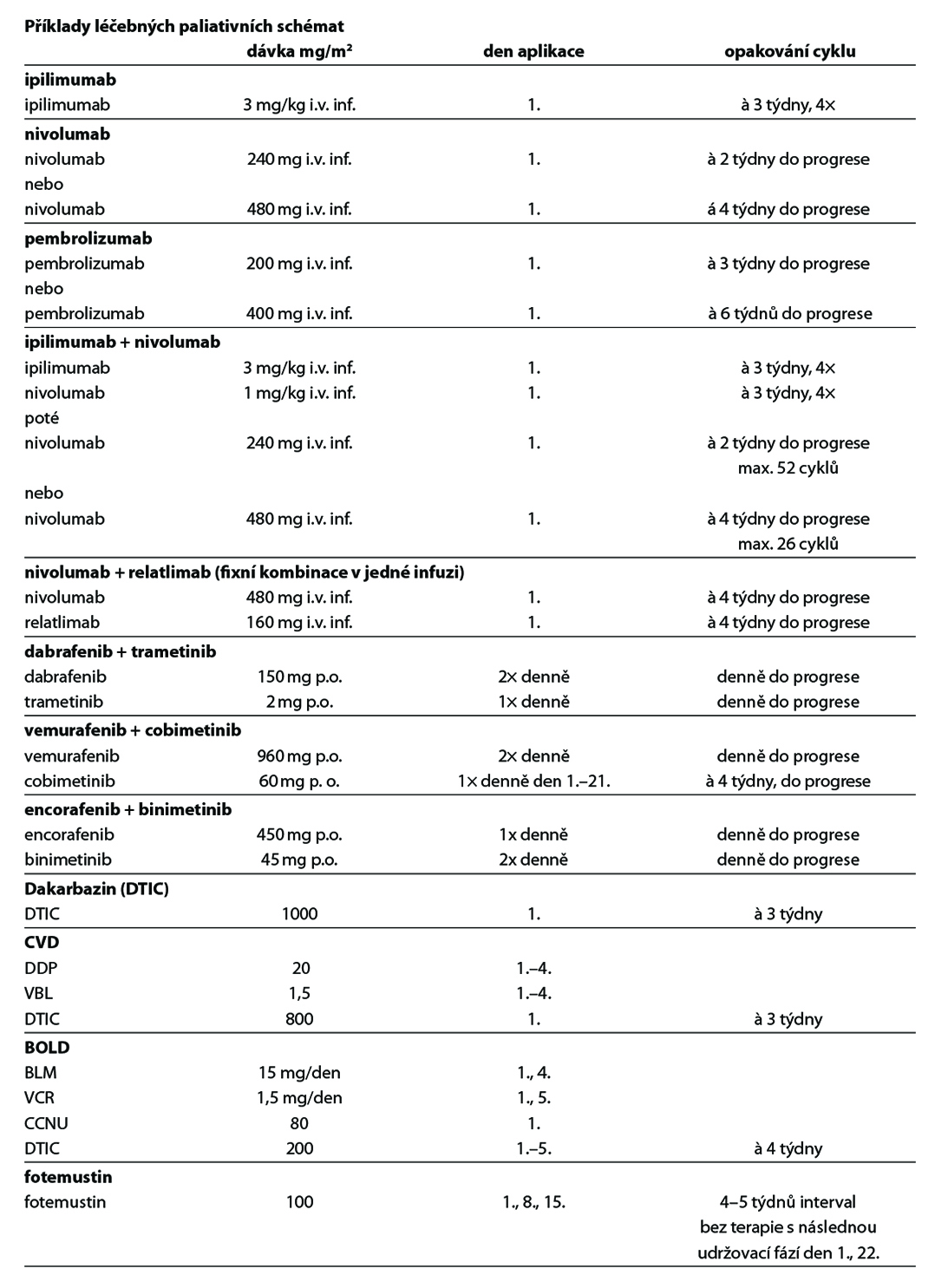
11.1.5 Dispenzarizace pacientů po léčbě (follow-up)
Dispenzarizaci provádí onkolog, dermatolog, případně praktický lékař.
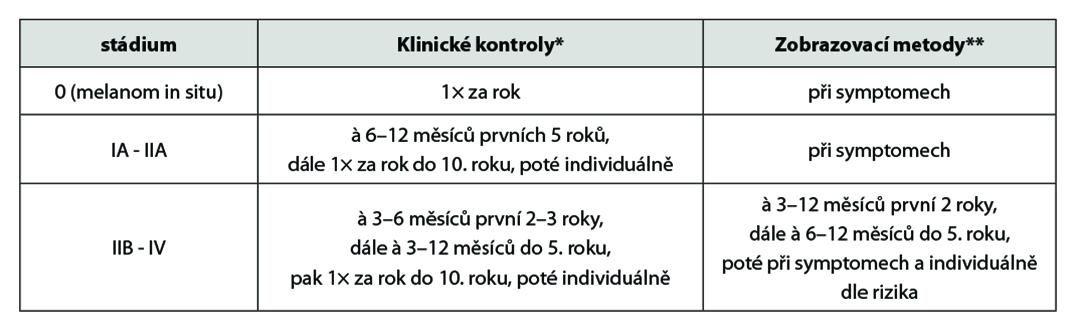
*Klinické kontroly: Intervaly mezi klinickými kontrolami nejsou pevně stanoveny. Vyšší frekvence jsou vhodné během prvních 2–3 let po operaci, kdy se vyskytuje nejvíce relapsů, zvláště u pokročilejších stádií. Kontroly provádět s ohledem na riziko relapsu (přítomnost ulcerace, mitóz, metastáz v sentinelové uzlině, satelitů, Clark IV-V u tenkých nádorů, výskyt spontánní regrese), historie melanomu v osobní anamnéze, pozitivní rodinná anamnéza, přítomnost dysplastických névů. V rámci kontrol klást hlavní důraz na vyšetření jizvy, palpace uzlin, pátrání po intransitních metastázách, vyšetření kůže. Kožní kontroly ideálně provádět ve spolupráci s dermatologem (zvýšené riziko duplicitních melanomů i nemelanomových nádorů kůže).
**Zobrazovací metody u asymptomatických pacientů: UZ vyšetření, RTG plic, CT, PET/CT, MR mozku – není shoda, vliv na celkové přežití dosud nebyl jednoznačně potvrzen. Provádět UZ kontroly spádové uzlinové oblasti u rizikových pacientů bez provedené SLNB (biopsie sentinelové uzliny), nebo u pacientů s pozitivní SLNB, kteří nepodstoupili disekci spádových uzlin (minimálně první 3 roky od operace).
Laboratorní vyšetření: nutnost pravidelného laboratorního vyšetření u asymptomatického pacienta je diskutabilní, není obecně doporučováno. Při podezření na relaps má sérový protein S100b větší míru specificity než LDH.
Doporučení: aktuálně není shoda na follow-up schématu (intervaly, zobrazovací metody), vliv na přežití není jasný. Zobrazovací vyšetření a laboratorní vyšetření jsou indikovány dle úvahy lékaře na základě klinického vyšetření. Klást důraz na pravidelné samovyšetřování – vyšetření kůže, jizvy a uzlin. U nemocných ve stádiu IV musí být přístup zcela individuální, podle konkrétního stavu pacienta.
Hlavní zdroj: NCCN Guidelines Version 1.2023 a ESMO Clinical Practice Guidelines z roku 2019
Literatura:
- Michielin O, van Akkooi ACJ, Ascierto PA, et al. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol.
2019 Dec 1;30(12):1884-1901. doi: 10.1093/annonc/ mdz411. PMID: 31566661. - Michielin O, van Akkooi A, Lorigan P, et al. ESMO consensus conference recommendations on the management of locoregional melanoma: under the auspices
of the ESMO Guidelines Committee. Ann Oncol. 2020 Nov;31(11):1449-1461. doi: 10.1016/j.annonc.2020.07.005. Epub 2020 Aug 4. PMID: 32763452. - Keilholz U, Ascierto PA, Dummer R, et al. ESMO consensus conference recommendations on the management of metastatic melanoma: under the auspices
of the ESMO Guidelines Committee. Ann Oncol. 2020 Nov;31(11):1435-1448. doi: 10.1016/j.annonc.2020.07.004. Epub 2020 Aug 4. PMID: 32763453. - NCCN Clinical Practice Guidelines in Oncology, Melanoma: Cutaneous, Version 3.2023
- Garbe C, Amaral T, Peris K, et al. European consensus-based interdisciplinary guideline for melanoma. Part 1: Diagnostics: Update 2022. Eur J Cancer. 2022
Jul;170:236-255. - Garbe C, Amaral T, Peris K, et al. European consensus-based interdisciplinary guideline for melanoma. Part 2: Treatment – Update 2022. Eur J Cancer. 2022
Jul;170:256-284.
11.2. Bazocelulární karcinom kůže (C44)
Nízce rizikové a malé nádory
Chirurgické odstranění s bezpečnostním lemem minimálně 2–3 mm.
Dále jsou možné lokální terapie: kryalizace, fotodynamická terapie, aplikace imiquimodu.
Rozsáhlé, ale ještě operabilní bazaliomy
Chirurgické odstranění s bezpečnostním lemem minimálně 5–10 mm, případně Mohsova mikrochirurgie.
Rozsáhlé inoperabilní bazaliomy
Radioterapie, brachyterapie.
Rozsáhlé inoperabilní a pro radioterapii nevhodné bazaliomy
U pacientů s lokálně pokročilým bazocelulárním karcinomem, který není vhodný k chirurgické léčbě nebo radioterapii, nebo pokud je chirurgická léčba nebo radioterapie kontraindikována a u pacientů se symptomatickým metastazujícím bazocelulárním karcinomem můžeme zvážit cílenou léčbu s přípravkem Erivedge (vismodegib). Doporučená dávka je jedna 150 mg tobolka jednou denně, léčba probíhá do progrese onemocnění nebo nepřijatelné toxicity.
U pacientů s lokálně pokročilým nebo metastazujícím bazocelulárním karcinomem (laBCC nebo mBCC), u kterých došlo k progresi nebo k intoleranci inhibitoru signální dráhy Hedgehog (HHI) je indikována imunoterapie s anti-PD-1 protilátkou – přípravek Libtayo (cemiplimab). Doporučená dávka přípravku LIBTAYO je 350 mg, podávaná každé 3 týdny formou intravenózní infuze po dobu 30 minut. Léčba může pokračovat až do progrese onemocnění nebo do výskytu nepřijatelné toxicity.
Dispenzarizace u pacientů po léčbě (follow-up)
U pacientů po primární léčbě lokalizovaného onemocnění: klinické kontroly à 6–12 měsíců prvních 5 let, dále 1× ročně.
Zobrazovací metody při nejasném nálezu a symptomech.
U pacientů v aktivní léčbě pro pokročilé onemocnění: klinické a zobrazovací metody individuálně.
Literatura
- Peris K, Fargnoli MC, Kaufmann R, et al. European consensus-based interdisciplinary guideline for diagnosis and treatment of basal cell carcinoma-update
2023. Eur J Cancer. 2023 Oct;192:113254. doi: 10.1016/j.ejca.2023.113254. - NCCN Clinical Practice Guidelines in Oncology, Basal Cell Skin Cancer, Version 2.2024.
11.3 Karcinom z Merkelových buněk (C44)
Primární nádor
Chirurgické odstranění s lemem 10–20 mm, možné zvážit vyšetření sentinelové uzliny, v případě její pozitivity je indikována exenterace příslušné lymfatické oblasti.
Ke zvážení adjuvantní radioterapie oblasti primárního nádoru, případně i regionální lymfatické oblasti při uzlinovém postižení.
Metastazující karcinom z Merkelových buněk
Pro léčbu dospělých pacientů s metastatickým karcinomem z Merkelových buněk je indikován v monoterapii přípravek Bavencio (avelumab). Doporučená dávka přípravku Bavencio v monoterapii je 800 mg podávaných intravenózně v průběhu 60 minut každé 2 týdny. Léčba je hrazena do progrese onemocnění, verifikované opakovaným radiologickým vyšetřením v odstupu 4–8 týdnů z důvodu odlišného mechanismu účinku imuno-onkologické terapie a/nebo neakceptovatelné toxicity.
Dispenzarizace u pacientů po léčbě (follow-up)
U pacientů po primární léčbě lokalizovaného onemocnění: klinické kontroly á 3–6 měsíců první 3 roky, poté à 6–12 měsíců po 2 roky, dále 1× ročně. Zobrazovací metody jako u melanomu.
U pacientů v aktivní léčbě pro pokročilé onemocnění: klinické a zobrazovací metody individuálně.
Literatura
- Gauci ML, Aristei C, Becker JC, et al. Diagnosis and treatment of Merkel cell carcinoma: European consensus-based interdisciplinary guideline - Update 2022.
Eur J Cancer. 2022 Aug;171:203-231. doi: 10.1016/j.ejca.2022.03.043. - NCCN Clinical Practice Guidelines in Oncology, Merkel Cell Carcinoma, Version 1.2024.
11.4 Spinocelulární karcinom kůže (C44)
Nízce rizikové a malé squamózní ca (menší než 20 mm s hloubkou menší než 6 mm)
Chirurgické odstranění s bezpečnostním lemem minimálně 4–6 mm.
Lokální terapie pouze u prekanceróz typu aktinické keratozy či Morbus Bowen: kryalizace, fotodynamická terapie, aplikace imiquimodu, aplikace 5-fluorouracilu.
Prognosticky nepříznivé nebo rozsáhlé, ale ještě operabilní squamózní ca (nádory větší než 20 mm, hloubka větší než 6 mm, perineurální šíření, dediferenciace, recidivující nádory, lokalizace na uších, spáncích a rtech)
Chirurgické odstranění s bezpečnostním lemem minimálně 6–10 mm, případně Mohsova mikrochirurgie.
Vyšetření sentinelové uzliny – jednoznačný přínos ale dosud nebyl prokázán.
Rozsáhlé inoperabilní squamózní ca
Radioterapie, brachyterapie.
Lokálně pokročilé inoperabilní a pro radioterapii nevhodné nebo metastazující squamózní karcinomy
U dospělých pacientů s metastazujícím nebo lokálně pokročilým spinocelulárním karcinomem kůže, kteří nejsou vhodní ke kurativní operaci či kurativnímu ozařování je indikován v monoterapii přípravek LIBTAYO (cemiplimab). Doporučená dávka přípravku LIBTAYO je 350 mg, podávaná každé 3 týdny formou intravenózní infuze po dobu 30 minut. Léčba může
pokračovat až do progrese onemocnění nebo do výskytu nepřijatelné toxicity.
Dispenzarizace u pacientů po léčbě (follow-up)
U pacientů po primární léčbě lokalizovaného onemocnění: klinické kontroly á 3–6 měsíců první 2 roky, poté à 6–12 měsíců po 3 roky, dále 1× ročně. Zobrazovací metody při nejasném nálezu a symptomech.
U pacientů v aktivní léčbě pro pokročilé onemocnění: klinické a zobrazovací metody individuálně.
Literatura
- Stratigos AJ, Garbe C, Dessinioti C,et al. European consensus-based interdisciplinary guideline for invasive cutaneous squamous cell carcinoma. Part 1:
Diagnostics and prevention-Update 2023. Eur J Cancer. 2023 Nov;193:113251. doi: 10.1016/j.ejca.2023.113251. - Stratigos AJ, Garbe C, Dessinioti C,et al. European consensus-based interdisciplinary guideline for invasive cutaneous squamous cell carcinoma: Part 2.
Treatment-Update 2023. Eur J Cancer. 2023 Nov;193:113252. doi: 10.1016/j.ejca.2023.113252. - NCCN Clinical Practice Guidelines in Oncology, Squamous Cell Skin Cancer, Version 1.2024.
Červeně jsou označeny moderní léky, které nemají k 1. 3. 2024 v dané indikaci stanovenu úhradu ze zdravotního
pojištění. Indikace ostatních moderních preparátů je podmíněna splněním pravidel úhrady dle SÚKL (www.sukl.cz).





