- 24.1 Chirurgická léčba
Základním léčebným přístupem u většiny mozkových nádorů je neurochirurgický zákrok. Cílem je provést maximální bezpečnou resekci bez poškození funkčně důležitých oblastí mozku a získání nádorové tkáně pro histologické a molekulárně genetické vyšetření. Rozsah resekce a velikost reziduálního nádorového objemu je považován za významný prognostický faktor, který ovlivňuje celkové přežití u gliomů všech typů a stupňů. Spíše než procentuální rozsah resekce je důležitý absolutní objem nádorového rezidua. Rozsah resekce by měl být posouzen během 24–48 hodin po operaci pomocí MR. Inoperabilní mozkový nádor je nutno alespoň histologicky verifikovat, minimálně stereotaktickou biopsií. K dosažení co největší radikality výkonu může být využito intraoperačních zobrazovacích metod jako UZ, intraoperační MR, operace po aplikaci kyseliny 5-aminolevulinové (5-ALA), nebo jejich kombinace. Pokud chirurgický výkon nemá kurativní potenciál a musí následovat brzká pooperační léčba (např. u gliomů), nemělo by při snaze o maximální resekci dojít k významnému poškození neurologických funkcí, zvýšení rizika dalších komplikací, snížení kvality života. Prevence nových trvalých neurologických deficitů je tak důležitější než rozsah resekce. Pooperační stav může zásadně ovlivnit další léčebné možnosti,
a tím i celkový osud pacienta. K minimalizaci rizika neurologického deficitu po operaci slouží předoperační plánování (funkční MR a traktografie), intraoperační zobrazení tumoru a intraoperační elektrofyziologické mapování elokventních oblastí. Pokud je nutno při operaci monitorovat řeč, tak se výkon provádí v bdělém stavu (tzv. awake kraniotomie).
Role neurochirurga je důležitá také při řešení recidiv primárních mozkových nádorů. Indikace reoperace je vždy posuzována individuálně z pohledu možného benefitu a rizika, ideálně cestou multidisciplinárních komisí.
Následující část bude věnována především gliomům, nejčastějším primárním nádorům CNS v dospělém věku.
24.2 Low-grade gliomy (oligodendrogliom G2, astrocytom G2, low-grade gliomy pediatrického typu)
24.2.1 Adjuvantní léčba
Pro indikaci pooperační léčby je vhodné kromě radikality výkonu zhodnocení dalších rizikových faktorů ( věk > 40 let, KPS < 70 %, nádor > 6 cm, přechod přes střední čáru a neurologický deficit před operací). Přítomnost 3 a více faktorů řadí pacienta do skupiny vysokého rizika (high-risk).
U pacientů po makroskopicky totální resekci tumoru, případně mladých (< 40 let) s drobným pooperačním reziduem, kteří jsou asymptomatiční nebo mají pouze záchvaty a pacientů s WHO G1 difúzním gliomem pediatrického typu (polymorfní low-grade neuroepiteliální tumor mladých, angiocentrický gliom, difúzní astrocytom, MYB-, MYBL-alterovaný a difúzní low-grade gliom s alterací MAPK kaskády) lze doporučit pouze sledování (watch and wait strategie).
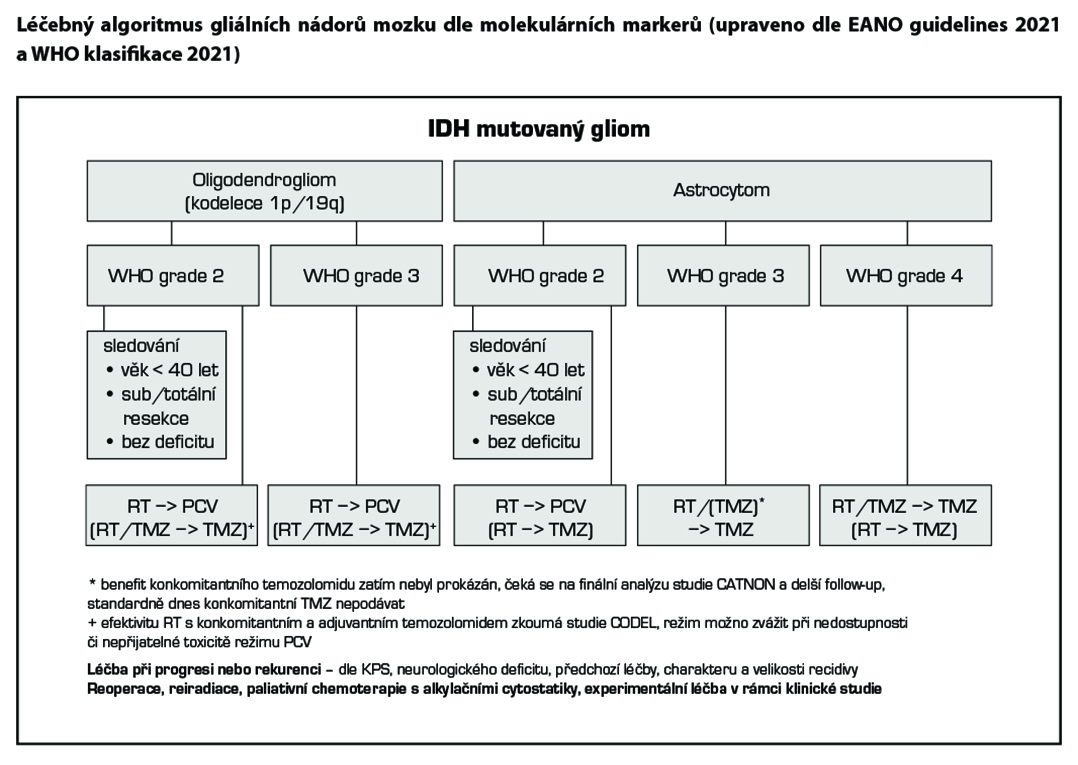
U rizikových dospělých pacientů, méně vhodných pro sledování (po neradikální resekci s neurologickým deficitem vzniklým před operací a/nebo věk > 40 let), je na základě výsledků studie 3. fáze RTOG 9802 doporučena pooperační radioterapie s následnou chemoterapií (6x PCV). Pokud není možno nebo není vhodné podat režim PCV (vysoké riziko toxicity, nedostupnost cytostatik), lze jako alternativu použít temozolomid. U high-risk low-grade oligodendrogliomů, včetně těch s průkazem homozygotní delece CDKN2A/B, je zatím obecně akceptován režim s konkomitantní chemoradioterapií a adjuvantní chemoterapií s temozolomidem dle Stuppa, i když klinická studie srovnávající Stuppův režim s radioterapií a následným podáním 6 cyklů PCV ještě běží (studie CODEL). Kontroverzní může být načasování léčby. U high-risk pacientů nevhodných nebo odmítajících chemoterapii volíme jen radioterapii. Samotná chemoterapie (temozolomid) je možnou variantou pro situace, kdy radioterapie není vhodná (např. objemný nádor, odmítnutí pacientem). Její výsledky jsou ale z pohledu dlouhodobé kontroly onemocnění pravděpodobně horší než u radioterapie.
Se zavedením nové verze WHO klasifikace z roku 2021 dochází k významným změnám. Molekulárně genetické faktory se staly znaky definujícími onemocnění, tedy diagnostickými, a proto již nejsou faktory prognostickými v rámci daného onemocnění. Na základě průkazu molekulárních biomarkerů se přesouvají některé sporné jednotky morfologicky vyhlížejících adultních low-grade gliomů mezi high-grade gliomy a měly by takto být léčeny. Výsledky molekulárně-genetické analýzy jsou tak nadřazeny nad morfologickým obrazem.
- Pokud je u adultních IDH mutovaných astrocytomů (s absencí nekróz a mikrovaskulárních proliferátů) prokázána homozygotní delece CDKN2A/B, pak se jedná o high-grade gliom. Přítomnost homozygotní delece CDKN2A/B je molekulární marker pro astrocytom WHO grade 4 IDH-mutovaný.
- Pokud není u adultního difúzního gliomu prokázána mutace genu IDH (imunohistochemicky a genovým sekvenováním) a je přítomen další molekulární marker jako mutace genu TERT, amplifikace genu EGFR a/nebo kombinovaná chromozomální aberace – trisomie 7. a monosomie 10. chromozomu, pak se jedná o glioblastom.
Pooperační možnosti léčby low-grade gliomů (LGG)
- sledování (low-risk skupina) (2A)*,
- adjuvantní radioterapie + chemoterapie (6× PCV) (1),
- konkomitantní chemoradioterapie + adjuvantní chemoterapie s temozolomidem (2A) u high-risk oligodendrogliomů
(studie CODEL) - adjuvantní radioterapie + chemoterapie (temozolomid) (2A),
- adjuvantní radioterapie (2A),
- adjuvantní chemoterapie (temozolomid) (2B).
*Sledování jen u pacienta po sub/totální resekci, < 40 let, neurologicky stabilního nebo asymptomatického a u pacientů s WHO G1 difúzním gliomem pediatrického typu. Difúzní gliomy pediatrického typu jsou všechny IDH-wildtype a dělí se na low-grade a high-grade gliomy. Low-grade difúzní gliomy pediatrického typu mají lepší prognózu než IDH-mutované gliomy adultní.
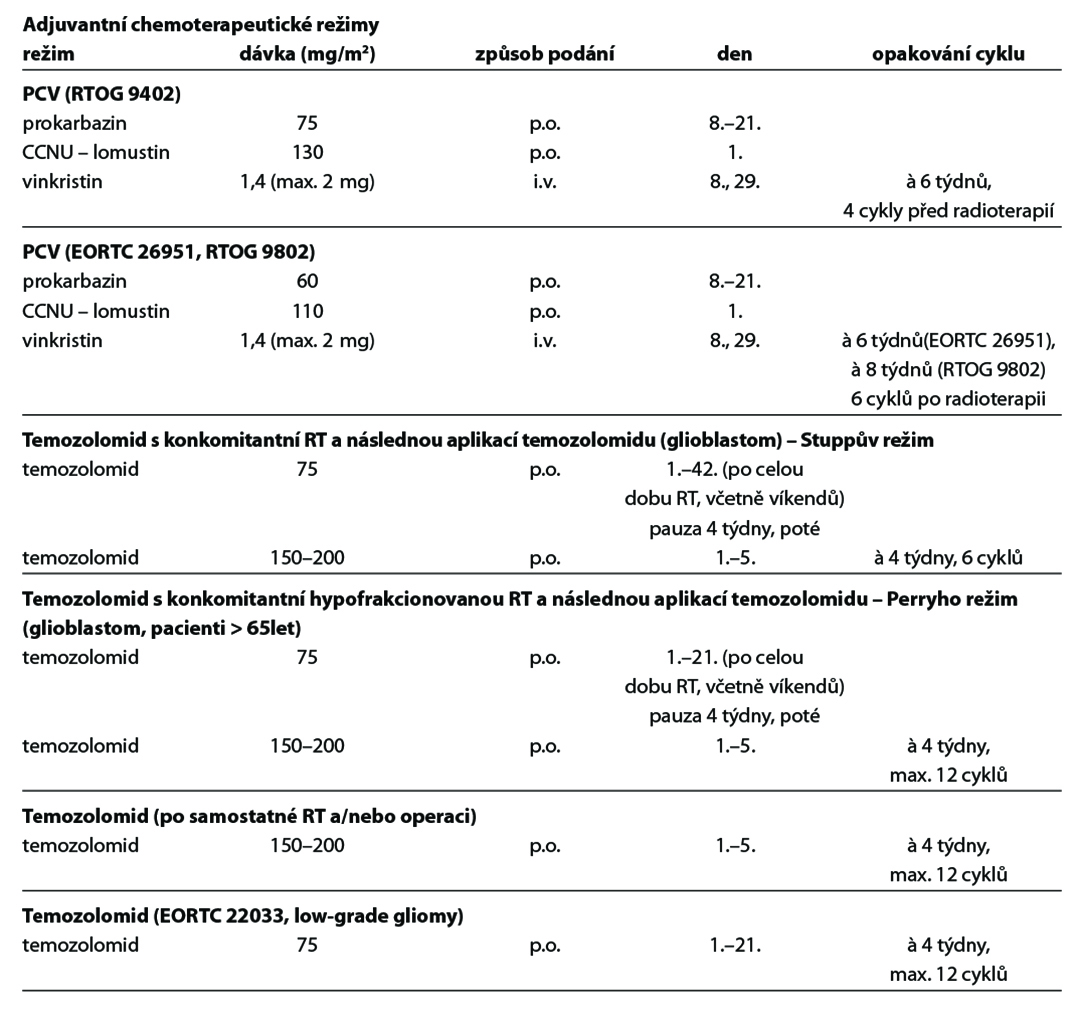
Režimy pro adjuvantní chemoterapii
• PCV (prokarbazin, CCNU, vinkristin),
• temozolomid v monoterapii.
Pozn.: Indikace adjuvantní radioterapie je specifikována v Národních radiologických standardech – radiační onkologie, Věstník MZ ČR, částka 2, 26. 1. 2016 (www.srobf.cz).
24.2.2 Léčba recidivy/progrese
Vyčerpat možnosti chirurgie a radioterapie.
Paliativní chemoterapii zvažovat u symptomatických onemocnění nebo při známkách progrese v high-grade gliom.
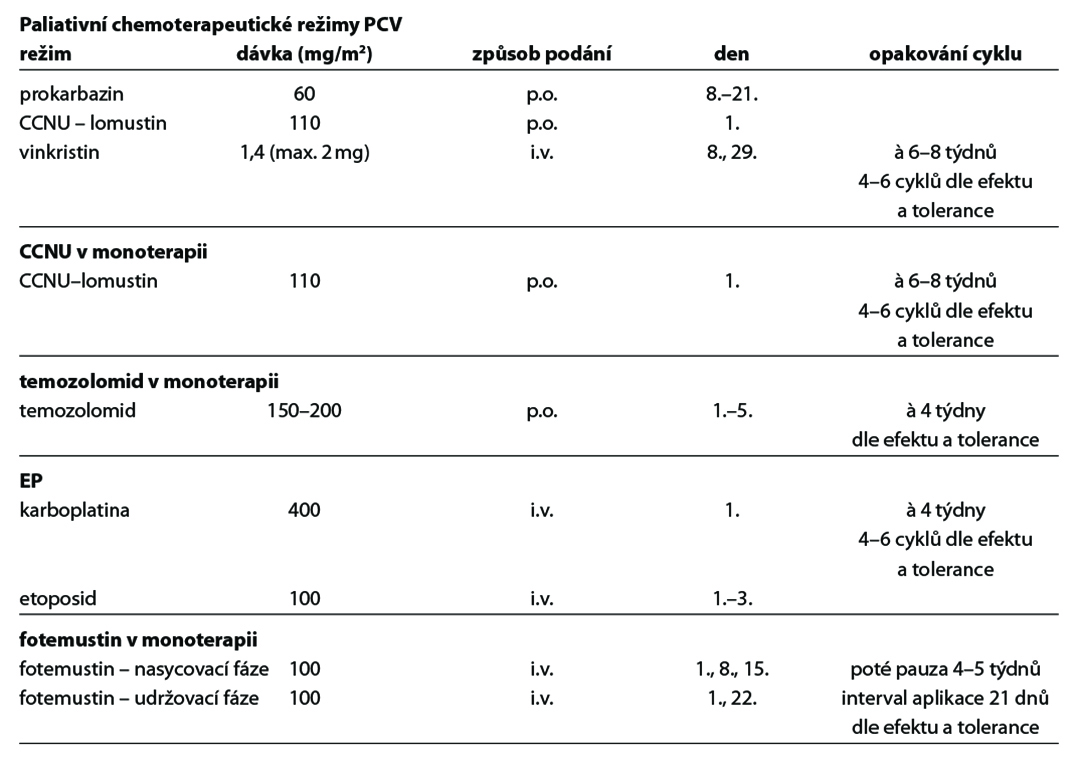
Režimy pro paliativní chemoterapii
• PCV (prokarbazin, CCNU, vinkristin), nebo nitrosourea v monoterapii,
• temozolomid v monoterapii,
• ostatní režimy paliativní chemoterapie (viz níže).
24.3 High-grade gliomy (oligodendrogliom G3, astrocytom G3 a G4, glioblastom)
24.3.1 Adjuvantní léčba
24.3.1.1 Oligodendrogliom IDH mutovaný s kodelecí 1p/19q, WHO G3
• radioterapie + (neo)adjuvantní chemoterapie s PCV (1),
• konkomitantní chemoradioterapie a adjuvantní chemoterapie s temozolomidem (2A),
• radioterapie (KI < 60 %) (2A).
Režim PCV (prokarbazin, CCNU, vinkristin) – možno zvážit 4× před nebo 6× po radioterapii u oligodendrogliomů G3. Dle randomizovaných klinických studií RTOG 9402 a EORTC 26951 byl u této skupiny pacientů potvrzen signifikantní vliv (neo)adjuvantní chemoterapie na prodloužení celkového přežití ve srovnání se samotnou radioterapií. Zda je lepší konkomitantní chemoradioterapie a adjuvantní chemoterapie s temozolomidem vs. radioterapie následovaná režimem PCV řeší studie CODEL. Režim s adjuvantním temozolomidem (s/bez konkomitantního podání s radioterapií) je dnes akceptovanou variantou pro pacienty nevhodné pro režim PCV nebo při jeho nedostupnosti. Samotná radioterapie je vhodná jen u pacientů neschopných následné chemoterapie (KI < 60 %).
24.3.1.2 Astrocytom IDH mutovaný, WHO G3/4 (non-kodelece 1p/19q)
• radioterapie + adjuvantní temozolomid (12×) (1)*,
• konkomitantní chemoradioterapie a adjuvantní chemoterapie s temozolomidem (2A)**,
• radioterapie (KI < 60 %) (2A),
• chemoterapie temozolomid při metylaci MGMT (KI < 60 %) (2B).
* Dle dosavadních výsledků studie 3. fáze CATNON bylo potvrzeno prodloužení celkového přežití v rameni s adjuvantní chemoterapií (12 cyklů TMZ) po provedené radioterapii. Pozitivní efekt adjuvantní chemoterapie byl prokázán jen u IDH mutovaných astrocytomů G3. Vliv konkomitantní chemoterapie s temozolomidem v průběhu radioterapie na celkové přežití zatím nebyl potvrzen, čeká se na analýzu po delším follow-up.
**Indikaci Stuppova režimu zvážit u astrocytomu G4 (dříve označovaný jako sekundární glioblastom).
24.3.1.3 Glioblastom IDH wildtype, WHO G4
• konkomitantní chemoradioterapie a adjuvantní chemoterapie s temozolomidem (Stuppův režim) (1),
• konkomitantní chemoradioterapie a adjuvantní chemoterapie s temozolomidem (Stuppův režim) + TTF* (1),
• hypofrakcionovaná radioterapie s konkomitantním a adjuvantním temozolomidem u pacientů > 65 let (Perryho režim) (1), indikace při předpokladu obtížného zvládání dlouhého šestitýdenního Stuppova režimu
• hypofrakcionovaná radioterapie (preference u pacientů > 70 let bez průkazu metylace MGMT nebo u pacientů s KI < 60 %) (2A),
• chemoterapie s temozolomidem při metylaci MGMT (možnost u pacientů > 70 let) nebo pacientů s KI < 60 %) (2A).
Stav metylace promotoru MGMT by měl být stanoven u všech glioblastomů jako prognostický a prediktivní faktor, pacienti starší (> 70 let) nebo křehčí by pak měli být léčeni temozolomidem na základě stavu metylace.
* Léčbu s TTF (Tumor Treating Fields - systém Optune) v kombinaci s adjuvantní chemoterapií s temozolomidem lze zvážit u dospělých pacientů s nově diagnostikovaným supratentoriálním glioblastomem, kteří jsou po provedené konkomitantní chemoradioterapii bez známek progrese nebo recidivy nádoru. Léčba s TTF probíhá do progrese onemocnění. O úhradě léčby s TTF
ze zdravotního pojištění nebylo k 1. 3. 2024 rozhodnuto.
Pozn.: Indikace adjuvantní radioterapie je specifikována v Národních radiologických standardech - radiační onkologie, Věstník
MZ ČR, částka 2, 26. 1. 2016 (www.srobf.cz).
24.3.1.4 High-grade gliomy pediatrického typu (Difúzní středočarový gliom, H3 K27M-alterovaný, Difúzní hemisférický gliom, H3 G34-mutovaný, Difúzní high-grade gliom pediatrického typu, H3-wildtype, IDH-wildtype, Hemisferický gliom infantilního typu)
Léčebný postup u výše uvedených jednotek odpovídá léčbě glioblastomu. Vždy je vhodná konzultace s dětskými onkology.
24.3.2 Léčba recidivy/progrese
Vyčerpat možnosti chirurgie a radioterapie. Individuálně po resekci recidivy glioblastomu, v závislosti na předchozím ozáření, opětovně zvážit pooperační konkomitantní chemoradioterapii následovanou samotnou chemoterapií (3).
24.3.2.1 U pacientů s progresí po předchozí chirurgické a radiační terapii
• preference režimů temozolomid monoterapie, lomustin monoterapie, PCV.
24.3.2.2 U pacientů s progresí po 1. linii chemoterapie, v celkově dobrém stavu
• 2. linie chemoterapie – volba odlišného režimu od režimů podaných v adjuvanci nebo 1. linii paliativní chemoterapie:
• temozolomid v monoterapii,
• PCV,
• lomustin (CCNU) v monoterapii,
• režim PEI (pro 3. a další linii),
• režim EP (pro 3. a další linii),
• fotemustin v monoterapii – indikovat u pacientů ve velmi dobrém stavu.
* Léčebná strategie nádorů CNS, zvláště pooperační léčba a léčba recidiv má být určena multidisciplinárním týmem. Standardem by dnes mělo být vyšetřování molekulárních markerů – kodelece 1p/19q, mutace IDH, mutace ATRX, metylace promotoru genu pro MGMT, nově též homozygotní delece CDKN2A/B, která je molekulárním markerem pro astrocytom WHO grade 4
IDH-mutovaný a pojí se tedy s horší prognózou. U středočarových WHO G4 gliomů vyšetřovat expresi H3 K27me3 a v případě průkazné ztráty exprese H3 K27me3 je nutné došetření genetických alterací definující difúzní středočarový gliom H3 K27-alterovaný (mutace H3-K27M, mutace nebo amplifikace EGFR anebo zvýšená exprese EZHIP). U intrakraniálního supratentoriálního ependymomu (G2/3) vyšetřovat RELA fúzní gen (prognostický faktor). Mutaci genu BRAF V600 vyšetřovat u pilocytického astrocytomu, pleomorfního xantoastrocytomu, gangliogliomu (prediktivní marker pro léčbu BRAF a MEK inhibitory). Individuálně zvažovat vyšetření NTRK fúze (prediktivní marker pro NTRK inhibitory).

24.4 Ependymomy
Možno zvážit paliativní chemoterapii na basi derivátů nitrosourey, temozolomidu, platiny a etoposidu u pacientů s vyčerpanými možnostmi chirurgie a radioterapie. Adjuvantní chemoterapie není standardně indikována.
24.5 Embryonální tumory (meduloblastomy)
U skupiny s běžným rizikem rekurence (reziduální nádor <1,5 cm2, bez metastáz v páteřním kanálu na MR, cytologicky negativní mozkomíšní mok, absence vzdálené diseminace) je indikována pooperační radioterapie kraniospinální osy (standardní nebo volitelně i redukovaná dávka) nebo konkomitantní chemoradioterapie kraniospinální osy s následnou chemoterapií.
U skupiny s vysokým rizikem rekurence (neresekabilní nebo reziduální nádor >1,5 cm2 nebo metastázy v páteřním kanálu na MR nebo cytologicky pozitivní mozkomíšní mok nebo vzdálená diseminace nebo velkobuněčný meduloblastom nebo supratentoriální embryonální tumor nebo při nalezení mutace TP53) je indikována pooperační konkomitantní chemoradioterapie
kraniospinální osy (standardní dávka ozáření) s následnou chemoterapií.
V případě recidivy zvažovat resekční výkon s následnou radioterapií a/nebo chemoterapií nebo high-dose chemoterapií s autologní transplantací PBSC.
Vzhledem k dětskému typu primárního nádoru mozku je vždy vhodná konzultace s dětskými onkology.

24.6 Dispenzarizace pacientů po léčbě (follow-up)
Dispenzarizaci provádí radiační a klinický onkolog, neurochirurg, případně praktický lékař. Klinické kontroly probíhají ve spolupráci s neurologem (EEG vyš., antiepileptická léčba).
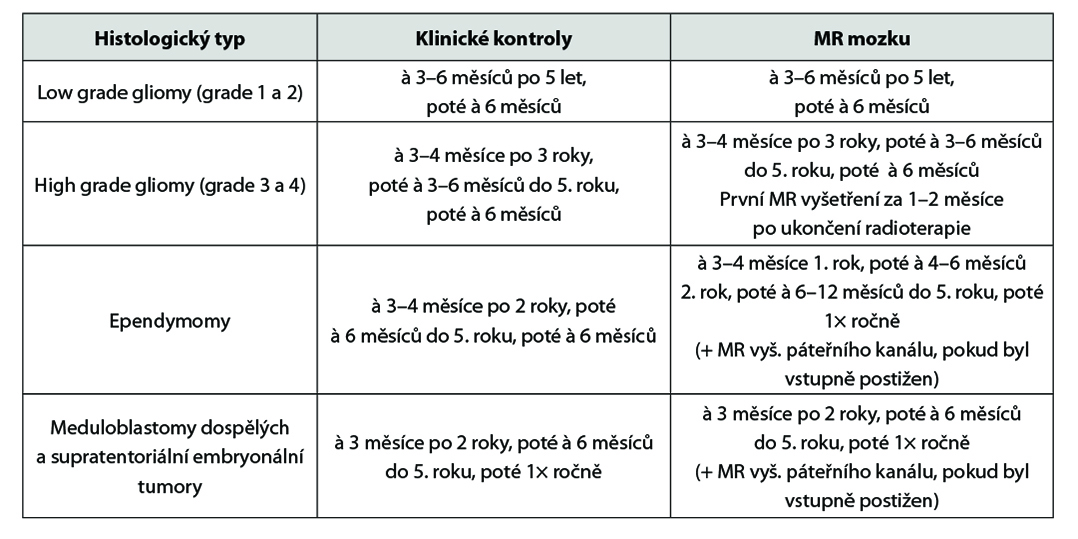
Laboratorní vyšetření:
• standardně jen při chemoterapii, při kortikoterapii glykémie a kalémie
• při antiepileptické terapii dle indikace hladina antiepileptik v séru, dále KO+dif., jaterní testy.
Zdroj: NCCN guidelines v 1.2023, EANO guidelines 2021.
Změna je plně v kompetenci ošetřujícího lékaře!!!
Literatura:
- Weller M, van den Bent M, Preusser M. et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol. 2021
Mar;18(3):170-186. - Capper D, Reifenberger G, French PJ, et al. EANO guideline on rational molecular testing of gliomas, glioneuronal, and neuronal tumors in adults for targeted
therapy selection. Neuro Oncol. 2023 May 4;25(5):813-826. doi: 10.1093/neuonc/noad008. - NCCN Clinical Practice Guidelines in Oncology, Central Nervous System Cancers, Version 1.2023.
- Šlampa P, a kol. Radiační onkologie. Maxdorf Jessenius, Praha, 2022, 772 s.





