Diagnostika a léčba sarkomů měkkých tkání by měla být prováděna pouze na pracovištích, pro která tato dg. není raritní, a to na základě rozhodnutí zkušeného multioborového týmu (MDT). Vhodné je zařazení pacientů k léčbě v rámci probíhajících mezinárodních klinických studií či jiných mezinárodních projektů.
Volba léčebné strategie závisí na lokalizaci a rozsahu primárního nádoru, operabilitě, histologickém subtypu, přítomnosti regionálních nebo vzdálených metastáz, celkovém stavu pacienta, přítomnosti komorbidit, věku a preferencích pacienta. Chirurgická léčba (R0) je jedinou metodou s kurativním potenciálem. Může být doplněná neoadjuvantní nebo adjuvantní radioterapií dle platných standardů pro radiační onkologii. Radioterapie je rovněž součástí léčby paliativní. Systémová léčba nenahradí R0 resekci.
Systémová léčba lokalizovaného onemocnění
– neoadjuvantní chemoterapie není standardním léčebným postupem, v indikovaných případech na základě rozhodnutí MDT možná/vhodná (+- RT)
a) se záměrem provedení končetinu šetřícího výkonu či dosažení „pohodlné“ R0 resekce,
b) a/nebo u HG sarkomů končetin/trupu nad 5 cm s předpokládanou chemosenzitivou a s predikovaným desetiletým OS pod 60 % dle prognostických nomogramů dostupných on line, např. SARCULATOR.
– adjuvantní chemoterapie není standardním léčebným postupem, pro HG sarkomy končetinové/trupu větší než 5 cm s předpokládanou chemosenzitivitou a s predikovaným desetiletým OS pod 60 % dle prognostických nomogramů vhodná, doporučována je v tom případě kombinace nejúčinnějších cytostatik.
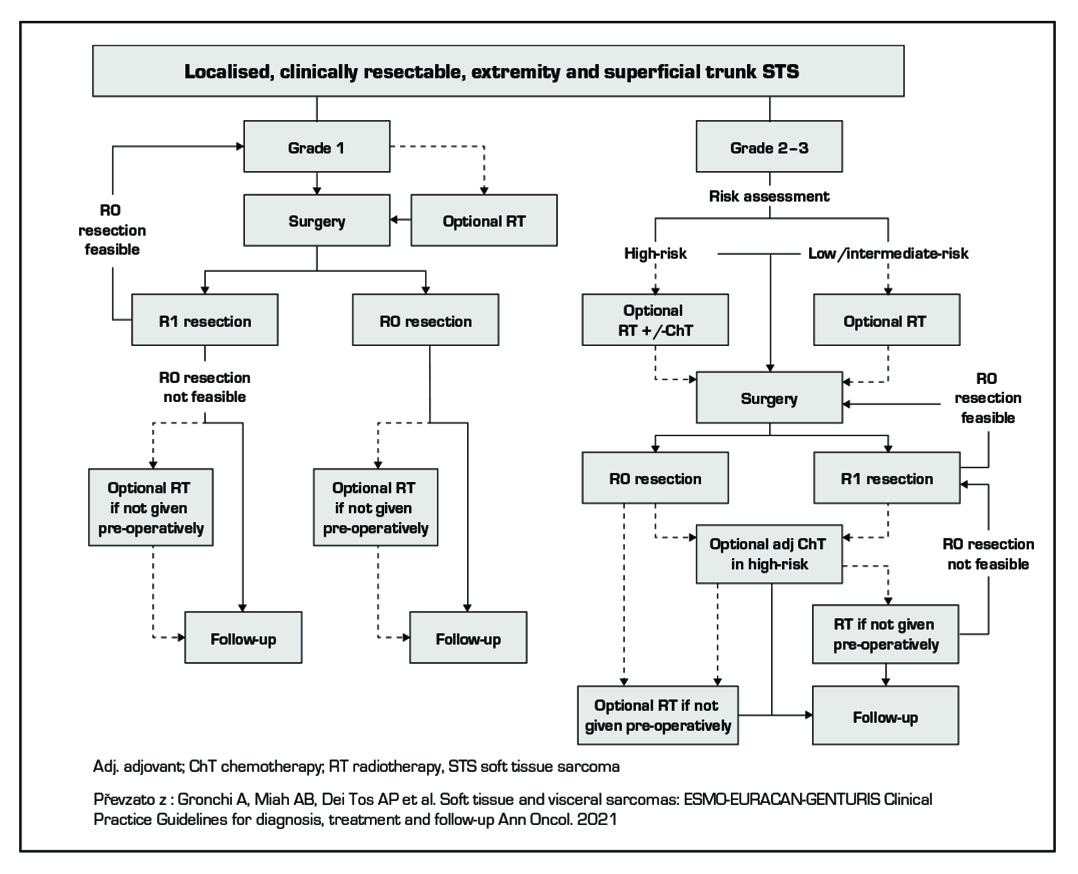
Léčba rekurentní/metastatické nemoci:
– paliativní systémová léčba možná, lze použít i sekvenční monoterapii
– lékem první volby je stále antracyklin, v dalších liniích se má léčba řídit histologií.
Některé zvl. podjednotky:
– izolovaná hypertermická končetinová perfuze kombinací TNF-α + melfalanu (ILP): lze zvažovat u lokálně pokročilého končetinového sarkomu inoperabilního a/nebo operabilního za cenu mutilujícího výkonu (či lokální recidiva po předchozí multimodální léčbě operabilní za cenu mutilujícího výkonu ev. inoperabilní) na základě rozhodnutí MDT samostatně nebo v kombinaci s předoperační chemoterapií, event. radioterapií,
– relabující/metastatický dermatofibrosarkom protuberans s translokací t (17, 22), imatinib 400 mg/den kontinuálně do progrese onemocnění,
– agresivní fibromatóza (desmoid) – iniciálně vyčkávací taktika, systémová léčba možná při progresi a/nebo LR: tamoxifen, vinblastin/methotrexát, TKI (imatinib, pazopanib, sorafenib), antracyklin, dakarbazin, NSA,
– možná tumor agnostická léčba např. u lokálně pokročilých nebo metastatických sarkomů s průkazem NTRK, ROS, ALK či RET translokace (ke dni vydání MK není v ČR úhrada léků pro tuto dg.),
– rhabdomyosarkom alveolární/embryonální – viz protokoly pro léčbu dětí a adolescentů (FaR-RMS, v.12/2021). Pleiomorfní RMS u dospělých se léčí jako ostatní HG STS,
– kulatobuněčné sarkomy (Ewing/Ewing like sarkomy) viz kapitola č. 10,
– léčba extrémně raritních subtypů (jako ASPT, SFT, IMT, PEComů, TGCT…) je nad rámec této kapitoly


ILP: mimotělní oběh, izolovaný kompartment postižené končetiny, po dosažení cílové teploty tkání
TNF-α (Beromun), 2 mg při perfuzi dolní končetiny, 1 mg při perfuzi horní končetiny, poté 60 min. perfuze melfalanem.
v dávce 10 mg/litr objemu dolní končetiny, resp. 13 mg/litr objemu horní končetiny (monitoring scintilační kamerou).
Červeně jsou označeny léky, které nemají k 1. 3. 2024 stanovenu úhradu ze zdravotního pojištění pro léčbu sarkomů. Indikace ostatních moderních preparátů je podmíněna splněním pravidel úhrady dle SÚKL (www.sukl.cz), (pouze pojištěncům ZP 111 je gemcitabin/docetaxel/paklitaxel hrazen dle Dohody s ČOS).
Sledování po léčbě: je doporučeno individualizovat v závislosti na míře rizika relapsu v korelaci s histologickým subtypem a charakterem proběhlé léčby (klinické vyšetření, zobrazovací metoda primárního tumoru a plic u LG sarkomů a 4–6 měsíců do 5 let, u HG sarkomů a 3–4 měsíce do 3 let, poté 2× ročně, po 6 letech ročně, další vyšetření při klinické indikaci). Lze využít nomogramů, např. PERSARC.
Literatura:
- NCCN Clinical Practise Guidlines in Oncology, STS, V 3/2023, www.nccn.org.
- Gronchi A, Miah AB, Dei Tos AP et al. Soft tissue and visceral sarcomas: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and
follow-up Ann Oncol. 2021 Jul 21;S0923-7534(21)02184-0. doi: 10.1016/j.annonc.2021.07.006. - Pasquali S, Colombo Ch, Bottelli S et al. The sarculator stratified prognosis of patients with high-risk soft tissue sarcomas (STS) of extremities and trunk wall
treated with perioperative chemotherapy in a randomised controlled trial (RCT). J Clin Oncol. 2017 35:15_suppl, 11016-11016. - Pasquali S, Pizzamiglio S, Touati N, ef at. The impact of chemotherapy on survival of patients with extremity and trunk wall soft tissue sarcoma: revisiting
results of the EORTC-STBSG 62931 randomised trial. Eur J Cancer 2019, 109, 51-60. - Pautier P, Italiano A, Piperno-Neumann S et al. Doxorubicin alone versus doxorubicin with trabectedin followed by trabectedin alone as first-line therapy for
metastatic or unresectable leiomyosarcoma (LMS-04): a randomised, multicentre, open-lable phase 3 trial. Lancet 2022, 23, 8, 1044-1054….update ESMO
Madrid 2023 (1930) - Kasper B et al: Desmoid Tumor Working Group. The management of desmoid tumours: A joint global consensus-based guideline approach for adult and
paediatric patients. Eur J Cancer. 2020;127:96-107. - Kasper B, Ratan R, Alcindor T et al. LBA2 DeFi: A phase 3, randomized controlled trial of nirogacestat versus placebo for progressing desmoid tumors (DT).
Sarcoma 2022; 33, 7: 1435-1436. - Demetri GD, Antonescu C, Bjerkehagen B, et al. Diagnosis and management of tropomyosin receptor kinase (TRK) fusion sarcomas: expert recommendations
from the World Sarcoma Network. Ann Oncol 2020;31:1506- 1517 - Bonvalot S, Gronchi A, Le Péchoux C, et al. Preoperative radiotherapy plus surgery versus surgery alone for patients with primary retroperitoneal sarcoma
(EORTC-62092: STRASS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2020;21:1366-1377. - Swallow C, Straus DC, Bonvalot S et al.: Management of Primary Retroperitoneal Sarcoma (RPS) in the Adult: An Update Consensus Aproach from the
Trans-atlantic Australasian RPS Working Group. Ann Surg Oncol 2021, nov 28 (12): 7873-7888. - S. Bonvalot, C. Roland, C. Raut, et al. Histology-tailored multidisciplinary management of primary retroperitoneal sarcomas, Eur J Surg Oncol,2023,6,
1061-1067. - Stacchiotti S, Dürr HR, Schaefer IM et al. Best clinical management of tenosynovial giant cell tumour (TGCT): A consensus paper from the community of
experts. Cancer Treat Rev. 2023 Jan;112:102491. doi: 10.1016/j.ctrv.2022.102491. - Rothermundt C, Andreou D, Blay JY etl al.Controversies in the management of patients with soft tissue sarcoma: Recommendations of the Conference on
State of Science in Sarcoma 2022. Eur J Cancer. 2023 Feb;180:158-179.
9.2 Gastrointestinální stromální tumor (GIST)
Gastrointestinální stromální tumory (GIST) představují vzácné mezenchymální nádory. Morfologické vyšetření nádorové tkáně se současným imunohistochemickým stanovením exprese receptoru CD117 je základem diagnostiky GIST, neboť téměř 95 % GIST tento receptor exprimuje. Pomocí molekulárně-genetického vyšetření lze stanovit přítomnost typických mutací v genech pro tyrozinkinázové receptory KIT a PDGFRA, které jsou přítomny až u 90 % GIST. Ve vzácných případech GIST bez nálezu typických mutací lze nalézt BRAF mutaci nebo rearrangement NTRK genu, s potenciálně terapeutickým cílem. V případě nepřítomnosti mutací KIT/PDGFRA lze doplnit imunochemické vyšetření SDH komplexu podjednotky B (SDHB) s cílem identifikace SDH-deficientního GIST. V případě KIT/PDGFR/BRAF/SDH negativního GIST je vhodné vyloučit syndrom neurofibromatózy typu 1 (NF1).
Léčba lokalizovaného GIST
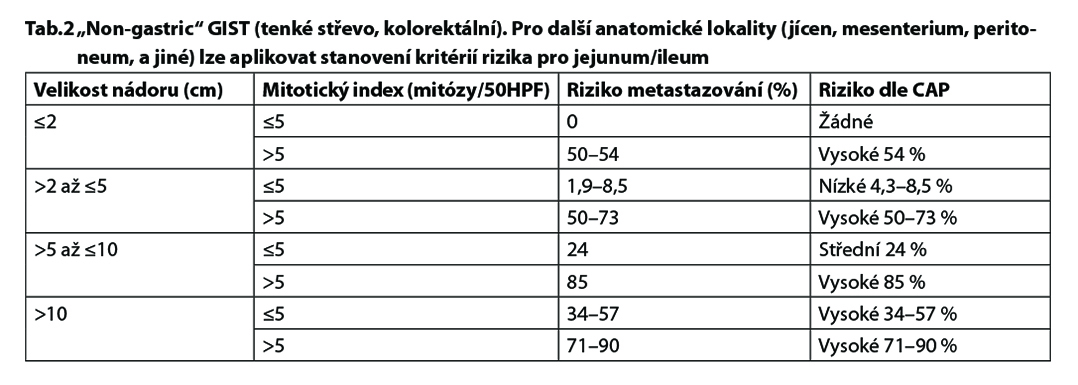
Základem je radikální chirurgické odstranění nádoru. Výběr pacientů k adjuvantní léčbě by se měl řídit reálným rizikem recidivy u konkrétního pacienta. Riziko recidivy GIST závisí na lokalizaci, velikosti tumoru a mitotickém indexu. Ruptura nádoru představuje vysoké riziko recidivy. GIST žaludku velikosti < 2 cm se vyznačuje indolentním chováním. Predikci rizika
maligního potenciálu GIST žaludku uvádí tabulka č.1. GIST tenkého střeva se vyznačuje obecně agresivnější biologií ve srovnání s GIST žaludku. Kolorektální GIST je obecně biologicky agresivnější, nádory recidivují a metastazují i při velikosti primárního nádoru < 2 cm. Predikce rizika recidívy u „non-gastric“ GIST uvádí tabulka č. 2. Predikce rizika je nejvhodnější
pro KIT nebo PDGRFA pozitivní GIST, SDH-deficientní GIST je špatně předvídatelný.

Adjuvantní léčba GIST
Pacienti s nízkým a velmi nízkým rizikem recidivy by neměli podstoupit adjuvantní léčbu imatinibem. Mutační analýza je nutná k predikci sensitivity na cílenou léčbu a prognózy.
Imatinib je indikován k adjuvantní léčbě dospělých pacientů s významným rizikem recidivy po R0 či R1 resekci KIT (CD117) pozitivního GIST nádoru, kteří vykazuji ECOG performance status 0–2. Terapie je indikována po dobu 36 měsíců. Pacienti s PDGFRA D842V-mutovaným GIST by neměli podstoupit adjuvantní léčbu. V případě mutace PDGFRA D842V lze zvážit neoadjuvantní léčbu avapritinibem.
Pacienti s GIST v rámci NF1 a negativní expresí SDH by neměli podstoupit adjuvantní léčbu. Pacienti s BRAF mutací a NTRK pozitivním nádorem by neměli podstoupit adjuvantní léčbu.
Léčba pokročilého/metastatického onemocnění
K léčbě inoperabilního nebo metastatického onemocnění se používá cílená léčba (imatinib, sunitinib, regorafenib, ripretinib, avapritinib). Testování alternativních mutací je vhodné u nádorů s wt KIT a wt PDGRFA. Zahrnuje stanovení SDHB deficience u GIST žaludku a vyšetření SDH mutace u SDHB-deficientních nádorů. NGS testování (BRAF, NF1, NTRK, FGFR fúze) umožní stanovení potenciální cílené terapie po selhání standardní léčby.
SDH-deficientní nádory mají nízkou senzitivitu na léčbu imatinibem, profitují spíš z léčby sunitinibem nebo regorafenibem. Genetické testování je nutné u všech pacientů s SDH-deficientním GIST a GIST s mutací NF1. GIST s pozitivitou NTRK je citlivý na léčbu NTRK inhibitory (larotrectinib, entrectinib). V léčbě GIST s BRAF mutací lze zvážit BRAF inhibitory (včetně kombinace BRAF-MEK inhibitorů).
I. Imatinib je indikován:
– k léčbě pacientů s lokálně pokročilým, inoperabilním/metastatickým GIST s pozitivním Kit (CD 117) a mutací KIT/PDGFRA. Není indikován u GIST s mutací PDGFRA exonu 18 D842. Standardní dávka imatinibu je 400 mg denně. V případě mutace KIT exonu 9 lze zvážit dávku imatinibu 800 mg denně.
– po nekompletní resekci GIST u pacientů bez předchozí terapie imatinibem,
– po nekompletní resekci GIST po předchozí neoadjuvantní léčbě imatinibem,
– u pacientů s lokalizovaným GIST, kde je pro komorbidity vysoké riziko pooperační morbidity a mortality,
– v případě progrese na dávce imatinib 400 mg lze eskalovat dávku na 800 mg denně (s výjimkou přítomnosti mutací necitlivých na imatinib)
– rechallenge s imatinibem (u předléčených indikovaných pacientů).
II. Sunitinib je indikován:
– k léčbě pacientů s GIST po selhání léčby imatinibem pro neúčinnost nebo intoleranci.
III. Regorafenib je indikován:
– k léčbě pacientů s GIST po selhání léčby imatinibem a sunitinibem pro neúčinnost nebo intoleranci.
IV. Ripretinib (Qinlock)
Přípravek ripretinib je indikován k léčbě dospělých pacientů s pokročilým GIST, kteří byli dříve léčeni třemi nebo více inhibitory tyrozinkináz, včetně imatinibu. Účinná látka ripretinib je novým inhibitorem tyrosinkinázy receptoru protoonkogenu KIT a kinázy PDGFRA a jiných kináz jako jsou PDGFRB, TIE2, VEGFR2 a BRAF. Účinnost byla prokázaná ve studii fáze III INVICTUS o 129 pacientech, kteří byli již dříve léčeni alespoň 3 dalšími protinádorovými přípravky nebo je netolerovali. Pacienti léčení tímto přípravkem dosahovali výrazně delší doby přežití bez progrese onemocnění i celkového přežití oproti pacientům v placebovém rameni.
V. Avapritinib (Ayvakyt)
Přípravek avapritinib je indikován jako monoterapie k léčbě dospělých pacientů s neresekovatelným nebo metastazujícím
GIST s přítomností mutace v genech receptoru pro destičkový růstový faktor alfa (PDGFRA) D842V.

Follow-up
Optimání follow-up není známý. High-risk pacienti relabují často do 1–3 roků po ukončení adjuvantní léčby. Low-risk pacienti mají někdy relaps později. Pro high-risk pacienty lze zvážit CT nebo MRI každých 3–6 měsíců po dobu 3 let po dobu adjuvantní léčby, po ukončení adjuvantní léčby každé 3 měsíce po dobu 2 let. Poté každých 6 měsíců po dobu 5 let po ukončení adjuvantní terapie a dalších 5 let ročně. Pro low-risk pacienty lze zvážit CT nebo MRI každých 6–12 měsíců po dobu 5 let u selektovaných pacientů. Pacienti s velmi nízkým rizikem recidivy pravděpodobně nevyžadují rutinní follow. up, riziko recidivy ovšem není nulové.
Literatura:
- Miettinen M, Lakota J. Semin. Dian Pathol 2006, 23 (2): 70-83
- Blanke CD, Rankin C, Demetri GD et al. Phase III randomized, intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or
metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033. J Clin Oncol 2008; 26: 626–632. - Gastrointestinal Stromal Tumor Meta-Analysis Group (MetaGIST). Comparison of two doses of imatinib for the treatment of unresectable or metastatic
gastrointestinal stromal tumors: a meta-analysis of 1640 patients. J Clin Oncol 2010; 28: 1247–1253. - Le Cesne A, Ray-Coquard I, Bui BN et al. Discontinuation of imatinib in patients with advanced gastrointestinal stromal tumors after 3 years of treatment:
an openlabel multicentre randomised phase 3 trial. Lancet Oncol 2010; 11: 942–949. - Demetri GD, van Oosterom AT, Garrett CR et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumor after failure of
imatinib: a randomised controlled trial. Lancet 2006; 368: 1329–1338. - George S, Blay JY, Casali PG et al. Clinical evaluation of continuous daily dosing of sunitinib malate in patients with advanced gastrointestinal stromal
tumor after imatinib failure. Eur J Cancer 2009; 45: 1959–1968. - Demetri GD, Reichardt P, Kang YK et al. on behalf of all GRID study investigators. Efficacy and safety of regorafenib for advanced gastrointestinal stromal
tumours after failure of imatinib and sunitinib (GRID): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381:
295–302. - Kang YK, Ryu MH, Yoo C et al. Resumption of imatinib to control metastatic or unresectable gastrointestinal stromal tumours after failure of imatinib and
sunitinib (RIGHT): a randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2013; 14. - NCCN Clinical Practice Guidelines in Oncology, GISTs v 1.2023, www.nccn.org.
- Blay JY, Serrano C, Heinrich MC, et al. Ripretinib in patients with advanced gastrointestinal stromal tumours (INVICTUS): a double-blind, randomised, placebo-
controlled, phase 3 trial. Lancet Oncol. 2020;21(7):923-934. - P G Casali1, J Y Blay2, N Abecassis et al. Gastrointestinal stromal tumours: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment
and follow-up. Ann Oncol. 2021 Sep 14;S0923-7534(21)04480-X. - Heinrich MC, Jones RL, von Mehren M, et al. Avapritinib in advanced PDGFRA D842V-mutant gastrointestinal stromal tumour (NAVIGATOR): a multicentre,
open-label, phase 1 trial. Lancet Oncol. 2020;21(7):935- 946.





