Obsah:
Co je karcinom plic?
Nádory plic a průdušek představují velmi nesourodou skupinu nádorů, které mohou na počátku vyrůstat v oblasti průdušnice, ve velkých průduškách, průdušinkách, ale také v plicních sklípcích a plicní tkáni. Nádory, jejichž růst začíná mimo dýchací cesty a plicní tkáň a do dýchacích cest a plicní tkáně se následně šíří, mezi nádory plic a průdušek nepatří. Většina nádorů plic a průdušek je zhoubných. Ze zhoubných nádorů je nejčastější karcinom plic. Jeho zastoupení mezi všemi nádory plic a průdušek je 90 %. Méně časté jsou nezhoubné (benigní) nádory, které mohou také vyrůstat v dýchacích cestách i v plicní tkáni.
Termínem rakovina plic (karcinom plic nebo také bronchogenní karcinom) se označují jak zhoubné nádory průdušek, tak nádory, které vznikají v plicní tkáni. Jejich klinický obraz je velmi podobný, a proto je nelze od sebe přesně oddělit. Přesné stanovení, zda nádor pochází z oblasti průdušek, nebo z plicní tkáně, není vždy možné a ani nemá pro další léčbu význam. Plicní rakovina je zhoubný nádor, který obsahuje maligní (zhoubné) buňky v různém stupni vývoje a může být tvořen i rozdílnými typy nádorové tkáně.
Dělení karcinomu plic
Plicní rakovinu dělíme podle biologického chování (schopnosti růst a šířit se), histologického složení (přesného složení nádorové tkáně), rozsahu a umístění. Co nejpřesnější určení složení nádoru a určení jeho velikosti a šíření je nezbytné pro plánování léčby, rozhodnutí o léčebné strategii a sledování.
Podle rozsahu onemocnění
První systém pro dělení zhoubných nádorů, který vycházel z anatomického rozsahu choroby (z umístění nádoru, ze vztahu k ostatním orgánům a z umístění metastáz), vypracoval Pierre Denoix z Francie v letech 1943–1952. Jeho „systém TNM“ je založen na určení tří složek. Jsou to: T – rozsah nádoru, N – nepřítomnost nebo přítomnost metastáz v regionálních mízních uzlinách a M – nepřítomnost nebo přítomnost vzdálených metastáz. Podle klasifikace TNM můžeme určit klinické stadium onemocnění (I–IV). Naposledy byla klasifi kace TNM přepracována v roce 2009, kdy byly vytvořeny nové podskupiny podle rozdílné prognózy nemocných v závislosti na velikosti nádoru.
Podle histologie
Toto dělení nabývá v poslední době na významu, protože u některých typů nádoru je zjištěno, který lék je pro daný typ nejvhodnější. Podle histologického typu (přesného rozboru nádorové tkáně) rakovinu plic dělíme následujícím způsobem:
- spinocelulární karcinom (skvamózní karcinom)
- malobuněčný karcinom
- adenokarcinom
- velkobuněčný karcinom
- adenoskvamózní karcinom
- karcinomy s pleomorfními, sarkomatoidními nebo sarkomatózními elementy
- karcinoid
- karcinom typu slinných žláz
- blíže nespecifi kovaný karcinom
Podle biologických vlastností
Z pohledu biologických vlastností a léčebných postupů můžeme karcinom plic dělit na 2 základní skupiny – malobuněčný karcinom plic (malobuněčná plicní rakovina) a nemalobuněčný karcinom plic (nemalobuněčná plicní rakovina). Malobuněčný karcinom plic představuje asi 20–25 % a nemalobuněčný 75–80 % onemocnění ze všech nemocných s karcinomem plic.
Nemalobuněčný karcinom plic zahrnuje všechny výše uvedené histologické typy mimo malobuněčný karcinom. Karcinom plic může obsahovat složku malobuněčného karcinomu
a současně buňky jiného typu karcinomu. Takový nádor se označuje jako kombinovaný karcinom.
Malobuněčný karcinom plic je charakterizován rychlým růstem, brzy vytváří vzdálené metastázy, což je důvodem omezených chirurgických možností léčby. Onemocnění obvykle dobře reaguje na protinádorovou léčbu cytostatiky a zářením.
Nemalobuněčný karcinom plic obvykle vykazuje ve srovnání s malobuněčným karcinomem pomalejší růst, takže v praxi bývají příznivější možnosti chirurgického odstranění za předpokladu, že nádor již nevytvořil metastatická ložiska (nerozšířil se z původního místa dále do těla). Na protinádorovou léčbu cytostatiky a radioterapii (ozařování) reaguje o něco hůře než malobuněčný karcinom.
Epidemiologie karcinomu plic
(kromě jiných kožních nádorů). Rovněž u žen se tyto nádory nacházejí na třetím místě (kromě jiných kožních nádorů) s hodnotou 38,0 onemocnění na 100 000 žen. Nejčastější výskyt karcinomu plic je mezi 55. až 80. rokem života, ale setkat se s ním můžeme i u velmi mladých i velmi starých jedinců.
Etiologie karcinomu plic
Na prvním místě mezi příčinami vzniku onemocnění je kouření. Jako „těžký kuřák“ je definován ten, kdo kouřil alespoň 20 cigaret denně po dobu alespoň 20 let nebo 40 cigaret denně po dobu 10 let atd. Těžký kuřák má 10–15% pravděpodobnost, že se u něj rozvine plicní karcinom. Kuřáci, kteří kouřili více než 20 cigaret denně po 20 let, mají 20krát vyšší riziko vzniku plicní rakoviny než nekuřáci (riziková hranice je 200 000 vykouřených cigaret). Výzkumem bylo prokázáno zvýšení rizika vzniku plicní rakoviny i u pasivních kuřáků. Zvláště ohroženou skupinou jsou děti a mladiství za předpokladu, že jsou dlouhodobě vystaveni intenzivní inhalaci cigaretového kouře.
Významným rizikovým faktorem vzniku karcinomu plic je radon, který může pronikat do obytných domů z geologického podloží i z nevhodně použitých stavebních materiálů. Koncentrace v bytových nebo pracovních prostorách závisí na konstrukci budov a na kvalitě odvětrávání.
Dále se mezi látky vyskytující se v pracovním prostředí, které zvyšují riziko vzniku plicní rakoviny, řadí azbest a rizikovým faktorem je i ionizující záření.
Příznaky karcinomu plic
Neexistují časné varovné signály, které by umožnily zachytit chorobu v počátečním stadiu. Jakmile se příznaky nemoci objeví, je už nádor ve stadiu pokročilém. Občas bývá nádor malého rozsahu objeven při vyšetřování jiné nemoci. Příznaky dělíme do tří skupin:
- Hrudní příznaky karcinomu plic (příznaky z místního šíření nádoru). Je to především nově vzniklý dlouhotrvající kašel nebo změna charakteru chronického kuřáckého kašle (například z kašle s vykašláváním na kašel dráždivý). V době stanovení diagnózy plicního nádoru trpí kašlem asi 80 % nemocných. Dalším příznakem, který bývá zřídkakdy přehlédnut, je vykašlávání krve nebo přítomnost nitek krve ve vykašlávaném hlenu. Běžné jsou záněty plic, které neustupují při léčbě antibiotiky nebo se opakovaně obnovují na stejném místě. Při pokročilém nádoru, který se šíří do pohrudnice, svalstva, žeber nebo do hrudní stěny, se dostavuje bolest neurčitého charakteru, často bývá vázána na nádech (asi 40 % nemocných). Kruté bolesti horní končetiny se vyskytují při zasažení nervových vláken nádorem. Asi 78 % nemocných má dechové obtíže. Další hrudní příznaky jsou: chrapot, syndrom horní duté žíly (projevuje se otokem krku a obličeje, jenž je způsobem tlakem nádoru nebo zvětšených lymfatických uzlin na žíly, které odvádí krev z oblasti hlavy a krku) a polykací obtíže (důsledek útlaku jícnu nebo prorůstání nádoru do jícnu).
- Mimoplicní příznaky karcinomu plic jsou vždy projevem rozsáhlého onemocnění a šíření nádoru do jiných orgánů (vznik metastáz), především do centrálního nervového systému, kostí, kostní dřeně a jater. I když se karcinom plic může šířit do kteréhokoli orgánu, nejnápadnější příznaky vyvolává postižení centrálního nervového systému (neurologické či psychické poruchy), kostí (bolesti, zlomeniny) a kostní dřeně (anemie). Naproti tomu metastázy do jater mohou dlouho zůstávat bez průvodních příznaků, a to i tehdy, když už jsou játra pohmatem zřetelně zvětšená. Mnohočetné metastázy do jater se mohou projevit žloutenkou.
- Paraneoplastické příznaky karcinomu plic (vedlejší projevy nádorového růstu) bývají velmi časté a mohou být i prvním projevem onemocnění. Vznikají především při vylučování některých hormonů, ale mohou vyvolávat i kožní změny, svalovou slabost, neurologické poruchy a změny cévní (záněty žil).
Diagnostika karcinomu plic
Klinické vyšetření. Prvním krokem, a to nejen u nádorového onemocnění, je objektivní klinické vyšetření nemocného. Poslech na hrudníku u nemocných s karcinomem plic bývá často normální, lékař se však může setkat se všemi obrazy patologického poslechového nálezu (s pískoty a vrzoty, vymizelým dýcháním či zkráceným poklepem). Zapotřebí je i vyšetřit pohmatem lymfatické uzliny a další orgány (především játra a slezinu), jejichž zvětšení může upozornit na šíření nádoru.
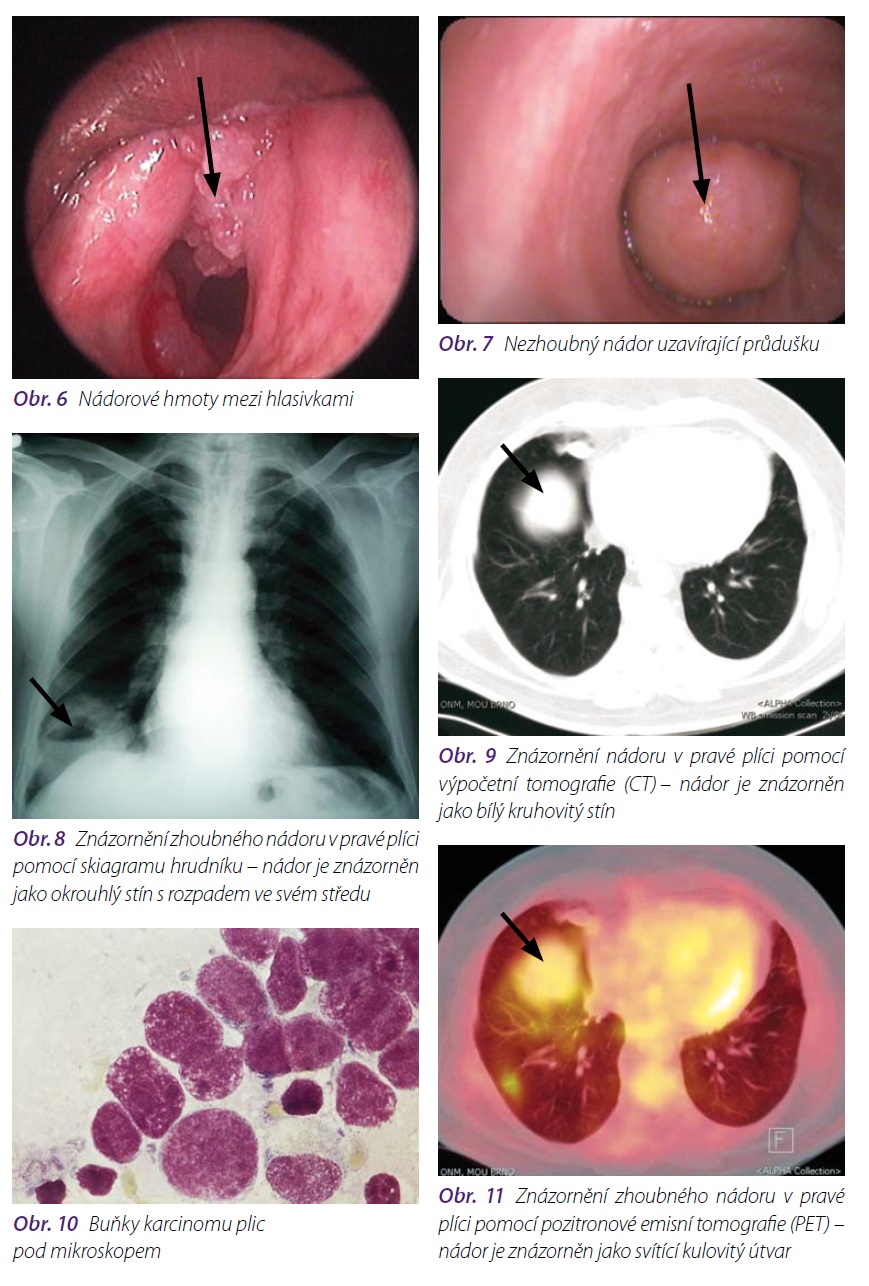
Zobrazovací metody následují po klinickém vyšetření. Jde především o rentgenový snímek hrudníku, dále o vyšetření počítačovou tomografií (CT), magnetickou rezonancí a novou citlivou metodou – pozitronovou emisní tomografií (PET). Všechna tato vyšetření umožňují určit umístění nádoru, určit jeho velikost, postižení uzlin, prorůstání nádoru mimo plicní tkáň (např. do cév, pohrudnice, hrudní stěny, jícnu). Ultrazvukové vyšetření břišní dutiny pomáhá odhalit metastázy především v játrech, radioizotopové vyšetření (scintigrafie) stanovuje metastázy v kostech a magnetická rezonance v mozku. Na základě zobrazovacích metod můžeme na diagnózu nádoru vyslovit pouze podezření.
Definitivní diagnóza, na jejímž základě může být zahájena odpovídající léčba, je diagnóza morfologická – výsledek histologického a/nebo cytologického vyšetření, které je zaměřeno na nález nádorové tkáně nebo nádorových buněk v odebraném materiálu. Nádorovou tkáň nebo nádorové buňky můžeme získat odběry v průběhu celé řady vyšetření.
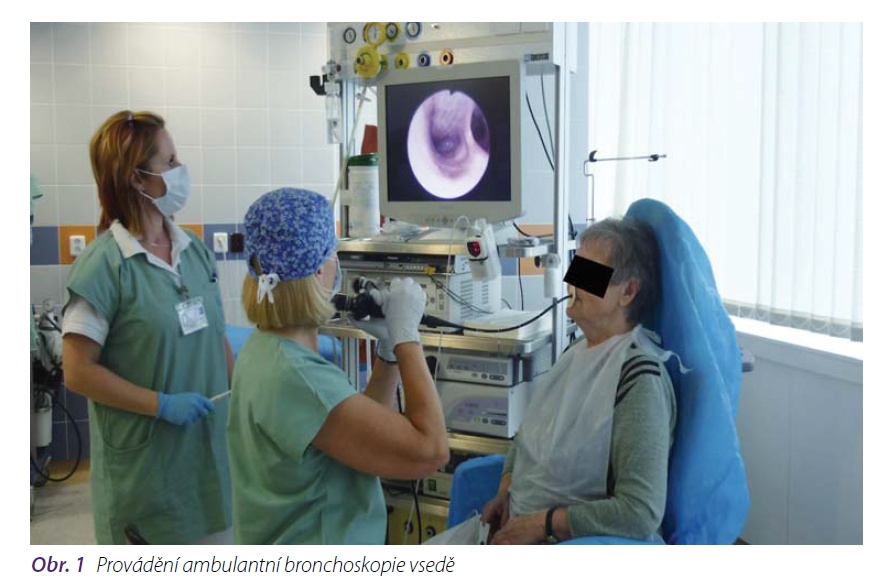
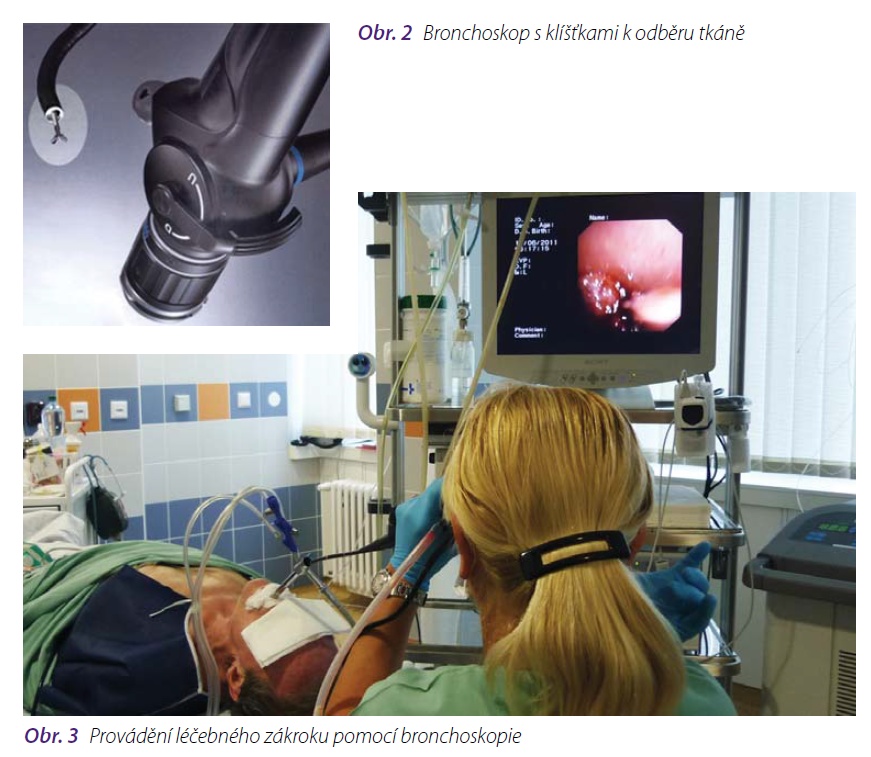
Bronchoskopie (prohlídka dýchacích cest pomocí speciálního přístroje) je základní vyšetření,které ke stanovení morfologické diagnózy užíváme. Toto vyšetření umožňuje odebrání tkáně na histologické vyšetření speciálními kleštěmi, nebo odebrání materiálu k cytologickému hodnocenípomocí speciálního kartáčku, aspirační cévky, výplachem průdušky nebo opakovanými výplachy(bronchoalveolární laváží – BAL). Pohledem lze zhodnotit změny v průduškách, sledovat změny v průběhu nemoci. Při bronchoskopii můžeme provádět i některé léčebné zákroky. Známky nádoruv průduškách mohou být přímé (uvnitř průdušky patrný růst nádoru) nebo nepřímé, podmíněnétlakem nádorové masy nebo zvětšených uzlin na stěnu průdušky. K zisku materiálu z uzlinnebo nádorové tkáně, která naléhá na průdušky zvenčí, užívají některá pracoviště endobronchiální ultrazvuk (EBUS) a k zisku tkáně z periferně uložených nádorů elektromagneticky navigovanou bronchoskopii. Zcela ojediněle se používá autofluorescenční bronchoskopie, která je založena na prohlídce sliznice průdušek po ozáření vlnovou délkou modrého světla, a NBI (NarowBand Imagine), které využívá osvětlení sliznice průdušek úzkým světelným svazkem.
Videoasistovaná torakoskopie (VATS) – prohlídka hrudní dutiny je další metoda, kterou lzezískat materiál k defi nitivnímu stanovení diagnózy. Je významnou metodou užívanou v diagnosticei léčbě patologických procesů v hrudníku. Kromě odběru vzorků z pohrudnice a zhodnoceníjejího vzhledu speciální optikou umožňuje provedení odběru plicní tkáně, případně i odnětí částiplicní tkáně. Při užití této metody je možné provést cílený odběr z plíce, z pohrudnice nebo mediastina(mezihrudí).
Mediastinoskopie (prohlídka mediastina – mezihrudí) se provádí zavedením speciální optiky do mezihrudí, bývá využívána především tehdy, když je nádor uložen v předním mediastinu naddělením průdušnice na pravou a levou hlavní průdušku. Touto metodou lze odebrat i zvětšenémediastinální lymfatické uzliny.
Cílená transparietální biopsie (odběr punkční jehlou přes hrudní stěnu) se provádí podrentgenologickou kontrolou, s výhodou pod CT, některá pracoviště využívají i ultrazvuk. Tento odběr umožňuje získat tkáň především z periferně uložených nádorů. U nemocných neschopných podstoupit náročnější diagnostické výkony může mít za určitých okolností význam cytologické vyšetření sputa.
Je-li zvažována operační léčba karcinomu plic, je nutno vyloučit vzdálené metastázy na základěvyšetření uvedených výše a posoudit, zda je nemocný operace schopen. Toto se rozhoduje dle rozsahu onemocnění v plicích. Pokud operace připadá v úvahu, tak se musí určit maximálnímožný rozsah odnětí plicní tkáně funkčním vyšetřením plic. Na základě zjištěných výsledků stanoví odborník, jak velkou část plic je možno během operace odstranit.
Laboratorní vyšetření ke stanovení diagnózy rakoviny plic zásadně nepomohou. Sledování nádorových markerů (známek nádoru) v krvi má význam především k hodnocení odpovědi na léčbu a v dalším sledování po ukončení léčby.
Léčba karcinomu plic
Tab. 1 Stupně stavu výkonnosti (performance status) nemocných
| Stupeň | |
| 0 | Plně aktivní, schopný běžného života bez omezení |
| 1 | Jsou přítomna mírná omezení běžného života, ale je schopen ambulantní léčby, je schopen lehčí práce a práce administrativní |
| 2 | Jsou četná omezení běžného života, je ale schopen ambulantní léčby, i když není schopen domácích prací, více než 50 % dne je mimo lůžko |
| 3 | Výrazné omezení běžného života s limitovanou sebeobsluhou, více než 50 % dne tráví na lůžku nebo v křesle |
| 4 | Zcela bezmocný, neschopný sebeobsluhy, zcela upoután na lůžko nebo do křesla |
| 5 | Mrtev |
Základní léčebné možnosti nemalobuněčného karcinomu plic
Léčba nemalobuněčného karcinomu plic se řídí zařazením dle klasifikace TNM do klinických stadií.
Chirurgická léčba. Podle současných poznatků je chirurgický zákrok s kurativním (léčebným)záměrem doporučován tehdy, když je nádor malého rozsahu a nádorové postižení uzlin je takéminimální. Jde především o klinická stadia I a II, není-li operace vyloučena z hlediska plicních funkcí(viz výše) nebo závažného interního onemocnění. Obdobně je tomu u klinického stadia IIIA,ale před operací se doporučuje u tohoto stadia zmenšit rozsah nádoru pomocí chemoterapie(podáním cytostatik), popř. v kombinaci s radioterapií. V době stanovení diagnózy je v České republicechirurgická léčba možná u 10–17 % nemocných. Pět let přežívá u klinického stadia I zhruba60–70 % operovaných nemocných, u stadia II je to 35–40 % a u stadia IIIA pouze 10–15 %. Přioperaci může být odstraněn plicní lalok (nebo jeho část), laloky (vpravo), či celé plíce. O tom, jakvelká část plicní tkáně bude odstraněna, rozhoduje rozsah onemocnění.
Chemoterapie (léčba cytostatiky, léčba cytostatická). Pokud je nádor diagnostikován jakomístně pokročilý, a nebo jsou přítomny metastázy, podává se chemoterapie s následnou nebo souběžnou radioterapií (ozářením). Cytostatika jsou léky pro boj se zhoubnými nádory, tedy i s karcinomem plic. Nádorové buňky vznikly z normálních buněk lidského těla a od normálníchbuněk se odlišují rychlejším množením (růstem). Bohužel se zatím nepodařilo najít žádné speciální zranitelné místo nádorových buněk, které by normální zdravé buňky neměly. Hlavním rozdílem, který činí nádorové buňky citlivějšími k léčbě cytostatiky, je jejich rychlé množení a tato vlastnost je v léčbě cytostatiky využívána. Díky rychlejšímu množení vstřebávají rakovinové buňky větší množství cytostatika z krve než ostatní zdravé buňky. To způsobuje jejich závažnější poškození proti normálním buňkám. Uvedený malý rozdíl v biologických pochodech mezi nádorovými a zdravými buňkami vysvětluje, proč cytostatika sice ničí nádorové buňky, ale v menším rozsahu poškozují i zdravé buňky těla. Existuje celá řada cytostatik, které se liší jak mírou účinnosti k různým typům nádoru, tak druhem a mírou nežádoucích účinků. Zásadní rozhodnutí, které lékař musí provést, je zvážit možný přínos léčby cytostatiky a jejich možné nežádoucí účinky. Při této rozvaze musí přínos léčby cytostatiky vždy převážit nad jejich nežádoucími účinky.
Jednotlivé zhoubné nádory se liší citlivostí buněk na cytostatika. Některé nádory mohou být cytostatiky zcela vyléčeny. U jiných typů mají cytostatika jen schopnost zmenšit rozsah nádoru, takže nemoc po určité pauze, kterou nazýváme remise, znovu propukne. V těchto případech mohou cytostatika prodloužit život a zlepšit jeho kvalitu, ne však nádor zcela vyléčit. Toto platí pro karcinom plic.
Názory na chemoterapii karcinomu plic se postupně vyvíjely. Před rokem1980 byl nemalobuněčný karcinom plic považován za nádor, který chemoterapii odolává a pro tuto léčbu není vhodný. V letech 1980–1990 se do léčby zavedla cytostatika cisplatina a karboplatina a procento nemocných, u kterých došlo ke zmenšení nádoru a oddálení úmrtí, vzrostlo. V devadesátých letech 20. století byla do léčby zařazena tzv. cytostatika III. generace (paclitaxel, docetaxel, vinorelbin, gemcitabin). Při použití léčebných kombinací s těmito cytostatiky se u více jak poloviny pacientů nádor zmenšuje, což pro nemocné znamená především ústup potíží. V posledních letech se na základě výzkumu užívá u určité skupiny nemocných (nemocných s adenokarcinomem a velkobuněčným karcinomem) kombinace pemetrexedu s cisplatinou. U pacientů s místně pokročilým onemocněním, kde se používá s chemoterapií i radioterapie,se obvykle podávají 4 cykly chemoterapie. U nemocných s pokročilým onemocněním, kde nenísoučástí léčebného plánu radioterapie, se podává 4–6 cyklů chemoterapie. Pokračovací udržovací léčba pemetrexedem je vhodná pro nemocné, kteří byli léčeni pemetrexedem s cisplatinou a u kterých bylo prokázáno po 4 cyklech léčby zmenšení nádoru nebo zastavení růstu. Pemetrexed se podává do zhoršení onemocnění.
Radioterapie (léčba zářením). Radioterapie s léčebným záměrem je indikována u nemocných, u kterých pro rozsah nádoru není možná operace a nemají prokázány vzdálené metastázy. U těchto nemocných je kombinovaná léčba chemoterapií s radioterapií standardním léčebným postupem. Dále je indikována radioterapie u těch nemocných, u kterých je nádor malého rozsahu, ale nejsou schopni pro přidružená onemocnění nebo špatné plicní funkce radioterapii podstoupit.
Léčba 2. linie, která se podává v případě zhoršení při léčbě nebo po léčbě, jež byla podávána po stanovení diagnózy, u nemocných v dobrém klinickém stavu pomáhá předevšímk ústupu příznaků. Z cytostatik se používá docetaxel a pemetrexed, dále lze použít i látky, které patří do skupiny cílené biologické léčby (erlotinib).
Erlotinib lze použít i ve 3. linii léčby.
Nové směry protinádorové léčby nemalobuněčné rakoviny plic (nemalobuněčného karcinomu) – cílená biologická léčba
Ukazuje se, že v léčbě cytostatiky (chemoterapii) již bylo dosaženo maximum a žádná nová cytostatika ani jejich nové kombinace již nepřispějí k významnému zlepšení léčebného efektu a přežívání nemocných. Biologická léčba se někdy také nazývá cílená molekulární terapie, protože lépe vyjadřuje skutečnost, že zasahuje do pochodů v nádorové buňce.
Většinou se jedná o nízkomolekulární látky, které vazbou např. na receptory buněk blokují signální dráhy do buněčného jádra. Ty ve svém důsledku ovlivňují vlastnosti buňky, které způsobují,že se buňka chová zhoubně. Mezi tyto zhoubné vlastnosti patří zastavení apoptózy (kontrolované buněčné smrti – u nádorové buňky nedochází ke kontrolované buněčné smrti tak, jako u normální buňky), schopnost novotvorby cév a vlastního zásobování nádoru živinami, nekontrolovanáproliferace nádorové buňky, schopnost nádorové buňky metastazovat.
V léčbě pokročilého nemalobuněčného karcinomu plic se používají inhibitory tyrozinkinázy receptoru epidermálního růstového faktoru (EGFR) – erlotinib , gefitinib a afatinib. Je patrné, že prospěch z této léčby mají jen určití nemocní, u nichž na povrchu nádorové buňky je tento receptor ve větším množství přítomen a navíc je nositelem určitých mutací, které nazýváme aktivační mutace. Jejich přítomnost se vyšetřuje pomocí molekulárně genetických vyšetření materiálů, které obsahují nádorovou tkáň nebo nádorové buňky. Pokud dochází k progresi při léčbě výše uvedenými preparáty, je zapotřebí zjistit, zda v nádorové tkáni nedošlo k rozvoji rezistentní mutace. Při jejím průkazu, který se provádí z nádorové tkáně, nádorových buněk a v určitých případech i z krve, je vhodná léčba osimertinibem. Jeho podání však zatím předchází souhlas zdravotní pojišťovny.
Dalším biologickým preparátem v léčbě nemalobuněčného karcinomu plic je protilátka, která blokuje receptor vaskulárního endoteliálního růstového faktoru VEGFR. Jedná se o bevacizumab, který se podává s cytostatickou léčbou u nemocných s pokročilým nedlaždicobuněčným nemalobuněčným karcinomem plic, a to po stanovení diagnózy. V jeho podávání se pokračuje ipo skončení cytostatické léčby do zhoršení onemocnění.
Dalším z preparátů biologické léčby je crizotinib. Z této léčby mají prospěch nemocní, u nichž byly zjištěny mutace ALK (anaplastické lymfom kinázy). V České republice je léčba crizotinibem indikována po průkazu mutací u nemocných, u kterých selhala léčba předchozí. Jeho podání lze zvažovat u nemocných s průkazem výše uvedené mutace ihned po stanovení diagnózy, ale s předchozím souhlasem zdravotní pojišťovny.
Pro nemocné, u nichž je nalezena mutace ALK (anaplastická lymfom kináza), lze po selhání crizotinibu zvažovat ceritinib nebo alectinib. Rovněž u těchto léků je zapotřebí předchozí souhlas zdravotní pojišťovny.
Dalším preparátem biologické léčby vhodným především pro adenokarcinom je nintedanib. Jedná se o inhibitor angiogeneze (novotvorbu cév), působící na několik cílů, které hrají v regulaci angiogeneze roli. Nintedanib v kombinaci s docetaxelem je indikován ve 2. Linii léčby. Předpokládá se, že nintedanib bude dostupný v ČR během roku 2017.
Nové směry protinádorové léčby nemalobuněčné rakoviny plic (nemalobuněčného karcinomu) - imunoterapie
Novým přístupem k léčbě nádorového onemocnění je imunoterapie. Tato léčba není zaměřena na nádor samotný, ale na imunitní systém pacienta. Cílem léčby je podpořit imunitní systém tak, aby mohl odstranit nádorové buňky. Nádory mohou být imunitním systémem rozpoznávány, ale zároveň mají řadu mechanismů, jak imunitní systém vyřadit ze hry. Jednou z těchto signálních drah, které tlumí lokální odpověď T-buněk, je dráha zprostředkovaná vazbou PD-1 molekuly (Programmed Death 1) na T-buňce s ligandem PD-L1, který se vyskytuje na povrchu mnoha buněk včetně nádorových. Po vazbě PD-1 na PD-L1 dojde k utlumení funkce T-buněk, snížení jejich aktivity a k anergii. Zabráníme-li vazbě PD-1 na svůj ligand, není tlumena imunitní odpověď T-buněk proti nádoru a v ideálním případě může dojít k napadení nádorové tkáně a k její destrukci. Jednou z možností, jak zablokovat PD-1 molekulu, je použití monoklonálních anti-PD1 protilátek.
Nivolumab je plně humánní monoklonální protilátka izotypu IgG4, která se váže na PD-1 na aktivovaných T-buňkách a zabraňuje vazbě receptoru na svůj ligand (PD-L1 a PD-L2). VČeské republice je nivolumab nivolumab indikován pro léčbu nemocných se skvamózním (dlaždicobuněčným) karcinomem, u nich došlo ke zhoršení po chemoterapii obsahující platinu. Jeho podání musí předcházet zvláštní souhlas zdravotní pojišťovny.
Dalším představitelem imunoterapie je pembrolizumab, což je plně humanizovaná IgG4 monoklonální protilátka proti PD-1. Předpokládá se, že v České republice bude léčba pembrolizumabem možná u nemocných s prokázanou pozitivitou PD-L. A to jak ve 2. linii (po selhání chemoterapie) léčby tak v 1. linii (po stanovení diagnózy).
Při imunoterapii se musí počítat s tím, že nástup účinku může být opožděný, neboť aktivace imunitního systému může trvat řádově týdny až měsíce. Počáteční indukovaná zánětlivá odpověď může vést i k dočasnému zvětšení nádoru nebo jeho metastáz.
Základní léčebné možnosti u malobuněčného karcinomu plic
Před rozhodnutím o léčbě je nutné určit, zda se jedná o „limitované stadium“, nebo „extenzivní stadium“. Limitované stadium je onemocnění ohraničené na jedno plicní křídlo, mohou být postiženy uzliny a může být přítomen stejnostranný výpotek. Ozařování může být provedeno v jednom ozařovacím poli. Extenzivní stadia jsou všechny ostatní formy onemocnění. Dva roky přežívá pouze 5 % nemocných s malobuněčným karcinomem plic.
V případě limitovaného stadia je standardním postupem chemoterapie (cytostatická léčba) v kombinaci s radioterapií. Chemoterapie spočívá v podání kombinace platinového derivátu (cisplatina, karboplatina) a etoposidu. Podávaný počet cyklů je 4–6. Po počáteční léčbě se u více než 95 % nemocných onemocnění vrátí. V těchto případech se přistupuje k léčbě druhé linie. Pokud se jedná o onemocnění, které se zhoršuje za dobu delší než 3 měsíce od poslední léčby, podává se opět platinový derivát s etoposidem. Pokud se onemocnění zhoršuje dříve a nebo na léčbu po stanovení diagnózy nereaguje, podává se topotecan.
Radioterapie v kombinaci s chemoterapií je u limitovaného stadia onemocnění standardní léčebný postup. U extenzivního stadia má význam především pro zmírnění příznaků, které onemocnění vyvolává. U nemocných s limitovaným stadiem onemocnění, v případě, že došlo při léčbě k zlepšení, se provádí preventivní ozáření mozku, aby se snížilo riziko mozkových metastáz,které obtěžují nemocného nejvíce. Preventivní ozáření mozku lze doporučit i u nemocných v extenzivním stadiu, pokud se nádor při léčbě cytostatiky výrazně zmenšil.
Vzhledem k biologické povaze malobuněčného karcinomu plic se operace provádí velmi vzácně a jen u nádorů velmi malého rozsahu a po operaci musí následovat léčba cytostatiky.
Paliativní léčba karcinomu plic
Cílem paliativní léčby je zmírnit potíže nemocného a pozitivně ovlivnit kvalitu jeho života. Týká se pacientů, jejichž nemoc je ve stadiu, kdy již nelze uvažovat o vyléčení. Zahrnuje všechny aspekty lékařské i nelékařské péče o nemocného i jeho rodinu, a to trvale po celou dobu nemoci.
Paliativní léčba je indikována u více než 50 % nemocných rakovinou plic již po stanovení diagnózy a řídí se stejnými zásadami jako u jiných nádorových onemocnění. Předepisujeme ji především kvůli potížím, které onemocnění způsobuje. Při tvorbě tekutiny v dutině hrudní se v rámci paliativní léčby využívá především aplikace cytostatik do pohrudniční dutiny, podávají se kortikoidy a někdy se i snažíme zmenšit nádor chirurgickou cestou. V případě uzávěru průdušek růstem nádoru dovnitř se pokoušíme zlepšit průchodnost dechových cest pomocí laseru nebo využitím elektrické energie (pomocí elektrokauteru), některá pracoviště využívají i zmrazení nádorové tkáně (kryoterapii). Lze použít také brachyterapii, což lze zjednodušeně vyjádřit jako zavedení zářiče přímo do dechových cest. Dalším řešením může být zavedení stentu při tlaku nádoru zvenčí. Endobronchiální stenty jsou umělohmotné, kovové (drátěné)nebo kombinované průduškové a bronchiální protézy se schopností udržet volný průsvit průduškya tím zabezpečit přívod vzduchu do ohrožené oblasti. Stenty jsou konstruovány tak, žejsou schopny v roztaženém stavu odolávat tlaku okolní tkáně. Při paliativní léčbě se nezapomíná ani na léčbu medikamentózní (pro zmenšení dechových obtíží, bolestí, zánětů žil, kašle, vykašlávání krve, srdečního selhávání) a léčbu přidružených interních nemocí. Velmi důležitou oblastí je péče o psychický stav nemocného. Veškerá paliativní léčba je nedílnou součástí komplexní onkologické péče.
Podpůrná léčba u karcinomu plic
Jedná se o léčbu, která není zaměřena přímo proti nádorovému onemocnění. Podpůrná léčba předchází nežádoucím účinkům vlastní protinádorové léčby nebo takové účinky mírní, a protinádorovou léčbu tak umožňuje. Podpůrná léčba rovněž mírní příznaky nádorového onemocnění a vede ke stabilizaci nebo zlepšení kvality života. Mezi nejčastěji používané preparáty při podpůrné léčbě patří antiemetika, bisfosfonáty, kortikoidy, laxativa, růstové faktory krvinek.
Pocit nevolnosti (nauzea) nebo zvracení jsou častým nežádoucím účinkem protinádorové léčby, která nedráždí žaludek, jak by se mohlo zdát, ale specifické nervové struktury – receptory v mozku. Antiemetické léky (granisetron, metoklopramid, ondansetron, palonosetron, thietylperazin, aprepitant, olanzapin, haloperidol, alprazolam, prometazin) tlumí či zcela odstraňují cytostatiky nebo radioterapií navozenou nevolnost a zvracení. Účinek níže uvedených léků může být posílen léky ze skupiny kortikoidů (prednison, dexamatazon).
Nádory mohou vytvářet metastázy v kostech. Za normálních podmínek kostní buňky zvané osteoklasty kost ‚rozpouštějí‘, zatímco osteoblasty neustále vytvářejí kost novou – tak je kost trvale přestavována a přizpůsobována zátěži. Při postižení kosti nádorem jsou aktivovány osteoklasty,‚rozpuštěná‘ kost však není nahrazována novou kostí. Výsledkem je oslabení kosti, které je bolestivé a může vyústit ve zlomeninu. Kromě toho je do krve z kostí vyplavován vápník, který je vylučován ledvinami, kde se může ukládat ve formě ledvinových kamenů. Bisfosfonáty – ibandronát, klodronát, pamidronát, zoledronát (podávají se ve formě injekcí nebo tablet) se vychytávají v kosti, kde brání aktivaci osteoklastů a ‚rozpouštění‘ kosti – tím je sníženo riziko zlomení kosti, snižuje se hladina vápníku v krvi a klesá riziko vytvoření ledvinných kamenů. Účinnou léčbou kostních metastáz je take podávání denosumabu, což je lék ovlivňující metabolizmus kostí.
je běžně produkován v ledvinách a řídí tvorbu červených krvinek. Při jejich nedostatkuje možno v některých případech tvorbu červených krvinek podpořit uměle vyrobeným růstovým faktorem. Taková léčba je někdy výhodnější než transfuze krve, protože její efekt bývá trvalejší. Používané preparáty jsou darbepoetin alfa, epoetin alfa, epoetin beta, epoetin zeta.
Důležité jsou i léky k léčbě zácpy (laxativa), která se často vyskytuje v souvislosti s podáváním opioidů při bolesti, může však souviset i s nedostatečným příjmem potravy a zejména tekutin.Laxativa jsou léky, které usnadňují průchod stolice střevem. Některé léky brání vstřebávání vody ze střeva nebo podporují sekreci vody ze střevních buněk do střeva – stolice je pak řidší a snáze střevem prochází (tímto mechanizmem působí i potraviny s vysokým obsahem vlákniny – obilniny,ovoce, zelenina). Při léčbě zácpy je proto vždy důležitý i dostatečný příjem tekutin. Jiné lékydráždí nervová zakončení ve střevu a tím urychlují pohyby střeva, mnohé léky působí oběma mechanizmy (laktulóza).
Bolest je častým příznakem nádorových onemocnění. V současné době již existuje celá řada různě ‚silných‘ léků tlumících bolest. Základem léčby bolesti jsou nesteroidní protizánětlivá analgetika – působí především v místě bolesti, většinou snižují i projevy zánětu. Při silnější bolesti se používají slabé nebo silné opioidy (anodyna) – tyto léky působí na mozek a míchu a taktlumí vnímání bolesti. Bolesti kostí je možno tlumit kalcitoninem – hormonem, který ovlivňujemetabolizmus vápníku, nebo bisfosfonáty. Účinnou léčbou kostních metastáz je take podávání denosumabu, což je lék ovlivňující metabolizmus kostí. Podle potřeby se podává kombinace různých léků, účinek analgetik může být podpořen podáním dalších léků, jako jsou například kortikosteroidy nebo léky ovlivňující psychiku (antidepresiva, neuroleptika, benzodiazepiny). Při chronické bolesti je důležité udržovat stálou hladinu léku v organizmu, to znamená podat dávku léku dříve, než předchozí dávka přestane působit. K udržení stálé hladiny napomáhá i použití léků,které se pomalu vstřebávají, jde o tablety s označením ‚retard‘, náplasti atd.
Při cytostatické léčbě často dochází k poklesu počtu bílých krvinek, zejména neutrofilních granulocytů (neutrofilů). Ke stimulaci jejich tvorby se užívají leukocytární růstové faktory.
Léčba nežádoucích účinků léčby inhibitory tyrosinkinázy (afatinib, erlotinib, gefitinib)
Již princip cílené biologické léčby naznačuje, že nežádoucí účinky biologické léčby jsou odlišné od těch, které pozorujeme při léčbě cytostatiky nebo při radioterapii. Jsou celkově méně závažné, ale někdy mohou vést k přerušení a dokonce předčasnému ukončení léčby. Kožní toxicita je nejčastějším nežádoucím účinkem léčby inhibitory tyrosinkinázy (afatinib, erlotinib, gefitinib) a protilátkou proti EGFR (receptor epidermálního růstového faktoru). Vyskytuje se až u 75 % nemocných. Má charakter papulopustulózního exantému, který se může komplikovat sekundární infekcí a vznikem impetiga. Vyskytuje se na všech částech těla s maximem na obličeji, ve vlasech a na hrudníku. Mírnějším, ale stejně nepříjemným projevem kožní toxicity je suchost a svědění kůže. Preventivně se doporučuje zamezení vysušování kůže, omezení slunění a nepoužívání parfemizovaných kosmetických přípravků, pojídání exotického ovoce. V léčbě jsou doporučovány hydratační pleťová mléka, ochranné masti se zklidňujícím účinkem (s obsahem zinku), při závažnější toxicitě pak lokální kortikosteroidy. Pokud se objeví sekundární infekce v kůži, podáváme systémově antibiotika (doxycyklin 100 mg 2 × denně). Průjem je druhým nejčastějším nežádoucím účinkem biologické léčby. V léčbě se doporučuje podávání loperamidu do ústupu průjmů, při podezření na sekundární infekci i antibiotika. Někdy je nutno lék přechodně vysadit nebo dávku léku snížit.
Léčba nežádoucích účinků imunoterapie
Imunoterapie jeví jako poměrně dobře tolerovaná, nežádoucí účinky bývají lehčího stupně Nejčastější jsou únava, snížení apetitu, průjem, nauzea, zácpa, kašel a dušnost, elevace jaterních enzymů, rush, svědění. V průběhu léčby se musí počítat i s výskytem toxicity na autoimunitním podkladě, jako jsou pneumonitida (neinfekční zánět plic), hepatitida (neinfekční zánět jater), abnormality funkce štítné žlázy, rozvoj neinfekčního zánětu střev, poškození ledvin, postižení kůže. Pro zvládnutí imunitně zprostředkovaných nežádoucích účinků je zapotřebí co nejčasnější nasazení kortikoidů.
Další užitečné informace můžete získat v části Péče o pacienta - Nežádoucí účinky léčby.
Výživa v průběhu onemocnění karcinomem plic
Základním léčebným postupem v případě karcinomu plic je protinádorová léčba, tedy operace, cytostatika, ozařování, biologické preparáty a jejich různé kombinace, působící většinou přímo proti nádoru, správná výživa je však nutným doplňujícím opatřením. Dobrý stav výživy může být nezbytný pro úspěšné dokončení celé onkologické léčby a naopak špatný stav výživy může být důvodem k předčasnému ukončení této léčby. Špatný stav výživy zhoršuje celkové vyhlídky nemocného na úspěšnou léčbu, a proto je nejlepším postupem současná léčba protinádorová spolu s včasnou podporou výživy, zaměřenou na zabránění zhubnutí a udržení stavu výživy.
Pokud nádorové onemocnění již vzniklo, dochází často už na začátku onemocnění k poklesu příjmu a nedostatečnému využití stravy. Tomu odpovídá skutečnost, že téměř u poloviny nemocných je již při zjištění nádorového onemocnění přítomna ztráta hmotnosti a je zhoršený výživový neboli nutriční stav. Pokud není tomuto problému věnována pozornost, může se porucha výživy dále prohlubovat a oslabovat nemocného, což není pro další léčbu nádoru výhodné. Organizmus, který není schopen přijímat dostatečné množství biologicky hodnotné stravy, je nucen začít využívat nejen zásobní tělesné živiny, ale i vlastní stavební látky, zejména svalovou a tukovou tkáň. Rozpad tělesných tkání vyčerpává pacienta postupnou ztrátou tělesných bílkovin. Bílkoviny jsou totiž rozhodující pro fungování celého organizmu, což je viditelné zejména na obranyschopnosti proti infekci pomocí imunitního systému a na funkci svalové hmoty. Rozpad tělesných bílkovin ale probíhá vždy rychleji než jejich obnova po překonané nemoci. I když nemocný po ukončení léčby dobře jí a znovu přibývá na váze, často jde spíše o přibývání tuku než svalu, a proto se někdy zdlouhavě vrací původní odolnost a výkonnost organizmu. Je tedy velmi důležité uvědomit si, že pro nemocného s nádorem není výhodné ani jen přechodné hubnutí v průběhu léčby, i když se váha rychle zpět upraví.
Déletrvajícím nedostatečným příjmem stravy vzniká celkově špatný stav výživy (podvýživa, malnutrice). Takový stav se může vyvíjet buď jako zjevné hubnutí, nebo ve skryté podobě jako pozvolná ztráta hmotnosti, způsobená opakovanými menšími výpadky stravy. U pacienta s nádorovým onemocněním je jedním z důležitých úkolů nutriční podpory včas obrátit pozornost nemocného i jeho rodiny na udržení pravidelného příjmu živin a na zabránění větších výpadků stravy, a to proto, že pacienti s nádorovým onemocněním, kteří jsou v dobrém stavu výživy a udrží příjem stravy v průběhu onkologické léčby, se lépe vyrovnávají s vedlejšími účinky onkologické léčby, jsou odolnější proti infekčním i jiným komplikacím, mají nižší riziko pooperačních komplikací, častěji se u nich nemusí přerušovat protinádorová léčba, jsou snáze schopni znovu vystavět tkáně poškozené protinádorovou léčbou,jsou fyzicky silnější a sami se celkově cítí lépe než nemocní špatně živení, mají lepší kvalitu života.
Navzdory nepochybnému významu výživy neexistuje dnes žádný důkaz, že by nějaká zvláštní dieta mohla vyléčit nádorové onemocnění nebo zabránit jeho postupu. Ani vitaminózní tablety a minerály nemohou vyléčit nemocného s nádorem.
Porucha výživy u pacienta s nádorovým onemocněním může být způsobena růstem nádoru. Pokud nádor postihuje zažívací systém, může snadno narušit polykání a příjem stravy nebo i využití stravy ve střevě. Avšak i nádory mimo zažívací systém vyvolávají svým růstem často nechutenství a poruchy přeměny cukrů, tuků a bílkovin, které pak mohou vést k hubnutí i při zachovaném příjmu stravy. Další příčinou poruchy výživy mohou být vedlejší účinky protinádorové léčby, které mohou přechodně vyvolávat pokles příjmu stravy tím, že vyvolávají nechutenství, nevolnost nebo celkovou slabost. Týká se to chemoterapie (cytostatik), radioterapie (ozařování), také operační léčby a můžeme se s tím zcela výjimečně setkat i při podávání biologické léčby. Poruchu výživy mohou způsobit i chronické obtíže, způsobené nádorem a komplikacemi nádorového onemocnění. Nízký příjem stravy může být způsoben také nedostatečně tlumenou bolestí jakéhokoliv původu, stejně jako nevolností, zácpou, úzkostí nebo depresí. Také komplikace, jako jsou zejména infekce s horečkami, způsobují často přechodné poklesy příjmu stravy.
Na poruše výživy nemocného se mohou podílet i další chronické obtíže, které provázejí nádorové onemocnění, jako jsou bolest, dušnost, žaludeční nevolnost a nebo zácpa, v jejichž důsledku obvykle klesá chuť k jídlu a příjem stravy, aniž si to nemocný musí uvědomovat. Pacient může v souvislosti s onkologickým onemocněním prožívat nejistotu, nervozitu nebo strach a následkem toho rovněž trpět ztrátou chuti k jídlu a nevolností, které pak vedou k prohlubující se poruše výživy.U nemocných, kteří v průběhu nádorového onemocnění hubnou, je obvykle na prvním místě potřeba upravit stravu tak, aby bylo zabráněno další ztrátě hmotnosti. I u nemocných, kteří dosud nezhubli, je na místě usilovat o plnohodnotnou výživu, která zajišťuje příjem všech nezbytných živin tak, abychom preventivně předcházeli oslabení organizmu.
Příjem stravy není jen příjmem živin, ale je a měl by být i zdrojem radosti, potěšení, posílením kontaktu mezi lidmi plní i určitou společenskou funkci. Je proto třeba dát šanci přirozenému způsobu výživy. Teprve v případě závažnějších déletrvajících nebo opakovaných potíží, kdy dochází k rozvoji poruchy výživy, je nutno nemocnému doporučit některou z forem umělé klinické výživy.
Podpora výživy musí začít velmi záhy s cílem co možná nejvíce udržet dobrý stav výživy a zabránit hubnutí hned na počátku nádorového onemocnění. Podpora výživy je totiž nejúčinnější na samotném počátku léčení, již při prvních problémech s příjmem stravy a s udržením tělesné váhy. Jakmile už došlo k větší ztrátě tělesné váhy, je léčba této poruchy nepoměrně obtížnější. Každé další hubnutí přirozeně situaci zhoršuje.
Pro zlepšení stavu výživy je nutné, aby byl příjem stravy dlouhodobě dostatečný, a pokud možno nedocházelo k větším výpadkům stravy. U nemocného, který již zhubnul, může například i jednodenní výpadek stravy dále zhoršit jeho stav výživy. Proto je třeba obrátit pozornost pacienta i jeho rodiny na udržení každodenního příjmu stravy a co možná nejvíce zamezit delším pauzám ve výživě.
Základem nutriční podpory u nemocného, který ztrácí na váze a nebo je váhovou ztrátou ohrožen, je dietní rada. Její součástí je informovat pacienta nejen o správném složení a množství stravy, ale ovlivnit i další okolnosti, které souvisejí s příjmem stravy.
Významným přínosem dietní rady je už ten fakt, že obrací pozornost nemocného na otázky výživy a nemocný se jimi začíná zabývat. Dietní rada, poskytovaná pacientům s nádorovým onemocněním,kteří mají neúplný příjem stravy a hubnou, má zásady společné pro všechna nádorová onemocnění. Cílem je zvýšit příjem biologicky hodnotné stravy a také zvýšit pestrost stravy, aby byl zajištěn příjem všech potřebných živin. Toho lze dosáhnout úspěšnou léčbou těch příznaků choroby,které obvykle snižují příjem stravy, jako jsou jakákoliv nedostatečně tlumená bolest, dušnost, zácpa,nevolnost a nebo zvracení, dále zrušením všech dietních omezení, která nejsou zcela nezbytná, zvýšením pestrosti stravy, obohacením jídelníčku, respektováním individuálního kolísání stavu nemocného v průběhu dne, tedy využitím k příjmu výživově nejhodnotnějších částí stravy tu část dne, kdy se nemocný cítí nejlépe, nenucením k dodržování předem daného neměnného časového rozvrhu jídla (nemocný může jíst, kdykoliv pocítí chuť k jídlu), respektováním přání nemocného, týkajících se chuťové oblíbenosti a způsobu stravování, intenzivní péčí o dutinu ústní, každodenním udržováním hygieny dutiny ústní, omezením kontaktu nemocného s příliš intenzivními pachy jídla při jeho přípravě i servírování, nepodáváním oblíbených jídel v době léčby cytostatiky a ozařování, ani v době zhoršení nevolnosti, aby se zabránilo vypěstování averze k těmto jídlům, nabízením atraktivních, lákavě připravených jídel, podáváním jídla v příjemném prostředí, nejlépe v kruhu svých příbuzných nebo známých, spoluprací nemocného s dietní sestrou nebo dietologem a lékařem.
Úprava diety směřuje ke zvýšenému příjmu energeticky (kaloricky) bohatých součástí stravy,kdy v malém objemu stravy dostává nemocný hodně živin. Může to znamenat příjem potravin s vyšším obsahem tuku (smetana, smetanové sýry, rostlinné oleje apod.), který představuje koncentrovanou energii, nebo i potravin s koncentrovanými cukry (např. med, kandované ovoce).Současně je však třeba zajistit i zvýšený příjem bílkovin.
Žádné jednotlivé jídlo ani jednotlivá skupina jídel nezabezpečuje dostatečný příjem všech potřebných živin. Biologická hodnota stravy je nejlépe zajišťována zvýšenou pestrostí stravy,což znamená jíst více druhů potravin z každé z hlavních skupin, pokud možno každý den nebo vícekrát týdně.
Dobrým zdrojem bílkoviny je maso, mléčné výrobky, vejce, cereálie a luštěniny. Jako odlehčená,dobře stravitelná strava bohatá na bílkoviny se u onkologických nemocných doporučuje podmáslí,netučný tvaroh, jemné libové telecí, jehněčí nebo drůbeží maso, dále rybí maso a celozrnné pečivo. Protože část nemocných udává nechutenství k masu, dostávají se stále více do popředí náhradní formy bílkovin, jako jsou sója nebo tofu.
Biologicky hodnotná strava musí dále obsahovat i dostatek minerálů, vitaminů a stopových prvků. Některé z těchto látek podporují imunitu a nebo mají jiné ochranné vlastnosti,především antioxidační působení. Mezi nejvýznamnější antioxidační látky patří vitaminy A, C, E, dále betakaroten (z něhož může vznikat vitamin A) a konečně i stopové prvky selen a zinek. Antioxidační systém zabraňuje poškození různých tkání a buněk v našem těle reaktivními formami kyslíku. Tyto formy kyslíku běžně vznikají i v těle zdravých osob, ale u nich jsou rychle omezeny a zneškodněny. U onkologických pacientů vznikají reaktivní formy kyslíku při chemoterapii a při infekčních komplikacích. Nemocný ve špatném stavu výživy s vyčerpanými zásobami vitaminů se však může reaktivnímu kyslíku špatně bránit a dochází tak k poškozování tkání. Zatím nebyla stanovena přesná doporučení pro užívání vitaminů a stopových prvků u nemocných s nádory.
Porucha výživy není při nádorovém onemocnění jeho nezbytnou součástí, naopak je možno jí včasnou úpravou výživy podle dietní rady u většiny nemocných zabránit, a neboji aspoň významně zmírnit. Pokud nemocný skutečně dokáže zařadit jednotlivá doporučení poskytnutá dietní radou do každodenního způsobu výživy, dokáže zpravidla lépe udržet stav výživy a může to mít pro celkovou úspěšnost jeho léčby velký význam. Základní cíle dietního režimu u onkologicky nemocných jsou včas zabránit většímu zhubnutí, stabilizovat váhu,předcházet dalšímu hubnutí, protože již rozvinutá malnutrice s velkou váhovou ztrátou se velmi obtížně léčí, úprava nedostatků jednotlivých živin, zejména bílkovin a vitaminů, zlepšení snášenlivosti protinádorové léčby, možnost dokončit protinádorovou léčbu v plném rozsahu a tím zlepšit celkový výsledek léčby nádorového onemocnění, zmírnění vedlejších účinků protinádorové léčby, zvýšení obranyschopnosti organizmu, zlepšení protiinfekční i protinádorové imunity, zlepšení kvality života nemocného, tj. pocitu fyzického zdraví, psychické, sociální i rodinné pohody.
Nádorové onemocnění může být provázeno potížemi, které snižují příjem stravy a způsobují hubnutí a tím i celkové oslabení nemocného. Některé z těchto potíží mohou být vyvolány také protinádorovou léčbou, ať již chemoterapií, ozařováním, nebo i moderní biologickou léčbou.Mezi tyto potíže patří nechutenství (někdy spíše pocit časného nasycení, chybění pocitu hladu),změny vnímání chutí různých jídel, nevolnost (nauzea), zvracení, suchost v ústech (xerostomie),bolest v ústech, obtížné polykání (dysfagie), bolestivé polykání (odynofagie), průjem, zácpa. Tyto potíže se mohou vyskytovat i současně u téhož pacienta, což může snadno vést ke sníženému příjmu stravy, hubnutí a celkové slabosti. Některé z těchto potíží mohou být zmírněny nebo i odstraněny podáváním léků. Ve většině případů je však nutná i úprava stravy a stravovacích zvyklostí,tzv. dietní rada.
Některá z níže uvedených dietních doporučení se mohou zdát na první pohled obyčejná, ale jejich důsledné uplatnění nemusí být snadné, pokud vyžaduje změnu dlouholetých návyků. Je vhodné všechna uvedená doporučení zavést do každodenního života. Další podrobné informace a doporučení při nechutenství, nevolnosti, zvracení, při vnímání chuti jsou uvedeny v části Péče o pacienta - Výživa během léčby.
Velmi důležité jsou i perorální nutriční doplňky. Ty jsou definovány jako kompletní směsi všech potřebných živin určené k příjímání ústy (perorální cestou). Obsahují jak cukry, tuky a bílkoviny,tak i vitaminy, minerální látky a stopové prvky.
Jsou dostupné většinou v tekuté formě, určené k okamžitému použití formou popíjení po malých jednotlivých dávkách. Tato forma užívání je označována anglickým výrazem sipping (srkání, upíjení). K dispozici jsou také instantní práškové formy těchto přípravků.
Perorální nutriční doplňky přinášejí možnost výživy nemocným, u nichž se nedaří ani pomocí opakované dietní rady udržet perorální příjem a tělesnou hmotnost. Oproti běžné stravě mají tyto přípravky některé výhody.
V klinické praxi je dnes široká paleta tekutých přípravků různého složení k okamžitému použití. U většiny z nich je bílkovina mléčného původu a sacharidy jsou zastoupeny formou lehce stravitelných maltodextrinů, produktů částečné hydrolýzy škrobu. Přípravky také obsahují celé spektrum vitaminů a stopových prvků, a to v množství vyšším, než by odpovídalo obsažené energii. Jedno balení o objemu 200 ml běžného přípravku obsahuje třetinu doporučené denní dávky vitaminů a stopových prvků, zatímco obsah energie odpovídá jedné šestině klidové potřeby průměrného pacienta. Obsah minerálů v těchto přípravcích je relativně malý, takže při jejich zvýšené potřebě je nutné hradit je zvlášť.
K dispozici jsou i speciální přípravky uzpůsobené pro diabetiky, které však obvykle mají nižší obsah energie a bílkovin při vyšší ceně přípravku. Mají výhodu u diabetiků se sklonem k vyšším hodnotám krevního cukru, ale pro léčbu podvýživy jsou méně vhodné. U většiny diabetiků používáme pro prevenci a léčbu podvýživy běžné nediabetické přípravky. Pokud jsou užívány podle doporučení v malých opakovaných dávkách, nedochází ke zhoršení kompenzace cukrovky.
K dispozici jsou také přípravky se speciálním složením, zvýšeným obsahem bílkovin, vitaminů,zinku a selenu, určené k podpoře hojení. V poslední době se objevují také perorální nutriční supplementy s vysokým obsahem bílkovin a mikronutrientů k podpoře hojení. Velká většina nabízených tekutých přípravků pro sipping má sladké příchutě. K dispozici jsou také přípravky ve formě džusu, bez obsahu tuku. Pro nemocné, kteří odmítají sladkou chuť, lze využít chuťově neutrální verze výživ (bez příchuti). Slané varianty ve formě polévek se příliš neujaly, hlavně pro potřebu ohřívání.
Pokud nemocný netoleruje tekuté přípravky, mohou být vhodné doplňky v práškové formě. Jsou bez příchuti a mohou být rozpuštěny buď ve vodě, v tekutých potravinách, nebo je možno je přidávat do omáček, polévek a dalších součástí stravy při její přípravě.
Modulové přípravky obsahují pouze jednu hlavní živinu bez přídavku vitaminů či dalších složek výživy, opět v chuťově neutrální formě. Prášková forma čisté bílkoviny (Protifar pulvis) slouží k obohacení stravy o samotnou bílkovinu. Protifar je možno přidávat do jogurtu, různých kaší a nápojů, a to v celkovém denním množství asi 10 odměrek (25 g Protifaru denně). Prášková forma samotného sacharidu (Fantomalt pulvis) umožňuje zvýšit obsah energie ve stravě, a to ve formě polysacharidů z kukuřičného škrobu. Proto má téměř neutrální chuť a může být přidáván do jogurtu, nápojů i jiných součástí stravy.
Pro nemocné s obtížným polykáním je možno využít instantního zahušťovadla, které usnadní polknutí tekutin i stravy. Nutilis nebo Resource Thicken Up jsou instantní práškové přípravky na bázi kukuřičného škrobu. Jejich přidáním do tekutin či rozmixované stravy dochází k zahuštění d opodoby sirupu, krému nebo pudinku, které nemocnému usnadní polykání upravené potraviny.Takto je možno upravit hustotu i u tekutých nutričních doplňků.
První podmínkou úspěšné léčby perorálními nutričními přípravky je dobrá spolupráce nemocného. K dosažení účinku výživového doplňku je třeba, aby nemocný dodržoval zásady správného užívání a aby v této léčbě vytrval delší dobu, zpravidla nejméně několik týdnů, nebo i měsíců. Nutriční doplňky je třeba popíjet po malých porcích mezi jídly podle stanoveného rozpis u tak, aby výživa byla přijímána navíc nad rámec normální stravy, jako skutečné obohacení energií a živinami. Popíjení po malých porcích je zvláště důležité na začátku užívání, než nemocný zjistí, zda přípravek bude snášet.
U nemocných v dobrém stavu výživy, ale ohrožených podvýživou při onkologické léčbě, je možno využívat perorální nutriční příjem pouze občasně, vždy při nárazovém výpadku stravy,jaký se může dostavit při horečce, bolesti nebo jiných potížích. Takto využívaný nutriční doplněk slouží jako pohotový zdroj kvalitních živin.
Je nevhodné nutit se do příjmu této kvalitní výživy v době podávání chemoterapie nebo při úporné žaludeční nevolnosti, kdy se snadno vypěstuje na přípravek averze a nemůže být pak využit ani později. V konkrétním případě je třeba se poradit s lékařem nebo dietní sestrou a nebo výživu krátkodobě vyzkoušet.
Určitou nevýhodou perorálních nutričních doplňků je jednotvárnost chuti a konzistence v porovnání s normální stravou. Proto pro déletrvající užívání není doporučováno více než 400–500 ml výživy denně, což odpovídá přibližně jedné čtvrtině až jedné třetině běžné denní potřeby. Další podrobnosti o perorálních nutričních doplňcích získáte v části Péče o pacienta - Výživa během léčby.
Prognóza a prevence karcinomu plic
Prognóza nemocných závisí na rozsahu onemocnění (klinickém stadiu), klinickém stavu, přidružených nemocech a imunologickém stavu. Důležitý je údaj o hmotnostním úbytku a přítomnosti paraneoplastických příznaků. Nejlepší prognózu mají nemocní, u nichž byl nádor diagnostikován ve stadiu, kdy ho lze operovat. Prognóza nemocných s neoperabilním nádorem je i přes veškerou poskytovanou léčbu stále špatná.Základním problémem nádorů plic je to, že bývá diagnostikován pozdě, v době, kdy má takový rozsah, že chirurgická léčba, která doposud jako jediná může vést k uzdravení, není možná.Proto probíhá řada studií, které se zaměřují na význam vyšetření zaměřených na včasný záchyt nádorů plic. Vzhledem k tomu, že byla prokázána výrazná souvislost s kouřením, je v současné době výchova k nekuřáctví významným preventivním opatřením.
Benigní (nezhoubné) nádory plic
K nádorům benigním, pro které je charakteristický pomalý neinvazivní růst a neschopnost zakládání metastáz, patří chondrohamartomy, dále nádory mezenchymálního původu, jako jsou fibromy, lipomy, myxomy, myoblastický myom a další. Benigní nádory bývají zřídka příčinouobtíží. Jsou lokalizovány častěji v plicích než v dýchacích cestách, jsou obvykle okrouhlé, ostřeohraničené od okolní tkáně, často uložené periferně – těsně při hrudní stěně. Rostou velmi pomalu.V případě růstu ve velkých dýchacích cestách mohou být nádory přisedlé, nebo prorůstajícído průdušky, bývají i na stopce. Ve velkých dýchacích cestách bývají často lokalizovány adenomy,které mají často polypovitý vzhled.
Diagnostika benigních nádorů
Diagnostika nezhoubných nádorů se opírá o zobrazovací vyšetřovací metody a určení složení nádoru. Poměrně charakteristický je rentgenový obraz lipomu (tuk), chondromu (chrupavka)a chondrohamartomu (chrupavka a hrudkovité či morušovité kalcifikace), nebo osteomu (kostní tkáň). Ostatní benigní nádory nelze přesvědčivě diagnostikovat, bývají hladce nebo laločnatě konturované, mohou deformovat průdušky a vést i k nevzdušnosti části plíce. Jen vzácně dosahujívětších rozměrů. Nádory, které rostou do nitra průdušek, lze diagnostikovat bronchoskopicky.
Léčba benigních nádorů
Chirurgická léčba je nezbytná především u těch nezhoubných nádorů, jež rostou tak, že dochází k poruše průchodnosti dýchacích cest, a u drobných tumorů, které se nedaří jinak ověřit. V případěendobronchiálně rostoucích a především stopkatých nádorů je vhodná endobronchiálníléčba (v průběhu bronchoskopie) za pomoci laseru nebo elektrokauteru.
Pneumoonkologická pracoviště (pracoviště pro diagnostiku a léčbu nádorů plic) v České republice
Kvalitní onkologická péče o nemocné s karcinomem plic je možná pouze při zachování komplexnosti s přihlédnutím ke všem současným možnostem. V popředí každé zvolené léčebné strategie musí být především snaha o zlepšení kvality života. U všech onkologicky nemocných platí zásada, že musí být trvale sledováni. Základní diagnostikou a léčbou příznaků rakoviny plic i nezhoubných plicních nádorů se zabývají plicní oddělení a kliniky v rámci fakultních, krajských i městských nemocnic. Rozšířenou diagnostikou se zaměřením na doporučované léčebné postupy, cytostatickou léčbou a léčbou jejich komplikací i endobronchiální léčbou se zabývají pneumologická pracoviště, která jsou součástí komplexních onkologických center, jejichž seznam je uveden níže. Na těchto pracovištích je také prováděna vysoce specializovaná a nejnákladnější léčba plicní rakoviny. Specializovaným pneumoonkologickým pracovištěm je takové, na kterém pracuje pneumolog s atestací z klinické onkologie, pracoviště má specializovaná pneumologická lůžka, okamžitou dostupnost intenzivní péče pneumologické péče, pracoviště intervenční bronchologie se zázemím hrudní chirurgie, dostatečné diagnostické zázemí k přesnému stanovení diagnózy včetně molekulární diagnostiky, je schopno sledovat, hodnotit a předkládat výsledky nákladné léčby. Toto specializované pracoviště je součástí komplexního onkologického centra.
Pneumoonkologická centra:
- Klinika nemocí plicních a TBC, Fakultní nemocnice Plzeň, Dr. E. Beneše 13, 305 99 Plzeň-Bory
- Klinika pneumologie, Nemocnice na Bulovce Budínova 2, 180 00 Praha-Libeň
- Klinika nemocí plicních a TBC, Fakultní nemocnice Motol, V Úvalu 84, 150 00 Praha 5
- Pneumologická klinika, Fakultní Thomayerova nemocnice v Praze, Vídeňská 800, 140 59 Praha-Krč
- Klinika nemocí plicních, Fakultní nemocnice Hradec Králové, Sokolská 581, 500 05 Hradec Králové
- Klinika nemocí plicních a TBC, Fakultní nemocnice Brno-Bohunice, Jihlavská 20, 625 00 Brno
- Klinika plicních nemocí a TBC, Fakultní nemocnice Olomouc, I. P. Pavlova 6, 775 20 Olomouc
- Klinika nemocí plicních a TBC, Fakultní nemocnice Ostrava, 17. listopadu 1790, 708 52 Ostrava-Poruba
- Onkologická klinika, Všeobecná fakultní nemocnice v Praze, U Nemocnice 2, 128 08 Praha
- Masarykův onkologický ústav v Brně*, Žlutý kopec 7, 602 00 Brno
* Pracoviště sice nejsou zaměřena na diagnostiku a intervenční bronchologii, ale také poskytujívysoce specializovanou protinádorovou léčbu.
Použité zdroje:
- Linkos - Slovníček - Podpůrná léčba
- Linkos - Péče o pacienta - Výživa během léčby.
- http://www.svod.cz
- PEŠEK M. ET A KOL: Bronchogenní karcinom. Galén, Praha, 2002, 235 s.
- SKŘIČKOVÁ J, KOLEK V. A KOL: Základy moderní pneumoonkologie. Maxdorf, Praha 2012, 490 s., ISBN 978-80-7345-298-8.
- SKŘIČKOVÁ, J. Karcinom plic. In: Pneumologie. 2. vyd. Praha: Maxdorf s.r.o., 2014. s. 315-334
- SKŘIČKOVÁ J. Nádory plic. In: J. Tomášek. Onkologie – minimum pro praxi, vydavatel Axonite 2015, ISBN 978-80-88046-01-1, str. 172-185
- ZATLOUKAL, P., PETRUŽELKA, L.: Karcinom plic. Grada, Praha, 2001
Obrazová příloha