Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Analýza regulací v nádorech
Číslo abstraktu: 203
Autoři: MUDr. Jana Vaňková; Mgr. Diana Grochová; RNDr. Barbora Ravčuková; Miluše Svitáková; prof. RNDr. Jana Šmardová, CSc.
Mutace v genu p53, lze detekovat různými metodami, například funkční analýzou separovaných alel v kvasinkách („functional analysis of separated alleles in yeast“ – FASAY), která využívá schopnosti lidského proteinu p53 fungovat i v kvasinkových buňkách Saccharomyces cerevisiae, jako transkripční faktor a také reparačního mechanismu na principu homologní rekombinace („gap repair“), který se v kvasinkách uplatňuje. Transaktivační schopnost p53 odvozeného metodou RT-PCR z vyšetřované nádorové tkáně je testována pomocí reportérského genu ADE2, , kterému je předřazena sekvence z promotoru genu RGC, („ribosomal gene cluster“). Míra traskripční aktivity p53 je hodnocena podle zbarvení kvasinkových kolonií na selekčním médiu. Kvasinky exprimující funkční p53 tvoří na selekčním médiu bílé kolonie, kvasinky exprimující mutantní, nefunkční p53 tvoří na selekčním médiu menší červené kolonie (obr. 1). Metodou FASAY jsme schopni odlišit plně inaktivující mutace p53 (červené kolonie) od pouze částečně inaktivujících, například teplotně senzitivních mutací (růžové kolonie), a také podrobněji analyzovat detailnější funkční rozdíly mezi jednotlivými typy mutací p53 (2,3). Metodu FASAY využíváme již několik let k analýze stavu p53 v různých typech nádorů. Postupně jsme vytvořili soubor 22 teplotně závislých mutantů. Většina mutantů (19/22) je teplotně senzitivních (ts) ,, to znamená že jsou nefunkční při vyšší teplotě a jejich funkce se obnovuje se snižující se teplotou. Nalezli jsme také 3 chladově senzitivní (cs) , mutanty, jejichž funkce se naopak zvyšuje se zvyšující se teplotou. Všeobecně jsou teplotně závislé mutace považovány za vhodný genetický a molekulárně biologický nástroj pro studium funkcí mnoha genových produktů. Každý teplotně senzitivní mutant může v sobě skrývat teplotně závislý intramolekulární mechanismus, např. teplotně závislé konformační změny. V případě nádorového supresoru p53 je správná konformace proteinu nezbytná pro jeho správnou fyziologickou aktivitu.
Testovali jsme transaktivační schopnosti teplotně závislých mutantů p53 v kvasinkových buňkách, kde reportérskému genu ADE2, byly předřazeny sekvence z promotorů genů bax, p21 a RGC , (obr. 2).
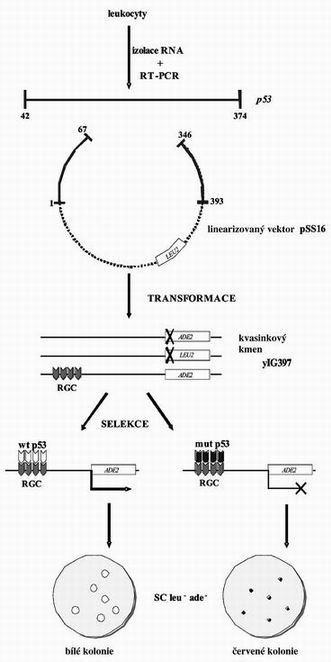
Obr. 1
Schéma metody FASAY. Z vyšetřovaného materiálu je izolována RNA a pomocí metody RT-PCR je amplifikována část genu p53, mezi kodóny 42 a 374. Kvasinkové buňky yIG397 jsou transformovány produktem PCR spolu s otevřeným expresním vektorem pSS16, který nese konce genu p53, a selekční marker LEU2,. Kvasinkový kmen yIG397 je leu-adea obsahuje reportérský gen ADE2, s předřazeným minimálním promotorem a vazebným místem pro p53. Buňky transformované plasmidem, který nese funkční p53, exprimují gen ADE2 a tvoří na selekčním mediu bílé kolonie. Buňky obsahující mutovaný protein p53 neexprimují gen ADE2, a tvoří na selekčním mediu menší červené kolonie v důsledku akumulace červeného meziproduktu syntézy adeninu.
Studovali jsme míru transaktivační schopnosti těchto variant p53 ve vztahu ke kultivační teplotě a jednotlivým responsibilním elementům. Zjistili jsme, že jednotliví teplotně závislí mutanti p53 se liší mírou své teplotní závislosti. To znamená, že teplota, při níž dochází k částečnému nebo úplnému obnovení transaktivační schopnosti p53, je u jednotlivých mutantů odlišná. Většina testovaných mutantů p53 se liší i mírou své aktivity na různých promotorech (bax, p21, RGC), mají tedy takzvaně diskriminující povahu.
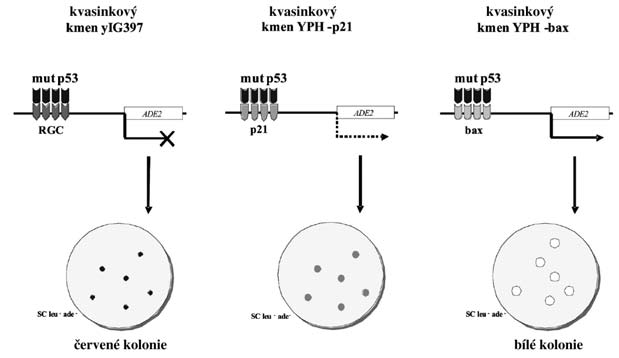
Obr. 2
Schéma sekvenčně specifické FASAY určené k detekci diskriminujících mutantů. Použité kvasinkové kmeny (yIG397, YPH-p21 a YPH-bax) se liší typem responzivního elementu, který je předřazen reportérskému genu ADE2,. Typ responzivního elementu v promotoru ovlivňuje míru exprese reportérského genu. V tomto případě je daný mutant p53 zcela nefunkční v kvasinkovém kmeni s responzivním elementem RGC (červené kolonie), částečně funkční v kmeni YPH-p21 (bílé kolonie) a plně funkční v kmeni YPH-bax (bílé kolonie). V případě jiného mutanta může nastat odlišná situace a docházet k diskriminaci jiných responzivních elementů.
Konformační stav teplotně závislých mutantů p53 v kvasinkách jsme studovali metodou imunoprecipitace pomocí konformačně specifických monoklonálních protilátek PAb1620 (rozeznává nativní konformaci proteinu p53) a PAb240 (specificky rozeznává mutantní konformaci proteinu p53) (4,5) (obr. 3).
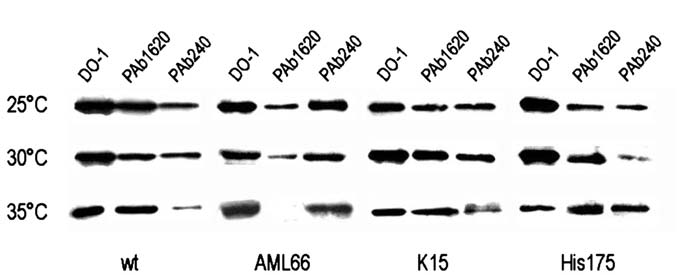
Obr. 3
Sledování teplotní závislosti konformačního stavu proteinů p53 v kvasinkách. Z kvasinkových buněk exprimujících analyzované varianty p53 a kultivovaných ve vyznačených teplotách byly připraveny proteinové lyzáty. Z nich byl pomocí specifické protilátky imunoprecipitován protein p53. K imunoprecipitaci byly použity kontrolní protilátka DO-1, která rozpoznává protein p53 nezávisle na jeho konformačním stavu, protilátka PAb1620, která specificky rozpoznává nativní konformaci, a protilátka PAb240, která rozpoznává mutantní konformaci p53. Uvedeny jsou kontrolní varianty p53: funkční protein p53 (wt), plně inaktivní mutant (His175) a dva příklady teplotně závislých mutantů p53: , ts mutanta E286K (AML66) a cs, mutanta P98A (K15).
Sledovali jsme také teplotní závislost konformačního stavu všech analyzovaných variant p53. Zjistili jsme, že konformační stav proteinu p53 je velmi závislý na teplotě, pří níž byly kvasinkové buňky exprimující daný typ mutantního proteinu p53 kultivovány. Jednotliví teplotně závislí mutanti p53 se ale výrazně liší podílem zastoupení nativní a mutantní konformace proteinu p53 a jeho teplotní závislostí.
Literatura,
1. Xirodimas DP, Lane DP. J. Biol. Chem. , 274(39) (1999) 28042-9.
2. Flaman JM, Frebourg T, Moreau V, Charbonnier F, Martin C, Chappuis P, Sappino AP, Limacher JM, Bron L, Benhattar J, Tada M, van Meir EG, Estreicher A, Iggo RD. Proc. Natl. Acad. Sci USA, 92 (1995) 3963-3967.
3. Schärer E, Iggo R. Nucl. Acid Res. , 20 (1992) 1539-1545.
4. Shiraishi K, Kato S, Han S-Y, Liu W, Otsuka K, Sakayori M, Ishida T, Takeda M, Kanamaru R, Ohuchi N, Ishioka C J. Biol. Chem. , 279(1) (2004) 348-55.
5. Cho Y, Gorina S, Jeffrey PD, Pavletich NP. Science, 265 (1994) 346-355.
Práce byla podpořena grantem IGA MZ ČR č íslo NR/8068-3. ,
Datum přednesení příspěvku: 13. 5. 2006





