Obsah:
Leukémie tvoří 30% zhoubných nádorů v dětském věku a jsou tak nejčastější malignitou ve věkovém období 1-15 let. U dospívajících mezi 15-19 lety se s germinálními nádory dělí o druhé místo za maligními lymfomy. Nejčastějším typem leukémie a tím i nejčastější malignitou v dětském věku je akutní lymfoblastická leukémie (ALL), která tvoří 80% všech leukémií a 25% dětských nádorů. Akutní myeloidní leukémie (AML) tvoří 15% leukémií, myelodysplastický syndrom (MDS) 5% a chronická myeloidní leukemie (CML) 2-3% leukémií. Incidence leukémie je v naší populaci 5 nových případů/100 000 dětí ve věku 0-18 let/rok. V praxi to znamená, že v České republice je ročně diagnostikováno přibližně 65 dětí s ALL, 12 dětí s AML, tři děti s MDS a jedno dítě s CML.
Etiologie a patogeneze
ALL se u dětí svými biologickými vlastnostmi liší od ALL dospělých. Vrcholem výskytu je období mezi 2-5 lety života. Batolata a předškolní děti mají ve velké většině případů nalézány v leukemických buňkách charakteristické chromozomální změny – více než 50 chromozomů nebo nález fúzního genu ETV6-RUNX1, produktu nejčastější translokace nacházené u dětské ALL – t(12;21). Výsledky léčby jsou v této věkové kategorii velmi dobré a jsou to právě tyto děti, které pozitivně ovlivňují výsledky léčby ALL jako celku. Jsou doklady, že právě v této věkové kategorii výskyt leukémie v posledních 20 letech v České republice stoupl.
Téměř všechny leukémie u dětí mají prokazovány změny počtu a/nebo struktury chromozomů v nádorové krvince, což je dokladem teorie vzniku leukémie jako důsledku opakovaného poškození chromozomální výbavy normálního prekurzoru lymfocytu. První změny mohou nastat již v nitroděložním životě, k vzniku leukémie ale samy o sobě nestačí. Příčinou dalších chromozomálních změn mohou být běžné virové a bakteriální infekce. ALL u dětí se tak dle této hypotézy jeví jako abnormální odpověď organizmu na běžné infekce. Oporou prenatálního vzniku prvního poškození buňky je průkaz stejných chromozomálních změn při diagnóze dítěte například v 5 letech života a při zpětném vyšetření (backtracking) Guthrieho kartiček s krví odebranou při skríninku novorozenců. Je-li teorie o prenatálně vzniklé „predispozici“ k leukémii platná pro všechny děti není zatím prokázáno. Je pravděpodobné, že různé chromozomální změny mají různou schopnost indukovat vznik nádorového bujení. Fúzní geny, produkty strukturálních odchylek chromozomů, poškozených endogenními i exogenními faktory, způsobují nádorové bujení zvýšením exprese („zapnutím“) onkogenů a snížením exprese („vypnutím“) tumor supresorových genů. Důsledkem je porušení funkce buněčných drah, které přináší do jádra podněty zevního prostředí obklopujícího buňku, zástava diferenciace buňky při zachovalé či zvýšené schopnosti proliferace, vznik klonální populace buněk vzniklých z jedné poškozené buňky, nesoucí s mateřskou krvinkou stejnou povrchovou výbavu (fenotyp) a stejné chromozomální změny (genotyp). Výzkum molekulární biologie buňky je v posledních letech opakovaně oceňován Nobelovou cenou. Pokroky jsou úžasné a dávají naději na změnu našich léčebných postupů – úspěšnou snahu ovlivňovat buněčné pochody související s nádorovým bujením. Příkladem této „cílené léčby“ je preparát imatinib který vzbudil oprávněné naděje pacientů s CML na vyléčení před několika lety. Tento lék blokuje konstitučně vzniklou tyrosin kinázovou aktivitu fusního onkogenu BCR/ABL vazbou na ABL kinázu, jejímž důsledkem je inhibice schopnosti ABL přenášet fosfát k proteinům zajišťujícím přenos signálu v buňce. Buňka přestává proliferovat a podléhá buněčné smrti (apoptóze). Tento lék se úspěšně uplatňuje i v léčbě obávané ALL s nálezem Filadelfského chromozomu. Na vývoji nových léků vstupujících do patogeneze nádorového bujení na úrovni buněčných drah se intenzivně pracuje a řada z nich je již ověřována v klinických studiích I., II. i III. etapy u pacientů. V současnosti je do standardní léčby relapsu ALL zařazena monoklonální protilátka blinatumomab v kombinaci s chemoterapií a její efekt v léčbě iniciální ataky leukémie ověřujeme randomizovanou studií. V léčbě relapsu AML se uplatňuje monoklonální protilátka gemtuzumab ozogamicin, rovněž v kombinaci s chemoterapií. Nicméně nezdá se reálné, že by chemoterapie byla v blízké budoucnosti zcela nahrazena cílenou léčbou. Léky blokující produkty onkogenů jsou pouze dalším stupněm k úspěchu v boji s maligními nádory. „Definitivní“ léčba malignity se může odehrávat pouze na úrovni změny genetické odchylky k nádoru vedoucí. Genová terapie opravující poškozené geny je v onkologii předmětem výzkumu již více než desetiletí, praktické pokroky zatím nejsou velké.
Akutní lymfoblastická leukemie
Diagnóza
Horečka či subfebrilní teploty k leukémii patří, mohou být způsobeny interkurentní, většinou banální infekcí, ale bývají i důsledkem nadměrné sekrece cytokinů nádorovými buňkami. Klasická „leukemická trias“ – krvácení do kůže a sliznic, zvětšení jater a sleziny a zvětšení mízních uzlin, se vyskytuje při diagnóze asi u jedné třetiny pacientů. Bolesti kostí, typicky střídavě postihující dolní končetiny, rameno, ale i páteř, mohou dokonce způsobit, že dítě odmítá chodit a je podrobováno řadě ortopedických a revmatologických vyšetření. Krevní obraz, je-li proveden, často v této situaci neobsahuje leukemické buňky a změny jsou diskrétní (mírná anemie, leukopenie, trombocytopenie) jsou-li vůbec. Častěji se změny v krevním obraze vyvíjí až v čase. Pro tuto leukémii je používán název „doutnající“ leukémie, dokládající její vývoj v čase týdnů i měsíců. Včas provedená aspirace kostní dřeně (což je spíše výjimkou) prokazuje pomalý nárůst leukemického klonu se zvyšujícím se podílem nádorových krvinek v diferenciálu kostní dřeně.
Protože významné zvětšení jater a sleziny není u dětské leukémie pravidlem a krevní obraz vykazuje častěji snížený počet krvinek než leukocytózu, stojí v diferenciální diagnóze leukémie aplastická anemie, ale i imunní trombocytopenická purpura či naopak maligní lymfom při zvětšení mízních uzlin a rozšíření mezihrudí. Je nutno zdůraznit, že rozlišení nehodgkinských lymfoblastických lymfomů a ALL je často pouze arbitrážní na podkladě procenta blastů v kostní dřeni (> 25% blastů = leukémie, < 25% blastů = lymfom), protože biologické chování obou malignit je velmi obdobné. Rovněž léčba není zásadně odlišná.
Stanovení správné diagnózy a přesného podtypu leukémie je spolu s odbornou úrovní ošetřujícího lékařského týmu hlavním prognostickým faktorem úspěchu léčby. Obecně platí, že ve fenotypu ALL je nutné odlišit leukémii z prekurzorů B lymfocytů (BCP-ALL, 85% všech ALL) a T lymfocytů (15%). T-ALL se léčí intenzivněji, má sklon k vzniku časných relapsů a leukemické infiltraci mozku. Klíčovým prognostickým faktorem je genotyp leukemické buňky. Některé podtypy leukémie (u dětí relativně vzácné), jako je například ALL s Filadelfským chromozomem (Ph+ALL) či MLL+ALL (postihuje 80% kojenců s leukémií) mají nepříznivou prognózu a jsou léčeny podle velmi intenzivních schémat. V léčbě Ph+ALL se v současnosti úspěšně uplatňuje imatinib v kombinaci s chemoterapií. Situaci odběru dostatečného množství biologického materiálu pro výše uvedená vyšetření někdy komplikuje sklon dětských ALL k „suchým“ punkcím kostní dřeně, kdy se dostatek buněk získává jen obtížně. Nicméně přesné stanovení podtypu leukémie je imperativem a proto v České republice existuje systém referenčních laboratoří morfologie, průtokové cytometrie, cytogenetiky a molekulární genetiky, které provádí některá specializovaná vyšetření či potvrzují diagnózu „druhým čtením“.
Dalším významným prognostickým faktorem je časná odpověď na léčbu (obecně platné pravidlo v onkologii), kterou hodnotíme u ALL úbytkem blastů v periferní krvi po týdenním izolovaném podávání prednizonu v kombinaci s jednou intratekální aplikací metotrexátu a mizením blastů z kostní dřeně, provedené za dva týdny od zahájení léčby. Děti s pomalou redukcí nádorové masy (pomalí respondeři) tvoří u ALL relativně malou skupinu pacientů (cca 15%) se špatnou prognózou v důsledku zvýšeného rizika relapsů. Citlivější metodou hodnocení časné odpovědi na léčbu je detekce minimální residuální nemoci (MRN) v kostní dřeni molekulárními metodami za 1 a 3 měsíce od zahájení chemoterapie.
Léčba
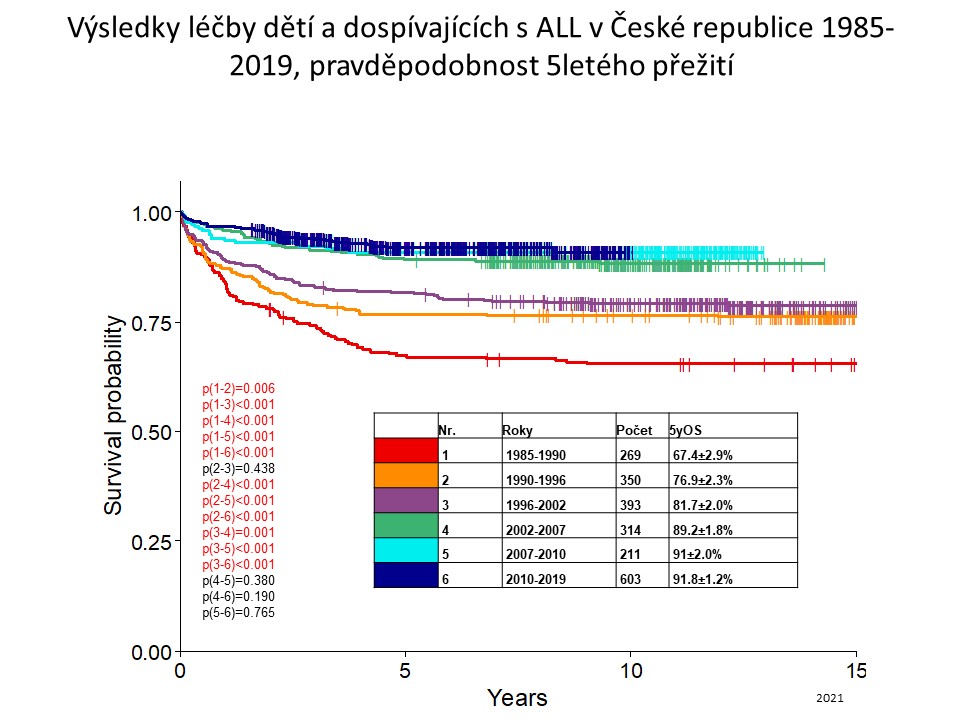
ALL u dětí je chemosenzitivní nemoc a kombinovaná chemoterapie dosahuje remise (vymizení blastů z kostní dřeně a mimodřeňových prostor) u 99% dětí, přežití bez relapsu nemoci (EFS = event-free survival = přežití do selhání) ř 80-85% a celkového přežití 90%. Neustále se zlepšující výsledky léčby dětí s ALL v České republice jsou zobrazeny na grafu 1. Šedesátiprocentní naděje na vyléčení v druhé polovině osmdesátých let se změnila na devadesátiprocentní šanci v současnosti. Cytostatika způsobují různými mechanismy apoptózu leukemických blastů. Nejúčinnějšími léky jsou kortikoidy (prednizon a dexametazon), vinkristin, antracyklinová cytostatika (daunorubicin a doxorubicin), asparagináza, cyklofosfamid, cytosin arabinosid, metotrexát a merkaptopurin. Chemoterapie trvá obvykle dva roky. Intenzivní léčba se skládá z měsíc trvající indukce remise, následuje její několikaměsíční konsolidace, pozdní reindukce (obdoba indukce) a udržovací léčba kombinací merkaptopurin a metotrexát. Prevencí leukemické infiltrace mozku jsou opakované intratekální aplikace metotrexátu do mozkomíšního moku a ozáření krania, které se používá u dětí s nejvyšším rizikem vzniku této komplikace (cca 5% pacientů s iniciální infiltrací CNS, T-ALL a vysokou leukocytózou nad 100x109/l).
Děti s ALL se dělí podle genetických změn blastů a časné odpovědi na léčbu do rizikových skupin standardního, středního a vysokého rizika. Děti standardního rizika potřebují méně intenzivní léčbu než děti vyšších rizik. Děti s nejméně příznivou prognózou (šance na vyléčení chemoterapií méně než 50%) jsou indikovány k transplantaci kostní dřeně v první remisi. Současné léčebné protokoly řídí léčbu pacientů podle výše MRN hodnocené v kostní dřeni v prvních třech měsících léčby. MRN je stanovena polymerázovou řetězovou reakcí detekcí pacient specifických leukemických „otisků prstů“ – přestaveb imunoglobulinových řetězců a T buněčných receptorů a detekcí s leukémií asociovaných aberantních molekul na povrchu blastů průtokovou cytometrií. Pomalý ústup MRN řadí pacienty do vysokého rizika, naopak rychlé mizení MRN je podnětem ke kontrolovanému snížení intenzity léčby.
Nejlepších výsledků léčby dosahují děti mezi 2-10 lety s BCP leukémií, které mají šanci na vyléčení více než 90% a tím pozitivně ovlivňují celkové výsledky léčby ALL, protože tvoří 70% dětí s ALL. 65% z nich má ETV6-RUNX1+ALL nebo hyperdiploidii nad 50 chromozomů s šancí na vyléčení 95%. Tyto formy leukémie jsou u dětí mladších dvou let nebo starších deseti let výjimečné, a proto jsou jejich výsledky léčby významně horší (kojenci mají přežití cca 50%, děti s Ph1+ALL 60-70%, dospívající starší 15 let přežití 70%). Děti s T-ALL mají v současné době již téměř stejné výsledky léčby jako děti s BCP-ALL. V minulosti měly více dřeňových i mimodřeňových relapsů. Děti s Ph1+ ALL kombinují chemoterapii s „cílenou léčbou“ inhibitorem tyrosinkinázy imatinibem, tak úspěšným v léčbě chronické myeloidní leukémie.
Současná léčba dětí s ALL probíhá v České republice v mezinárodní studii AIEOP-BFM ALL 2017 spoluprací národních leukemických skupin Itálie, Německa, Rakouska, Švýcarska, České republiky, Slovenska, Izraele a Austrálie. Jednotný léčebný přístup se společnou databází umožní zařazení 1500 pacientů do studie ročně.
Řazení pacientů do rizikových skupin je i nadále prováděno měřením minimální zbytkové nemoci v průběhu počáteční léčby. Poprvé jsou k této rizikové stratifikaci a léčebným rozhodnutím využity výsledky genomických metod. Chemoterapie je formou randomizované studie kombinována s imunoterapií – monoklonální protilátkou blinatumomabem. Tento lék prokázal velmi nadějné výsledky v léčbě pacientů s pokročilými stádii leukémie, a proto je formou randomizované studie zařazen do iniciální léčby pacientů vyššího a vysokého rizika. Cílem bude snížit nepříznivé akutní vedlejší účinky léčby při zachování/zlepšení jejích výsledků.
Odlišná biologie ALL dospělých má za následek horší výsledky léčby. Srovnání výsledků léčby dospívajících mezi 15-19 lety protokoly aplikovanými v pediatrických a dospělých hematologických centrech vyznělo příznivě pro léčebné přístupy pediatrické a proto se v současnosti mladší dospělí až do 50 let věku léčí schématy vycházejícími z pediatrických protokolů.
Relaps leukémie postihuje v současné době 12-15% dětí. Nejčastější je izolovaný nebo kombinovaný (spolu s CNS nebo testikulární infiltrací) relaps kostní dřeně, méně častý je izolovaný relaps v centrálním nervovém systému (nejčastěji v podobě leukemické infiltrace mozkomíšních plen – meningosis leucemica) nebo ve varlatech. Důvodem těchto mimodřeňových projevů leukémie je existence hematoencefalické a hematogonadální bariéry, přes které cytostatika pronikají v nedostatečných koncentracích. Intenzivní chemoterapie včetně vysokých dávek metotrexátu, četné intratekální aplikace metotrexátu (15-20 v průběhu intenzivní léčby) a ozáření mozku u pacientů nejvyššího rizika výskyt těchto komplikací snižují. Pacienti s časným relapsem do 6 měsíců od vysazení léčby mají malou šanci na vyléčení chemoterapií a hlavní roli v jejich léčbě hraje transplantace kostní dřeně. Pacienti s pozdními relapsy více než 6 měsíců od skončení léčby mají šanci na vyléčení i chemoterapií a o volbě léčebného postupu rozhoduje časná odpověď na léčbu. V léčbě relapsu se začaly uplatňovat monoklonální protilátky, které se kombinují s chemoterapií.
U ALL provádíme většinu léčby ambulantním způsobem. Pacient je propuštěn do domácí péče krátce po zavedení dlouhodobého centrálního žilního katetru (CŽK) a úspěšné iniciální redukci zvýšené nádorové masy (riziko renálního selhání a metabolického rozvratu). Děti přicházejí k ambulantní léčbě chemoterapií, intratekální aplikaci léků a transfusím v častých intervalech. Některé fáze protokolu (zejména léčba vysokého rizika) je nutné provádět při hospitalizaci. Důsledkem chemoterapie je snížená obranyschopnost, selhání kostní dřeně s pancytopenií a poškození tkání obsahujících rychle se dělící buňky jako jsou například sliznice. Riziko exogenní a endogenní infekce je značné, proto jsou rodiče dětí poučeni o nutnosti dostavit se do 2 hodin od vzestupu teploty přes 380C k přijetí a zahájení intravenózní léčby širokospektrými antibiotiky. Důvodem je vysoké riziko sepse u pacientů v neutropenii (neutrofily < 500/µl krve). Snahou snížit riziko infekce jsou vedena dietní doporučení dětem léčeným intenzivní chemoterapií – vynechat čerstvou zeleninu, mléčné výrobky s obsahem živých kultur, i většinu čerstvého ovoce. Po skončení intenzivní léčby (cca po 8–10 měsících) navazuje již méně intenzivní léčba udržovací (kombinací dvou perorálních cytostatik merkaptopurinu a metotrexátu), intervaly kontrol se prodlužují, funkce imunitního systému se zlepšuje, dítě (ale i rodina) se „vrací do života“ (návrat do školy, do kolektivu dětí, uvolnění diety, vynětí CŽK atd.). Přesto po celou dobu chemoterapie i po jejím bezprostředním skončení (do 6 měsíců po léčbě) je nutné zachovat maximální ostražitost a rychlé reakce na počínající infekci. Děti užívají preventivně po celou dobu udržovací léčby cotrimoxazol dva dny v týdnu v prevenci Pneumocystové pneumonie. Rodiče jsou poučeni, aby v případě kontaktu s varicelou (tj. od 2 dnů před výsevem do krust) ihned nahlásili tuto skutečnost lékaři. Riziko infekce sníží aplikace imunoglobulinu se zvýšeným obsahem protilátek proti viru neštovic (Varitect) a aplikace acikloviru per os od 7. do 21. dne inkubační doby (do 2 let 200 mg/4x denně, 2-6 let 400 mg/4x denně, nad 6 let 800 mg/4x denně). Při úrazu dodržujeme zásady protitetanové prevence. Běžná očkování zahajujeme více než 6 měsíců po skončení chemoterapie (2,5 roku od diagnózy). Doporučujeme pravidelné očkování proti chřipce každý podzim.
Časné a pozdní následky léčby
Významnou součástí léčby dítěte s leukémií jsou antracyklinová antibiotika (daunorubicin, doxorubicin). Daní za jejich účinnost je riziko pozdní kardiotoxicity, která je většinou subklinická a postihuje 5-10% dětí déle než 5 let od diagnózy. Elbl prokázal patologické hodnoty frakčního zkrácení (< 30%) při vyšetření klidovou echokardiografií u 8% českých dětí léčených kumulativní dávkou antracyklinů 240 mg/m2 (medián), což je běžná dávka u dětí s ALL.
Růst dětí je opožděn v průběhu intenzivní léčby, po jejím skončení děti rychle deficit doženou a konečná tělesná výška je většinou normální. Vysoké preventivní dávky ozáření (24 Gy), způsobující poruchy hypotalamo-hypofyzární osy, ale i vyšší výskyt nádorů mozku, byly již v moderních protokolech opuštěny. Obezita u dětí vyléčených z leukémie není vzácností. Bezprostředně ji způsobují kortikoidy, v dlouhodobém efektu se na ní podílí nižší pohybová aktivita onkologicky léčených dětí. Rekreační sport je u těchto dětí vhodné doporučovat a podporovat. Osteoporóza může být přítomna již při diagnóze leukémie a být tak příčinou patologických zlomenin, chemoterapie (a zejména kortikoidy) její výskyt v průběhu léčby dále zvyšují. Vyšetření kostní denzity při diagnóze a po skončení intenzivní léčby provádíme rutinně u všech pacientů. Je vodítkem pro léčebná a dietní doporučení (zvýšený přísun kalcia, vitamin D). Léčbu bifosfonáty zatím zahajujeme výjimečně v situaci patologických zlomenin zejména obratlů. U 10-20% dospívajících s leukemií vzniká aseptická nekróza postihující nejčastěji nosné kosti (kyčel, koleno). Projeví se bolestí typicky ve fázi udržovací léčby po skončení chemoterapie. Diagnóza je rentgenologická, léčbou klidový režim, výjimečně jsou nutné operativní zákroky (umělá náhrada kyčelního kloubu). Přibližně u 20% dětí se v průběhu léčby kortikoidy a cytostatikem asparaginázou rozvíjí přechodný steroidní diabetes mellitus, vyžadující dietní opatření a ne vzácně léčbu insulinem. Rodiče jsou poučeni o nutnosti pravidelných kontrol glykosurie u dětí na této léčbě. Dlouhodobě zavedený centrální žilní katetr je rizikovým faktorem vzniku žilních trombóz. Poškození zárodečných pohlavních žláz není při běžné chemoterapii pravidlem. Dospívající děvčata mají vyšší riziko rozvoje hypergonadotropního hypogonadismu a proto jsme zavedli preventivní hormonální terapii uvádějící gonády do klidové fáze, méně citlivé vůči chemoterapii. Zničení pohlavních buněk a snížení produkce testosteronu je pravidlem u chlapců, léčených pro leukemickou infiltraci varlat ozářením. Plodnost chlapců je obecně v důsledku chemoterapie více ohrožena než u děvčat a proto doporučujeme u chlapců starších 14 let sběr a zamražení semene před zahájením léčby.
Akutní myeloidní leukemie
Léčba akutní myeloidní leukémie je intenzivnější, přesto ale méně úspěšná než léčba ALL. Děti stráví v nemocnici většinu intenzivní léčby, což je přibližně prvních 6 měsíců od diagnózy. Udržovací léčba se u AML neuplatňuje. Vyléčit se daří 75% pacientů. I u této diagnózy hraje významnou roli molekulární genetika a detekce minimální reziduální nemoci pro určení rizika nepříznivého průběhu. Vyšetření všech pacientů při diagnóze pomáhá odhalit pacienty s „příznivými“ chromozomálními změnami, kteří mají značnou naději na vyléčení chemoterapií a naopak průkaz prognosticky nepříznivé genetické změny a/nebo vysoká hladina minimální reziduální leukémie po skončení indukční léčby jsou pro dítě indikací k transplantaci krvetvorných buněk v první remisi, která je realizována častěji než je tomu u ALL. Riziko pozdních následků je zde vyšší než u ALL. V léčbě relapsu AML se uplatňuje kombinace chemoterapie s monoklonální protilátkou gemtuzumab ozogamicin, všechny děti jsou indikovány k transplantaci.
Akutní promyelocytární leukémie (APL) tvoří u dětí 10-15% AML, v České republice jsou diagnostikovány 2 děti ročně. Pacienti standardního rizika s leukocyty ˂ 10x109/l jsou léčeni kombinací kyseliny all-trans retinové (ATRA) v dávce 25 mg/m2/den a oxidu arzenitého (ATO), která dosahuje excelentních léčebných výsledků při významném snížení akutní a pozdní toxicity (kardiotoxicita). Šance na vyléčení stoupla při této léčbě na více než 90%. U pacientů vysokého rizika s leukocyty ≥ 10x109/l ověřujeme v mezinárodní studii efekt gemtuzumab ozogamicinu přidaného ke kombinaci ATRA+ATO.
Chronická myeloidní leukemie
Onemocnění je u dětí vzácné a postihne v České republice ročně 1-2 děti a dospívající ve věku 0-18 let. Typickým prvním projevem nemoci je zvětšující se obvod břicha v důsledku zvětšené sleziny. V krevním obraze se nachází významná leukocytóza, často s trombocytózou. Léčeba dětí se neliší od doporučených postupů pro dospělé. Transplantace kostní dřeně ustoupila do pozadí a indikována je výjimečně při selhání léčby tyrozinkinázovými inhibitory.
Myelodysplastický syndrom
Jedná se o heterogenní skupinu onemocnění, dělících se na refrakterní cytopenii, refrakterní anemii s excesem blastů, refrakterní anemii s excesem blastů v transformaci a juvenilní myelomonocytární leukemii (JMML). S výjimkou JMML je spojuje nález periferní cytopenie při zvýšeně buněčné kostní dřeni (neefektivní krvetvorba) s nálezem dysplastických morfologických změn krvinek a častým nálezem monosomie 7. chromozomu v cytogenetickém vyšetření. Děti s refrakterní cytopenií mají častěji sníženou buněčnost kostní dřeně. Stanovení diagnózy není vždy snadné a může vyžadovat delší dobu sledování a opakovaná vyšetření. Část dětí s MDS má vrozenou predispozici pro rozvoj tohoto onemocnění způsobenou mutací rizikových genů (GATA2, SAMD9/L) v zárodečných buňkách. MDS s excesem blastů u dětí poměrně časně progreduje do akutní leukémie. Léčbou je transplantace kostní dřeně, která vyléčí 70% pacientů. Děti s refrakterní cytopenií mohou být úspěšně léčeny imunosupresivní léčbou antitymocytárním globulinem a cyklosporinem A. JMML postihuje velmi malé děti, kojence a batolata, je charakterizována zvýšeným počtem bílých krvinek s vyplavováním jejich nezralých stadií z kostní dřeně a velikou slezinou. Včasná transplantace krvetvorných buněk je pro většinu pacientů jedinou nadějí na vyléčení. Obávanou komplikací JMML je potransplantační relaps.
Downův syndrom a myeloidní malignity
Děti s morbus Down mají ve věku 0-4 roky 56x vyšší riziko vzniku leukémie než děti zdravé. Vyšší výskyt leukémie je popisován až do věku 15 let, dále je již riziko stejné jako v normální populaci. Pro nejmenší děti s morbus Down je typický výskyt dvou krevních onemocnění. Nejméně 10% dětí má po narození projevy transientní myeloproliferativní reakce charakterizované anemií, trombocytopenií a zvýšeným počtem blastů v periferní krvi a kostní dřeni, které jsou původem z megakaryocytů. Tato přechodná leukemická reakce odezní, většinou bez léčby, v průběhu několika týdnů až měsíců. Třicet procent těchto dětí vyvine s odstupem měsíců i let akutní megakaryocytární leukémii, která postihuje i děti bez této neonatální reakce. Na rozdíl od jinak zdravých dětí s AML je tato myeloidní forma leukémie velmi dobře léčitelná chemoterapií s redukovanými dávkami některých cytostatik. Šance na vyléčení je 90%, neléčená nemoc je smrtelná. Děti s Downovým syndromem a jinými formami AML než je megakaryocytární leukémie nebo s ALL mají naopak prognózu horší než děti zdravé, protože mají vyšší riziko úmrtí na toxické komplikace léčby i horší léčebnou odpověď.
Literatura u autora
Prof. MUDr. Jan Starý, DrSc.
Klinika dětské hematologie a onkologie UK 2.LF a FN Motol
V úvalu 84
150 06 Praha 5
e-mail: jan.stary@lfmotol.cuni.cz