25.1 Diferencovaný karcinom štítné žlázy
Papilární karcinom představuje 40–80 % a folikulární karcinom 15 % tyreoidálních malignit.
Léčba diferencovaných karcinomů je chirurgická s následnou terapií radiojódem 131I v hluboké hypotyreóze nebo po předchozí stimulaci thyreotropinem alfa, která vede ke snížení výskytu lokoregionálních relapsů a zlepšuje celkové přežití.
Po operaci je nutná terapie hormony štítné žlázy v tzv. supresních dávkách, jejíž délka závisí na stratifikaci rizika tumoru vstupně a také po léčbě.
25.1.1 Lokoregionální relaps/metastatické onemocnění
Vždy je nutno zvážit kombinaci chirurgické léčby a terapii radiojódem. U resekabilních metastáz upřednostňujeme jejich chirurgické odstranění před následnou léčbou 131I.
V případě radiojód rezistentního onemocnění lze použít následující postupy:
• observace u asymptomatického, pomalu progredujícího postižení,
• chirurgický výkon,
• v případě metastáz do CNS neurochirurgický výkon,
• zevní RT, event. stereotaktická RT,
• paliativní lokoregionální léčba – RFA, embolizace,
• generalizované, progredující a/nebo symptomatické onemocnění:
• cílená léčba – lenvatinib, sorafenib, cabozantinib (viz níže),
• selpercatinib – v případě přítomnosti RET fúze,
• NTRK inhibitory – larotrektinib, entrectinib
• doplnění vyšetření NGS (next generation sequencing) dle klinického stavu a po konzultaci na multidisciplinárním týmu.
25.1.2 Systémová léčba
V léčbě 1. a 2. linie je nutno na prvním místě zvažovat léčbu TKI – sorafenib, lenvatinib.
V další linii po předléčení 1-2 TKI je možno indikovat cabozantinib.U pacientů se zjištěnou RET-fúzí je možno indikovat též selpercatinib po předchozí léčbě sorafenibem a/nebo lenvatinibem.
25.1.3 Zevní radioterapie je indikována u tumorů neakumulujících radiojód jako
• adjuvantní nebo kurativní léčba,
• paliativní RT.
25.2 Medulární karcinom štítné žlázy
Tvoří 8 % malignit štítné žlázy. Vyskytuje se ve formě sporadické, familiární nebo v rámci syndromu MEN 2 (syndrom mnohočetné endokrinní neoplazie typ 2). U familiární formy a MEN 2 je indikováno genetické vyšetření (mutace RET protoonkogenu), včetně vyšetření rodiny v přímé linii. Při podezření na MEN 2 je nutno diagnostikovat případný feochromocytom, hyperparatyreózu apod.
Terapie je chirurgická. Nádory neakumulují radiojód.
Kalcitonin je velmi specifickým i senzitivním onkomarkerem pro MTC, z dalších laboratorních parametrů stanovujeme kalcemii a CEA. Nedetekovatelné sérové hladiny kalcitoninu a CEA po operaci jsou známkou kompletní remise onemocnění. Jejich zvýšení je naopak prediktorem progrese onemocnění.
Po operaci je nutná celoživotní substituční terapie hormony štítné žlázy.
25.2.1 Lokoregionální relaps/metastatické onemocnění
• observace u asymptomatického, pomalu progredujícího postižení,
• chirurgický výkon,
• v případě metastáz do CNS neurochirurgický výkon,
• zevní RT, event. stereotaktická RT,
• terapie MIBG u pacientů s kumulací radiofarmaka v nádorové tkáni,
• generalizované, progredující a/nebo symptomatické onemocnění,
• cílená léčba případě přítomnosti RET mutace – selprecatinib, vandetanib, cabozantinib (viz níže),
• paliativní chemoterapie – dacarbazin,
• doplnění vyšetření NGS (next generation sequencing) dle klinického stavu a po konzultaci na multidisciplinárním týmu.
25.2.2 Systémová léčba
V 1. linii léčby je indikována cílená terapie TKI – selpercatinib, vandetanib, cabozantinib.
Neoadjuvantní ani adjuvantní chemoterapie není indikována. Paliativní chemoterapie má velmi omezenou účinnost, v případě progrese onemocnění po aplikaci cílené léčby lze podat dacarbazin.
25.2.3 Zevní radioterapie
• adjuvantní RT,
• paliativní RT.
25.3 Nediferencovaný (anaplastický) karcinom štítné žlázy
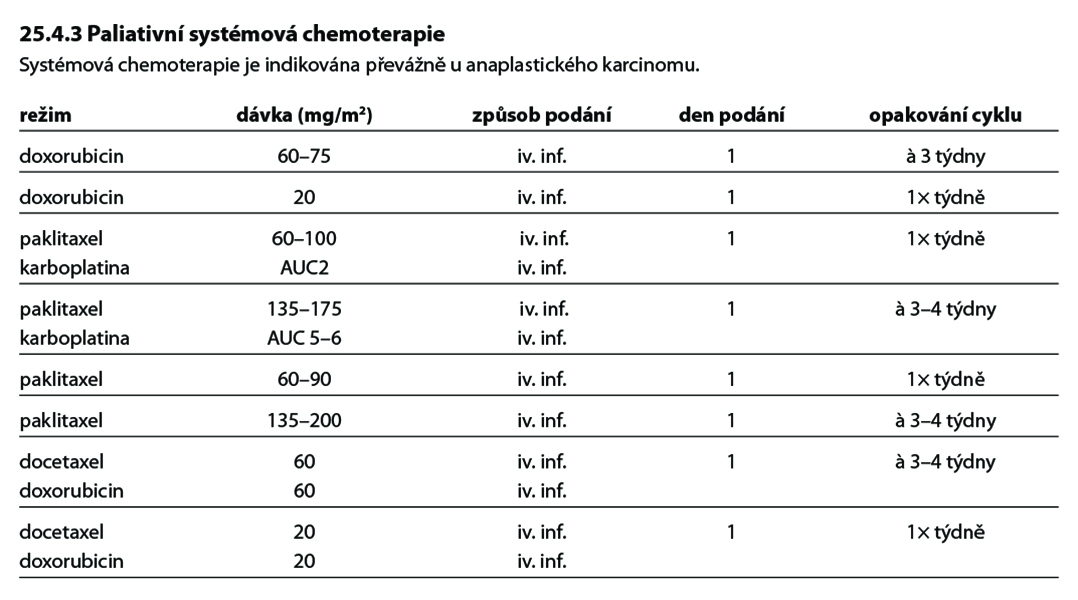
Jedná se o nejméně častý, avšak velmi agresivní typ nádoru štítné žlázy. Téměř u 50% pacientů jsou vstupně přítomny vzdálené metastázy. Neexistuje žádná dlouhodobě efektivní léčba ani jednotné léčebné schéma. V léčbě anaplastického karcinomu je léčbou volby zevní radioterapie a chemoterapie na bázi antracyklinů, taxanů nebo platinových derivátů. Chirurgická léčba je indikována často jen za účelem zprůchodnění dýchacích cest. Celkové přežití se pohybuje kolem 6–24 měsíců.
U této diagnózy je vhodné zvažovat doplnění vyšetření NGS (next generation sequencing) dle klinického stavu a po konzultaci na multidisciplinárním týmu.
25.3.1 Lokoregionální onemocnění
• v případě možnosti R0/R1 resekce chirurgický výkon, následně pooperační RT a CHT na bázi antracyklinů a/nebo taxanů (zahájení nejlépe do 3 týdnů od operačního výkonu),
• v případě neresekabilního postižení nebo u předpokládané R2 resekce – kombinace RT a CHT
25.3.2 Metastatické onemocnění
• paliativní chirurgický výkon,
• systémová paliativní chemoterapie,
• nádory s NTRK fúzí – larotrectinib, entrectinib
• paliativní RT.
25.4 Léčebná schémata u lokálně pokročilého a metastatického onemocnění
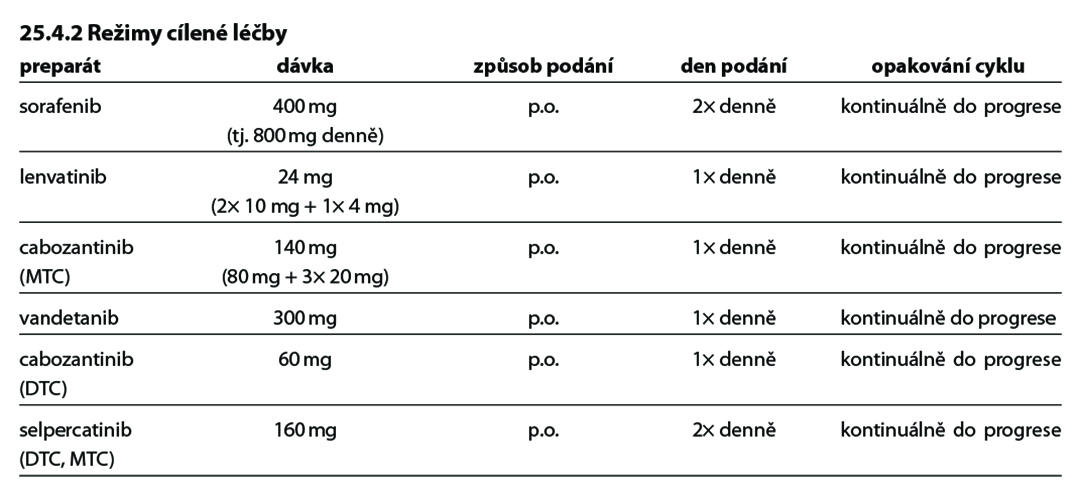
25.4.1 Cílená léčba
25.4.1.1 Lenvatinib
Lenvatinib je multikinázový inhibitor (VEGFR, FGFR, PDGFR, RET, KIT), který je indikován k léčbě diferencovaného karcinomu štítné žlázy (1). V registrační studii SELECT bylo dosaženo významné prodloužení doby do progrese onemocnění oproti placebu (19 měsíců oproti 3,6 měsícům). Míra odpovědi na léčbu lenvatinibem činila 65 %.
Indikace dle SPC
Lenvatinib je hrazen v léčbě dospělých pacientů s progresivním, lokálně pokročilým nebo metastazujícím diferencovaným (papilárním/folikulárním/z Hürthleho buněk) karcinomem štítné žlázy (differentiated thyroid carcinoma – DTC), který je refrakterní na léčbu radioaktivním jódem. Pacienti musejí splňovat všechny tyto podmínky: stav výkonnosti dle ECOG 0-1, diagnóza progresivního, lokálně pokročilého nebo metastazujícího diferencovaného karcinomu štítné žlázy (papilární/folikulární/z Hürthleho buněk), který je rezistentní na léčbu radiojódem a u kterého není možné nebo vhodné použití alternativní lokoregionální terapeutické alternativy (zevní radioterapie, embolizace, intraluminální radiofrekvenční termoablace). Terapie je hrazena do progrese onemocnění. Rezistence na radiojód (RAI) je definována následovně: léze bez vychytávání jodu na RAI snímku nebo progrese po RAI léčbě během 12 měsíců po podání terapie RAI nebo podaná kumulativní dávka RAI větší nebo rovna 22,2 GBq.
Léčba je možná jako 1. nebo 2. linie u pacientů předléčených jiným tyrozinkinázovým inhibitorem – v registrační studii vykazovali i tito nemocní léčebný benefit (doba do progrese 15,1 měsíců).
25.4.1.2 Sorafenib
Sorafenib je dalším multikinázovým inhibitorem pro léčbu diferencovaného karcinomu štítné žlázy (VEGF, PDGF, RET, RAF) (1). V registrační studii DECISION prokázal signifikantní prodloužení doby do progrese onemocnění oproti placebu (10,8 měsíců oproti 5,8 měsícům).
Indikace dle SPC
Sorafenib je indikován v léčbě dospělých pacientů dosud neléčených pro karcinom štítné žlázy cílenou terapií, thalidomidem nebo chemoterapií o stavu výkonnosti dle ECOG 0-1 s progresivním, lokálně pokročilým nebo metastazujícím diferencovaným (papilární/folikulární/z Hürthleho buněk) karcinomem štítné žlázy, který je rezistentní na léčbu radiojodem a u kterého není možné nebo vhodné použití alternativní lokoregionální terapeutické alternativy (zevní radioterapii, embolizaci, intraluminální radiofrekvenční termoablaci). Rezistence na radiojód (RAI) je definována následovně: léze bez vychytávání jodu na RAI snímku nebo kumulativní dávka RAI je větší nebo rovna 22,2 GBq nebo progrese po RAI léčbě během 16 měsíců od zařazení nebo po dvou léčbách pomocí RAI s odstupem 16 měsíců.
25.4.1.3 Cabozantinib
Cabometyx (cabozantinib) je indikován v monoterapii k léčbě dospělých pacientů s lokálně pokročilým nebo metastatickým diferencovaným karcinomem štítné žlázy (DTC), refrakterním nebo nezpůsobilým k léčbě pomocí radioaktivního jódu (RAI), u kterých došlo k progresi během předchozí systémové léčby nebo po ní.
Volbu konkrétního TKI je nutno zvažovat individuálně, s ohledem na očekávanou terapeutickou odpověď a komorbidity
Pozn. Před zahájením léčby DTC multikinázovými inhibitory se doporučuje, aby lékaři pečlivě posoudili prognózu každého pacienta individuálně. Týká se to zejména pacientů s pomalu progredujícím, asymptomatickým onemocněním, bez metastatického postižení CNS, jejichž kvalita života by mohla být nepříznivě ovlivněna nežádoucími účinky léčby.
25.4.1.4 Larotrectinib
Možnosti cílené léčby zejména papilárního karcinomu štítné žlázy rozšiřuje inhibitor NTRK (neutrophin-tropomyosin receptor kinase) larotrectinib. Papilární karcinomy vykazují přítomnost NTRK fúze v rozmezí 2–12 %, nádory štítné žlázy celkově pak v rozmezí 5–25 %.
Efektivita léčby byla potvrzena v rámci basket studie zahrnující solidní tumory s NTRK fúzí, včetně DTC a anaplastických karcinomů; léčebná odpověď činila 86 %.
Indikace dle SPC:
Přípravek larotrectinib je v monoterapii indikován k léčbě dospělých a pediatrických pacientů se solidními nádory, které vykazují fúzní gen NTRK, kteří mají lokálně pokročilé, metastatické onemocnění nebo u něhož by chirurgická resekce pravděpodobně vedla k závažné morbiditě a pro které neexistují uspokojivé možnosti léčby.
25.4.1.5 Vandetanib
Vandetanib jako cílená léčba pacientů s medulárním karcinomem štítné žlázy je silným inhibitorem VEGFR-2, EGFR a RET tyrosinkináz (1). V registrační studii ZETA prokázal statisticky signifikantní prodloužení doby do progrese onemocnění oproti placebu (více než 30 měsíců oproti 19,3 měsícům). Parciální odpověď na léčbu byla zaznamenána u 45 % pacientů, Medián
celkového přežití (81,6 měsíců v rameni s vandetanibem a 80,4 měsíců v rameni s placebem) byl podobný v obou ramenech.
Indikace dle SPC
Vandetanib je indikován k léčbě agresivního a symptomatického medulárního karcinomu štítné žlázy (MTC) s mutací RET (rearranged during transfection) u pacientů s neresekovatelným lokálně pokročilým nebo metastatickým onemocněním. Vzhledem k tomu, že účinnost přípravku Caprelsa je na základě dostupných údajů považována u pacientů bez identifikované
mutace RET za nedostatečnou, musí být před zahájením léčby přípravkem Caprelsa přítomnost mutace RET stanovena validovaným testem. Pokud je to možné, je při stanovení statusu mutace RET žádoucí odebrat vzorky tkáně v době zahajování léčby a nikoliv v době stanovení diagnózy.
25.4.1.6 Cabozantinib
Cabozantinib je dalším preparátem pro cílenou léčbu pacientů s medulárním karcinomem štítné žlázy(1). Působí jako inhibitor receptorových tyrosinkináz (VEGF, MET, RET). Doba do progrese onemocnění v registrační studii EXAM byla signifikantně delší (11,2 měsíce oproti 4,0 měsícům).
Indikace dle SPC
Cabozantinib je indikován k léčbě dospělých pacientů s progresivním, inoperabilním lokálně pokročilým nebo metastatickým medulárním karcinomem štítné žlázy.
U pacientů, u kterých není znám stav mutace RET (rearranged during transfection) nebo je negativní, se před individuálním rozhodnutím o léčbě musí zohlednit možnost nižšího přínosu.
25.4.1.7 Selpercatinib
Selpercatinib rozšiřuje terapeutické možnosti léčby medulárního karcinomu s RET mutací. V rámci klinické studie LIBRETTO- 531 prokázal selpercatinib v 1.linii pokročilého MTC s RET mutací signifikantní prodloužení doby do progrese onemocnění ve srovnání s terapií vandetanibem nebo cabozantinibem. Data o celkovém přežití ještě nejsou zralá.
Indikace dle SPC
Přípravek Retsevmo je indikován v monoterapii k léčbě dospělých a dospívajících ve věku 12 let a starších s pokročilým medulárním karcinomem štítné žlázy (medullary thyroid cancer, MTC) s mutací RET.
Pozn.
Červeně jsou označeny moderní léky, které nemají k 1. 3. 2024 stanovenu úhradu ze zdravotního pojištění. Indikace ostatních moderních preparátů je podmíněna splněním pravidel úhrady dle SÚKL (www.sukl.cz).
V České republice se systémové léčbě lokálně pokročilého a metastatického karcinomu štítné žlázy věnují tato Komplexní onkologická centra: FN Brno, FN České Budějovice, FN Hradec Králové, FN Motol Praha, FN Olomouc, FN Plzeň, MOÚ Brno
Literatura
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology [online], ver 2.2019 URL: http://www.nccn.org/professionals/
physician_gls/pdf/thyroid.pdf>[cit. 2019-09-16]. - Pacini F, Castagna MG et al. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 23 (Supp 7):
vii110-vii119, 2012. - Smallridge RC, Ain KB, Asa SL et al. American Thyroid Association guidelines for management of patients with anaplastic thyroid cancer. Thyroid. 2012
Nov;22(11):1104-39. doi: 10.1089/thy.2012.0302.





