Autoři tímto pilotním metodickým sdělením reagují na řadu podnětů týkajících se možnosti predikce hodnot celkového přežití pacientů se zhoubnými nádory ze zástupných parametrů, zejména z rychleji dosažitelných klinických výsledků typu přežití bez známek progrese (PFS) nebo času do progrese (TTP). Jako model byla zvolena diagnóza karcinomu prsu u žen, u které dochází nejen v české populaci k významnému prodlužování celkového přežití i na populačním úrovni. K této modelové diagnóze existují velmi robustní data z české populace léčených žen i recentní data z mezinárodních studií, které metodickému rozboru dodávají aktuálnost. Publikované sdělení je koncipováno jako úvodní metodický rozbor a bude dále dopracováno do podoby vědeckého článku určeného k publikaci v domácím či mezinárodním časopise.
Úvod
Karcinom prsu je jedním z nejčastějších nádorových onemocnění celosvětově i v České republice (Dušek et al., 2007). Část pacientek je i přes zlepšenou informovanost a vyhledávání nemocných v rámci organizovaného screeningového programu (Skovajsová et al., 2014) diagnostikována ve stádiu pokročilého onemocnění, u dalších dochází v čase k relapsu či progresi onemocnění. Naštěstí je nyní i pro tyto pacientky k dispozici moderní terapie, která zlepšuje výsledky léčby. Například medián celkového přežití u pacientek léčených s rekurentním karcinomem prsu se podařilo prodloužit z 15 měsíců udávaných v 70. letech na 58 měsíců podle dat z přelomu tisíciletí (Giordano et al., 2004) díky vstupu nových, účinnějších léčivých přípravků a využívání moderních metod léčby.
Pokrok v léčbě pacientek s karcinomem prsu lze demonstrovat i na populačních datech Národního onkologického registru ČR (NOR ČR), který je součástí Národního onkologického registru (NOR ČR). K hodnocení výsledků onkologické péče se na mezinárodní úrovni dlouhodobě využívá metodologie hodnocení tzv. relativního přežití (Allemani et al., 2018), která byla adaptována a publikována i pro českou populaci (Pavlík et al., 2009). Ukazatel pětiletého relativního přežití umožňuje hodnotit střednědobou prognózu pacientek se zhoubným nádorem prsu, přičemž umožňuje adjustovat výsledky na mortalitu obecné populace, a tak efektivně odhadnout mortalitu z příčiny samotného zhoubného nádoru prsu (Brenner et al., 2004).
Analýza provedená na recentních datech NOR ČR (Obr. 1, Tab. 1) přesvědčivě dokládá postupné zlepšování prognózy léčených pacientek: zatímco u pacientek diagnostikovaných v letech 1990-1994 bylo relativní pětileté přežití 68,5%, u pacientek žijících s diagnózou v letech 2013-2016 již odhadované přežití činí 88,2 %. Velmi úspěšná je léčba pacientek ve stadiu I, kde pětileté relativní přežití je blízké 100 %, mortalita u této kohorty pacientek se tak v pětiletém období prakticky neliší od obecné populace. Zvláště významné (a u solidních nádorů dospělých i výjimečné) je, že ke zlepšení dochází postupně i u pacientek s pokročilejšími stadii onemocnění.
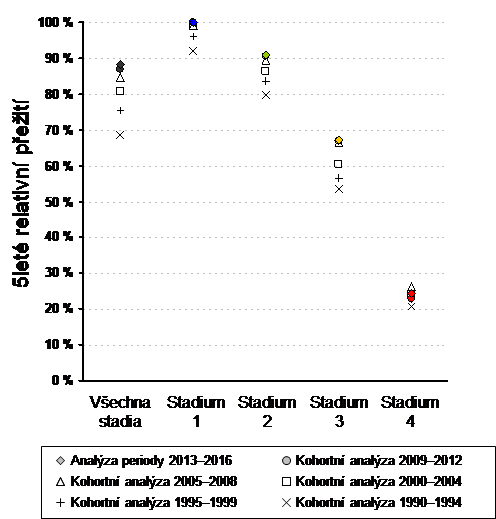
Obr. 1. Časový vývoj hodnot relativního pětiletého přežití pacientek léčených se zhoubným nádorem prsu v ČR, hodnocení dle klinických stadií onemocnění. Zdroj dat: NOR ČR, ÚZIS ČR.
| Kohortní analýza 1990–1994 | Kohortní analýza 1995–1999 | Kohortní analýza 2000–2004 | Kohortní analýza 2005–2008 | Kohortní analýza 2009–2012 |
Analýza periody 2013–2016 |
|
|
Stadium 1 |
91,8 % |
96,2 % |
98,9 % |
99,3 % |
99,9 % |
99,9 % |
|
Stadium 2 |
79,7 % |
83,6 % |
86,3 % |
89,3 % |
90,5 % |
90,8 % |
|
Stadium 3 |
53,5 % |
56,5 % |
60,5 % |
66,7 % |
66,9 % |
67,2 % |
|
Stadium 4 |
20,5 % |
22,5 % |
23,9 % |
26,1 % |
22,8 % |
24,3 % |
|
Celkem |
68,5 % |
75,6 % |
80,9 % |
84,7 % |
86,9 % |
88,2 % |
Tab. 1. Časový vývoj hodnot relativního pětiletého přežití pacientek léčených se zhoubným nádorem prsu v ČR, hodnocení dle klinických stadií onemocnění. Zdroj dat: NOR ČR, ÚZIS ČR.
Tento bezpochyby pozitivní jev na druhou stranu může komplikovat konvenční posuzování účinnosti nových léčivých přípravků při vstupu na trh, protože v okamžiku jejich registrace nejsou z důvodu nutnosti dlouhé doby sledování v klinických studiích k dispozici data o celkovém přežití pacientek. Léčivé přípravky v této indikaci tak bývají posuzovány na základě jiných klinických výsledků, např. doby do progrese onemocnění, celkové odpovědi onemocnění na léčbu apod. Data o celkovém přežití u pokročilého karcinomu prsu, zejména u pacientek absolvujících první linii léčby, bývají k dispozici až po mnohaletém sledování a mohou být po takové době často zatížena i povoleným přechodem na aktivní léčbu po progresi onemocnění, tzv. crossover (Jönsson et al., 2014), nebo zastavením studie a přechodem pacientů na aktivní léčbu z etických důvodů, pro její doloženou výrazně vyšší účinnost. Příkladem může být léčivý přípravek Perjeta (pertuzumab) v trojkombinaci pro léčbu metastatického HER2+ karcinomu prsu v 1. linii léčby, kde byla dostupná data o celkovém přežití v kontrolní skupině v intention-to-treat analýze ovlivněna crossover strategií, přesto bylo doloženo významné zlepšení celkového přežití (Swain et al., 2015).
Fakt, že posuzovaný léčivý přípravek nemá v okamžiku žádosti o úhradu k dispozici konkluzivní údaje o celkovém přežití, výrazně komplikuje i jeho posouzení z hlediska nákladové efektivity, neboť některé lékové agentury ve světě (NICE, SBU, CADTH) i Státní ústav pro kontrolu léčiv (SÚKL) v České republice preferují při posuzování toho, zda je léčivý přípravek nákladově efektivní, parametr rok života v plné kvalitě (QALY), pro jehož výpočet je korektní odhad doby celkového přežití nezbytný. Nejistota spojená s odhadem celkového přežití pacientek léčených posuzovanými léčivými přípravky (extrapolací křivek přežití odhadnutých parametrickými modely nebo za předpokladu proporcionality rizik pomocí parametru odhadovaného poměru rizik ze známé křivky přežití pacientů léčených komparátorem) často neumožňuje objektivně a přesně vyhodnotit nákladovou efektivitu. Ta je zatížena vysokou mírou nejistoty v souvislosti s volbou konkrétního scénáře, což zpomaluje proces získání úhrady posuzovaného léčivého přípravku a přístup pacientek k potenciálně prospěšné léčbě.
Příkladem takové situace mohou být i aktuálně probíhající správní řízení v ČR, v nichž je posuzován klinický přínos a nákladová efektivita CDK 4/6 inhibitorů v léčbě pokročilého HR+, HER2- karcinomu prsu u pacientek bez předchozí léčby pokročilého onemocnění. Konkrétně se jedná o léčivé přípravky Kisqali (ribociklib) a Ibrance (palbociklib). Oba posuzované přípravky prokázaly v kombinaci s letrozolem ve srovnání s letrozolem samotným v registračních studiích významný klinický přínos v parametru přežití bez známek progrese, PFS (Hortobagyi et al., 2016, Finn et al., 2016, Hortobagyi et al., 2018). Konkluzivní data o celkovém přežití (OS) prozatím nejsou k dispozici. Data OS z menší studie fáze II účinnosti palbociclibu PALOMA-1 jsou zatížena velkou nejistotou a nedoložila statisticky významné zlepšení OS (Finn et al., 2017).
Zatímco stanoviska SÚKL v souladu s registračními studiemi připouští klinicky významný inkrementální přínos CDK 4/6 inhibitorů v parametru PFS ve srovnání s monoterapií letrozolem, inkrementální přínos v parametru OS je předmětem diskusí s držiteli rozhodnutí o registraci. Tato situace není výjimečná a podobné diskuze probíhají i u jiných diagnostických skupin a jiných modalit léčby zhoubných nádorů. Ve vědecké literatuře je tedy široce diskutována realizovatelnost predikce přínosu v parametru OS z klinických výsledků typu přežití bez známek progrese (PFS) nebo času do progrese (TTP). V případě přesvědčivého doložení možnosti této extrapolace by regulační orgány získaly možnost lépe hodnotit klinický přínos a potažmo nákladovou efektivitu u posuzovaných léčivých přípravků, a tak umožnit pacientkám včasný přístup k moderní farmakoterapii za předpokladu její nákladové efektivity a dostupnosti. Oprávněnost extrapolačního postupu u pokročilého karcinomu prsu studovali Li and Pan (2018) a Forsythe et al. (2018).
Metodika
Aby bylo možné diskutovat možnost predikce OS z PFS s využitím českých dat, byla provedena analýza oprávněnosti předpokladu zástupnosti parametru OS (OS surrogacy assumption). Konkrétním cílem bylo vyhodnotit, zda hodnota přežití bez známek progrese (PFS) u konkrétní pacientky predikuje hodnotu přežití po progresi (post-progression survival, PPS), potažmo celkové přežití (OS), přičemž platí (Négrier et al., 2014):
PFS + PPS = OS
Pro podrobnější hodnocení zástupnosti parametru OS byla tato data vyhodnocena Weibullovým statistickým modelem, který umožňuje odhadnout parametry křivky PPS (a tedy i medián PPS) v závislosti na individuálních hodnotách PFS. Tento model umožňuje pro konkrétní pacientku dle pozorované hodnoty PFS predikovat hodnotu PPS, potažmo OS, neboť platí, že OS = PFS + PPS.
Pro studii byla retrospektivně hodnocena validní a již publikovaná data pacientek z registru BREAST garantovaného Českou onkologickou společností ČLS JEP. Tato data byla na agregované úrovni verifikována proti dalším externím datovým zdrojům, zejména vůči záznamům Národního onkologického registru, administrativním datům nemocnic a vůči záznamům o mortalitě. Jednalo se o pacientky s metastatickým karcinomem prsu, léčené v 1. linii přípravkem Herceptin (trastuzumab).
Výsledky
K datu 8. 1. 2018 se v registru BREAST nacházely údaje 1294 pacientek léčených trastuzumabem v 1. linii pro metastatický karcinom prsu. Z nich 1276 mělo validní údaje. Pro účely statistické analýzy byly využity údaje pacientek, u nichž byla zaznamenána progrese či úmrtí onemocnění (N = 927). U 114 pacientek bylo zaregistrováno přímo úmrtí bez předchozí progrese, do time-to-event analýzy PPS bylo tedy zahrnuto 813 pacientek. Hodnota PFS byla v popisné analýze kategorizována. Kódování „PPS eventu“ nebylo vyžadováno, pro PPS byla provedena standardní analýza přežití s cenzorováním.
Byly sestrojeny Kaplan-Meierovy křivky PPS dle kategorie PFS. Analýza dokládá významnou závislost PPS na kategorii PFS a tedy pozitivní korelaci mezi PFS a PPS (a tedy zároveň mezi PFS a OS) v definované kohortě pacientek (Obr. 2). U jednotlivých podskupin s PFS 20+, 10-19 a 0-9 měsíců činilo PPS 24,6 měsíců (95% IS 20,4-30,1), 18,0 měsíců (95% IS 13,0-21,7) a 10,4 měsíců (95% IS 9,0-11,7), rozdíly dosahují statistické významnosti (log-rank p < 0,001).
Odhadované parametry Weibullova modelu zároveň umožňují individuální modelovou predikci hodnot OS z hodnoty PFS. Tyto predikce pro jednotlivé hodnoty PFS prezentuje tabulka 2.
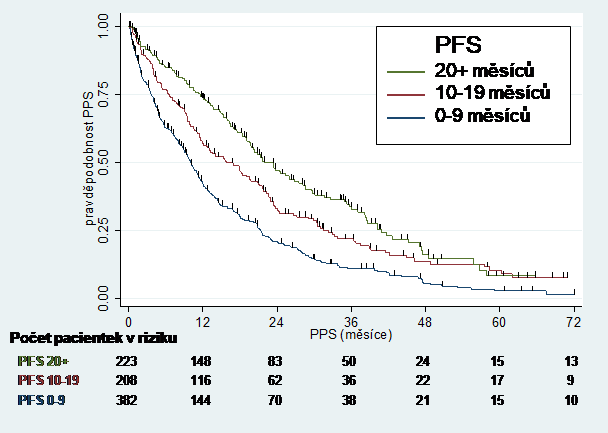
Obr. 2. Odhad křivek přežití po progresi (PPS) pro pacientky dle délky jejich přežití bez známek progrese (PFS)
| Délka PFS (měsíce) |
Predikovaný medián PPS (měsíce) |
Predikovaný medián OS (měsíce) |
| 1 | 10,8 | 11,8 |
| 2 | 11,1 | 13,1 |
| 3 | 11,4 | 14,4 |
| 4 | 11,7 | 15,7 |
| 5 | 12,1 | 17,1 |
| 6 | 12,4 | 18,4 |
| 7 | 12,7 | 19,7 |
| 8 | 13,1 | 21,1 |
| 9 | 13,5 | 22,5 |
| 10 | 13,8 | 23,8 |
| 11 | 14,2 | 25,2 |
| 12 | 14,6 | 26,6 |
| 13 | 15,0 | 28,0 |
| 14 | 15,4 | 29,4 |
| 15 | 15,8 | 30,8 |
| 16 | 16,3 | 32,3 |
| 17 | 16,7 | 33,7 |
| 18 | 17,2 | 35,2 |
| 19 | 17,7 | 36,7 |
| 20 | 18,2 | 38,2 |
| 21 | 18,7 | 39,7 |
| 22 | 19,2 | 41,2 |
| 23 | 19,7 | 42,7 |
| 24 | 20,3 | 44,3 |
| 25 | 20,8 | 45,8 |
| 26 | 21,4 | 47,4 |
| 27 | 22,0 | 49,0 |
| 28 | 22,6 | 50,6 |
| 29 | 23,2 | 52,2 |
| 30 | 23,9 | 53,9 |
Tab. 2. Predikovaný medián přežití po progresi (PPS) a celkového přežití (OS) pro pacientky dle délky jejich přežití bez známek progrese (PFS).
Diskuse
Prezentované výsledky přesvědčivě dokládají oprávněnost předpokladu zástupnosti OS pro vybranou kohortu českých pacientek léčených v první linii chemoterapii v kombinaci s trastuzumabem pro metastatický karcinom prsu, která byla dostupná pro statistickou analýzu. Bylo ukázáno, že delší hodnota PFS je u pacientek statisticky významně spjata s delší hodnotou přežití po progresi onemocnění, a tedy i s očekávanou hodnotou celkového přežití. Kvalitativně lze tuto korelaci povařovat za jednoznačně prokázanou, nicméně otázkou zůstává modelová kvantifikace výše inkrementu OS dosažitelného při určitých hodnotách PFS.
Pokud bychom závislost mezi PFS a OS odvozené pro tuto kohortu použili na výsledky studie MONALEESA-2 (Hortobagyi et al., 2018), kde medián PFS v relevantní skupině pacientek z evropského regionu léčených ribociclibem (150 pacientek) byl 27,6 měsíců a ve skupině s placebem (146 pacientek) 16,5 měsíců (rozdíl 11,1 měsíců), predikované hodnoty mediánu OS (viz tabulka 1) by byly 50,6 měsíců, resp. 33,7 měsíců (rozdíl 16,9 měsíců). Je nicméně třeba zdůraznit, že takto modelované predikce mediánu OS pro danou kohortu je nezbytné považovat za orientační, neboť navržená metoda je konstruována zejména pro predikci mediánu OS na individuální úrovni (Négrier et al., 2014).
Předkládaná analýza navazuje na publikované práce hodnotící oprávněnost předpokladu zástupnosti OS parametrem PFS u pacientek léčených s metastatickým karcinomem prsu. Za nejrelevantnější pro diskusi předpokladu u CDK4/6 inhibitorů lze považovat recentní práci autorky Forsythe et al. (2018), jež se specificky věnovala možnosti predikce OS z PFS u pacientek s HR+/HER2- metastatickým karcinomem prsu, které odpovídají cílové populaci pro CDK4/6 inhibitory. Studie založená na systematickém přehledu randomizovaných klinických studií, jež identifikoval 40 relevantních prací, potvrdila významnou korelaci mezi PFS/TTP a OS a umožnila sestavit predikční model pro takovou extrapolaci. Aplikace výsledků pacientek z evropského regionu ze studie MONALEESA-2 na tento predikční model předpovídá pro inkrement PFS ve výši 11,1 měsíce inkrement OS ve výši 13,1 měsíce, resp. 9,1 měsíce, při využití jednorozměrného, resp. vícerozměrného predikčního modelu (výpočet viz Tab. 3-4).
| Inkrement OS (m) | 13,1 | |
|
Odhad regresního koeficientu |
Hodnoty prediktorů pro MONALEESA-2 (evropská populace) |
|
| β1 (inkrement PFS) | 1,13 | 11,1 |
| β0 (absolutní člen) | 0,58 | 1 |
Tab. 3: Ilustrativní příklad kalkulace inkrementálního OS dle vztahu ze studie Forsythe et al. (2018). Jednoduchá regrese, adaptováno pro ribociklib dle výsledků evropské populace studie MONALEESA-2 (Hortobagyi et al., 2018)
| Inkrement OS (m) | 9,1 | |
| Odhad regresního koeficientu | Hodnoty prediktorů pro MONALEESA-2 (evropská populace) |
|
| β1 (studie s CHT) |
-0,27 |
0 (ne) |
| β2 (TTP jako surogát) | 5,80 | 0 (ne) |
| β4 (inkrement PFS) | 0,76 | 11,1 |
| β0 (absolutní člen) | 0,65 | 1 |
Tab. 4: Ilustrativní příklad kalkulace inkrementálního OS dle vztahu ze studie Forsythe et al. (2018). Jednoduchá regrese, adaptováno pro ribociklib dle výsledků evropské populace studie MONALEESA-2 (Hortobagyi et al., 2018)
Rovněž metodika českého SÚKL pro posuzování analýzy nákladové efektivity (Státní ústav pro kontrolu léčiv, 2017) uvádí, že pokud nelze použít parametr získané roky života (LYG), je možné použít podstatné a měřitelné kritérium příslušného onemocnění. Metodika dále odkazuje na Doporučení skupiny NICE Decision Support Unit, která k této problematice uvádí, že analýza nákladové efektivity založená na zástupném vztahu mezi PFS a OS by měla být podpořena transparentním vysvětlením, jak je vztah v modelu kvantifikovaný (NICE Decision Support Unit). Publikovaný systematický přehled (Forsythe et al., 2018) byl proveden na relevantní kohortě pacientek s metastatickým HER2- HR+ karcinomem prsu a umožnil sestrojit model pro predikci inkrementálních měsíců OS. Jako nepřímý důkaz oprávněnosti předpokladu zástupnosti PFS pro predikci OS u CDK 4/6 inhibitorů může posloužit i recentní publikace hodnotící přínos palbocicilibu u pacientek progredujících na předchozí hormonální terapii (Cristofanilli et al., 2018), kde se navýšení PFS o 6,6 měsíců promítlo do navýšení OS o 6,9 měsíců.
Korelace mezi PFS a PPS byla prokázána i u dalšího typu cílené léčby. Ve studii BOLERO-2 randomizující pacientky s HR+HER2- metastatickým karcinomem prsu k léčbě kombinací přípravků everolimus + exemestan versus exemestan v monoterapii byl medián PFS hodnocený zkoušejícími (primární cíl studie) prodloužen o 4,6 měsíce (7,8 vs 3,2 měsíce, p < 0,001), čemuž odpovídalo i prodloužení mediánu OS o 4,4 měsíce (31,0 vs 26,6 měsíce, p=0,14). Ačkoli prodloužení mediánu OS nebylo statisticky signifikantní, samotná korelace mezi PFS a OS je zřejmá. Ani v této studii nebyl umožněn crossover k experimentální léčbě (Piccart et al, 2014)
Z dostupných výsledků klinických studií je nicméně patrné, že korelace mezi PFS a PPS nemusí platit pro všechny typy léčby. Příkladem je terapie antiangiogenní protilátkou bevacizumab u karcinomu prsu. V randomizované studii fáze III bevacizumab významně prodloužil PFS ve srovnání se samotným paklitaxelem (medián 11,8 vs. 5,9 měsíce, p < 0,001), avšak k prodloužení OS nedošlo (medián 26,7 vs. 25,2 měsíců, p = 0,16). V této studii nebylo povoleno překřížení ramen (crossover) (Miller et al., 2007).
Podobné výsledky přinesly i jiné studie s bevacizumabem u karcinomu prsu (Montero et al., 2012). Důležité je však si uvědomit, že bevacizumab neprodloužil ve druhé linii ani PFS (Miller et al., 2005), a v tom kontrastuje s výsledky inhibitorů CDK 4/6, u nichž ve druhé linii došlo k prodloužení jak PFS, tak OS (Cristofanilli et al., 2018). Inhibitory CDK 4/6 nepatří mezi léky s přímým antiangiogenním účinkem, a proto zde bude vztah PFS a OS (resp. PPS) jiný než u inhibitorů angiogeneze.
Z uvedených zkušeností vyplývá, že definitivní odpověď ohledně prodloužení OS mohou poskytnout až zralá data získaná v klinických studiích. Lze předpokládat, že jednotlivé třídy léků budou vykazovat různou závislost mezi PFS a PPS. V této situaci se nabízí aplikace modelu používaného americkou agenturou FDA, kde je možná dočasná úhrada léku na základě prodloužení PFS nebo jiných sekundárních parametrů s přehodnocením úhrady po získání údajů o OS. Tento způsob registrace je flexibilní a umožňuje včasný přístup k danému léku nemocným, jejichž zdravotní stav samozřejmě nedovoluje čekat na konečné výsledky klinických studií.
Předkládaný rozbor na kohortě českých pacientek léčených pro metastatický karcinom prsu dokládá oprávněnost předpokladu o zástupném vztahu PFS a OS na modelovém příkladu léčby trastuzumabem. Přes možnou limitaci danou odlišností zkoumané kohorty (HR a HER markery) se autoři domnívají, že tato studie dále doplňuje základnu vědeckých poznatků o potenciální účinnosti moderních léčiv a potvrzuje na datech z reálné klinické praxe možnost predikce celkového přežití z přežití bez známek progrese.
Literatura
- ALLEMANI, C., MATSUDA, T., DI CARLO, V., HAREWOOD, R., MATZ, M., NIKŠIĆ, M., BONAVENTURE, A., VALKOV, M., JOHNSON, C. J. & ESTÈVE, J. 2018. Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. The Lancet, 391, 1023-1075.
- BRENNER, H., GEFELLER, O. & HAKULINEN, T. 2004. Period analysis for 'up-to-date' cancer survival data: theory, empirical evaluation, computational realisation and applications. Eur J Cancer, 40, 326-35.
- CRISTOFANILLI, M., SLAMON, D. J., RO, J., BONDARENKO, I., IM, S.-A., MASUDA, N., COLLEONI, M., DEMICHELE, A., LOI, S., VERMA, S., IWATA, H., HARBECK, N., LOIBL, S., ANDRÉ, F., THEALL, K. P., HUANG, X., GIORGETTI, C., BARTLETT, C. H. & TURNER, N. C. 2018. Abstract LBA2_PR Overall survival (OS) with palbociclib plus fulvestrant in women with hormone receptor-positive (HR+), human epidermal growth factor receptor 2-negative (HER2−) advanced breast cancer (ABC): Analyses from PALOMA-3. Annals of Oncology, 29.
- DUŠEK, L., MUŽÍK, J., KUBÁSEK, M., KOPTÍKOVÁ, J., ŽALOUDÍK, J. & VYZULA, R. 2007. SVOD.cz - Epidemiologie zhoubných nádorů v České republice [Online]. Masarykova univerzita. Available: http://www.svod.cz/ [Accessed 9.10.2018.
- FINN, R. S., CROWN, J., LANG, I., BOER, K., BONDARENKO, I., KULYK, S. O., ETTL, J., PATEL, R., PINTER, T. & SCHMIDT, M. 2017. Overall survival results from the randomized phase II study of palbociclib (P) in combination with letrozole (L) vs letrozole alone for frontline treatment of ER+/HER2–advanced breast cancer (PALOMA-1; TRIO-18). American Society of Clinical Oncology.
- FINN, R. S., MARTIN, M., RUGO, H. S., JONES, S., IM, S.-A., GELMON, K., HARBECK, N., LIPATOV, O. N., WALSHE, J. M. & MOULDER, S. 2016. Palbociclib and letrozole in advanced breast cancer. New England Journal of Medicine, 375, 1925-1936.
- FORSYTHE, A., CHANDIWANA, D., BARTH, J., THABANE, M., BAECK, J. & TREMBLAY, G. 2018. Progression-free survival/time to progression as a potential surrogate for overall survival in HR+, HER2− metastatic breast cancer. Breast Cancer: Targets and Therapy, 10, 69.
- GIORDANO, S. H., BUZDAR, A. U., SMITH, T. L., KAU, S. W., YANG, Y. & HORTOBAGYI, G. N. 2004. Is breast cancer survival improving? Trends in survival for patients with recurrent breast cancer diagnosed from 1974 through 2000. Cancer: Interdisciplinary International Journal of the American Cancer Society, 100, 44-52.
- HORTOBAGYI, G., STEMMER, S., BURRIS, H., YAP, Y., SONKE, G., PALUCH-SHIMON, S., CAMPONE, M., PETRAKOVA, K., BLACKWELL, K. & WINER, E. 2018. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Annals of Oncology.
- HORTOBAGYI, G. N., STEMMER, S. M., BURRIS, H. A., YAP, Y.-S., SONKE, G. S., PALUCH-SHIMON, S., CAMPONE, M., BLACKWELL, K. L., ANDRÉ, F. & WINER, E. P. 2016. Ribociclib as first-line therapy for HR-positive, advanced breast cancer. New England Journal of Medicine, 375, 1738-1748.
- JÖNSSON, L., SANDIN, R., EKMAN, M., RAMSBERG, J., CHARBONNEAU, C., HUANG, X., JÖNSSON, B., WEINSTEIN, M. C. & DRUMMOND, M. 2014. Analyzing overall survival in randomized controlled trials with crossover and implications for economic evaluation. Value in Health, 17, 707-713.
- LI, L. & PAN, Z. 2018. Progression-free survival and time to progression as real surrogate end points for overall survival in advanced breast Cancer: A meta-analysis of 37 trials. Clinical breast cancer, 18, 63-70.
- MILLER, K., WANG, M., GRALOW, J., DICKLER, M., COBLEIGH, M., PEREZ, E. A., SHENKIER, T., CELLA, D. & DAVIDSON, N. E. 2007. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. New England Journal of Medicine, 357, 2666-2676.
- MILLER, K. D., CHAP, L. I., HOLMES, F. A., COBLEIGH, M. A., MARCOM, P. K., FEHRENBACHER, L., DICKLER, M., OVERMOYER, B. A., REIMANN, J. D., SING, A. P., LANGMUIR, V. & RUGO, H. S. 2005. Randomized phase III trial of capecitabine compared with bevacizumab plus capecitabine in patients with previously treated metastatic breast cancer. J Clin Oncol, 23, 792-9.
- MONTERO, A. J., ESCOBAR, M., LOPES, G., GLÜCK, S. & VOGEL, C. 2012. Bevacizumab in the treatment of metastatic breast cancer: friend or foe? Current oncology reports, 14, 1-11.
- NÉGRIER, S., BUSHMAKIN, A., CAPPELLERI, J., KORYTOWSKY, B., SANDIN, R., CHARBONNEAU, C., MICHAELSON, M., FIGLIN, R. & MOTZER, R. 2014. Assessment of progression-free survival as a surrogate end-point for overall survival in patients with metastatic renal cell carcinoma. European Journal of Cancer, 50, 1766-1771.
- NICE DECISION SUPPORT UNIT. Progression-free survival and overall survival (PFS-OS). Available: http://nicedsu.org....development/pfs-os/ [Accessed 28/09/2018].
- PAVLÍK, T., DUŠEK, L., MÁJEK, O. & ŽALOUDÍK, J. 2009. Five-Year Survival Rates of Cancer Patients in the Czech Republic. In: DUŠEK, L. & ET AL. (eds.) Czech Cancer Care in Numbers 2008-2009. Praha: Grada Publishing, a.s.
- PICCART, M., HORTOBAGYI, G. N., CAMPONE, M., PRITCHARD, K., LEBRUN, F., ITO, Y., NOGUCHI, S., PEREZ, A., RUGO, H. & DELEU, I. 2014. Everolimus plus exemestane for hormone-receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: overall survival results from BOLERO-2. Annals of oncology, 25, 2357-2362.
- SKOVAJSOVÁ, M., MÁJEK, O., DANEŠ, J., BARTOŇKOVÁ, H., NGO, O. & DUŠEK, L. 2014. Výsledky Národního programu screeningu karcinomu prsu v České republice. Klinická onkologie, 27, 69-78.
- STÁTNÍ ÚSTAV PRO KONTROLU LÉČIV 2017. Postup pro posuzování analýzy nákladové efektivity (SP-CAU-028 - W), Praha.
- SWAIN, S. M., BASELGA, J., KIM, S.-B., RO, J., SEMIGLAZOV, V., CAMPONE, M., CIRUELOS, E., FERRERO, J.-M., SCHNEEWEISS, A. & HEESON, S. 2015. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. New England Journal of Medicine, 372, 724-734.







