Konference: 2011 XVIII. Jihočeské onkologické dny
Kategorie: Gastrointestinální nádory
Téma: Varia
Číslo abstraktu: 31
Autoři: MUDr. Zdeněk Linke
Gastrointestinální stromální nádor není příliš častý nádor zažívacího traktu a tvoří asi 2-5 % nádorů GIT, na druhou stranu jeho podíl v rámci mesenchymálních nádorů GIT činí více než 70 % a zcela oproti jiným sarkomům GIT dominuje! Nejčastěji je lokalizován extramurálně v oblasti žaludku a tenkého střeva, primární lokalizace v oblasti retroperitonea, omenta, rekta a jícnu jsou vzácná. Jeho výskyt se v poslední době relativně zvyšuje; a to zejména se zdokonalováním imunohistochemické diagnostiky, 90-97 % nádorů jsou c-KIT (CD 117) positivní.
Imatinib, malá molekula, která blokuje tyrokinkinázy (c-KIT, BCR-ABL), osvědčil svoji výraznou účinnost v léčbě pokročilého GIST v celé řadě klinických studií. Zejména klinická studie fáze 2 B2222 prokázala přínos v paliativní indikaci pokročilého GIST - a to nejen počtem léčebných odpovědí, prodloužením periody bez progrese (DFS), ale zejména prodloužením celkového přežití - v této studii medián celkového přežití dosáhl 57 měsíců. Oproti tomu historické kontroly před érou imatinibu reportovaly přežití okolo 19 měsíců! Imatinib mesylát vedl u studie B2222 k 68 % klinických léčebných odpovědí a u 84 % ke klinickému benefitu. Díky studii BFR14 byl celkem jednoznačně prokázán původní předpoklad; a to, že při kompletní či parciální remisi pokročilé nemoci během léčby imatinibem má pacient benefit z pokračování protinádorové biologické léčby. Po jejím přerušení dochází u většiny pacientů k rychlým recidivám. Klinické studie S 0033 a EORTC 60025 prokázaly přínos z eskalace - při primární progresi pokročilého GIST na iniciální dávce imatinibu má velkou šanci na další efektivitu imatinibu při jeho eskalaci.
Primární léčbou by měla být radikální chirurgická resekce. Standardem pro pacienty s radikální chirurgickou resekcí byla donedávna observace a dispenzarizace - a to i u vysoce rizikových případů, s ohledem na dobrý paliativní efekt imatinibu u metastatické choroby se však dal předpokládat benefit z adjuvantní léčby, a to zejména u skupiny pacientů s vysokým rizikem recidivy.
Obr. 1. Riziko recidivy s ohledem na velikost, mitotický index a primární lokalizaci základního nádoru dle Miettinena a Lasoty.
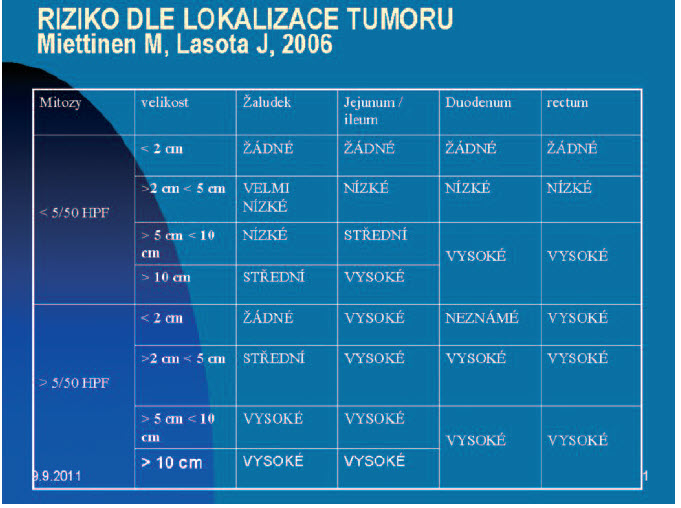
Donedávna nejvýznamnější studie ohledně adjuvatní aplikace jsou stěžejní ACOSOG Z9000 a ACOSOG Z9001. Pro gastrointestinální stromální nádor není vytvořen TNM systém; základem pro stanovení míry rizika recidivy nádoru jsou zejména velikost primárního nádoru a počet mitóz při histologickém vyšetření nádoru. Jsou definovány 4 stupně rizika recidivy - velmi nízké, nízké, střední a vysoké.
Klinická studie fáze 2 U. S. Intergroup ACOSOG Z9000 je otevřená, jednoramenná klinická studie. V rámci této studie bylo léčeno 107 pacientů s vysokým rizikem recidivy - zařazení pacientů předpokládalo jednak vysokou expresi KIT receptoru a jednak větší velikost primárního tumoru (> 10cm), rupturu nádorové pseudokapsuly nebo radikální resekci primárního tumoru při současné metastatické choroby na peritoneu (< 5 peritoneálních metastáz). Pacienti absolvovali roční adjuvantní terapie imatinibem s iniciální dávkou 400 mg/den. V průběhu 3 let bylo dosaženo jednak celkové přežití (OS) v 1. roce, v 2. roce, resp. v 3. roce od ukončení adjuvantní léčby imatinibem 99%, 97%, resp. 97%. Přežití bez známek recidivy (RFS) dosáhlo v 1. roce, v 2. roce, resp. v 3. roce 94%, 73%, 61%. V porovnání s historickými kontrolami, kde 2leté celkové přežití (OS) dosahovalo u subjektů s vysokým rizikem jen 50 %, imatinib prokázal předchozí hypotézu. A to - pakliže imatinib dosahoval vysoký počet regrese metastatické a KIT positivní pokročilé nemoci, dá se předpokládat také snížení rizika recidivy u radikálně resekovaných rizikových případů KIT pozitivních nádorů při následné adjuvantní aplikaci imatinib mesylátu.
Na základě nadějných výsledků studie ACOSOG Z9000 byla koncipována další klinická studie North American Intergroup Phase III ACOSOG Z9001. Podkladem této studie se stala pilotní studie Nilsona et al o adjuvantní aplikaci imatinibu. Do 04/2007 bylo do klinické studie zařazeno 708 pacientů s primárním nádorem GIST nad 3 cm s expresí KIT receptoru, kteří byli randomizováni do dvojitě slepé studie - do prvního ramene s účinnou látkou imatinibem s aplikací do dobu 1 roku nebo do druhého ramene s placebem. Pro případy progrese byla studie odslepena; v rameni s adjuvantní s aplikací imatinibu 400 mg/den byla dávka eskalována pro případ paliace na 800 mg/den a v rameni s placebem proběhla léčba pro případ paliace s iniciální dávkou imatinibem 400 mg/den. Interim analýza 644 zařazených pacientů prokázala medián do případné progrese 1.2 roku; dále počet pacientů bez progrese v 1 roce (jednoroční RFS) v rameni s účinným imatinibem 97 %, kdežto v rameni s placebem dosahoval pouze 83 %, hazard ratio dosahoval 0.325 (95% CI 0.198 - 0.534) (p = 0.0000014). Rozdíl v celkovém přežití (OS) po dobu relativně krátkého sledování potvrzen ve studii Z9001 nebyl /mimo jiné z důvodu nasazení imatinibu v případě progrese na placebové větvi, což obecně zkresluje data o celkovém přežití/. Rozdíl v ročním přežití bez progrese (RFS) byl však natolik podstatný, že se tato studie stala pokladem pro zařazení adjuvance imatinibem po dobu 1 roku v dávce 400 mg/den u KIT positivních nádorů středního a vysokého rizika. Přesto se rozdíly v přežití bez progrese v delším odstupu začínají snižovat a to bylo důvodem uvažovat o možnosti, že roční adjuvance imatinibem není dostatečně dlouhá a další adjuvantní studie byly i takto koncipovány.
Z jiných menších nebo starších studií o adjuvantní aplikaci imatinibu KIT positivních GIST vyššího rizika lze zmínit klinickou studii fáze 2 o adjuvantní aplikaci imatinibu 400 mg/den po dobu 1 roku od čínských autorů. Celkem bylo do této studie zařazeno mezi 08/2004 a 09/2005 57 pacientů s KIT positivním tumorem o velikosti > 5 cm nebo s vysokým počtem mitóz > 5/50 HPF. 43 pacientů bylo hodnotitelných po 12 měsících léčby - v této skupině byla progrese konstatována u 2 pacientů (po 350 a 680 dnech po primární resekci). Nežádoucí účinky byly zaznamenány u 57.89 % pacientů (z toho nežádoucí účinky v souvislosti s imatinibem u 50.88 % z nich), ale nejednalo se o významné nežádoucí účinky, tyto jako SAE reportovány nebyly!
Jiný pohled na míru rizika recidivy nastínil na Gastrointestinal Cancers Symposiu 2007 Gold se spolupracovníky. Nastínil deviaci křivek po radikální resekci s a bez adjuvantní aplikace imatinibem - jako rizikové a prognostické faktory uvedl jen velikost a mitotický index. Později Takahashi a spolupracovníci přidali k prognostickým kritériím nádoru krom velikosti nádoru a mitotického indexu i případnou peritoneální nebo další, resekovanou metastatickou chorobu, invazi nádoru nebo peroperační rupturu pseudokapsuly nádoru. Tyto faktory u KIT positivních nádorů staly prediktorem k adjuvantní léčbě imatinibem.
V současné době probíhají nábory do celé řady adjuvantních studií s imatinibem, ale jsou již publikovány některé velice zajímavé výsledky. Skandinávsko-německá studie SSG XVIII / AIO je otevřená, multicentrická, randomizovaná studie, která porovnávala krátkou adjuvanci imatinibem (1 rok) oproti prodloužené adjuvanci imatinibem (3 roky). Zařazováni jsou pacienti s rizikovým nádorem (tumor > 10 cm; nádor jakékoli velikosti s mitotickým indexem > 10 mitóz/50 HPF; nádor > 5 cm s mitózami > 5 mitóz / 50 HPF). Bylo zařazeno 400 pacientů; 200 pacientů s roční adjuvancí a 200 pacientů s prodlouženou 3 letou léčbou imatinibem. Průměrná délka follow-up byla v době sdělení 54 měsíců a přežití bez známek relapsu (RFS - relapse free survival) byla signifikantně vyšší v tříletém rameni - 65.6% - oproti roční adjuvanci - 47.9% (p < 0.0001; HR 0.46). Důležitějším zjištěním však bylo signifikantně prodloužené 5leté přežití v rameni s tříletou adjuvancí - 92.0% -proti rameni s roční adjuvancí - 81.7% (p = 0.019; HR 0.45).
Klinická studie EORTC 62024 je otevřená klinická studie porovnávající pacienty středního a vysokého rizika po radikální resekci GIST, kteří buď byli léčeni 24 měsíců adjuvantní aplikací imatinibu nebo byli po radikální chirurgii jen dispenzarizováni. Podmínkou je KIT positivita, plánuje se zařazení 760 subjektů klinického hodnocení, primárním cílem je zhodnocení celkového přežití (OS), sekundárními cíly jsou poté bezpečnost a přežití bez progrese (RFS). Nově jednoramenná studie PERSISTfáze 2 dokonce nasazuje adjuvanci imatinibem na dobu 5 let! Studie RTOG - S - 0132 byla otevřená klinická studie (23) s nedávno ukončeným náborem pacientů. Jednalo se o neoadjuvantní aplikaci imatinibu u nádoru potencionálně operabilních (ž 5 cm) nebo u recidiv či metastatické nemoci s primárním nádorem ž 2 cm. Celkem bylo zařazeno 63 pacientů, 10 týdnů pacienti absolvovali léčbu imatinibem 600 mg/den, následoval restaging, radikální resekce a poté adjuvantní aplikace imatinibu 600 mg/den po dobu 2 let. Cíly neoadjuvantní studie jsou počet léčebných odpovědí (RR), případy bez progrese v neoadjuvantní a později v adjuvantní fázi léčby imatinibem a bezpečnost aplikace. Podobné neoadjuvantní studie fáze 2 pro lokálně pokročilého nemetastatického GIST probíhají t. č. v Německu a v Kanadě.
V ČR a na Slovensku byl vytvořen společný česko-slovenský registr GIST, který sleduje aktuální počet pacientů s touto diagnózou, jejich epidemiologická a demografická data, modality užité léčby a její výsledky, přežití pacientů, toxicitu užité terapie.
Obr. 2. Zúčastněná centra česko-slovenského registru - stav k 31. 3. 2011.
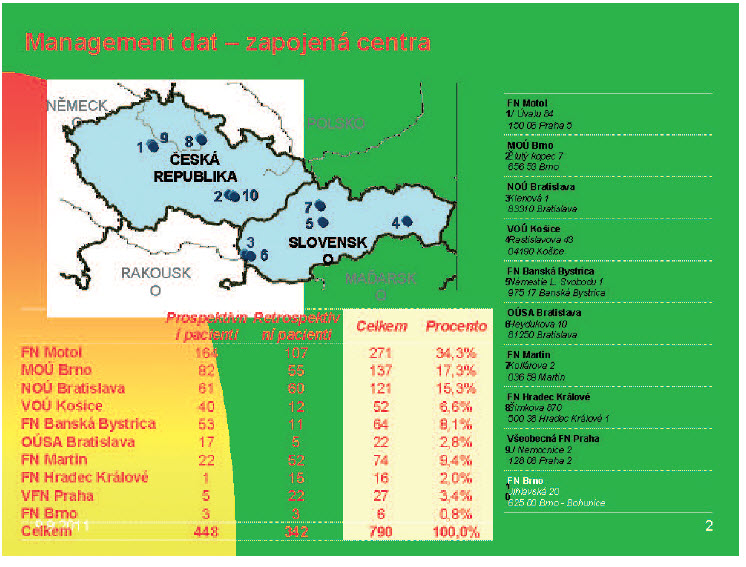
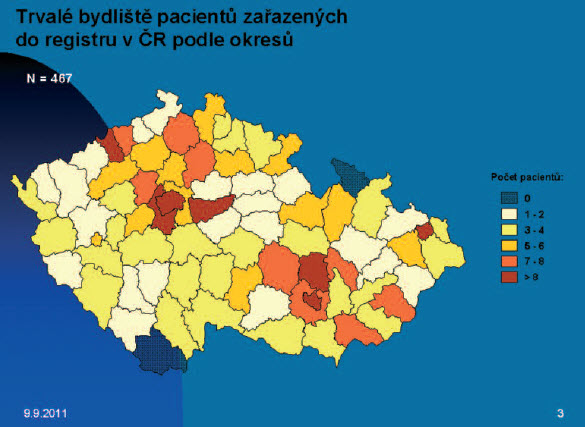
K 31. 3. 2011 bylo v ČR zařazeno 467 pacientů, rozdíly v počtu zařazených pacientů s ohledem na jejich bydliště se značně liší. Toto může souviset s hustotou zalidnění jednotlivých okresů, odpovědností stran vkládání dat, ale jistě se může na tomto podílet i problematická diagnostika endoskopická či patologická, příp. minimální podvědomí o této diagnóze v regionálních onkologických ambulancích.
Obr 3. Mapa ČR znázorňující počty pacientů s GIST - zařazených do registru v ČR podle okresů.
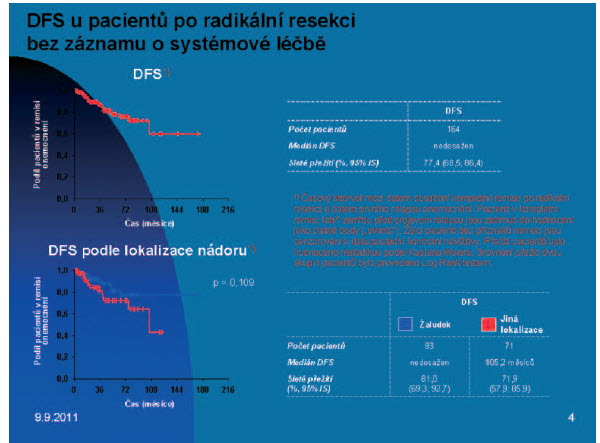
Léčebné výsledky, které prokazuje český registr, ukazují na vysokou účinnost imatinibu, progression - free survival dosahoval u pacientů na iniciální dávce imatinibu přes 52 měsíců a medián celkového přežití nebyl dosud dosažen!
Obr. 4. Zhodnocení přežití bez známek choroby (DFS), a léčebné výsledky 1. paliativní linie imatinibem - přeží bez progrese (PFS) a celkové přežití (ODS) T.

Datum přednesení příspěvku: 15. 10. 2011





