Konference: 2009 XVI. Jihočeské onkologické dny
Kategorie: Zhoubné nádory plic a průdušek
Téma: Postery
Číslo abstraktu: p05
Autoři: Mgr. Bc. Eva Suttrová (Hirmerová); MUDr. Aleš Panczak, CSc.; Ing. Věra Kebrdlová; Ing. Aleš Hořínek; prof. MUDr. Jiří Homolka, DrSc.; Ing. Jitka Štekrová; doc. MUDr. Milada Kohoutová, CSc.
V naší pilotní studii jsme zvolili dva přístupy zaměřené jednak na predispoziční faktory na úrovni zárodečné DNA, jednak na změny v DNA nádorových buněk u pacientů s nemalobuněčným karcinomem plic (NSCLC). Prvním přístupem byla genotypizace čtyř jednonukleotidových polymorfismů (SNP) umístěných na dlouhém raménku 15.chromozomu blízko genů pro podjednotky nikotinového acetylcholinového receptoru (nAChR), které byly nedávno popsány jako asociované s plicní rakovinou. Druhou oblastí našeho zájmu je analýza genomové nestability (ztráty heterozygozity - LOH) krátkých tandemových repetic (STR) v blízkosti čtyř tumor supresorických genů (APC, VHL, FHIT a TP53), jejichž mutace jsou často popisovány v buňkách plicní rakoviny. Uvedené STR jsme vyšetřovali ve volné DNA (cell free DNA, cfDNA) izolované z plasmy pacientů s plicní rakovinou.
Materiál a metody
Vzorky
Vzorky genomické DNA byly izolovány ze suspenze
jaderných buněk krve získané od 64 pacientů s diagnózou NSCLC
(skupina NSCLC) a od 81 pacientů s jiným plicním nenádorovým
onemocněním (skupina KOP). Kontrolní skupinu (skupina KOA) tvořilo
89 anonymizovaných DNA izolovaných ze zbytkových periferních krví
rutinní hematologické laboratoře.
Vzorky plasmatické cfDNA byly izolovány od 47
pacientů s diagnózou NSCLC (skupina NSCLC) a od 70 pacientů s jiným
plicním nenádorovým onemocněním (skupina KOP). Kontrolní skupinu
(skupina KOA) tvořilo 28 anonymizovaných cfDNA izolovaných z plasmy
zbytkových periferních krví rutinní hematologické laboratoře.
Oba typy DNA vzorků jsme izolovali pomocí kolony
QIAGEN podle příslušných firemních protokolů (QIAamp DNA Minikit
firmy QIAGEN) z 800 l plasmy, resp. z 25 l buněčné supenze.
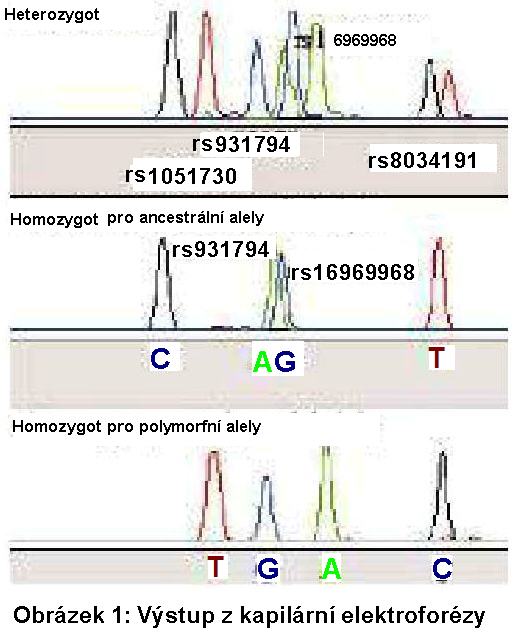
SNP analýza
Polymorfismy rs16969968, rs931794, rs1051730,
rs8034191 v genomické DNA byly analyzovány pomocí kitu SNaPshot
Multiplex kit (Applied Biosystems) podle standardního firemního
protokolu. Podstatou této metody je sekvenace jedné báze u všech
polymorfismů současně na základě vmezeřování dideoxynukleotidů.
Produkty sekvence jsou různě dlouhé a byly detekovány pomocí
kapilární elektroforézy na analyzátoru PERKIN ELMER ABI Prism 310
Genetic Analyser dle standardních provozních protokolů (obrázek
1).
STR analýza
Kvantifikace cena
Koncentraci DNA v izolátech z plasmy a z
jaderných buněk jsme měřili s použitím Real Time PCR pomocí
analyzátoru ABI PRISM 7 000 (Applied Biosystems). Signál
odpovídající amplifikaci zkoumaného roztoku DNA se porovnává se
standardní křivkou DNA o známé koncentraci. Výsledná koncentrace
zkoumaného roztoku DNA se vyjadřuje v počtu genomových ekvivalentů
(GE) v 1ml plasmy. Pro detekci celkového obsahu cell free DNA v
roztoku byla použita sekvence housekeepingového genu pro
glyceraldehyd-3-fostát dehydrogenázu (GAPDH). Pro zajištění
reprodukovatelnosti následné STR analýzy byly použity vzorky,
jejichž koncentrace byla vyšší než 90 GE.
Time release PCR (TR PCR)
Jedná se o PCR, kdy se postupně snižuje teplota
anealingu. Počáteční vysoká teplota anealingu má za následek
zvýšení specifity nasedání primeru; postupné snižování teploty a
větší množství cyklů (50-60) zvyšuje výnosnost reakce.
Použité primery, které ohraničovaly STR úseky,
byly TPP53 di, D5S346, D5S318, D5S299, D3S1560, D3S1300, D5S82.
Před samotnou reakcí jsme nechali zaktivovat AmpliTaqGold
polymerázu (Applied Biosystems) 1 min. při teplotě 95°C. Dále pak
reakce probíhala takto: denaturační teplota byla 94°C, teplota
anaelingu klesala od 61°C do 57°C po 1 stupni na cyklus a teplota
extenze byla 72°C.
Analýza fenotypu MSI/LOH
Mikrosatelity neboli STR jsou repetitivní úseky
DNA nacházející se v průběhu celého genomu. Mikrosatelitová
instabilita (MSI) je potvrzena, jestliže se délka repetitivních
úseků DNA liší v tumoru a ve zdravé tkáni. Jedná se o důsledek
poruchy genů chránících integritu genomu, a tedy neschopnosti
opravit chybnou replikaci genomu v nádorové buňce. Nejčastějším
projevem MSI je tzv. ztráta heterozygozity (LOH, loss of
heterozygosity)

Výsledky
SNPanalýza
Vyšetřované polymorfismy (rs16969968, rs931794,
rs1051730, rs8034191) mapovaly do segmentu dlouhého 88 kbp.
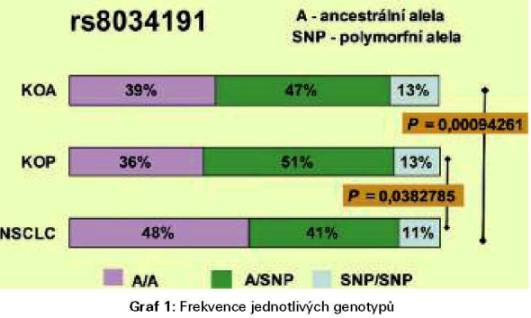
Rozložení genotypů pro sledovanou a obě kontrolní skupiny pro
polymorfismus rs8034191 znázorňuje Graf 1, pro ostatní polymorfismy
jsou nálezy podobné. V našem souboru jsme detekovali nižší
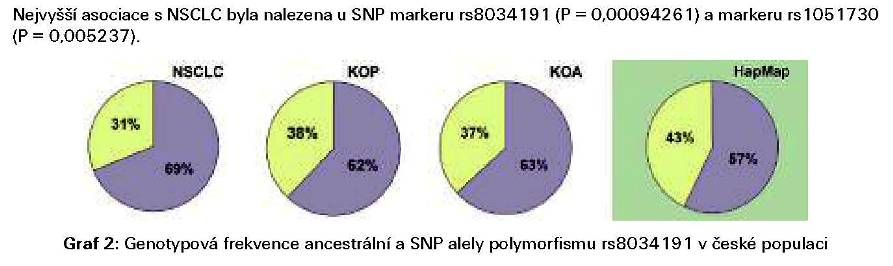
frekvenci homozygotů pro jednotlivé SNP alely než uvádí databáze
HapMap. Nejnižší frekvence SNP alel jsme detekovali u nádorových
pacientů na rozdíl od ostatních skupin (Graf 2). Jakkoli jsou
genotypová rozložení mezi jednotlivými skupinami rozdílná, rozdíly
mezi alelickými frekvencemi pro nádorovou a kontrolní skupiny
nejsou statisticky signifikantní.
STR analýza
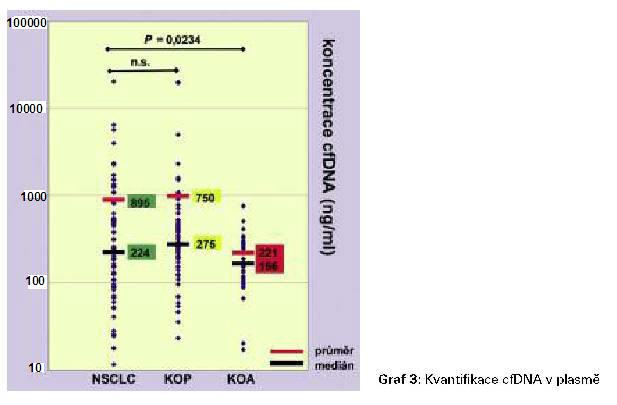
Kvantifikací cfDNA v plasmě všech vyšetřovaných
osob jsme zjistili, že tato hladina je zvýšená jak v plasmě
pacientů s nádorovým onemocnění tak i u pacientů s jinými plicními
onemocněním. Nejvyšší rozptyl jednotlivých koncentrací jsme
detekovali u pacientů s nádorem (Graf 3).
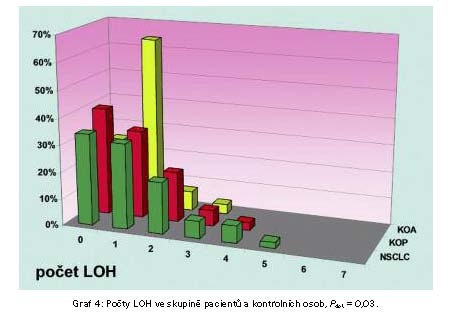
Dále jsme analyzovali genomovou nestabilitu
pomocí detekce LOH v STR úsecích. U 66% pacientů s nádorem byla
detekována žádná či alespoň jedna LOH, podobný výsledek jsme ale
nalezli i u obou kontrolních skupin (60% KOP, 75% KOA respektive).
Dva a více LOH u jednoho pacienta byly častěji pozorovány u
pacientů s nádorovým (34%) a u kontrol s jiným plicním onemocněním
(27%) na rozdíl od skupiny anonymizovaných osob (11%) (Graf 4).
Nejvyšší počet LOH na jednoho pacienta byl pozorován jen ve skupině
pacientů s nádorem (5 LOH na pacienta ze sedmi vyšetřovaných STR),
v této skupině jsme také detekovali tzv. úplnou LOH, kdy jedna z
alel kompletně vymizí, a MSI (rozpad signálu jedné z alel) v okolí
genu TP53. Tuto MSI jsme detekovali i u jednoho pacienta s
jiným plicním onemocněním.
Diskuse
Nedávné celogenomové asociační studie (GWAS,
genome-wide association studies) (Amos et al. 2008, Thorgeirsson et
al. 2008) objevily, že oblast 15q25.1 se zdá být asociovaná s
plicními nádory. Tyto studie vytipovaly na větších populačních
vzorcích (původem z Islandu, Skandinávie, západní Evropy a USA)
několik polymorfismů, které by mohly být predispoziční k tomuto
onemocnění. V naší laboratoři jsme testování těchto polymorfismů
nedávno zavedli a použili na soubor našich pacientů a kontrol s
cílem, zda v české populaci také objevíme určitou asociaci s
nádorovým onemocněním. V naší pilotní studii jsme zjistili, že náš
soubor českých pacientů má nižší frekvenci homozygotů pro SNP alelu
než je uváděno v databázi HapMap pro evropskou populaci. Dále jsme
nedetekovali žádnou závislost mezi frekvencí konkrétní alely a
diagnózou pacienta. Náš výsledek je možné vysvětlit daleko menším
souborem osob vyšetřovaných v pilotní studii než je uváděno v
celogenomových asociačních studiích. Dále jsme detekovali
statisticky signifikantní rozdíl v rozložení genotypů mezi skupinou
pacientů s NSCLC a kontrolní skupinou anonymizovaných osob u SNP
markeru rs8034191 (P = 0,00094261) a rs1051730 (P = 0,005237). Zdá
se, že v naší populaci je rizikovější ancerstrální alela.
Druhým přístupem byla analýza volné plasmatické
DNA (cfDNA) pacientů s NSCLC, která se řadí po bok metodám
využívajícím k molekulárně genetickým testům DNA izolovanou ze
sputa, z kondenzátu vydechovaného vzduchu či z cirkulujících
nádorových buněk; již delší dobu je diskutováno její využívání pro
zkvalitnění diferenciální diagnostiky plicních tumorů. Nejprve jsme
provedli její kvantifikaci. Z našeho nálezu vyplývá, že pacienti s
plicní rakovinou mají mírně zvýšenou hladinu cfDNA v plasmě a také
nejvyšší rozptyl hodnot této koncentrace na rozdíl od obou
kontrolních skupin. Obecně se však nezdá být pouhé měření této
koncentrace významným pomocníkem při diferenciálně diagnostické
rozvaze nad pacientem.
Po kvantifikaci cfDNA následovala LOH analýza STR
úseků v okolí genů APC, VHL, FHIT a TP53, které jsou
spojovány s vývojem plicní rakoviny. Pro jednotlivé tyto oblasti
jsme srovnávali genomovou stabilitu cfDNA s nálezy v DNA izolované
z jaderných buněk periferní krve téhož jedince, a to napříč všemi
skupinami. Zjistili jsme, že kumulativní nález dvou a více LOH je
charakteristický spíše pro skupinu nádorových pacientů. Častý nález
jedné LOH v kontrolní skupině pacientů s jiným plicním onemocněním
není zas tak překvapující, protože nálezy LOH byly popsány i u
benigních (především zánětlivých) plicních onemocnění, kdy dochází
k akumulaci a degradaci normálních buněk. U anonymizovaných vzorků
(skupina KOA) je tento nález možné vysvětlit tím, že nás jednak
omezovala hraniční koncentrace 90 GE (zdraví jedinci mají většinou
velmi malou koncentraci cfDNA v plasmě a nelze je proto testovat
opakovaně, případně vůbec), a za druhé tyto vzorky pocházejí z
rutinní hematologické laboratoře, a proto se domníváme, že nejde o
zcela a nikoli vždy (pomineme-li skrínink u gravidních žen) zdravé
jedince. MSI a LOH jsou totiž popisovány i u jiných nenádorových
onemocnění jako je astma, autoimunita, ateroskleróza aj.
Na souboru pacientů s NSCLC (zatím omezeného
rozsahu) jsme nenalezli žádnou signifikantní spojitost mezi MSI/LOH
analýzou cfDNA v plasmě a individuálním genotypem (alelami) čtyř
SNP v oblasti 15q25.1.
Závěrem můžeme konstatovat, že STR analýza nám
zároveň posloužila k průkazu (větší či menší) příměsi nádorové DNA
v celkové plasmatické cfDNA. Příštím pokračováním výzkumu na cfDNA
tak může být pátrání po specifických mutacích v přepisovaných
(exonických) oblastech kandidátních genů plicní kancerogeneze.
Literatura
- Amos, C.I. et al. (2008) Genome-wide association scan of tag
SNPs identifies a susceptibility locus for lung cancer at 15q25.1.
Nat. Genet., 40,616–622
- Andriani, F., Conte, D., Mastrangelo, T., Leon, M., Ratcliffe,
C., Roz, L., Pelosi, G., Goldstraw, P., Sozzi, G. and Pastorino, U.
(2004). Detecting lung cancer in plasma with the use of multiple
genetic markers. Int J Cancer 108:91-96.
- Beau-Faller, M., Gaub, M. P., Schneider, A., Ducrocq, X.,
Massard, G., Gasser, B., Chenard, M. P., Kessler, R., Anker, P.,
Stroun, M., Weitzenblum, E., Pauli, G., Wihlm, J. M., Quoix, E. and
Oudet, P. (2003). Plasma DNA microsatellite panel as sensitive and
tumor-specific marker in lung cancer patients. Int J Cancer 105:361
-370.
- Sozzi, G. et al. (2003). Quantification of free circulating DNA
as a diagnostic marker in lung cancer. J ClinOncol 21, 3902 -
3908.
- Thorgeirsson, T.E. et al (2008) Avariant associated with
nicotine dependence, lung cancer and peripheral arterial disease.
Nature, 452, 638 – 642
- Xue, X., Zhu, Y. M. and Woll, P. J. (2006). Circulating DNA and lung cancer. Ann NY Acad Sci 1075:154 - 164.
Datum přednesení příspěvku: 23. 10. 2009





