Konference: 2012 3. pražské mezioborové onkologické kolokvium Prague ONCO
Kategorie: Gastrointestinální nádory
Téma: Review
Číslo abstraktu: 007
Autoři: Doc. MUDr. Mária Wagnerová, CSc.
Neuroendokrinné tumory (NETy) tvoria veľmi heterogénnu skupinu s rozdielnou biologickou povahou, prognózou a pestrou symptomatologiou.(2,14)
Za posledných 30 rokov došlo k vzostupu incidencie o 500 % (5,8 % za rok), pričom sa nezmenilo prežívanie. Za dôvody stúpajúcej incidencie sa považuje nárast endoskopických vyšetrení, lepšia diagnostika (stanovená 5-7 rokov pred nástupom príznakov), diétne návyky a vplyv životného prostredia. NETy sú druhé najčastejšie nádory gastrointestinálneho traktu. Incidencia endokrinných nádorov pankreasu a žalúdka začína prevyšovať incidenciu adenokarcinómov.(14)
Etiopatogenéza NETov je neznáma. Najčastejšie chromozomálne aberácie predstavuje translokácia 17 a 19 a delécia 18.(9) Na vznik NETu v žalúdku má významný vplyv hypergastrinémia. NETy pankreasu a žalúdka mávajú rovnaké príčiny vzniku, ako je nadmerné fajčenie, chronický zápal, rodinná záťaž, prípadne čerstvý záchyt diabetes mellitus.
Nehomogenita NETov, ktoré pochádzajú z enterochromafinných buniek lokalizovaných v neuroendokrinnom tkanive predstavuje veľkú výzvu pre klinikov. (16)
Schopnosť produkovať, hromadiť a uvolňovať aktívne látky hormonálnej povahy ich dovoľuje zadeliť na funkčné a nefunkčné typy.(18) Patria sem:
- gastroenteropankreatické neuroendokrinné nádory;
- nádorové bunky ostrovčekov GITu;
- pheochromocytómy/paragangliomy;
- zle diferencované malobunkové atypické pľúcne karcinoidy;
- malobunkový karcinóm pľúc;
- Merkel cell karcinómy.
Neuroendokrinné nádory gastroenteropankreatickej osi (GEP-NETy) bývajú v čase diagnózy pokročilé.
Pretože biologické a klinické vlastnosti nádorov v týchto skupinách bývajú často odlišné, bola v roku 2000 zavedená WHO klasifikácia, ktorá zapracovala modifikáciu názorov na biologické správanie NETov, zaviedla novú terminológiu a pojem klinicko-patologických korelácií s ohľadom na veľkosť nádoru, spôsob jeho rastu a metastázovanie. V roku 2010 bola táto klasifikácia modifikovaná ENETS (European Neuroendocrine Tumour Society) ďalšími údajmi na podklade nových molekulárne biologických poznatkov. (18,19,21) WHO/ENETS klasifikácia je v tabuľke 1.
Pre NETy gastroenteropankreatickej osi platia 3 histologické typy:
- dobre diferencovaný neuroendokrinný nádor;
- dobre diferencovaný neuroendokrinný karcinóm;
- zle diferencovaný neuroendokrinný karcinóm (malobunkový karcinóm).
Prežívanie v závislosti na histopatologickom gradingu je uvedené na obrázku 1.
Tabuľka 1: WHO/ENETS klasifikácia
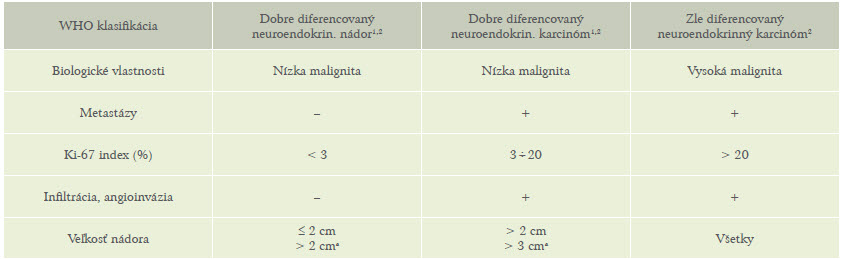
Obrázok 1: Prežívanie v závislosti na histopatologickom gradingu
Medián prežívania pacientov s metastatickými NETmi predstavuje 33 mesiacov. Lokalizované NETy majú dobrú prognózu, medián prežívania je 18,6 roka. U pacientov s regionálnym postihnutím lymfatických uzlín medián prežívania predstavuje 9,3 roka. Približne 27 % NETov je diseminovaných v čase diagnózy a tie majú veľmi zlú prognózu. Aj malé NETy do 0,5 mm majú metastatický potenciál. Prežívanie metastatických NETov je podobné ako u iných solídnych nádorov.(2)
Diagnostika GEP-NET sa opiera predovšetkým o špecif cké klinické príznaky, histologické vyšetrenie, hladiny hormónov, zobrazovacie metódy nukleárnej medicíny ale aj metódy rádiodiagnostické. Multidisciplinárny prístup je preto nevyhnutný vrátane tzv. druhého čítania patológa na špecializovanom pracovisku. Z diagnostických metód je veľmi prínosná scintigrafia somatostatinových receptorov (oktreosken), ktorá môže odhaliť aj lézie nedetekovateľné inými metódami, a tak môže prispieť k rozhodovaniu o použití somatostatinových analógov v liečbe.(14)
Z nádorových markerov sledujeme chromogranin A (CGA), ktorý predstavuje najlepšie definovaný cirkulujúci biomarker vhodný pre všetky typu NETu. Ďalej sa sleduje neurón špecifická enoláza a vylučovanie metabolitu serotoninu, t.j. kyseliny 5-hydroxyindooctovej (5-HIAA) močom. Nádejnými sa zdajú aj ďalšie markery, ako napríklad MA2 – protilátka proti paraneoplastickému antigénu MA2, normálne exprimovaná len v nervovom tkanive. Má vyššiu špecificitu a senzitivitu ako CGA. Jej vysoká koncentrácia je spojená s kratším celkovým a bezrelapsovým prežívaním. Zdá sa, že bude užitočná pre včasný záchyt NETu tenkého čreva a jeho relapsov. Cirkulujúce nádorové bunky by mohli byť užitočné ako prediktory radiologickej odpovede alebo monitor efektu liečby.(15,16)
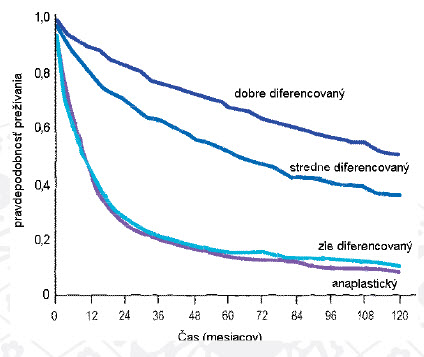
Somatostatínové receptory (SSTR) sú prítomné u vysokého percenta NETov ako súčasť klinického využitia somatostatinových analógov (SSTA). Cieľové SSTR majú priame a nepriame protinádorové účinky, ako vidno v tabuľke 2.(15)
Tabuľka 2: Priame a nepriame protinádorové účinky SSTR
|
Priame pôsobenie |
Nepriame pôsobenie |
|
• inhibíciou bunkového cyklu |
• inhibíciou angiogenézy |
|
• inhibíciou rastových faktorov |
• moduláciou imunosystému |
|
• indukciou apoptózy |
• inhibíciou rastových faktorov a niektorých hormónov |
Aktivácia SSTR má potenciál ovplyvnenia symptómov, biochemických parametrov a nádorovej kontroly. SST receptory patria k superrodine receptorov so siedmimi transmembránovými doménami. Doteraz bolo identifikovaných 5 podtypov špecifických membránových receptorov. Gény pre jednotlivé podtypy receptorov sú lokalizované na rôznych chromozómoch, čo naznačuje nielen individuálnu transkripčnú kontrolu, ale aj ich rozdielnu funkčnosť. (24)
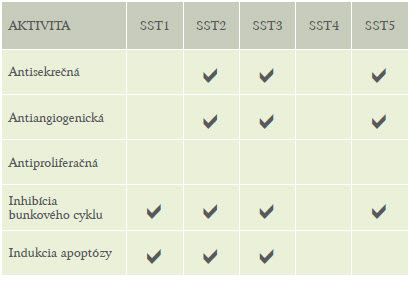
Tabuľka 3 uvádza aktivity všetkých 5 známych podtypov SST receptorov.
Liečebná stratégia sa opiera o histologický typ nádora, rozsah ochorenia a tiež prítomnosť endokrinnej nadprodukcie nádorových buniek. Jedinou kuratívnou liečebnou aktivitou je chirurgická liečba, ktorá by mala byť zvažovaná úvodne. Na rozdiel od iných solídnych nádorov aj cytoreduktívny výkon prináša zlepšenie stavu a zmiernenie nadprodukcie hormónov.
U lokalizovaného ochorenia je chirurgický výkon metódou voľby. Adjuvantná systémová liečba nie je indikovaná. (2)
U metastatiského ochorenia je možné využiť lokálne paliatívne výkony, ako je cytoreduktívne zmenšenie primárneho nádora, odstránenie hepatálnych metastáz alebo mezenteriálnych uzlín. Embolizácia alebo chemoembolizácia je indikovaná u pacientov s neresekabilným metastatickým postihnutím pečene. Cieľom liečby je zmenšenie nádorových más a zníženie nadprodukcie peptidických hormónov. Takýmto liečebným zásahom môžeme navodiť ischémiu nádorových buniek a poprípade zvýšiť ich citlivosť na ďalšiu systémovú liečbu. Na embolizáciu možno použiť polymérové mikročastice alebo pridaním cytostatík vykonať tzv. chemoembolizáciu, najčastejšie s použitím doxorubicínu alebo cisplatiny. Kontraindikáciou tohto postupu je obštrukcia portálnej žily alebo insuficiencia funkcie pečene. Päťročné prežívanie po embolizácii sa pohybuje na úrovni 50-60 %, symptomatická odpoveď 40-80 %. Mortalita nie je vyššia ako 4-6 %. Aj táto liečebná stratégia má nežiaduce účinky v podobe postembolizačného syndrómu (bolesti abdomenu, teploty, nauzea). (6,7)
Tabuľka 3: Aktivity piatich známych podtypov SST Receptorov
Inou paliatívnou možnosťou liečby metastatického ochorenia pečene je rádiofrekvenčná ablácia. Je indikovaná u pacientov po neúspešnej chemoembolizácii. Možno ju vykonávať perkutánne pod CT kontrolou alebo laparoskopicky. Metóda je limitovaná veľkosťou ložiska, ktoré nesmie presiahnúť 3 cm. Kombinácia chemoembolizácie a radiofrekvenčnej ablácie môže zabezpečiť zmenšenie nádorových ložísk a tým samozrejme zníženie nadprodukcie hormónov. Takýto postup významne zlepšuje liečebné výsledky. (23)
Transplantácia pečene je indikovaná výnimočne s individuálnym posudzovaním každého jednotlivého prípadu. (13)
NETy sú väčšinou rádiorezistentné. Rádioterapia je indikovaná s paliatívnym cieľom analgetickej liečby u kostných metastáz, alebo k zmierneniu príznakov po vyčerpaní všetkých možností liečby.(14,15)
Systémová liečba je používaná u primárneho nádora, ak je inoperabilný, alebo u progredientnej choroby, najčastejšie však u rozvinutého karcinoidového syndrómu.(18,19,26)
Bioterapia s použitím somatostatinových analógov je indikovaná na kontrolu symptómov nádorov s hormonálnou nadprodukciou, ako je:
• karcinoidový syndróm;
• Verner-Morrison syndróm;
• glukagónový syndróm
a ďalšie. Antiproliferatívny efekt somatostatínových analógov, menovite Octreotidu LAR, bol dokázaný in vitro aj in vivo v klinických štúdiach.(11)
Viac ako 80 % NETov produkuje SSTR. Účinok somatostatínových analógov spočíva v silnej inhibícii uvolňovania mediátorov, takže SSTR signál inhibuje sekréciu a proliferačnú aktivitu. Štúdie protinádorovej aktivity demonštrovali stabilizáciu a parciálnu regresiu v subsetoch pacientov.(27) Nevýhodou predchádzajúcich štúdií bolo chýbanie placebom kontrolovaných štúdií. Naviac aj zaraďovanie heterogénnej populácie pacientov rozdielneho pôvodu a biologickej povahy nedávali jednoznačnú odpoveď. Väčšina štúdií nezaradila naivných pacientov. Nezodpovedané otázky riešila klinická štúdia PROMID. Išlo o randomizovanú dvojito-slepú placebom kontrolovanú štúdiu fázy III B, na ktorej sa zúčastnilo 18 centier v Nemecku. Primárnym cieľom štúdie bol čas do progresie a sekundárnym cieľom liečebná odpoveď, prežívanie, biochemická odpoveď, kontrola symptómov kvality života a bezpečnosti. Dizajn štúdie je na obrázku 2.
Obrázok 2: Dizajn štúdie PROMID
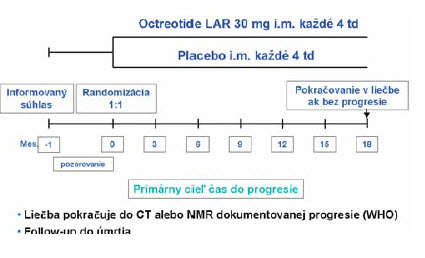
Do PROMID štúdie boli zaradení pacienti histologicky potvrdení novodiagnostikovaní a naivní, lokálne pokročilí alebo s dobre difrencovaným midgut (jejunum, ileum, appendix coekum) NETom. Zastúpenie mali pacienti s funkčným aj nefunkčným midgut nádorom s merateľnou léziou.(22)
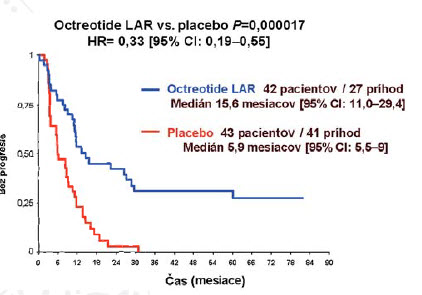
Z výsledkov štúdie (obrázky 3,4) je zrejmé, že oktreotid LAR 30 mg signifikatne zlepšuje čas do progresie u pacientov s metastatickým midgut dobre diferencovaným NETom. Dokumentovaná bola 67% redukcia rizika progresie bez ohľadu na funkčný stav.
Obrázok 3: Oktreotid vs. placebo (signifikantné zvýšenie času do progresie – PROMID)
Obrázok 4: Oktreotid vs. placebo (čas do progresie – PROMID)
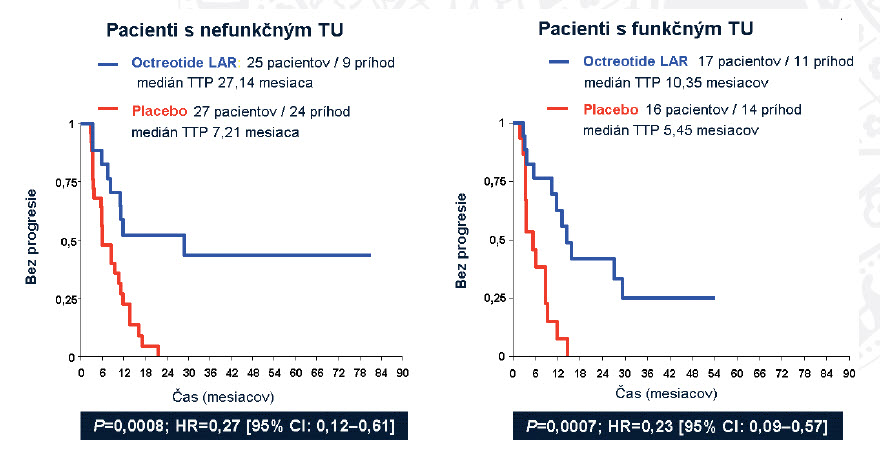
Celkové prežívanie ostalo naďalej v sledovaní a bude ťažké rozhodovať o výsledku, nakoľko bol možný cross-over po progresii z placeba na oktreotid LAR.
Profil toxicity ostal nezmenený, ako bol známy z predchádzajúcich štúdií s oktreotidom LAR u pacientov s NETmi. Oktreotid LAR predstavuje dnes štandardnú liečbu u pacientov s dobre diferencovaným midgut neuroendokrinným nádorom.(1)
Pred zavedením SSTA bol interferón liekom prvej voľby. V súčasnosti sa používa v ďalších líniach liečby alebo v kombinácii so somatostatinovými analógmi.(28) Symptomatická a biochemická odpoveď je asi na úrovni 50 % a signifikantná redukcia tumoru predstavuje 10-15 %. Toxicita sa objavuje najčastejšie ako flu-like syndróm, alebo ako autoimunne prejavy.
Z nových somatostatinových analógov si pozornosť zaslúži pasireotid, nový multireceptorový ligand vysoko afínny k štyrom z piatich SSTR subtypov, významne rozširuje účinnosť multireceptorovým pôsobením. Unikátny väzbový profil pasireotidu prináša širší terapeutický účinok s dlhším trvaním liečebnej odpovede.(15,16)
Možnosti systémovej liečby antineoplastickými látkami sú u pokročilých NETov limitované.(2)
Dáta o chemoterapii sú neuspokojivé. Najlepšia odpoveď sa dosahuje u nádorov nízko diferencovaných, ktoré nemajú somatostatinové receptory a nemajú hormonálnu nadprodukciu. Tieto nádory odpovedajú na chemoterapiu až v 70 % s celkovou dĺžkou odpovede na 8-10 mesiacov. Historicky boli režimy streptozotocín a doxorubicin napriek toxicite akceptované ako štandardná liečba bez dokumentácie zlepšenia intervalu bez progresie alebo prežívania v porovnaní s najlepšou podpornou starostlivosťou (best suportive care). (8,14,21) Neexistuje odporúčanie v prípade zlyhania chemoterapie.
Tabuľka 4: Prehľad režimov chemoterapie
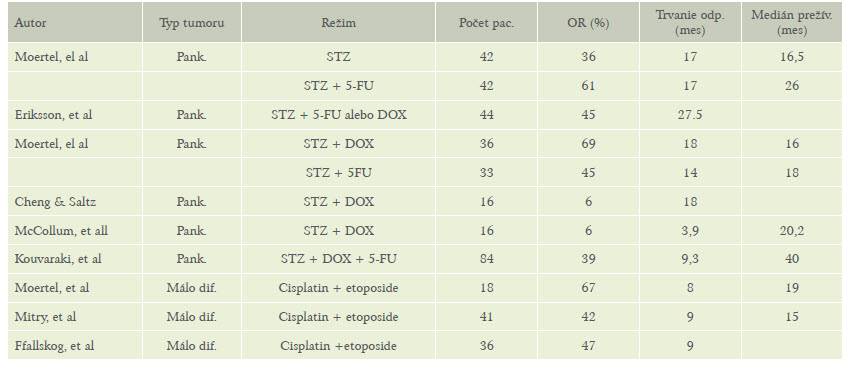
Možnosť zabrániť progresii ochorenia po chemoterapii výrazne zaostáva za cieľmi liečby. Tieto skutočnosti dokumentuje aj prehľad režimov chemoterapie na obrázku 5.
Liečba radioizotopmi (peptide receptore radiotherapy) je veľmi účinná u symptomatických inoperabilných alebo generalizovaných NETov dobre diferencovaných s KI-67 menej ako 10 %. Pri tejto liečbe sa využíva schopnosť nádorov vychytávať rádionuklidom značený oktreotid. Používa sa 131J, 111In, ale najčastejšie 177Lutecium. Táto liečba má sice pomalú odpoveď, ale až 46 % odpovedí, z toho 2 % kompletných a 28 % parciálnych remisií. Toxicita predstavuje nízku myelotoxicitu a prakticky žiadnu nefrotoxicitu. Nádejnými sa zdajú byť kombinácie radioizotopovej liečby s cytostatikami a aj s inhibítormi tyrozinkináz, kde možno dosiahnuť 94% stabilizáciu, zlepšenie kvality života a predĺženie voľného intervalu.(4,12,25)
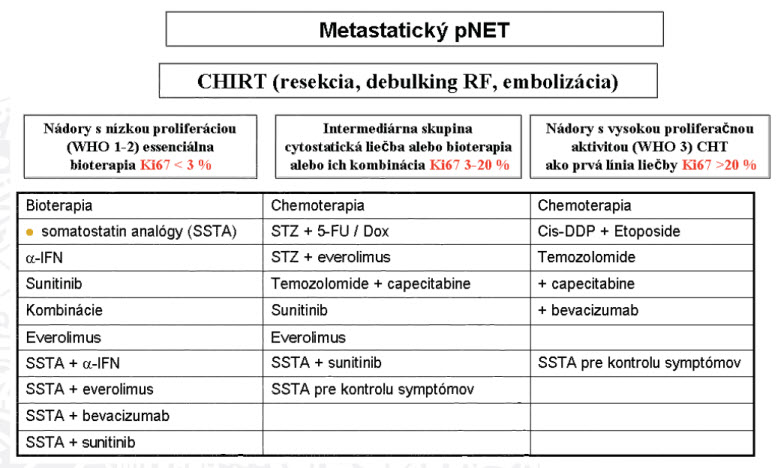
Jedinečnou podskupinou NETou sú neuroendokrinné nádory pankreasu (pNETy). Zahŕňajú menej ako 10 % všetkých gastroenteropankreatických neuroendokrinných nádorov. Vačšina je dobre diferencovaná a ich medián prežívania v metastatickej fáze je 27 mesiacov. Možnosti systémovej liečby cytostatikami sú limitované. Ale práve v tejto entite sa ukázali významným prínosom nové stratégie cielenej liečby. Prevencia progresie ochorenia je primárnym cieľom liečby pokročilých pNETov.(31) V klinických štúdiach nádejné výsledky ukázali mTOR inhibítory (everolimus), inhibítory tyrozinkináz (gef tinib, sunitinib), antiangiogénne preparáty (bevacizumab) a ďalšie.(5,14,18,19,29)
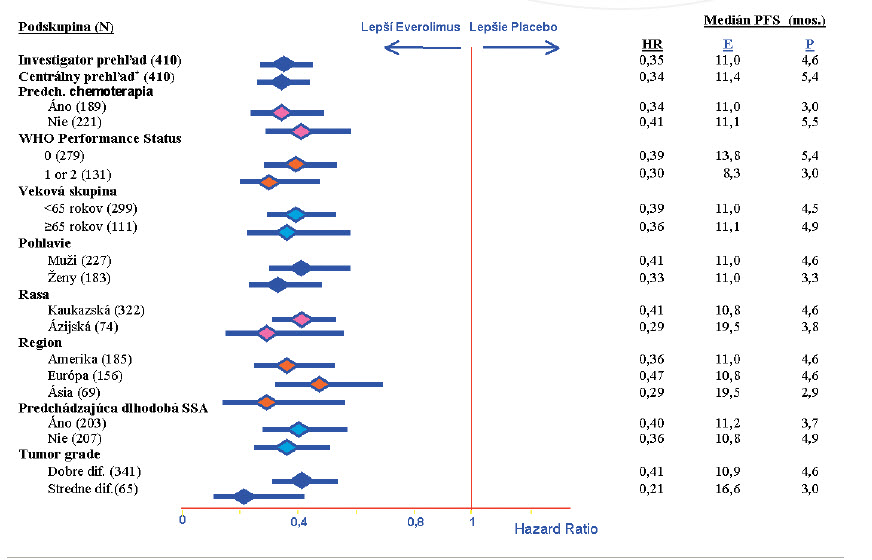
mTOR (mammalian Target of Rapamycin) je známy ako centrálny regulátor bunečnej aktivity, regulátor syntézy proteinov, predstavuje „down stream“ prenosu signálu rastových faktorov a výživových signálov. Everolimus ako predstaviteľ mTOR inhibítora bol skúšaný v klinických štúdiach RADIANT 1,2,3.(30) Radiant 1 priniesol povzbudivé výsledky pre pokročilé pNETy, v štúdii fáze II sa porovnávala účinnosť kombinácie everolimu so somatostatinovým analógom Sandostatinom LAR. Štúdia potvrdila účinnosť kombinácie. Radiant 2 sa zaoberal porovnaním kombinácie SSTA s everolimom u pokročilého funkčného karcinoidu. Výsledky potvrdili opäť kombináciu.(17) Radiant 3 bola medzinárodná multicentrická dvojito-slepá klinická štúdia, placebom kontrolovaná u pokročilých pNETov. Zahrnovala 410 pacientov progredujúcich počas 12 mesiacov pri povolenej predchádzajúcej liečbe. Primárnym cieľom bol čas do progresie hodnotený podľa RECIST kritérií 1,0. Štúdia hodnotila aj predchádzajúce a konkomitantné použitie somatostatinových analógov. (17,27)
Výsledky liečby ukazuje obrázok 5, liečba everolimom signif katne zvyšuje medián prežívania bez progresie o 6,4 mesiacov (4,6 vs. 11 mes.), redukuje riziko progresie o 65 % oproti placebu. 18 mesiacov času do progresie poukazuje na dlhodobý benefit everolimu. Bezpečnostný profil lieku je akceptovateľný. Radiant 3 je najväčší a najširšie koncipovaný randomizovaný trial pacientov s progredujúcim pokročilým pNETom. Tieto dáta podporili zaradenie everolimu do štandardnej liečby progredujúcich pokročilých pNETov. Naviac sa potvrdilo, že ani predchádzajúce ani konkomitantné užívanie somatostatinových analógov neovplyvňuje liečebné účinky everolimu.(29,31)
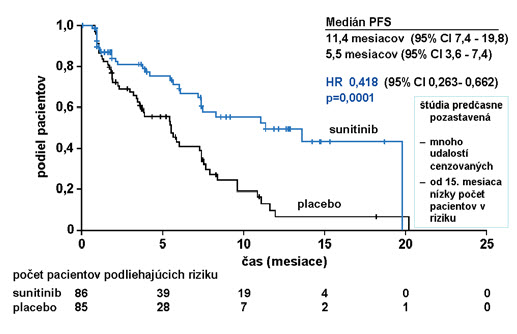
Pre pokročilý dobre diferencovaný pNET máme dnes k dispozícii aj ďalšie možnosti liečby inhibítorom tyrozinkináz – sunitinibom. V dvojitej zaslepenej randomizovanej klinickej štúdii fázy III (sunitinib vs. placebo) bolo zaradených 171 pacientov. Primárnym cieľom bol čas do progresie.(10) Miera objektívnej odpovede sa hodnotila podľa RECIST kritérií a celkové prežívanie bez progresie dokumentuje obrázok 6.
U pacientov s progresívnym, dobre diferencovaným pankreatickým endokrinným tumorom, malo podávanie sunitinibu v dávke 37,5 mg/deň pri kontinuálnom dávkovacom režime za výsledok klinicky signifikantné zlepšenie mediánu PFS 11,4 mesiacov vs. 5,5 na placebe, (HR 0,418; p = 0,0001), zlepšenie celkového prežívania (HR 0,409, p = 0,0204), klinicky signifikantné zvýšenie celkovej liečebnej odpovede 9,3 % vs. 0 %, (p = 0,0066).(10) V klinickom skúšaní sú tiež ďalšie tyrozín-kinázové inhibítory, ako napríklad pazopanib alebo sorafenib, skúšané v monoterapii alebo v kombinácii s inými molekulami.
Obrázok 5: Bezrelapsové prežívanie podľa podskupín (RADIANT 3)
Obrázok 6: Celkové prežívanie bez progresie
Nežiadúce účinky (NÚ) pozorované pri kontinuálnom dávkovacom režime so sunitinibom boli vo všeobecnosti tolerovateľné a menežovateľné prerušením podávania, redukciou dávky a/alebo štandardnou konkomitantnou liečbou. Najčastejšie NÚ boli podobné tým, ktoré sa vyskytli v predchádzajúcich štúdiách so sunitinibom. Miera asténie, vracania a únavy bola podobná v oboch ramenách (20) Tieto údaje podporujú klinickú účinnosť a bezpečnosť sunitinibu u pacientov s pokročilým pNET. Obrázok 7 predstavuje algoritmus terapie pre metastatické pNETy.
Záver
Pokročilé NETy nie je možné vyliečiť, môžeme však zlepšiť kvalitu života a predĺžiť ich prežívanie. Cytostatiká majú obmedzenú účinnosť, je nutné hľadať nové režimy a nové kombinácie. Rozšírenie indikácií biologickej liečby je nielen povzbudivé, ale aj nádejné.(3)
Obrázok 7: Algoritmus terapie pre metastatické pNETy
Somatostatinové analógy predstavujú dnes zlatý štandard aj pre nefunkčné NETy. Príprava nových štúdií je nevyhnutná, tak ako aj definícia štandardizovaných postupov. (19)
Možnosti zlepšenia liečebných výsledkov vyžadujú zabezpečenie včasnej diagnostiky. Diagnóza je často oddialená 5-7 rokov, mnohokrát až do diseminácie ochorenia. Zabezpečenie viac než kontroly symptómov je nevyhnutné. Budúcnosť predstavuje cielená liečba a kombinácia s cytostatikami. Optimalizácia špecializovaných prístupov žiada využívanie multidisciplinárnych postupov k zlepšeniu diagnostiky a liečby a využívanie konzultácií referenčných centier. doc.
MUDr. Mária Wagnerová, CSc. VOÚ a. s. Klinika radioterapie a onkológie, Košice e-mail: wagnerova@vou.sk
Literatúra
- Arnold R, Muller H, Schade-Brittinger C, et al. Placebo-controlled, double blind, prospective, randomized study of the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: A report from the PROMID study group. Presented at 2009 Gastrointestinal Cancers Symposium, San Francisco, CA, January 15-17, 2009 (abstr 121).
- Barkmanova J, Honova H. Neurokrinní nádory. Sborník témat a přednášek, XV. dni prof. Vladimíra Staška, Praha, 27-28 leden 2011, str. 25-29.
- Broglio KR, Berry DA. Detecting an overall survival benefit that is derived from progression-free survival. J Natl Cancer Inst 2009;101:1642-1649.
- Bushnell DL Jr, O‘Dorisio TM, O‘Dorisio MS, et al. 90Y-edotreotide for metastatic carcinoid refractory to octreotide. J Clin Oncol 2010;28:1652-1659.
- Dodd LE, Korn EL, Freidlin B, et al. Blinded independent central review of progression-free survival in phase III clinical trials: Important design element or unnecessary expense? J Clin Oncol 2008;26:3791-3796.
- Gupta S, Johnson MM, Murthy R, et al. Hepatic arterial embolization and c. hemoembo ization for the treatment of patients with metastatic neuroendocrine tumors: Variables affecting response rates and survival. Cancer 2005;104:1590-1602.
- Kennedy AS, Dezarn WA, McNeillie P, et al. Radioembolization for unresectable neuroendocrine hepatic metastases using resin 90Y-microspheres: Early results in 148 patients. Am J Clin Oncol 2008;31:271-279.
- Kouvaraki MA, Ajani JA, Hoff P, et al. Fluorouracil, doxorubicin, and streptozocin in the treatment of patients with locally advanced and metastatic pancreatic endocrine carcinomas. J CIin Oncol 2004;22: 762-4771.
- KuIke MH, Freed E, Chiang DY, et al. High-resolution analysis of genetic alterations in small bowel carcinoid tumors reveals areas of recurrent amplification and loss. Genes Chromosomes Cancer 2008;47:591-603.
- Kulke VH, Lenz HJ, Meropol NJ, et al. Activity of sunitinib in patients with advanced neuroendocrine tumors. J Clin Oncol 2008;26:3403-3410.
- Kvols LK, Moertel CG, O‘Connell MJ, et al. Treatment of the malignant carcinoid syndrome: Evaluation of a long-acting somatostatin analog. N Engi J Med 1986;315:663-666.
- Kwekkeboom DJ, de Herder WW, Kam BL, al. Treatment with the radiolabeled somatostatin analog [177 Lu-DOTA 0,Tyr3]octreotate: Toxicity, efficacy, and survival. J Clin Oncol 2008;26:2124-2130.
- Le Treut YP, Gregoire E, Be ohiti J, et al. Predictors of long-term survival after liver transplantation for metastatic endocrine tumors; An 85-case French multicentric report. Am J Transplant 2008;8:1205-1213.
- Mandys V. Neuroendokrinní nadory zažívacího traktu - historie a současnost, Čes-slov Patol 2009;45:57-63.
- Oberg K. Somatostatin analog octreotide LAR in gastro-entero-pancreatic tumors. Expert Rev Anticancer Ther 2009;9:557-566.
- Oberg KE, Rheubi JC, Kwekkeboom DJ, Krenning EP. Role of somatostatins in gastroenteropancreatic neuroendocrine tumor development and therapy. Gastroenterology 2010;139:742-753.
- Pavel M, Hainsworth JD, Baudin E, et al, A randomized, double-blind, placebo-controlled, multicenter phase III trial of everolimus + octreotide LAR vs. placebo + octreotide LAR in patients with advanced neuroendocrine tumors (NET) (RADIANT-2). Ann Oncol 2010;21:viii4,(abstr).
- Plockinger U, Rindi G, Arnold R, et al. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology 2004;80:394-424.
- Plockinger U, Wiedenmann E3, de Herder WW. ENETS Consensus Guidelines for the Standard of Care in Neuroendocrine Tumors. Neuroendocrinology 2009;90: 159-161.
- Raymond E, Niccoli-Sire P, Bang Y, et al: Updated results of the phase Ill trial of sunitinib versus placebo for treatment of advanced pancreatic neuroendocrine tumor (NET). Presented at 2010 Gastrointestinal Cancers Symposium, Orlando, FL, January 22-24, 2010 (abstr 127).
- Rindi G, Kloppel G, Cowielard A, et al. TNM staging of midgut and hindaut (neuro) endocrine tumors: A consensus proposal including a grading system. Virchovvs Arch 2007;451:757-762.
- Rinke A, Muller H, Schade-Brittinger C, et al. Placebocontrolled, double blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: A report from the PROMID Study Group. J Clin Oncol 2009;27:4656-4663.
- Sarmiento JM, Que FG. Hepatic surgery for metastases from neuroendocrine tumors. Surg Oncol Clin N Am 2003;12:231-242.
- Slaby O, Sachlova M, Bednarikova M, et al. Gene expression of somatostatin receptor 4 predicts clinical outcome of patients with metastatic neuroendocrine tumors treated with so matostatin analogs. Cancer Biother Radiopharm 2010;25: 237-243.
- Teunissen JJ, Kwekkeboom DJ, de Jong M, et al. Endocrine tumours of the gastrointestinal tract: Peptide receptor radio nuclide therapy. Best Pract Res Clin Gastroenterol 2005;19: 595-616.
- Yao JC, Hassan M, Phan A, et al. One hundred years after „carcinoid“: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Glin Oncol 2008;26: 3063-3072.
- Yao JC, Lombard-Bonas C, Baudin E, et al: Daily oral everolimus activity in patients with metastatic pancreatic neuroendocrine tumors after failure of cytotoxic chemotherapy: A phase II trial. J Clin Oncol 2010;28:69-76.
- Yao JC, Phan A, Hoff PM, et al. Targeting vascular endothelial growth factor in advanced carcinoid tumor: A random assignment phase II study of depot octreotide with bevacizumab and pegylated interferon alpha-2b. J Clin Oncol 2008;26:1316-1323.
- Yao JC, Phan AT, Fogleman D, et al. Randomized run-in study of bevacizumab (B) and everolimus (E) in low- to in termediate-grade neuroendocrine tumors (LGNETs) using perfusion CT as functional biomarker. J Clin Oncol 2010;28:301 (suppl, abstr 4002).
- Yao JC, Phan AT, Chang DZ, et al. Efficacy of RAD001 (everolimus) and octreotide LAR in advanced low- to intermediate-grade neuroendocrine tumors: Results of a phase II study. J Olin Oncol 2008;26:4311-4318.
- Yao JC, Shah MH, Ito T, et al. A randomized, double-blind, placebo-controlled, multicenter phase III trial of everolimus in patients with advanced pancreatic neuroendocrine tumors (pNET) (RADIANT-3). Ann Oncol 2010;21:viii4.
Datum přednesení příspěvku: 26. 1. 2012





