Konference: 2007 XIV. Jihočeské onkologické dny
Kategorie: Maligní lymfomy a leukémie
Téma: Diagnostika a léčba maligních lymfomů
Číslo abstraktu: 010
Autoři: MUDr. Robert Pytlík, Ph.D.
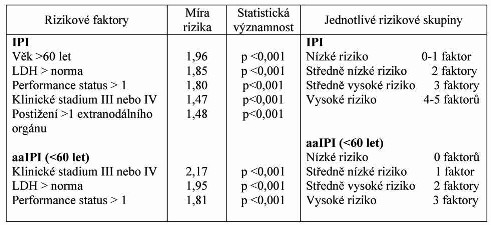
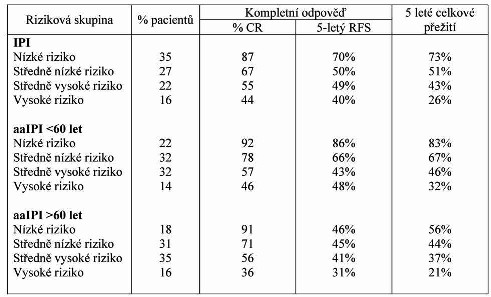
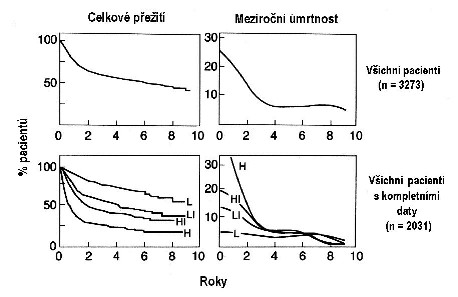
Moderní etapa léčby difusního velkobuněčného B-lymfomu začíná v roce 1993 zveřejněním Mezinárodního prognostického indexu (IPI) pro agresívní lymfomy (2). Tato studie zahrnovala i jiné lymfomy než DLBCL, ale validita zjištěných údajů pro pacienty s difusním velkobuněčným B-lymfomem byla později mnohokrát ověřena. Všichni zahrnutí pacienti byli léčeni režimy obsahujícími antracykliny. Mezinárodní prognostický index umožnil rozdělit pacienty na základě pěti jednoduchých klinických parametrů do čtyř skupin (Tabulka 1-2, Obrázek 1), které se lišily jak pravděpodobností dosažení kompletní remise, tak pravděpodobností přežití bez relapsu a pravděpodobností celkového přežití. Zveřejnění této studie pokládáme za nesmírně důležité právě proto, že ukázala, jaké výsledky můžeme očekávat u pacientů léčených tehdy standardní terapií a rovněž proto, že umožnila koncipovat klinické studie pro specifické kategorie pacientů (starší či mladší, s nižším či vyšším rizikem). Citovaná studie nám dodnes poskytuje užitečné údaje, podle kterých můžeme usoudit, nakolik je naše léčba pacientů s DLBCL úspěšnější než před patnácti či dvaceti lety.
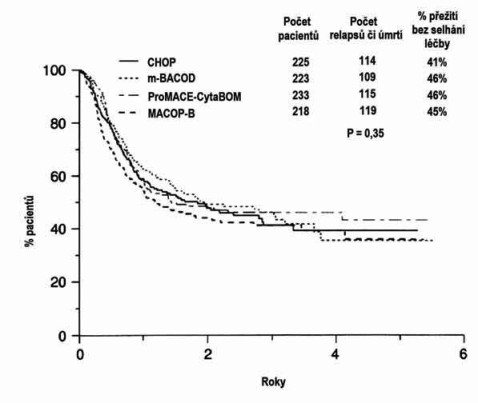
To, že je možné pacienty s DLBCL a s jinými agresívními lymfomy vyléčit kombinovanou chemoterapií s antracykliny, bylo známo již před zveřejněním studie definující Mezinárodní prognostický index. Shodou okolností rovněž v roce 1993 byla zveřejněna studie zkoumající, zda nové chemoterapeutické režimy 2. a 3. generace poskytují pacientům s agresívními lymfomy (opět nešlo pouze o DLBCL) lepší naději na vyléčení než standardní chemoterapie CHOP (3). Jak je dobře známo, výsledky této studie znamenaly pro mnohé zklamání, protože takzvané „intenzifikované“ režimy (ProMACE-CytaBOM, MACOP-B, m-BACOD) s sebou přinesly pouze vyšší toxicitu, ale nikoli lepší výsledky. Nicméně i tato studie byla nesmírně důležitá jednak v tom, že definovala jako léčebný standard jednoduchý a relativně nejméně toxický režim CHOP, jednak opět proto, že ukázala, co můžeme od této tehdy standardní léčby očekávat (kompletní remise cca u 60-70% pacientů s pokročilým onemocněním a dlouhodobé přežití bez progrese u cca 40-45% z nich - Obrázek 2).
Neúspěch chemoterapeutických režimů druhé a třetí generace byl dán především tím, že v době, kdy nebyly rutinně užívány růstové faktory, bylo nutno v těchto režimech snížit dávky klíčových léků (cyklofosfamid a antracykliny), aby bylo možno přidat do kombinace léky další. Po zavedení G-CSF a GM-CSF do klinické praxe bylo možné koncept dávkové intenzity nově zrevidovat a eskalovat výhradně nejúčinnější léky, mezi které se vedle cyklofosfamidu a antracyklinů zařadil i etoposid. Paralelně se začaly uplatňovat koncepty takzvané sekvenční terapie (indukce-intenzifikace), kdy jako intenzifikace byla používána především vysokodávkovaná chemoterapie s autologní transplantací (ASCT) v léčbě 1. linie.
Většina studií publikovaných ve druhé polovině 90. let byly fáze 2 studie a až v posledních deseti letech bylo publikováno několik randomizovaných klinických studií, které si svou váhu podržely dodnes.
Zvýšení dávkové intenzity konvenční chemoterapie se zabývaly dvě paralelní studie Německé skupiny pro studium vysoce maligních lymfomů (DSHNHL). V první z nich (NHL-B1) byli pacienti mladší 60 let s normálním LDH randomizováni do čtyř ramen: CHOP ve dvoutýdenních či třítýdenních intervalech (ramena CHOP-14 a CHOP-21) nebo CHOP s přidáním etoposidu ve stejných intervalech (CHOEP-14 a CHOEP-21). Ve dvoutýdenních intervalech dostávali pacienti G-CSF (Neupogen) ode dne 4 do dne 13 (4). Stejně koncipovaná byla i studie NHL-B2 (5), do níž byli randomizováni pacienti starší 60 let všech rizikových kategorií.
Výsledky jsou přehledně uvedeny v Tabulce 3. U mladších pacientů (NHL-B1) zvýšilo přidání etoposidu pravděpodobnost dosažení kompletní remise a 5letého přežití bez události (EFS) zhruba o 12% (p = 0,003 a p = 0,004), zatímco zkrácení intervalu ze tří na dva týdny zlepšilo 5leté celkové přežití (OS) o necelých 5% (p = 0,05 či 0,044 v multivariantní analýze). U starších pacientů (NHL-B2) zvýšilo zkrácení intervalu v režimu CHOP ze 3 na 2 týdny přežití bez události o 10% a celkové přežití o 13% v 5 letech (p <0,001 pro oba parametry v multivariantní analýze). Přidání etoposidu u těchto pacientů již pouze zvyšovalo celkovou toxicitu režimu oproti CHOP14.
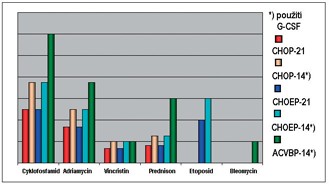
Doklad o účinnosti správně aplikované dávkové intenzity přinesla i studie francouzské studie GELA (6), která randomizovala pacienty ve věku 61-69 let mezi standardní režim CHOP-12 a intenzifikovaný režim ACVBP. Opět bylo dosaženo mírného zlepšení EFS o 10 % a OS o statisticky významného zlepšení o 10%, resp. o 8% (p = 0,005 a 0,036). Je ovšem nutno si uvědomit, že jak v německých, tak i ve francouzské studii bylo nutno ke zlepšení sledovaných parametrů o 5 či 10% zvýšit dávkovou intenzitu o několik desítek procent (Obrázek 3).
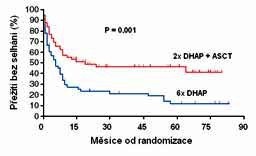
Jako další možnost zlepšení léčebných výsledků u nově diagnostikovaných rizikových pacientů s DLBCL byla zkoumána možnost užití vysokodávkované chemoterapie s autologní transplantací jako konzolidační terapie. Tento koncept získal teoretickou podporu po roce 1995, kdy byly zveřejněny výsledky tzv. PARMA studie (7), které ukázaly, že u relabovaných či primárně rezistentních agresívních lymfomů, které jsou chemosenzitivní na léčbu druhé linie, vede autologní transplantace ke zlepšení přežití bez selhání terapie (Obrázek 4) i ke zlepšení celkového přežití oproti konvenční léčbě. Randomizované studie zkoumající tuto strategii strategie jako součásti léčby první linie však přinesly přinejlepším rozporuplné výsledky, v některých případech dokonce pacienti léčení ve standardních ramenech dosahovali lepších výsledků než pacienti v ramenech transplantačních. Dvě recentně publikované metaanalýzy (8, 9) neprokázaly výhodu autologní transplantace v první kompletní remisi, a to ani u rizikových pacientů. Obě tyto práce se ovšem potýkaly s extrémní heterogenitou publikovaných prací, která znesnadňuje jejich přímé srovnání. V řadě studií byli pacienti zařazení do ramene s ASCT léčeni zkrácenou indukční terapií, jinde dokonce byla dávková intenzita indukční léčby nižší v „intenzifikovaném“ rameni než v rameni „standardním“ (10). V řadě studií značná část pacientů zařazená do transplantační větve nakonec transplantována nebyla. Strehlova metaanalýza (8) naznačila, že autologní transplantace jako součást léčby první linie by mohla být prospěšná u pacientů se středně vysokým či vysokým rizikem dle IPI, kteří dostanou nezkrácenou standardní léčbu před autologní transplantací a je u nich dosaženo optimální cytoredukce. Eventuální další studie mohou dále prokázat efekt transplantace za předpokladu, že budou zahrnovat především mladší pacienty (věkový medián <40 let), z nichž alespoň 50% bude mít masívní nádor (>10 centimetrů v průměru) a pokud alespoň 75% pacientů zařazených do transplantačního ramene bude skutečně transplantováno.
Z předchozích odstavců je patrné, že další zvyšování dávkové intenzity u pacientů s DLBCL je obtížně představitelné a k dalšímu zlepšení léčebných výsledků bude třeba zvolit jinou strategii. AntiCD20 protilátka Rituximab (Mabthera) byla prvně použita v monoterapii u nízce maligních B lymfomů, ale brzy bylo zjištěno, že i u agresívních B-lymfomů má významnou klinickou aktivitu (11). Její přidání ke standardnímu antracyklinovému režimu přineslo výrazné zlepšení léčebných výsledků jak u starších pacientů (studie ECOG 4494/CALGB 9793 a GELA), tak u mladších pacientů s nízkými rizikem (studie MInT). Výsledky těchto randomizovaných studií byly dále potvrzeny studiemi z lymfomových registrů (z registru Britské Kolumbie a z registru Kooperativní lymfomové skupiny).
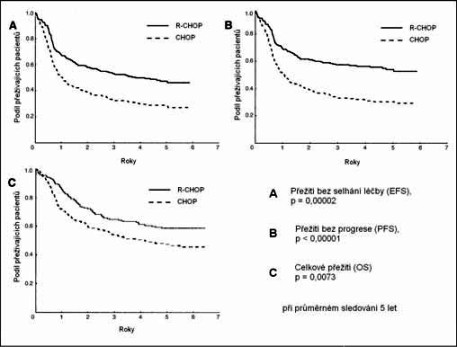
Francouzská studie GELA LNH 98-5 byla prvně publikována v roce 2002 a doplněna delším sledováním v roce 2005 (12, 13). Přidání Rituximabu k režimu CHOP zvýšilo počet kompletních remisí o 12% (75% v. 63%), pětileté přežití bez progrese (PFS) téměř o dvojnásobek (54% v. 30%), a celkové pětileté přežití o 13% (58% v. 65%). Důležité je, že tyto výsledky jsou stabilní i po delší době sledování a nůžky mezi rameny s Rituximabem a bez něho se spíše nadále rozvírají (Obrázek 5). Americká studie ECOG 4494/CALGB 9793 dosáhla obdobných výsledků, i když design studie byl komplikován zařazením „udržovací“ terapie Rituximabem, což poněkud znesnadňuje interpretaci výsledků (14). Platnost uvedených výsledků pro starší věkové skupiny pacientů byla potvrzena i studií RICOVER, která užívala 14denní CHOP a kromě randomizace do ramene s rituximabem či bez něho randomizovala ještě mezi 6 a 8 cyklů chemoterapie. Konečná analýza této studie dosud nebyla zveřejněna, ale opět byly potvrzeny lepší výsledky větví s rituximabem a navíc bylo prokázáno, že 6 cyklů chemoterapie je stejně účinných jako 8 cyklů.
Mezinárodní studie MInT, jejíž konečné výsledky byly publikovány v loňském roce (15), potvrdila účinnost chemoterapie kombinované s Rituximabem i u mladších, méně rizikových pacientů (věkově upravené IPI 0-1). Tato studie se od obou předchozích lišila v tom, že umožňovala použít i jiné režimy než CHOP, jmenovitě CHOEP, MACOP-B či PMitCEBO. Kombinované výsledky opět potvrdily superioritu režimů s rituximabem: přežití bez události (EFS) bylo v režimech s rituximabem vyšší o 20% ve 3 letech (79% v. 59%, p = 0,0001). Celkové přežití se sice lišilo pouze o 8% (93% v. 84%), ale i tak bylo statisticky vysoce významné (p = 0,0001); navíc je nutno mít na paměti, že šlo o mladé pacienty s nízkým rizikem, kteří v případě relapsu dostávali záchranný režim s rituximabem a v případě chemosenzitivity byli transplantováni. Nejdůležitější výsledky studie MiNT jsou znázorněny na Obrázku 6. Z dalších výsledků je třeba uvést, že nebyl zjištěn žádný rozdíl v léčebných výsledcích pacientů léčených režimem R-CHOP a R-CHOEP, přestože lepší výsledky CHOEP oproti CHOP byly potvrzeny, pokud tyto režimy byly podány bez rituximabu. Zdá se tedy, že rituximab může působit jako jakýsi „chemoekvalizér“, který umožní alespoň některé pacienty ušetřit nežádoucích důsledků dávkově intenzifikované léčby.
Výsledky uvedených studií byly potvrzeny i daty ze specializovaných lymfomových registrů, jmenovitě z Britské Kolumbie (16, Obrázek 7 a, b) a z České kooperativní lymfomové skupiny. Je tedy zřejmé, že rituximab prospívá nejen pacientům splňujícím často přísná kritéria klinických studií, ale celé široké populaci nemocných s difusním velkobuněčným B-lymfomem. Registrová data rovněž do určité míry vyvažují skutečnost, že žádná studie R-chemoterapie versus chemoterapie samotná nebyla dosud provedena u mladších rizikových pacientů a patrně ani provedena nebude.
Data z Britské Kolumbie rovněž umožnila upravit Mezinárodní prognostický index (IPI) tak, aby byl aplikovatelný pro pacienty léčené chemoimunoterapií s rituximabem (tzv. R-IPI) (17). Jak je patrné z Obrázku 7 c a d, v současné době neexistuje skupina pacientů, která by při léčbě R-CHOP měla pravděpodobnost vyléčení menší než 50%. Výrazný problém ovšem představuje skutečnost, že neumíme na základě R-IPI (a zatím ani na základě jiných parametrů, protože se zdá, že rituximab dokáže vymazat nepříznivý vliv exprese bcl-2, absence exprese bcl-6 či nepříznivého profilu genové exprese).
Kooperativní lymfomová skupina se už téměř deset let systematicky zabývá terapií mladších pacientů (do 60 či 65 let) s rizikovým DLBCL (2-3 nepříznivé faktory dle věkově upraveného IPI). První dvě studie fáze II (MegaCHOP-BEAM a MegaCHOP-ESHAP-BEAM) byly koncipovány ještě před zařazením rituximabu do léčby agresívních B-lymfomů. Sestávaly ze 3 až 6 cyklů intenzívní indukce, završené konzolidací vysokodávkovanou terapií a ASCT. Tyto studie zahrnovaly i pacienty s T lymfomy, což se odrazilo na celkových výsledcích (Obrázek 8). Pokud však analýzu omezíme pouze na pacienty s difusními velkobuněčnými B-lymfomy a obě studie zkombinujeme, získáme data pro přežití bez progrese (PFS) 59% a pro celkové přežití 70% v 5 letech. Pravděpodobnost celkového přežití i přežití do progrese byla zejména v první z těchto studií výrazně závislá na věkově upraveném IPI.
Třetí studie, R-MegaCHOP-ESHAP-BEAM, zařadila do léčebného schématu k šesti cyklům intenzívní indukce šest dávek rituximabu ve standardním dávkování. Celkem bylo zahrnuto 107 pacientů, z toho 105 mohlo být analyzováno. Při předběžné analýze prvních 65 pacient bylo dvouleté přežití bez progrese (PFS) 80% a celkové dvouleté přežití 82%. Nebyl žádný rozdíl mezi pacienty s aaIPI 2 a aaIPI 3 (Obrázek 9). Při srovnání s předchozími dvěma studiemi pozorujeme ve studii s Rituximabem trend k lepšímu celkovému přežití i přežití bez progrese, i když pouze přežití bez progrese je statisticky významné. Výsledné hodnocení studie bude uvedeno na ASH 2007.
Zavedení pozitronové emisní tomografie (PET) ukazuje, že pacienti, kteří dosáhnou PET negativity po dvou či čtyřech cyklech terapie, mají výrazně lepší naději na vyléčení, než pacienti, kteří PET negativity nedosáhnou (18). Tento koncept dosud nebyl studován v prospektivní studii, respektive taková studie dosud nebyla publikována. Právě taková studie je však v současné době připravována Kooperativní lymfomovou skupinou (PET-RIMCEB). Druhou otázkou, na kterou by měla tato studie odpovědět, je význam autologní transplantace u rizikových pacientů v 1. kompletní remisi. Pacienti v této studii budou léčeni dvěma cykly chemoterapie R-MegaCHOP, se čtyřmi dávkami rituximabu. Po provedení PET vyšetření budou PET negativní pacienti randomizováni do větve netransplantační (léčba 3. cyklem R-MegaCHOP a následně 3 cykly R-CHOP) nebo do větve transplantační (3. cyklus R-MegaCHOP, 3x R-CHOP a vysokodávkovaná terapie s ASCT). Pacienti, kteří budou po 2. R-MegaCHOP PET pozitivní, budou pokračovat v původním protokolu R-MegaCHOP-ESHAP-BEAM. Schéma studie je uvedeno přehledně na Obrázku 10. Vzhledem k tomu, že dle předběžných zkušeností je pouze zhruba 25% pacientů po 2-3 cyklech R-MegaCHOP PET pozitivních, mohla by tato strategie v budoucnu vést ke snížení léčebné zátěže u výrazného počtu mladších rizikových pacientů s DLBCL.
Současná doporučení KLS pro léčbu pacientů s difusním velkobuněčným B-lymfomem vycházejí z výše uvedených poznatků. Pro pacienty nad 60 let a pro pacienty mladší 60 let s aaIPI 0-1 pokládáme za standardní terapii 6-8x R-CHOP (celkem vždy s 8 dávkami rituximabu), preferenčně po 2 týdnech s použitím růstových faktorů, pokud jsou toto pacienti schopni tolerovat. Pacienty, kteří dostanou alespoň 4 cykly chemoterapie CHOP a všech 8 dávek rituximabu, je možno referovat či přímo zařazovat do studie NHL-13, která zkoumá význam udržovacího rituximabu u pacientů s difusním velkobuněčným B-lymfomem. Pro mladší rizikové nemocné doporučujeme zvážit autologní transplantaci v léčbě 1. linie, buď po 6-8 cyklech R-CHOP nebo v rámci protokolu R-MegaCHOP-ESHAP-BEAM, po otevření studie PET-RIMCEB pak v rámci této studie. Doporučení pro léčbu relapsů se nemění - opět záchranný režim s rituximabem (R-DHAP, R-ESHAP, R-ICE) a autologní transplantaci. Po znovuotevření studie CORAL budeme moci pacienty opět referovat do této studie, v jejímž rámci rovněž probíhá randomizace mezi udržovací léčbu rituximabem a sledování.
Literatura
- The Non-Hodgkin’s Lymphoma Classification Project. A Clinical
Evaluation of the International Lymphoma Study Group Classification
of Non-Hodgkin’s Lymphoma. Blood, 89: 3909-3918; 1997.
- The International Non-Hodgkin’s Lymphoma Prognostic Factor
Project: A predictive model for aggressive non-Hodgkin’s lymphoma.
The New Engl J Med, 329: 987-994; 1993.
- Fisher RI, Gaynor ER, Dahlberg S, et al. Comparison of a
Standard Regimen (CHOP) with Three Intensive Chemotherapy Regimens
for Advanced Non-Hodgkin’s Lymphoma. The New Engl J Med, 328:
1002-1006; 1993.
- Pfreundschuh M, Trumper L, Kloess M, et al, for the German
High-Grade Non-Hodgkin’s Lymphoma Study Group (DSHNHL). Two-weekly
or 3-weekly CHOP chemotherapy with or without etoposide for the
treat-
ment of young patients with good-prognosis (normal LDH) aggressive lymphomas: results of the NHL-B1 trial of the DSHNHL. Blood, 104: 626-633; 2004. - Pfreundschuh M, Trumper L, Kloess M, et al, for the German
High-Grade Non-Hodgkin’s Lymphoma Study Group (DSHNHL). Two-weekly
or 3-weekly CHOP chemotherapy with or without etoposide for the
treatment of elderly patients with aggressive lymphomas: results of
the NHL-B2 trial of the DSHNHL. Blood, 104: 634-641;
2004.
- Tilly H, Lepage E, Coiffier B, et al. Intensive conventional
chemotherapy (ACVBP regimen) compared with standard CHOP for
poor-prognosis aggressive non-Hodgkin lymphoma. Blood, 102:
4284-4289; 2003.
- Philip T, Guglielmi C, Hagenbeek A, et al. Autologous bone
marrow transplantation as compared with salvage chemotherapy in
relapses of chemotherapy-sensitive non-Hodgkin’s lymphoma. N Engl J
Med, 333:
1540-1545; 1995 - Strehl J, Mey U, Glasmacher A, et al. High-dose chemotherapy
followed by autologous stem cell transplantation as first-line
therapy in aggressive non-Hodgkin’s lymphoma: a meta-analysis.
Haematologica,
88:1304-1315; 2003. - Greb A, Bohlius J, Trelle S, et al. High-dose chemotherapy with
autologous stem cell support in first-line treatment of aggressive
non-Hodgkin lymphoma - results of a comprehensive meta-analysis.
Cancer Treat Rev, 33: 338-46; 2007.
- Gisselbrecht C, Lepage E, Molina T, et al. Shortened first-line
high-dose chemotherapy for patients with poor-prognosis aggressive
lymphoma. J Clin Oncol. 2002; 20: 2472-2479.
- Coiffier B, Haioun C, Ketterer N, et al. Rituximab (anti-CD20
monoclonal antibody) for the treatment of patients with relapsing
or refractory aggressive lymphoma: A multicenter phase II study.
Blood, 92: 1927-1932; 1998.
- Coiffier B, Lepage E, Briere J, et al. CHOP chemotherapy plus
rituximab compared with CHOP alone in elderly patients with diffuse
large-B-cell lymphoma. N Engl J Med; 346: 235-242, 2002.
- Feugier P, Van Hoof A, Sebban C, et al. Long-Term Results of
the R-CHOP Study in the Treatment of Elderly Patients With Diffuse
Large B-Cell Lymphoma: A Study by the Groupe d’Etude des Lymphomes
de l’Adulte. J Clin Oncol, 23: 4117-4126; 2005.
- Habermann MT, Weller EA, Morrison VA, et al. Rituximab-CHOP
Versus CHOP Alone or With Maintenance Rituximab in Older Patients
With Diffuse Large B-Cell Lymphoma. J Clin Oncol, 24: 3121-3127;
2006.
- Pfreundschuh M, Trumper L, Osteborg A, et al. CHOP-like
chemotherapy plus rituximab versus CHOP-like chemotherapy alone in
young patients with good-prognosis diffuse large-B-cell lymphoma: a
randomised controlled trial by the MabThera International Trial
(MInT) Group. Lancet Oncol, 7: 379-391; 2006.
- Sehn LH, Donaldson J, Chhanabhai M, et al. Introduction of
Combined CHOP Plus Rituximab Therapy Dramatically Improved Outcome
of Diffuse Large B-Cell Lymphoma in British Columbia. J Clin Oncol,
23: 5027-5033; 2005.
- Sehn LH, Berry B, Chhanabhai M, et al. The revised
International Prognostic Index (R-IPI) is a better predictor of
outcome than the standard IPI for patients with diffuse large
B-cell lymphoma treated with
R-CHOP. Blood, 109: 1857-1861; 2007. - Haioun C, Itti E, Rahmouni A, et al.
[18F]fluoro-2-deoxy-D-glucose positron emission tomography
(FDG-PET) in aggressive lymphoma: an early prognostic tool for
predicting patient outcome. Blood. 2005 Aug
15;106(4):1376-81.
Tabulka 1 - Rizikové faktory a rozdělení pacientů do
jednotlivých rizikových skupin podle IPI a aaIPI.
IPI = Mezinárodní prognostický index, aaIPI = věkově upravený
Mezinárodní prognostický index.Tabulka 3.
Tabulka 2 - Parametry přežití u pacientů jednotlivých
rizikových skupin podle IPI. CR = kompletní remise, RFS = přežití
bez relapsu.
Tabulka 3 Srovnání výsledků 14 a 21denních režimů CHOP s
etoposidem (CHOEP) či bez něho. LDH = laktátdehydrogenáza, CR =
kompletní remise, EFS = přežití bez události (bez relapsu či bez
úmrtí z jakékoli příčiny), OS = celkové přežití. Vyznačeny jsou
statisticky významné rozdíly. Každá studie měla jiný způsob
hodnocení, ve studii NHL-B1 byly porovnávány 14denní a 21denní
režimy mezi sebo a režimy s etoposidem a bez etoposidu mezi sebou;
ve studii NHL-B2 byly všechny režimy porovnávány s CHOP-21.

Obrázek 1 - Celkové přežití a míra úmrtnosti všech pacientů
s agresívními lymfomy (horní grafy) a celkové přežití a míra
úmrtnosti u jednotlivých rizikových skupin podle Mezinárodního
prognostického indexu (IPI) – podle The International Non-Hodgin’s
Lymphoma Prognostic Factor Project, 1993.
Obrázek 2 - Srovnání režimu CHOP se třemi intenzifikovanými
režimy (m-BACOD, ProMACE-CytaBOM a MACOP-B) v léčbě
agresívních lymfomů - podle Fisher et al, 1993.
Obrázek 3 - Srovnání relativní dávkové intenzity režimu
CHOP-21 se třemi dávkově intenzifikovanými režimy (CHOP-14,
CHOEP-21, CHOEP-14, ACVBP-14). Dávková intenzita = množství léku
podaného v jednom týdnu jednoho chemoterapeutického cyklu. Uvedené
vztahy jsou relativní, protože absolutní dávky léků se liší
natolik, že by neumožňovaly vytvoření srozumitelného grafu.
Obrázek 4 - Přežití bez selhání léčby v rameni s autologní
transplantací a v rameni s konvenční chemoterapií ve studii PARMA.
Celkové přežití vychází rovněž statisticky významně ve prospěch
transplantace (p = 0,038) - podle Philip et al, 1995.
Obrázek 5 - Výsledky dlouhodobého sledování studie GELA LNH
98-5 (R-CHOP v. CHOP) - podle Feugier P et al, 2005.
Obrázek 6 - Hlavní výsledky studie MInT - podle Pfreundschuh
et al, 2006.
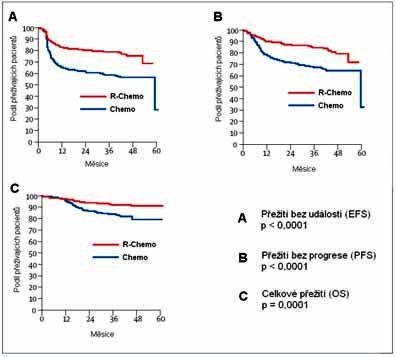
Obrázek 7 - Výsledky léčby CHOP a R-CHOP z registru Britské
Kolumbie (a, b) a konstrukce nového prognostického indexu (R-IPI).
Při léčbě rituximabem dochází ke sblížení prognózy pacientů s 1-2
nepříznivými faktory a se 3-5 nepříznivými faktory dle původního
IPI (c). Sdružení těchto skupin vede k vytvoření třech křivek
pro pacienty s různou prognózou dle R-IPI (d, e).
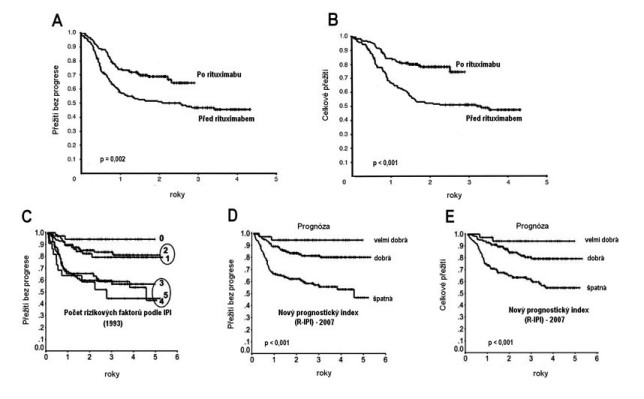
Obrázek 8 - Přežití bez progrese a celkové přežití v
kombinovaných studiích MegaCHOP-BEAM a MegaCHOP-ESHAP-BEAM
Kooperativní lymfomové skupiny (všichni pacienti, včetně
non-DLBCL).HhH
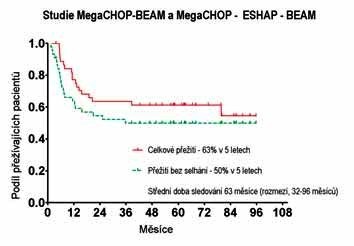
Obrázek 9 - Přežití bez progrese a celkové přežití ve studii
R-MegaCHOP-ESHAP-BEAM (předběžná analýza 65 pacientů).
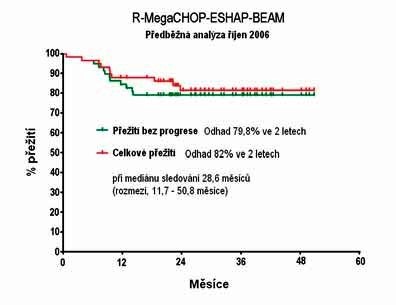
Obrázek 10 - Schéma připravovanéstudie PET-RIMCEB (viz
text).
Datum přednesení příspěvku: 12. 10. 2007





