Zahrnuje skvamozní karcinom (lokalizován zejména v proximálních 2/3 jícnu) a adenokarcinom (v distálním jícnu a gastroezofageální junkci). U všech pacientů s karcinomem jícnu je nutné věnovat zvýšenou pozornost podpůrné léčbě, zejména zajištění nutriční podpory. Posouzení strategie léčby probíhá cestou multidisciplinární komise. Primární léčba je založena na lokalizaci a rozsahu nádoru, histologickém typu, komorbiditách/PS pacienta. Doporučené léčebné postupy jsou kategorie 1, není-li uvedeno jinak.
Chirurgická léčba:
Chirurgická resekce karcinomu jícnu (ezofagektomie) je indikována ve stadiu I–IV a vždy po individuálním posouzení multidisciplinární komise. Chirurgická léčba se týká všech oddílů jícnu s výjimkou krčního jícnu, kde je preferována definitivní chemoradioterapie, i zde lze však ve výjimečných případech volit chirurgické řešení. Klíčovým faktorem úspěšnosti chirurgické resekce je vzhledem k náročnosti výkonu a zátěže pro pacienta optimální selekce pacientů schopných prodělat extenzivní chirurgický výkon. Důležitá je adekvátní předoperační příprava včetně rehabilitace a nutriční intervence. Rozsah resekce jícnu a typ výkonu je dán lokalizací nádoru a rozsahem nádorového postižení včetně uzlin. Dále zde hraje roli i expertíza operatéra. V případě karcinomu kardie je indikace ezofagektomie jednoznačná u nádoru typu Siewert I, většinou u nádorů Siewert II tam, kde orální konec nádorů zasahuje více jak 3 cm nad gastroezofageální junkci, v tomto stadiu ale není optimální postup vyjasněn (je možná ezofagektomie i gastrektomie). Nádory typu Siewert III jsou léčeny jako primární nádory žaludku. Ve výjimečných případech rozsáhlých nádorů postihujících žaludek i jícen bez významného postižení uzlin je možná ezofagogastrektomie. Operace se liší typem přístupu (pravostranná či levostranná torakotomie a laparotomie, torakofrenolaparotomie, ezofagektomie bez torakotomie), volbou štěpu – náhrady jícnu a jeho umístěním (žaludek, tlusté střevo, jejunum v původní lokalizaci v zadním mediastinu či retrosternálně), technikou anastomosy a její lokalizací (nitrohrudní, krční). Nedílnou součástí operačního výkonu je lymfadenektomie, jedná se o standardní či rozšířenou (en bloc) lymfadenektomii, zahrnující spádové oblasti jícnu v celém jeho nitrohrudním a nitrobřišním průběhu. V indikovaných případech se může jednat o tzv. lymfadenektomii 3 polí, tj. včetně krční disekce.
V určité části případů lze jícen resekovat miniinvazivně (MIE), jedná se buď o čistě miniivazivní či kombinovanované (hybridní) výkony, totéž se týká robotických ezofagektomií (RAMIE), jejichž podíl celosvětově narůstá. Miniinvazivní výkony jsou spojeny s nižší perioperační morbiditou, kratší délkou hospitalizace, dle některých studií i s prodlouženým přežíváním pacientů.
Limitované onemocnění (cT1-T2cN0M0)
Základem je chirurgická léčba. U pacientů s T1a adenokarcinomem je preferována endoskopická resekce. U pacientů s nádorem T1/T2N0 je primární léčba chirurgická, bez neoadjuvantní léčby. Není-li operace možná z důvodu komorbidit nebo nesouhlasu pacienta, je preferována kombinovaná chemoradioterapie, která má lepší výsledky než radioterapie samotná.
Doporučení pro endoskopickou léčbu premaligních a časných maligních lézí jícnu jsou zpracovány a dostupné na www.endoskopiste.cz/wp-content/uploads/2021/06/barrett-guidelines.pdf.
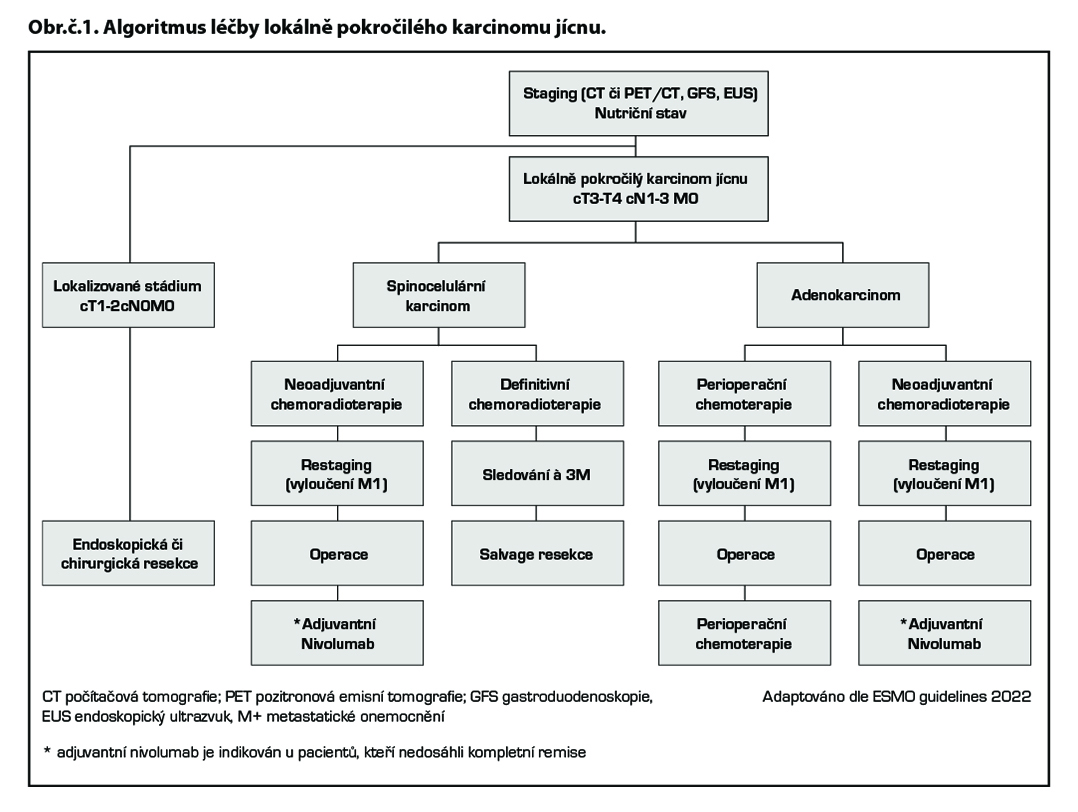
Lokálně pokročilé onemocnění (cT3-T4 nebo cN1-3 M0)
Neoadjuvantní léčba je indikována u operabilních pacientů.
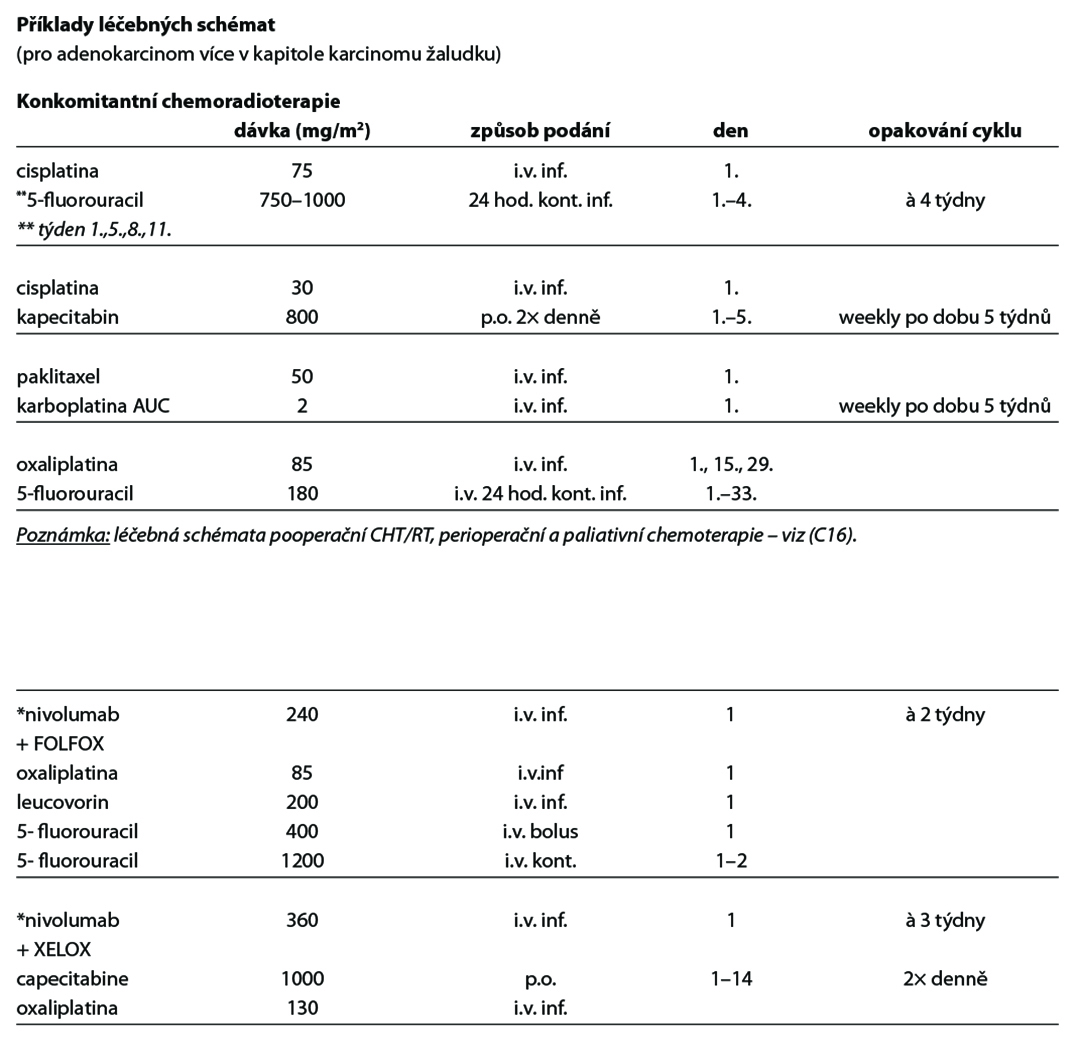
U pacientů se skvamozním karcinomem je preferována chemoradioterapie před pouhou chemoterapií (dosažení vyššího počtu radikálních resekcí a lepší lokální kontroly). Standardem léčby je tedy neoadjuvantní konkomitantní chemoradioterapie, následně operace. Preferovaným chemoterapeutickým režimem je režim studie CROSS (paklitaxel/karboplatina podávaný 1× týdně s radioterapií o dávce 41,4 Gy aplikované ve 23 frakcích).
Definitivní kurativní chemoradioterapie (CHTRT) se doporučuje v případě krční lokalizace nádoru a je volbou u pacientů bez možnosti chirurgické léčby (T4b, neresekabilní nádor, komorbidity, odmítnutí pacientem). Po definitivní chemoradioterapii je indikováno sledování. V případě perzistence tumoru či lokální progrese může následovat elektivní chirurgický
výkon. Tradičním standardním režimem definitivní chemoradioterapie jsou čtyři série chemoterapie založené na fluorouracilu (kapecitabinu) a cisplatině v kombinaci s radioterapií o dávce 50,4 Gy v 28 frakcích (nebo 50 Gy ve 25 frakcích). Dávka radioterapie >50,4 Gy nepřinesla lepší lokální kontrolu ani delší přežití, navíc dávky nad >55 Gy zvyšovaly postoperační mortalitu a morbiditu v případě salvage ezofagektomie. Alternativním chemoterapeutickým režimem je 6× FOLFOX nebo režim studie CROSS (týdenní paklitaxel s karboplatinou). Tento režim je lépe tolerován a akceptován jako standard i v rámci definitivní chemoradioterapie.
Pro adenokarcinomy jícnu a gastroezofageální junkce je indikována perioperační chemoterapie nebo neoadjuvantní chemoradioterapie.
Perioperační chemoterapie (CHT) je založena na kombinaci docetaxelu, oxaliplatiny a fluoropyrimidinu, případně dle stavu pacienta, jeho věku a komorbidit pouze na dvojkombinaci platinového derivátu a fluoropyrimidinu, v celkové délce 8–9 týdnů před a 8–9 týdnů po operaci (viz doporučení u karcinomu žaludku).
Dle retrospektivní metaanalýzy dat z pěti randomizovaných studií fáze III vedla perioperační chemoterapie založená na dvojkombinaci 5-fluorouracilu a platinovém derivátu u skupiny s MSI-H/MMR-D k horším výsledkům než samostatná chirurgie, a proto by tato skupina pacientů neměla být léčena perioperační dvojkombinací fluoropyrimidinu a platinového derivátu.
Perioperační léčba u dMMR/MSI-H adenokarcinomů: prospektivní studie fáze II, a to francouzská NEONIPIGA (ipilimumab/nivolumab), italská INFINITY (tremelimumab/durvalumab), dokladovaly u pacientů s lokálně pokročilým primárně operabilním dMMR/MSI-H adenokarcinomem GEJ/žaludku léčených samotnou neoadjuvantní imunoterapií dosažení patologické kompletní remise (pCR) až v 60 % případů (pT0N0). Podobně data ze studie fáze II DANTE ověřila přínos kombinace FLOT a atezolizumab. Léčba checkpoint inhibitory nabízí u této skupiny pacientů možnost orgán záchovného postupu. Všichni pacienti s lokálně pokročilým adenokarcinomem by měli být testováni na dMMR/MSI-H stav a v případě deficitu/instability konzultováni cestou multidisciplinárního týmu. Léčba checkpoint inhibitory v této indikaci však není hrazena a postup by měl být individuální.
Neoadjuvantní chemoradioterapie: je preferovaným postupem u proximálněji uložených či hraničně operabilních tumorů; preferovaným režimem je paklitaxel/karboplatina, případně lze použit kombinaci fluorouracil/oxaliplatina. Oxaliplatina nahradila cisplatinu pro srovnatelný efekt při lepší toleranci. Neoadjuvantní chemo (radio) terapie je následována resekcí nádoru jícnu s disekcí lymfatických uzlin.
Přímé srovnání efektu neoadjuvantní chemoradioterapie versus chemoterapie provedla v roce 2021 randomizovaná studie fáze III Neo-AEGIS. Neo-AEGIS porovnávala dva standardní režimy, a to předoperační CHTRT (CROSS režim) a perioperační CHT (režim ECF nebo FLOT). Mezi oběma léčebnými rameny nebyl pozorován žádný rozdíl v OS, avšak v rameni s radioterapií bylo dosaženo vyšší lokoregionální odpovědi a vyššího počtu patologických kompletních remisí. Většina pacientů v rameni s CHT však byla léčena starším režimem ECF a nikoliv více účinným režimem FLOT. Definitivní porovnání obou léčebných modalit poskytnou data ze studie ESOPEC, která srovnává režim CROSS s FLOT.
Adjuvantní imunoterapie u lokálně pokročilého karcinomu jícnu a GEJ: ve studii CheckMate 577 prodloužila adjuvantní imunoterapie nivolumabem dobu do relapsu onemocnění pacientů (DFS) s karcinomem jícnu a GEJ, kteří byli léčeni neoadjuvantní konkomitantní chemoradioterapií s následnou operací a nedosáhli kompletní remise (medián DFS byl 22,4 měsíců vs 11,0 měsíců v rameni s placebem (HR pro rekurenci či smrt 0,69; 96,4 % CI, 0,56 až 0,86; P <0,001)).
Lokálně pokročilé neresekabilní či metastatické onemocnění
Systémová léčba
- Výběr chemoterapeutického režimu v první linii závisí na celkovém stavu pacienta, komorbiditách, profilu nežádoucích účinků léčby. Systémová chemoterapie adenokarcinomu jícnu a GEJ je analogická léčbě adenokarcinomu žaludku. U skvamozního karcinomu je preferována kombinace na bázi fluorouracilu a platinového derivátu. Většina režimů u skvamozního karcinomu je přejata ze studií s adenokarcinomem, nicméně studie fáze II potvrdily standard kombinace cisplatiny a 5-FU. Infuzní fluorouracil a kapecitabin jsou volně zaměnitelné, stejně jako cisplatina a oxaliplatina. Starší a křehcí pacienti mohou být na základě dat ze studie fáze III GO2 léčeni režimem XELOX, případně FOLFOX, s redukcí dávky na 60 %. Tento režim prokázal stejnou účinnost s nižší toxicitou. Podobně, stejná studie prokázala benefit pro skupinu pacientů, u nichž byla zvažována pouze symptomatická terapie, OS byl nesignifikantně delší při použití chemoterapie versus BSC.
- U adenokarcinomu je standardem kombinace fluorouracilu a oxaliplatiny, případně cisplatiny. Efektivita a dobrá tolerance irinotekanu byla prokázána ve francouzské studii f. III (French Intergroup Study). FOLFIRI je léčebnou alternativou k platinovému režimu v první linii metastatického onemocnění (2A). U adenokarcinomů gastroezofageální junkce s expresí
HER2 prodlužuje přežití kombinace trastuzumabu a chemoterapie cisplatina/fluorouracil. Všichni pacienti musí mít validní laboratorní metodou v referenční laboratoři prokázanou expresi HER2 a výsledek IHC2+ potvrzen pozitivním výsledkem SISH nebo FISH. V případě kontraindikace nebo intolerance cisplatiny je možná náhrada oxaliplatinou. - U HER2 pozitivních adenokarcinomů GEJ a žaludku je po progresi po předchozí léčbě režimem založeném na trastuzumabu indikován *trastuzumab deruxtekan (podrobněji viz adenokarcinom žaludku).
- Chemoterapie dalších linií závisí na celkovém stavu pacienta a předchozí chemoterapii. Studie REGARD a RAINBOW zavedly standardní léčbu 2. linie – důkaz o prodloužení přežití v randomizované studii fáze III oproti placebu – na základě těchto studií je *ramucirumab (CYRAMZA) od 12/2014 registrován EMA v této indikaci samostatně nebo v kombinaci s paklitaxelem. Cytostatika s prokázanou aktivitou jsou taxany, irinotekan.
- Chemoterapie 3. a vyšší linie. *Trifluridine/tipiracil je cytostatická kombinace antimetabolitu trifluridinu a inhibitoru thymidinfosforylázy tipiracilu, jehož účinnost a bezpečnost byla zhodnocena studií III. fáze (TAGS) u pacientů s metastazujícím karcinomem žaludku (včetně adenokarcinomu gastroesofageální junkce), kteří byli dříve léčeni alespoň dvěma režimy systémové terapie pro pokročilé stádium onemocnění zahrnující chemoterapii založenou na fluoropyrimidinu, platině a buď taxanu nebo irinotekanu, spolu s odpovídající terapií anti HER2. Trifluridine/tipiracil vedl ke statisticky signifikantnímu zlepšení OS (medián OS 5,7 měsíce vs 3,6 měsíce v rameni s placebem; HR 0,69 (95% CI: 0,56, 0,85;p = 0,0003).
Imunoterapie u lokálně pokročilého a metastatického karcinomu jícnu a GEJ
Imunoterapie je v první linii účinná u obou histologických typů s lehce lepším efektem u skvamózního karcinomu. Studie fáze III CheckMate 648 randomizovala pacienty s lokálně pokročilým inoperabilním či metastatickým skvamozním karcinomem do ramene s nivolumabem, fluorouracilem a cisplatinou nebo nivolumabem plus anti-CTLA-4 protilátkou ipilimumabem nebo chemoterapií samotnou. Pacienti léčeni nivolumabem, fluorouracilem a cisplatinou měli prodloužený OS ve srovnání s chemoterapií samotnou, s maximem účinku ve skupině exprimující PD-L1 (hodnoceno dle TPS≥1%: medián OS 15,4 versus 9,1 měsíce (HR 0,54, 99,5% CI 0,37-0,80; P<0,001)). Nivolumab–ipilimumab také prodlužuje OS ve srovnání s chemoterapií (TPS≥1%: medián OS 13,7 versus 9,1 měsíce; HR 0,64; 98,6% CI, 0,46 – 0,90; P=0,001), avšak nikoliv dobu bez příznaků onemocnění (PFS), navíc bylo v rameni s kombinovanou imunoterapií zaznamenáno více časných úmrtí.
Na základě této studie je kombinace nivolumab s fluorouracilem a cisplatinou či nivolumab/ipilimumab standardem první linie léčby u pacientů s TPS≥1%. S ohledem na časná úmrtí v prvních měsících léčby samostatnou imunoterapií a nesignifikantní PFS je preferovaným režimem kombinace nivolumabu s chemoterapií.
Podobně pembrolizumab a ostatní check point inhibitory (camrelizumab, tislelizumab, sintilimab etc.) mají data o účinnosti ze studií f. III. Tyto checkpoint inhibitory však nejsou v indikaci léčby první linie u skvamozního karcinomu v ČR hrazeny.
Studie fáze III CheckMate 649 hodnotila efekt kombinace nivolumab + režim s fluoropyrimidinem a oxaliplatinou u nepředléčených pacientů s neresekabilním nebo metastatickým HER2 negativním adenokarcinomem žaludku, GEJ a jícnu. Pacienti v rameni s nivolumabem dosáhli lepší léčebné odpovědi, PFS a celkového přežití, což tuto kombinaci etablovalo jako nový léčebný standard první linie pro adenokarcinomy s PD-L1 expresí definovanou jako CPS ≥ 5 (mOS 14,4 versus 11,1 měsíce, HR 0,71 [98,4% CI 0,59–0,86]; p<0,0001).
U skvamozního karcinomu prokázal nivolumab v druhé linii po předléčení fluoropyrimidinem a platinovým derivátem prodloužení celkového přežití (10,9 vs 8,4 měs, HR 0,77) a trvání léčebné odpovědi (6,9 vs 3,9 měs.) ve srovnání s paklitaxelem či docetaxelem.
Pacienti s metastatickým MSI high adenokarcinomem žaludku dosahují vyšší odpovědi, ale i dlouhodobého léčebného efektu při léčbě anti-PD-1 terapií.
Retrospektivní analýza randomizovaných studií fáze III (KEYNOTE-062, CheckMate-649, JAVELIN Gastric 100 and KEYNOTE- 061) zahrnující 2545 pacientů se zhodnoceným MSI stavem, z čehož 123 (4,8 %) mělo MSI-high karcinomy, publikovala HR pro celkové přežití (OS) při léčbě založené na anti-PD-1 0,34 (95% CI: 0,21-0,54) pro MSI-nádory versus 0,85 [95% confidence
interval (CI): 0,71-1,00] pro mikrosatelitně stabilní nádory.
Prospektivní data ze studie Keynote 158 (pembrolizumab*) a ze studie NO LIMIT (ipilimumab/nivolumab*) potvrdila účinnost a možnost dosažení dlouhodobé remise při použití imunoterapie u metastatického onemocnění a pacienti s tumory MSI high/dMMR jsou kandidáty léčby *imunoterapií.
Podobně pacienti, u nichž byla diagnostikována fúze NTRK genu, jsou kandidáty terapie NTRK inhibitory *entrektinibem a *larotrektinibem.
Prediktivní vyšetření
Pro skvamozní karcinom je podmínkou léčby první linií chemoterapie a nivolumabu, případně kombinací nivolumab/ipilimumab hodnota TPS≥1%, pro léčbu *pembrolizumabem hodnota PD-L1 exprese vyjádřena CPS≥10.
U všech pacientů s adenokarcinomem GEJ a žaludku je doporučeno vyšetřit HER2 a MSI-H/MMR-D před stanovením strategie léčby, v (neo)adjuvantním záměru před zahájením chemoterapie.
Ve IV. klinickém stadiu je doporučeno před zahájením 1. linie systémové léčby vyšetřit i PD-L1 expresi.
Hodnocení PD-L1 exprese se liší dle histologického typu a použitého checkpoint inhibitoru. U adenokarcinomu je indikací k léčbě nivolumabem CPS≥5.
V individuálních případech lze u pacientů ve IV. klinickém stadiu vyšetřit fúze NTRK (možnost terapie larotrektinibem a entrektinibem) a u pacientů v dobrém stavu při vyčerpání možností standartní léčby testování NGS a vyšetření TMB. Dále je doporučováno vyšetření DPYD k predikci toxicity chemoterapie fluoropyrimidiny.
*O úhradě přípravku ze zdravotního pojištění nebylo v této indikaci k 1. 3. 2024 rozhodnuto.
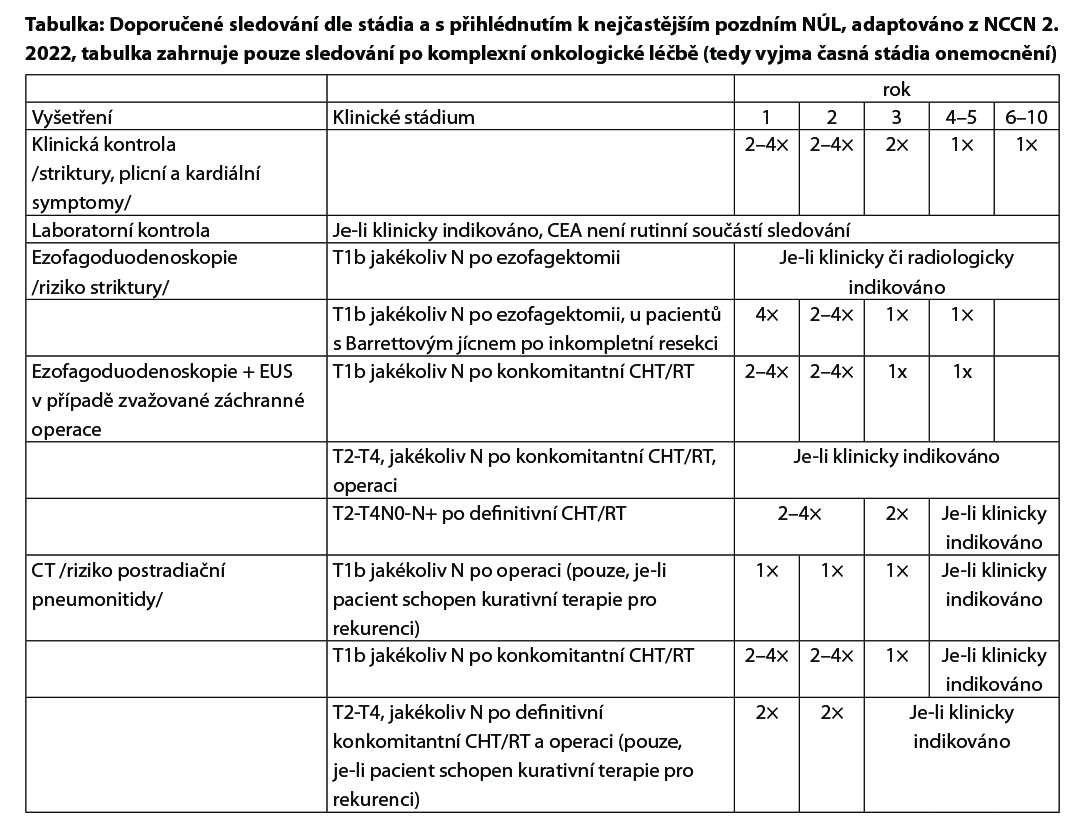
Karcinom jícnu – follow up po kurativní léčbě
Všichni pacienti by měli být sledováni systematicky, nicméně konsensus pro standardní follow-up neexistuje. Naše doporučení vychází z evropských(ESMO) a amerických (NCCN) guidelines.
PET/CT a ezogagoduodenoskopie může být součástí follow-up, je-li klinické podezření na recidivu/relaps onemocnění. U všech pacientů doporučujeme zvážit nutnost nutriční podpory.
Literatura:
- André T, et al. Neoadjuvant Nivolumab Plus Ipilimumab and Adjuvant Nivolumab in Localized Deficient Mismatch Repair/Microsatellite Instability-High
Gastric or Esophagogastric Junction Adenocarcinoma: The GERCOR NEONIPIGA Phase II Study. J Clin Oncol. 2022 Aug 15:JCO2200686. doi: 10.1200/
JCO.22.00686. Epub ahead of print. PMID: 35969830. - Hall PS, et al. Efficacy of Reduced-Intensity Chemotherapy With Oxaliplatin and Capecitabine on Quality of Life and Cancer Control Among Older and Frail
Patients With Advanced Gastroesophageal Cancer: The GO2 Phase 3 Randomized Clinical Trial. JAMA Oncol. 2021;7(6):869-877. - Marabelle A, Le DT, Ascierto PA, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient
Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol. 2020 Jan 1;38(1):1-10. doi: 10.1200/JCO.19.02105. Epub 2019 Nov 4. PMID: 31682550;
PMCID: PMC8184060. - NCCN Clinical Practice Guidelines in Oncology: Esophageal and Esophagogastric Junction Cancers, version 3.2023 https://www.nccn.org/professionals/
physician_gls/pdf/esophageal.pdf - Obermannová R et al. ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology 2022, S0923-7534(22)01850-6.
- Okines AF,et al. Multimodality treatment for localized gastro-oesophageal cancer. Ann Oncol 2010; 21 Suppl 7: vii286-93.
- Reynolds JVet al.Neo-AEGIS (Neoadjuvant trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study): Preliminary
results of phase III RCT of CROSS versus perioperative chemotherapy (Modified MAGIC or FLOT protocol). (NCT01726452). Journal of Clinical Oncology 2021
39:15_suppl, 4004-4004 - Shitara K, Bang YJ, Iwasa S, et al. DESTINY-Gastric01 Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J
Med. 2020 Jun 18;382(25):2419-2430. doi: 10.1056/NEJMoa2004413. Epub 2020 May 29. PMID: 32469182. - TNM klasifikace zhoubných novotvarů 8. vydání, 2017.





