19.1 Léčba lokalizovaného a lokálně pokročilého karcinomu prostaty
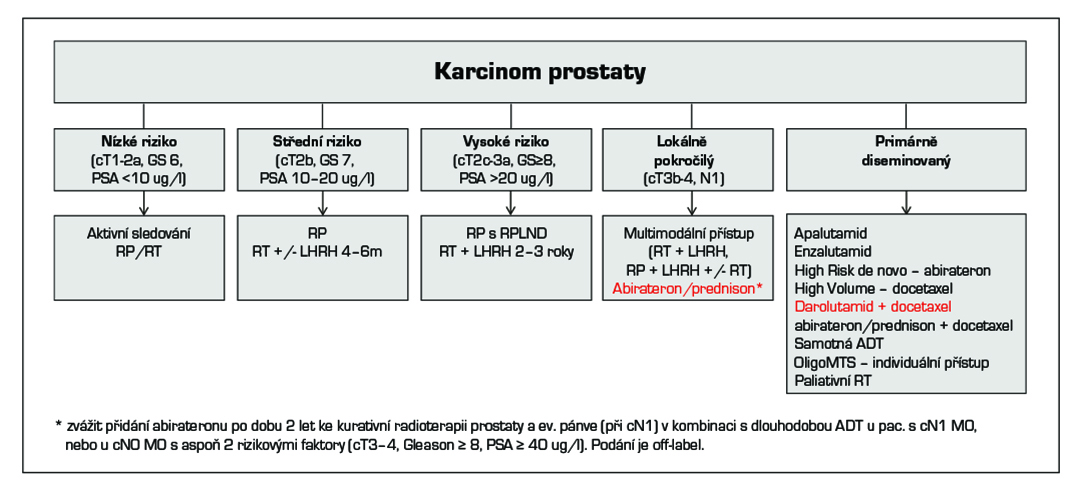
19.1.1 Léčba nízce rizikového (cT1-2a a GS 6 a PSA < 10 μg/l) a středně rizikového (cT2b a/nebo GS 7 a/nebo PSA 10–20 μg/l) karcinomu prostaty
Léčba dle preference informovaného pacienta
1. Radikální prostatektomie (RP)
- operační přístupy – otevřená, laparoskopická, robotická RP jsou z hlediska onkologické bezpečnosti a funkčních výsledků (kontinence, erekce) srovnatelné,
- nemocní s předpokládanou dlouhou dobou dalšího života (nad 10 let),
- rozšířená pánevní lymfadenektomie u pacientů s rizikem postižení uzlin dle nomogramů MSKCC či Briganti a pod.
2. Radioterapie (RT) s kurativním záměrem viz standard SROBF (www.srobf.cz)
Indikace radioterapie je specifikována v Národních radiologických standardech – radiační onkologie
- teleradioterapie – 3D konformní radioterapie nebo IMRT (intensity modulated RT), případně stereotaktická RT (ta má zatím nižší úroveň důkazů – 2A),
- radioterapie s neoadjuvantní, konkomitantní či adjuvantní hormonální supresí (u nemocných s nízkým rizikem není nutná, u pacientů se středním rizikem – krátkodobé režimy 4–6 měsíců),
- brachyterapie (intersticiální – trvalá nebo dočasná), trvalá intersticiální brachyterapie lze indikovat u LR karcinomu prostaty (cT1c nebo T2a, GS6, PSA < 10 ug/l, velikost prostaty < 30 g, IPSS ≤ 12),
- kombinovaná zevní radioterapie a brachyterapie.
3. Active surveillance (aktivní sledování) a watchful waiting (pečlivé vyčkávání)
- u pacienta s nízkým rizikem je aktivní sledování preferovaným postupem,
- k aktivnímu sledování je vhodný pacient s nádorem cT1-2a, s nízkou hodnotou PSA (≤ 10 μg/l), nízkým GS (GS ≤ 6), s denzitou PSA (PSA/objem prostaty z TRUS) ≤ 0,2 ug/l/ml a očekávanou délkou života 10 a více let,
- lze zařadit i pacienty s GS 3+4 bez kribriformního nebo intraduktálíno karcinomu, mající postižení maximálně 50 % vzorků (MR pozitivní ložiska se počítají každá jako jeden vzorek) a zároveň podstoupili MR prostaty s fúzní biopsií,
- při fúzní biopsii prostaty není v případě GS 6 limitace počtem vzorků,
- součástí aktivního sledování jsou pravidelné kontroly PSA (alespoň 1× za 6 měsíců) a per rektum vyšetření (alespoň 1× za 12 měsíců) a rebiopsie při změně nálezu na MR dle PRECISE kritérií,
- součástí aktivního sledování by měla být i multiparametrická MR prostaty, její provedení by mělo předcházet kontrolní cílené rebiopsii,
- léčbu zahajujeme při známkách aktivity onemocněni (nejčastěji při progresi GS, méně často při ≥ 3 pozitivní vzorky v rebiopsii či při známkách lokální progrese) nebo dle přání pacienta,
- významným faktorem při rozhodování o sledování je celkový stav pacienta a prognóza přežití. Watchful waiting na rozdíl od active surveillance neobsahuje doporučení k rebiopsiím, nýbrž jen sledování PSA a klinické vyšetření à 4–6 měsíců. Tato strategie je vhodná pro nemocné s významnými komorbiditami limitujícími celkové přežití či nevhodných k radikální léčbě (RP nebo RT)..
19.1.2 Léčba vysoce rizikového karcinomu prostaty (cT2c-T3a a/nebo GS 8-10 a/nebo PSA > 20 μg/l) karcinomu prostaty
Léčba dle preference informovaného pacienta, vždy zvažována multimodální léčba, u chirurgické léčby vhodná centralizace na high volume centra
- Radioterapie s neoadjuvantní, konkomitantní a adjuvantní hormonální supresí, hormonální léčba prolongovaná na 2–3 roky, individuálně kombinovaná zevní radioterapie s intersticiální brachyterapií.
- RP s rozšířenou pánevní lymfadenektomií (pacient musí být informován o vysoké pravděpodobnosti následné multimodální léčby.
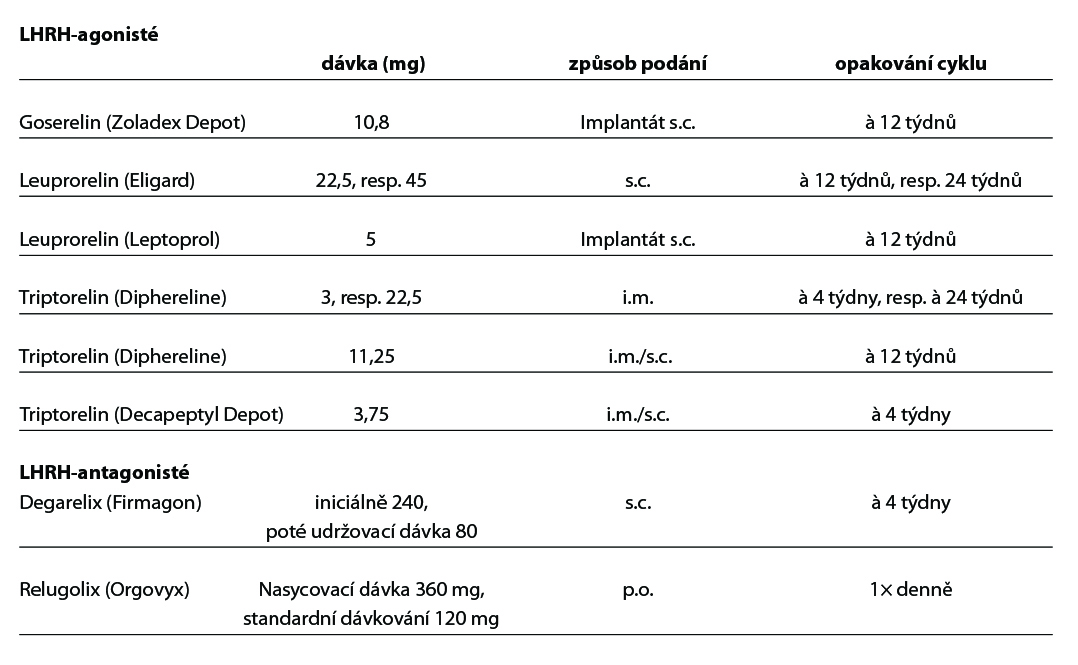
- Hormonální léčba pacientů nevhodných ke kurativní léčbě jako paliace symptomů u lokálně pokročilého onemocnění. Léčba primárně jako monoterapie – LHRH agonisté/antagonista nebo orchiektomie, tzv. androgen deprivační terapie – ADT.
• časná (zahájení při diagnóze),
• odložená (zahájení při progresi onemocnění),
• androgenní suprese v režimu kontinuálním (preferováno), nebo intermitentním (vysazení LHRH při poklesu PSA a znovunasazení při elevaci, platí pouze pro monoterapii LHRH).
19.1.3 Léčba lokálně pokročilého karcinomu prostaty (T3b-T4 nebo N1)
- RT s dlouhodobou ADT ,
- RP s PLND jen jako součást multimodální léčby, nabízet jen vybraným pacientům,nutné posouzení na multioborové
komisi, - zvážit přidání abirateronu po dobu 2 let ke kurativní radioterapii prostaty a ev. pánve (při cN1) v kombinaci s dlouhodobou
ADT u pac. s cN1 M0, nebo u cN0 M0 s aspoň 2 rizikovými faktory (cT3–4, Gleason ≥ 8, PSA ≥ 40 ug/l). Podání
je off-lable.
19.1.4 Lokální terapie karcinomu prostaty – RP a kurativní RT:
- po RP je očekáváno, že nedetekovatelného PSA bude dosaženo do 6 týdnů ,
- po kurativní RT je pokles PSA pomalejší, dosažení nadiru (až 3 roky a více) PSA < 0,5 μg/ml je spojováno s dobrou
prognózou.
19.1.5 Adjuvantní a salvage léčba po RP
Možnosti adjuvantní a záchranné lokálně-regionální (nebo lokální) léčby:
- časná salvage/adjuvantní radioterapie může být individuálně zvážena u vysoce rizikových pacientů s pN0 při splnění aspoň 2 ze 3 rizikových faktorů (GS > 8, pT3, pozitivní resekční okraj), avšak preferovaným postupem je odložená (salvage) radioterapie,
- v případě pN1 je by měla být zvážena adjuvantní léčba dle postižení lymfatických uzlin: LHRH + radioterapie, samotná LHRH či sledování (při postižení max. 2 uzlin a hodnotě PSA < 0,1 ug/l),
- odložená salvage radioterapie při vzestupu PSA > 0,2 μg/l (optimálně před dosažením hladiny 0,5 μg/l) s ADT na 6 měsíců.
19.1.6 Obecná doporučení indikace androgendeprivační léčby (ADT) kombinované s radioterapií
• Neoadjuvantní ADT
Je indikována u pacientů s vysoce rizikovým karcinomem prostaty, u pacientů se středně rizikovým karcinomem prostaty je ke zvážení. Optimální trvání neoadjuvantní aplikace je 4–6 měsíců.
• Adjuvantní ADT
U pacientů se středně rizikovým karcinomem prostaty bez ADT, ev. zvážit krátkodobé podání ADT na 4–6 měsíců (pokud tato léčba nebyla podána v neoadjuvanci). U pacientů s vysoce rizikovým karcinomem prostaty je doporučená doba podávání ADT 2–3 roky.
19.1.7 Selhání lokální léčby
PSA monitoring slouží k zachycení residuálního pánevního postižení či výskytu mikrometastáz
- za selhání lokální léčby po RP je považováno jakékoliv potvrzené zvýšení PSA nad detekční limit kitu ve dvou následných měřeních
- za selhání lokální léčby po kurativní RT je považován vzestup PSA o 2 μg/l nad nadir po RT
Zvažované možnosti léčby:
- po RP – radioterapie nebo androgenní deprivace dle pravděpodobnosti lokální nebo systémové recidivy (riziko systémového onemocnění = GS 8–10 nebo pT3b nebo PSA doubling time < 12 měsíců nebo PSA relaps < 3 roky od výkonu),
- po RT – androgenní deprivace, salvage RP pouze ve vybraných případech
19.1.8 Zobrazovací metody ve stagingu
S narůstajícím rizikem stoupá pravděpodobnost vzdálené diseminace a dle toho bychom měli indikovat zobrazovací stagingová vyšetření.
U pacientů s nízkým rizikem nepoužívat další zobrazovací metody (CT, scintigrafie)
Se středním rizikem od ISUP ≥ 3 (≥ GS 4+3) je vhodné CT břicha a pánve a scintigrafie skeletu
S vysokým rizikem by mělo být provedeno minimálně CT břicha a pánve a scintigrafie skeletu, ev. moderní zobrazovací metody: 18F-cholin PET/CT nebo 68Ga-PSMA PET/CT vyšetření.
PET/CT ev. PET/MR používáme zvláště v rámci restagingu při biochemickém relapsu. S narůstající hodnotou PSA stoupá i senzitivita metody. Nejvyšší senzitivitu a pravděpodobnost pozitivního nálezu nabízí 68Ga-PSMA PET/CT. 18F-cholin PET/CT i 18F-fluciclovin PET/CT je při biochemickém relapsu vhodné indikovat při splnění jednoho z následujících kritérií:
PSA DT kratší než 6 měsíců, a/nebo absolutní hodnota PSA > 1 ng/ml.
Při nesplnění alespoň jednoho z těchto kritérií je senzitivita cholin- i fluciclovin- PET/CT udávána okolo 40 %, u 68Ga-PSMA PET/CT senzitivita 30–65 %. Při hladinách PSA > 2 ng/ml je senzitivita pro 68Ga-PSMA, 18F-cholin i 18F-flucicovin PET/ CT až okolo 90–95 %.
68Ga-PSMA PET/CT je indikováno 1) u pacientů s vysoce rizikovým karcinomem prostaty k upřesnění stagingu před plánovanou kurativní léčbou, 2) u pacientů s biochemickou progresí po kurativní léčbě, 3) u pacientů, kdy je zvažována cílená radionuklidová terapie s ligandy PSMA.
19.1.9 Prevence kostních příhod
Všichni pacienti s ADT by měli užívat kombinaci vápníku s vitaminem D jako prevenci osteoporózy.
U pacientů s ADT, neužívajících bisfosfonáty či denosumab (BMA), by mělo být zváženo provedení denzitometrie.
Zvážit podávání BMA u pacientů s mHSPC při rozsáhlém kostním postižení či osteolýze.
U pacientů s mCRPC a kostním postižení vždy zvažovat podávání BMA.
19.2 Léčba metastatického karcinomu prostaty (Tx Nx M1)
19.2.1 Hormonální léčba metastatického hormonálně senzitivního karcinomu prostaty (mHSPC)
Primární androgenní deprivace, (ADT) – monoterapie – LHRH antagonista/agonisté nebo bilaterální orchiektomie(1)
- časná nebo odložená (pouze u vybraných pacientů),
- kontinuální nebo intermitentní (pouze u vybraných pacientů a za pečlivé monitorace)
- podávání abirateron/prednison acetátu spolu se zavedenou ADT u pacientů se vstupně generalizovaným onemocnění (M1) s vysokým rizikem časné progrese definovaným splněním dvou ze tří tzv. high risk kritérii: GS ≥ 8, ≥ tři kostní metastázy, viscerální metastázy. Léčba abirateronem musí být zahájena do tří měsíců od zahájení ADT.
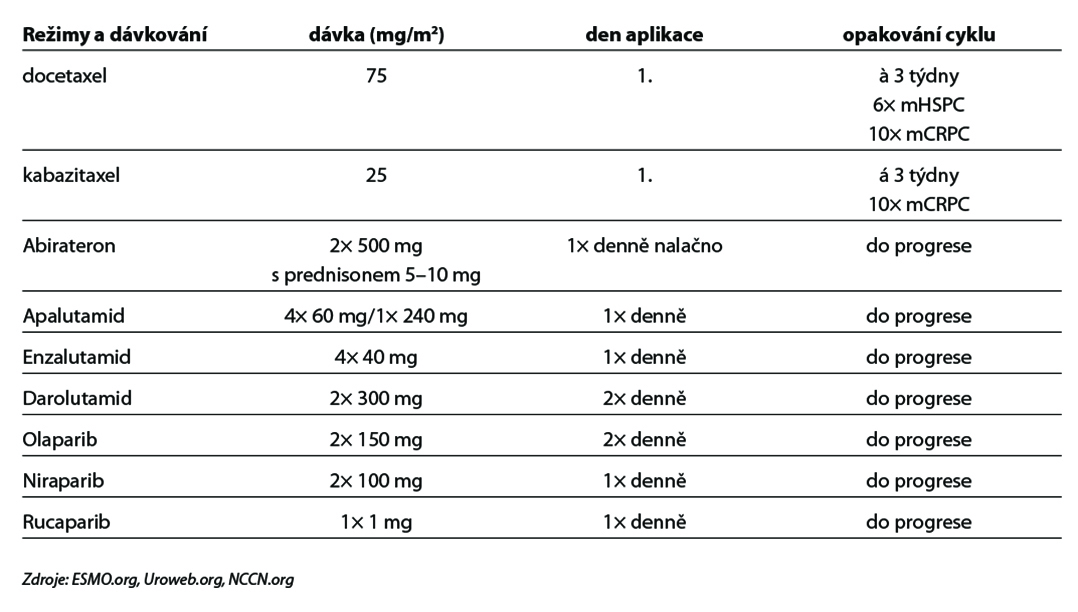
- chemohormonoterapie (ADT + docetaxel s/bez prednisonu). Chemoterapie je indikována u pacientů s vysokým rizikem časné progrese definovaným tzv. high volume kritérii: přítomnost viscerálních metastáz a/nebo ≥ 4 kostní metastázy (minimálně jedna z těchto metastáz musí být mimo pánev a páteř). Současně je indikována ADT. Je indikováno 6 cyklů chemoterapie docetaxel s/bez prednisonu) (1). Tato indikace docetaxelu je v současnosti off-label,
- apalutamid je indikován k léčbě pacientů s metastatickým hormon senzitivním CaP v kombinaci s ADT bez ohledu na to, zda je nemoc generalizovaná již v době diagnózy nebo k ní došlo po lokoregionální léčbě a bez ohledu na rozsah metastatického onemocnění. Lečba apalutamidem musí být zahájena do šesti měsíců od zahájení ADT.
- enzalutamid je indikován k léčbě pacientů s metastatickým hormon senzitivním CaP v kombinaci s ADT bez ohledu na to, zda je nemoc generalizovaná již v době diagnózy nebo k ní došlo po lokoregionální léčbě a bez ohledu na rozsah metastatického onemocnění. Lečba enzalutamidem musí být zahájena do šesti měsíců od zahájení ADT.
- darolutamid je indikován k léčbě dospělých mužů s metastazujícím hormonálně senzitivním CaP v kombinaci s docetaxelem a androgen deprivační terapií.
- abirateron/prednison je indikován k léčbě dospělých mužů s de novo High Risk metastazujícím hormonálně senzitivním CaP v kombinaci s docetaxelem a androgen deprivační terapií.
- u pacientů v dobrém stavu PS 0-1 s nově diagnostikovaným karcinomem prostaty s limitovaným metastatickým postižením (tedy nesplňujícími kritéria high-volume disease) lze zvážit radioterapii na primární nádor 55Gy/20 frakcí/ 4 týdny (1 frakce denně), případně 36Gy/6 frakcí/6 týdnů (jedna frakce týdně).
- po selhání ADT nutno zvážit existenci kastračně rezistentní formy onemocnění.
- antiresorpční léčba u pacientů s mHSPC nemá jednoznačný přínos s výjimkou pacientů s osteolytickými metastázami (při nízce diferencovaném karcinomu).
19.3 Léčba kastračně rezistentního karcinomu prostaty (CRPC)
Kastračně rezistentní karcinom prostaty je definován kastračními hladinami testosteronu (< 50 ng/dl nebo 1,7 nmol/l) a jedním z následujících kritérií:
- biochemická progrese: tři následné vzestupy PSA v odstupu minimálně jednoho týdne; výsledné zvýšení PSA je 2× o 50 % nad nadir a současně je výsledná hodnota PSA nad > 2 ug/l.
nebo - radiologická progrese: výskyt dvou nebo více nových kostních lézí nebo progrese v měkkých tkáních podle RECIST.
U všech nemocných je indikováno zajištění kastračních hladin LHRH agonisty/antagonisty, nebo chirurgickou kastrací (1).
Další možnosti léčby závisí na rozsahu onemocnění M0 CRPC a M1 CRPC a přítomnosti symptomů. K časné klinické detekci M1 CRPC může posloužit doporučení skupiny RADAR. Při PSA nad 2 μg/ml provést scintigrafii skeletu a CT břicha a malé pánve. Jsou-li vyšetření negativní, měla by být opakována, když je PSA nad 5 μg/ml a opět při zdvojení PSA při testování PSA po 3 měsících. Při indikaci citlivějších moderních zobrazovacích metod bychom měli zvažovat benefit pro pacienta.
Léčba nemetastatického CRPC (nmCRPC, M0 CRPC, non-mCRPC)
- nmCRPC je definován kastračním stavem pacienta a stoupající hladinou PSA (podle definice CRPC – viz výše) a zároveň absencí metastáz prokazatelných konvenčními stagingovými metodami (CT plic, břicha a malé pánve a scintigrafie skeletu).
- zajištění ADT (LHRH analoga nebo antagonisty nebo OE),
- sledování u nemocných, kde PSA-DT > 10 měsíců,
- apalutamid je indikován u pacientů s nemetastatickým kastračně rezistentním karcinomem prostaty, kteří mají vysoké riziko vzniku metastatického onemocnění (PSA-DT < 10 měsíců). (1)
- enzalutamid je indikován u pacientů s nemetastatickým kastračně rezistentním karcinomem prostaty, kteří mají vysoké riziko vzniku metastatického onemocnění. (PSA-DT < 10 měsíců). (1)
- darolutamid je indikován u pacientů s nemetastatickým kastračně rezistentním karcinomem prostaty, kteří mají vysoké riziko vzniku metastatického onemocnění. (PSA-DT < 10 měsíců). (l)
Léčba asymptomatického či mírně symptomatického metastatického onemocnění (mCRPC):
- pokračování v ADT (LHRH analoga), nebyla li provedena OE,
- abirateron + prednison(1),
- enzalutamid (1),
- olaparib v kombinaci s abirateronem a prednisonem u pacientů s mCRPC, u kterých chemoterapie není klinicky indikována
- niraparib/abirateron + prednison u pacientů s mutacemi genu BRCA 1/2 (zárodečné a/nebo somatické), u kterých není klinicky indikována chemoterapie, v kombinaci s prednisonem nebo prednisolonem.
- talazoparib + enzalutamid u pacientů s mCRPC, u kterých chemoterapie není klinicky indikována
- docetaxel + prednison
- prevence kostních příhod SRE (1),
- paliativní radioterapie.
Léčba symptomatického metastatického onemocnění (mCRPC) ECOG 0-1:
- chemoterapie docetaxel + prednison ve třítýdenním režimu (1); doporučováno aplikovat maximálně 10 cyklů. Léčba by měla být upřednostněna u pacientů s rychlou progresí onemocnění nebo viscerálními metastázami.
- Radium-223 u nemocných se symptomatickými kostními metastázami (bez známých viscerálních metastáz s možnou lymfadenopatií do 3 cm) jejichž onemocnění progreduje po nejméně dvou předchozích liniích systémové léčby mCRPC (jiné než analogy LHRH) nebo kteří nejsou způsobilí pro žádnou dostupnou systémovou léčbu mCRPC.
Léčba symptomatického metastatického onemocnění (mCRPC) ECOG 2-3:
- docetaxel + prednison
- Radium-223 u nemocných se symptomatickými kostními metastázami (bez známých viscerálních metastáz, ECOG 0-2 metastáz s možnou lymfadenopatií do 3 cm) jejichž onemocnění progreduje po nejméně dvou předchozích liniích systémové léčby mCRPC (jiné než ADT) nebo kteří nejsou způsobilí pro žádnou dostupnou systémovou léčbu mCRPC.
- symptomatická a podpůrná léčba
Následná léčba:
Pro pacienty ECOG 0-1 předléčené režimem obsahujícím docetaxel:
- chemoterapie kabazitaxel + prednison (1),
- inhibitor androgenní biosyntézy abirateron acetát + prednison (ECOG 0-2) (1),
- inhibitor signalizace androgenních receptorů enzalutamid (ECOG 0-2) (1),
U uvedených léčebných možností bylo prokázáno prodloužení celkového přežití a paliativní efekt po selhání chemoterapie docetaxel + prednison. PSA flare up při podávání taxanů v prvních 12 týdnech není známkou selhání léčby a důvodem k jejímu ukončení (1). Abirateron acetát, enzalutamid, kabazitaxel, radium-223 (viz aktuální indikační omezení) jsou indikovány na základě randomizovaných studií jako standard léčby u mCRPC po selhání docetaxelu (1). Na základě údajů z retrospektivních studií se poukazuje na možnost využití kumulativního benefitu pro přežití u sekvenčního podávání nových agents (kabazitaxel a ARTA) v léčbě mCRPC po docetaxelu (3). Použití docetaxelu (docetaxel retreatment) v této indikaci není ověřeno na základě prospektivních dat, je založeno převážně na retrospektivních datech, která jsou v řadě aspektů inkonzistentní (3).
- 177Lu-PSMA-617 s nebo bez ARTA u karcinomů s expresí PSMA, kteří již byli léčeni ARTA a chemoterapií na bázi taxanů
Pro pacienty ECOG 0-1 předléčené režimem ARTA:
- docetaxel + prednison
- Olaparib je indikován v monoterapii k léčbě dospělých pacientů s germinální a/nebo somatickou mutací BRCA1/2 mCRPC, u kterých došlo k progresi po předchozí léčbě zahrnující nový hormonální léčivý přípravek.

19.4 Indikace ke genetickému vyšetření nemocných s karcinomem prostaty
U přibližně 5–10 % případů karcinomu prostaty se předpokládá familiární predispozice. Část těchto pacientů jsou nosiči germinálních mutací genu BRCA 1, 2 a téměř třetina pacientů má deficit v HRR genech.
Indikace ke genetickému vyšetření:
• ≥ 2 případy karcinomu prostaty u blízkých příbuzných, aspoň u jednoho ve věku ≤ 55 let,
• ≥ 3 případy karcinomu prostaty u blízkých příbuzných v jakémkoli věku,
• karcinom prostaty (Gleason ≥ 7, nebo primárně metastatický karcinom) a ≥ 1 případů karcinomu prostaty, prsu, ovaria nebo pankreatu u blízkých příbuzných.
Multigenové testování pro účely personalizované medicíny:
1. testování germinálních mutací – navrhuje onkolog a odesílá pac. na genetickou poradnu
2. testování somatických mutací – pacienti s vysoce rizikovým karcinomem prostaty, především M1 v době diagnozy a se vzácnou histologií.
Doporučuje se multigenové testování. Preferováno je testování z recentní biopsie, případně testování cirkulující nádorové DNA.
Mužští příbuzní pacientů s prokázaným nebo předpokládaným hereditárním karcinomem prostaty by měli zahájit PSA skríning ve věku 40 let.
19.5. Obecná doporučení ke sledování po lokální terapii:
- rutinní DRE po RP není vyžadováno u pacientů s příznivou histologií (tj. < pT3, pN0, GS < 8), pokud se pravidelně kontroluje PSA
- rutinní DRE po RT by mělo probíhat vždy, vzhledem k možnosti vzniku sekundárních malignit (rekta, anu) a chronické radiační proktitidy
- rutinní follow-up u asymptomatických pacientů zahrnuje PSA +/- DRE ve 3., 6. a 12. měsíci po léčbě, poté každých 6 měsíců ve 2.–3. roce a následně ročně celoživotně
- biopsie prostaty po kurativní RT by měla být indikována pouze u pacientů indikovaných k salvage terapii
- u asymptomatických pacientů bez biochemického relapsu nejsou indikovány žádné zobrazovací metody
Kastračně senzitivní onemocnění – sledování během androgen-deprivační terapie:
- obecně jsou pacienti sledováni ve 3–6 měsíčních intervalech
- před zahájením a dále dle prvních výsledků: PSA, KO, kreatinin, jaterní testy, glykemie, testosteron (především v 1. roce a kdykoliv při vzestupu PSA pro potvrzení účinnosti léčby), lipidový profil, +/- DRE
- u všech pacientů by měla být doporučena změna životního stylu (tj. dieta, fyzická zátěž, ukončení kouření apod.)
- pacienti na dlouhodobé ADT terapii by měli být předem vyšetřeni a dále monitorováni se zaměřením na vedlejší účinky ADT (osteoporóza, metabolický syndrom, kardiovaskulární riziko)
Kastračně rezistentní onemocnění:
- u non-mCRPC monitorace PSA každých 3–6 měsíců, sledování doubling time PSA, zobrazovací metody až dle vývoje PSA či symptomů
- pacienti s mCRPC na systémové léčbě by měli být pravidelně vyšetřováni s cílem ověřit odpověď na léčbu či detekovat progresi
19.6. Screening karcinomu prostaty
Screeningový program je určen pro asymptomatické muže ve věku 50 až 70 let, kterým bude u praktického lékaře nebo urologa odebrán vzorek krve na vyšetření PSA. Při vyšší hodnotě PSA bude následovat komplexní vyšetření urologem. Při přetrvávajícím podezření na karcinom prostaty bude pacient odeslán na MR prostaty a eventuálně provedena fúzní biopsie. Při známkách signifikantního karcinomu prostaty již při prvním vyšetření u urologa bude biopsie provedena bez zbytečných odkladů.
Upozornění: V případě léčby hrazené z prostředků veřejného zdravotního pojištění je u všech doporučených léků nutné sledovat aktuální úhradová omezení na www.sukl.cz.