Tato kapitola se zabývá problematikou specifického subtypu melanomu původem z nitroočních pigmentových struktur, tj. z uveálního traktu, což zahrnuje melanomy cévnatky (chorioidea, C69.3), melanomy z řasnatého tělesa (corpus ciliare, C69.4) a melanomy duhovky (iris, C69.4). Nezabývá se problematikou melanomů spojivkových (konjuktiválních) ani melanomů původem v kůži očního víčka, které se léčí dle doporučení platných pro kožní, resp. slizniční melanomy.
23.1 Primární terapie – léčba onemocnění lokalizovaného na bulbus
Onemocnění se nejčastěji projevuje zhoršením zrakové ostrosti a výpadky v zorném poli. Může být také provázeno dalšími očními fenomény jako jsou jiskření a záblesky, někdy i bolestí bulbu a nezřídka bývá onemocnění i asymptomatické. Komplexní oční vyšetření a speciální diagnostické metody probíhají na oftalmologických pracovištích. Po stanovení diagnózy a rozsahu onemocnění je na základě doporučení oftalmologa indikována léčba primárního očního melanomu.
- U malých tumorů (pod 2 cm a do 2,5 mm tloušťky): brachyradioterapie, protonová radioterapie.
- U malých tumorů s větší tloušťkou (pod 2 cm s tloušťkou 2,5 mm – 10 mm): brachyradioterapie, protonová radioterapie, enukleace.
- U velkých tumorů (2 cm a více nebo s tloušťkou nad 10 mm resp. nad 8 mm při infiltraci optického nervu): protonová radioterapie, stereotaktická radioterapie, enukleace.
Při nálezu pozitivního chirurgického okraje při enukleaci nebo při infiltraci struktur orbity může být indikována exenterace orbity a radioterapie orbity.
U malých melanomů duhovky je indikováno lokální chirurgické řešení – iridektomie. Tento subtyp uveálního melanomu má lepší prognózu než melanom vycházející z cévnatky nebo řasnatého tělesa.
23.2 Léčba lokálních recidiv
Při recidivě omezené na bulbus je indikována adekvátní radikalizující terapie, tj. nejčastěji enukleace, případně opět radioterapie.
Při recidivě v orbitě po enukleaci je nejčastější léčebnou metodou zevní radioterapie. V indikovaných případech lze také kombinovat radioterapii s chirurgickou léčbou.
23.3 Léčba metastatického onemocnění
Uveální melanom metastazuje velmi často, a to zhruba v 50 % případů. Cesta metastazování je prakticky výhradně hematogenní, což je dáno nepřítomností lymfatického systému u uvey. Nejčastěji jsou postižena játra (cca 90 % případů), metastázy jsou typicky vícečetné a inoperabilní. Méně často pak onemocnění metastazuje do plic, skeletu, měkkých tkání a dalších orgánů. Onemocnění má vzhledem k dominantnímu postižení jater a omezeným možnostem systémové léčby velmi špatnou prognózu. Ve srovnání s primárním kožním melanomem má uveální melanom odlišné biologické a genetické vlastnosti. U uveálního melanomu téměř nikdy nenacházíme mutace onkogenů BRAF a NRAS a kvůli původu v imunitně privilegované tkáni má výrazně menší léčebný potenciál imunoterapie s inhibitory kontrolních bodů (anti- -CTLA-4, anti-PD-1/PD-L1). Stejně tak má u metastazujícího uveálního melanomu mizivý efekt chemoterapie. V léčbě
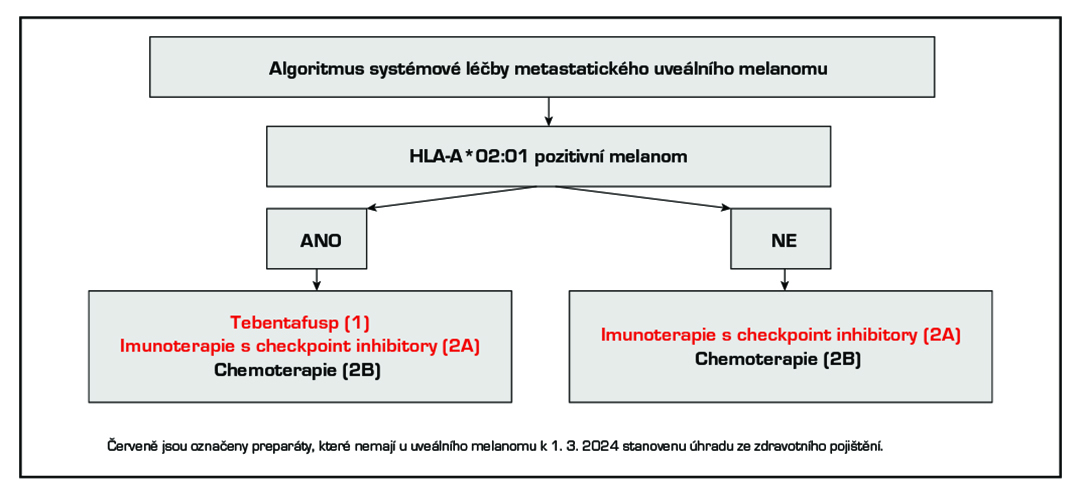
metastazujícího onemocnění je proto kladem velký důraz na využití lokoregionálních metod léčby, dále je vždy vhodné zvážit možnosti zařazení do klinických studií. U pacientů s průkazem pozitivity HLA-A*02:01 by se měla zvážit nová forma imunoterapie – immTAC (preparát tebentafusp – Kimmtrak).
a) Lokoregionální metody léčby metastatického uveálního melanomu
Vzhledem k časté výhradní lokalizaci metastáz uveálního melanomu v játrech a malé účinnosti systémové léčby se nabízí využití lokálních a regionálních metod léčby. Jejich využití je ale omezeno na případy s izolovaným a oligometastatickým postižením jater, případně u oligometastatického postižení jiných orgánů.
Lokoregionální modality používané v léčbě metastatického uveálního melanomu:
- chirurgické řešení (metastazektomie) a/nebo cílená radioterapie (SRS)
- embolizace – chemoembolizace (TACE), radioembolizace, imunoembolizace
- ablační techniky – radiofrekvenční ablace (RFA)
- v případě izolovaného postižení jater – intraarteriální chemoterapie (hepatic arterial infusion – HAI) fotemustin nebo melfalan
- v případě izolovaného postižení jater – izolovaná jaterní perfuze (Delcath systém) s vysokodávkovaným melfalanem
b) Systémová léčba metastatického uveálního melanomu
- Tebentafusp (Kimmtrak) pro případy s průkazem positivity HLA-A*02:01 – viz následující odstavec. Tato léčba nemá
doposud v ČR schválenou úhradu ze zdravotního pojištění. - Léčba anti-PD-1 – nivolumab, pembrolizumab
- Léčba anti-CTLA-4 – ipilimumab
- Duální blokáda CTLA-4 a PD-1 – ipilimumab+ nivolumab
Imunoterapie s checkpoint inhibitory není v indikaci uveálního melanomu v ČR hrazená. Přítomnost očního melanomu představuje výjimku v „indikačním omezení úhrady“ těchto preparátů. Jejich účinnost je významně menší ve srovnání s jejich použitím u kožního melanomu. Duální blokáda CTLA-4 a PD-1 (ipilimumab+ nivolumab) je dle nepřímého srovnání
dostupných klinických studií efektivnější než monoterapie, ale za cenu významně vyšší toxicity.
- Chemoterapie (dakarbazin, temozolomid, paklitaxel, fotemustin)
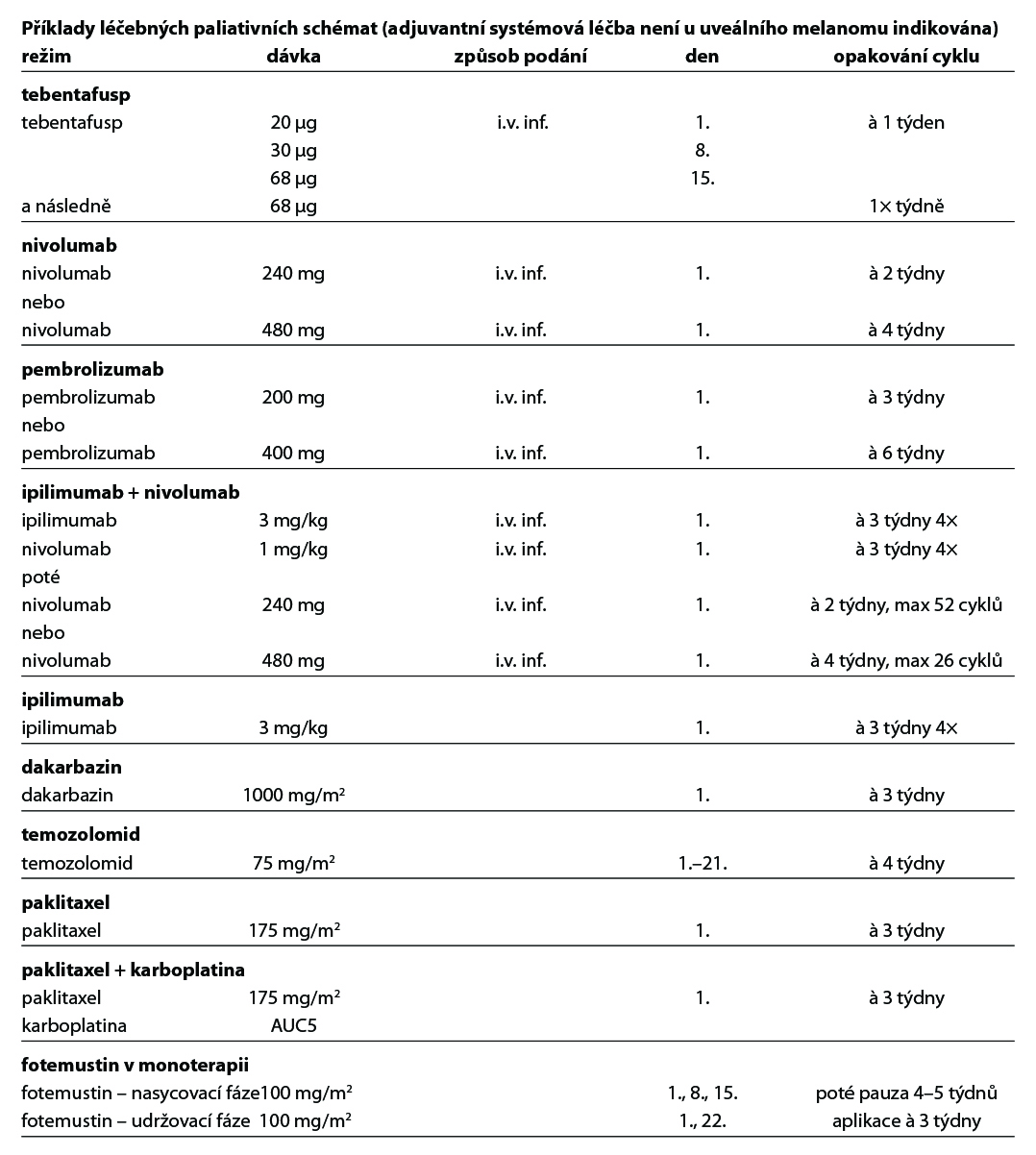
Léčba tebentafuspem (Kimmtrak)
Dne 1. dubna 2022 byl v EU schválen pro léčbu dospělých pacientů s neresekovatelným nebo metastatickým uveálním melanomem s pozitivním lidským leukocytárním antigenem HLA-A*02:01 přípravek tebentafusp (Kimmtrak). Doporučená dávka tebentafuspu je 20 μg v den 1, 30 μg v den 8, 68 μg v den 15 a následně 68 μg jednou týdně v krátké infuzi 15 až 20 minut. První tři léčebné dávky tebentafuspu musí být podávány v nemocnici s nočním monitorováním známek a příznaků spojených se syndromem z uvolnění cytokinů (cytokine release syndrome, CRS). Při dobré toleranci lze následující dávky podávat ambulantně. Podrobné informace pro aplikaci a řešení vedlejších účinků léčby jsou uvedeny v SPC. V léčbě tebentafuspem se má pokračovat, dokud je pro pacienta klinickým přínosem a není přítomna nepřijatelná toxicita. Testování HLA-A*02:01 je hrazeno ze zdravotního pojištění, provádí se ze vzorku periferní krve pacienta a vyšetření je dostupné v rámci hematonkologických center.
23.4 Léčebné režimy
23.5 Sledování po primární terapii
Základem je pravidelné oční vyšetření – hodnocení oftalmoskopického nálezu, ultrazvukového a OCT (optická koherentní tomografie) nálezu. Doporučována je frekvence vyšetření každé 3 měsíce a při prokázané regresi nádoru se interval sledování prodlužuje na 6 měsíců. Oční kontroly jsou důležité i pro sledování vedlejších účinků léčby (např. poradiační retinopatie, chronické konjuktivitidy). Z hlediska screeningu vzdáleného metastazování je doporučováno cílené vyšetření jater metodou dle zvyklostí pracoviště (UZ, CT nebo MRI) v intervalu 1× za 6–12 měsíců.
Literatura:
- Olofsson BR, Nelson A, Shafazand A, et al. Isolated Hepatic Perfusion With Melphalan for Patients With Isolated Uveal Melanoma Liver Metastases: A Multicenter,
Randomized, Open-Label, Phase III Trial (the SCANDIUM Trial). J Clin Oncol. 2023 Jun 1;41(16):3042-3050. - Piulats JM, Espinosa E, de la Cruz Merino L, et al. Nivolumab Plus Ipilimumab for Treatment-Naïve Metastatic Uveal Melanoma: An Open-Label, Multicenter,
Phase II Trial by the Spanish Multidisciplinary Melanoma Group (GEM-1402). J Clin Oncol. 2021 Feb 20;39(6):586-598. - Nathan P, Hassel JC, Rutkowski P, et al. Overall Survival Benefit with Tebentafusp in Metastatic Uveal Melanoma. N Engl J Med. 2021 Sep 23;385(13):1196-
1206. - NCCN Clinical Practice Guidelines in Oncology, Melanoma: Uveal, Version 1.2023.





