Vakcinace proti chřipce
I když není známo, zda je u nemocných s nádory vyšší riziko infekce chřipkou, mají pacienti s přítomným nádorovým onemocněním nebo pacienti s nádorem v anamnéze vyšší riziko závažných komplikací chřipky. To často vede k přerušení léčby, co zhoršuje pacientovu prognózu. Pacienti s malignitou hospitalizovaní pro chřipku nebo její přímé komplikace mají přibližně 10krát vyšší mortalitu než pacienti hospitalizovaní pro chřipku bez konkomitantního nádorového onemocnění. Relativní riziko úmrtí ve srovnání s běžnou populací je nejvyšší u onkologických pacientů mladších 65 let. Proto se u pacientů s aktivním nádorovým onemocněním nebo s nádorem v osobní anamnéze (s výjimkou nemelanomových nádorů kůže) doporučuje podání inaktivované tetravalentní vakcíny proti chřipce jednou ročně. Nežádoucí účinky ani zhoršení klinického stavu pacientů s nádory nebylo v souvislosti s vakcinací pozorováno. Jediným neobvyklým následkem vakcinace proti chřipce může být falešná pozitivita nálezu při vyšetření pozitronovou tomografií.
Registrované očkovací látky
V České republice jsou aktuálně pro sezónu 2023/2024 registrovány následující inaktivované tetravalentní očkovací látky proti chřipce: Influvac Tetra® a Vaxigrip Tetra® a od roku 2022 je registrovaná i živá atenuovaná nasálně podávaná vakcína – Fluenz Tetra®. Její podání se v současné době onkologickým pacientům nedoporučuje, protože o její bezpečnosti je málo údajů a existují bezpečné alternativy neživými vakcínami. Od podzimu 2022 je pro osoby starších 60 let dostupná tetravaletní vakcína se 4x vyšším množstvím antigenů – Efluelda.Antigenní složení chřipkových vakcín je každoročně upravováno podle doporučení Světové zdravotnické organizace. Podávají se v jedné dávce jednou ročně.
Časování vakcinace u pacientů léčených chemoterapií a radioterapií
Optimálně by měla být vakcína proti chřipce podána minimálně 2 týdny před zahájením chemoterapie nebo radioterapie, aby se maximalizovala pravděpodobnost vytvoření aktivní protektivní imunity. V případě potřeby, zejména během chřipkové epidemie, lze vakcínu bezpečně a s relativně dobrou účinností podat i mezi cykly chemoterapie.
Vakcinace proti onemocnění COVID-19
Dle aktuálního doporučení České vakcinologické společnosti je očkování proti COVID-19 doporučeno všem imunokompromitovaným osobám, včetně osob s onkologickými onemocněními a osob s imunosupresivní terapií. Tyto osoby mají zvýšené riziko komplikovaného průběhu nemoci covid-19 včetně zvýšeného rizika úmrtí a i když u nich může být účinnost vakcinace snížená, její předpokládaný prospěch převyšuje její možná rizika. Očkování by mělo být podána nejlépe před podzimní a zimní sezónou 2023/24. Toto doporučení platí bez ohledu na počet dávek, které osoba dříve obdržela. Ve skupině dosud neočkovaných osob se doporučuje 1 dávka adaptované monovalentní vakcíny zaměřené na variantu Omikron XBB.1.5. Osobám, které byly v minulosti očkovány jinými očkovacími látkami, než je očkovací látka zaměřená na Omikron XBB.1.5, se doporučuje očkování 1 dávkou této adaptované vakcíny zaměřené na variantu Omikron XBB.1.5, a to nejméně 4 měsíce od poslední dávky očkování proti covid-19.
Očkovací látky
K lednu 2024 jsou v ČR dostupné tyto vakcíny:
• Comirnaty Omicron XBB.1.5®
• Nuvaxovid XXB.1.5®
• Comirnaty Original/Omicron BA.4-5®
• Spikevax bivalent Original/Omicron BA.4-5®
Časování vakcinace u pacientů v aktivní onkologické léčbě
Z dosavadních studií nemáme žádné důkazy, že by vakcíny COVID-19 klinicky významně ovlivnily účinnost chemoterapie, imunoterapie nebo cílené léčby. Vakcinace by měla být ideálně provedená 2 týdny před zahájením protinádorové léčby. U pacientů, kde již probíhá onkologická léčba zatím neexistuje konktrétně doporučení načasování vakcinace s ohledem na probíhající léčbu. Rozhodnutí o vakcinaci by mělo být individuálně zváženo podle rizika nákazy a jejího nepříznivého průběhu u daného pacienta. Např. u probíhající cytotoxické terapie je vhodné načasovat vakcinaci mezi cykly až po restituci krevního obrazu. Ani pro pacienty léčené imunoterapií není jednotní konsensus načasování vakcinace. V klinických studiích je doporučován časový odstup mezi očkováním a podáním imunoterapie minimálně 2 dny a nejlépe 7 dnů.
Vakcinace proti pneumokokovým infekcím
Pneumokokové infekce jsou spojeny s vysokou morbiditou a mortalitou v rizikové populaci. Očkování je doporučeno k ochraně před invazivními pneumokokovými infekcemi, zahrnující sepse, meningitidy, pneumonie s bakteriemií a bakteriemie. Cílovými skupinami jsou především osoby ve věku 60 let a starší, zvláště imunitně oslabené nebo s doprovázejícími chronickými onemocněními a kuřáci. Účinnost vakcinace byla prokázána zejména v prevenci invazivních onemocnění. V případě pneumonií bez bakteriemie a otitis media, což jsou neinvazivní pneumokokové infekce, studie prokázaly nižší účinnost než u invazivních pneumokokových infekcí.
Registrované očkovací látky
V současnosti jsou v ČR registrované 4 vakcíny: polysacharidová pneumokoková vakcína Pneumovax23® a konjugované pneumokokové vakcíny: Prevenar 13®, Vaxneuvance® a Apexxnar®. Výhodou konjugovaných pneumokokových vakcín je vyšší imunogenita a nepřítomnost hyporesponsivity u vyšších věkových skupin (nad 65 let věku) a osob s chronickými onemocněními a sníženou funkcí imunitního systému. Nevýhodou je nižší sérotypové pokrytí v porovnání s polysacharidovou vakcínou Pneumovax23 (13–20 sérotypů).Ideální očkovací schéma u hyposple- nických/asplenických pacientů zahrnuje tedy jednu dávku konjugované vakcíny a následně v odstupu minimálně 8 týdnů jednorázovou aplikaci polysacharidové vakcíny (Pneumovax23®) k rozšíření spektra pokrytých sérotypů.
Časování vakcinace u pacientů léčených chemoterapií a radioterapií
Pneumokoková vakcinace by měla být podána 4–6 týdnů (minimálně ale 2 týdny) před zahájením chemoterapie či radioterapie. Pokud to není možné, vakcinaci je doporučeno podat až 3 měsíce od ukončení imunosupresivní terapie (chemoterapie, kortikoterapie, radioterapie s možností myelosuprese, některé typy cílené léčby). Vakcinace během imunosupresivní léčby není doporučována. Vakcínu Prevenar 13 je možno kombinovat s vakcínou proti chřipce.
Profylaxe infekcí u nemocných po splenektomii
Péče o nemocné po splenektomii zahrnuje edukaci zaměřenou na vysvětlení celoživotně zvýšeného rizika závažných infekcí, antibiotickou profylaxi/pohotovostní antibiotickou léčbu a vakcinace. Pacienti po splenektomii mají být dispenzarizováni u infektologa nebo u onkologa (pokud jde o onkologickou indikaci splenektomie).
Antibiotická profylaxe se podává jen v případech, kdy přínos jasně převažuje nad riziky. Takovou situací může být současná imunosupresivní terapie. Antibiotika se pak podávají preemptivně na krytí období těžkého imunodeficitu. Profylaxe je cílena především proti invazivním pneumokokovým infekcím. Výběr přípravku se řídí individuálními vlastnostmi pacienta (alergie), ale také citlivostí pneumokoků v daném regionu. Obvyklými léky jsou V-penicilin (500 mg à 12 h), cefuroxim axetil (500 mg à 24 h), kotrimoxazol (960 mg à 24 h) nebo klaritromycin (500 mg à 24 h).
Pohotovostní zásoba antibiotik je indikovaná pro pacienty, u nichž není zajištěna dostupnost léčebné péče v průběhu 2 hodin. Antibiotika začne pacient užívat v případě náhlého rozvoje horečnatého stavu, než se dostane do nemocnice. Doporučuje se amoxicilin klavulanát (dávka 1 g à 6–8 h) nebo cefuroxim axetil (500 mg à 6–8 h).
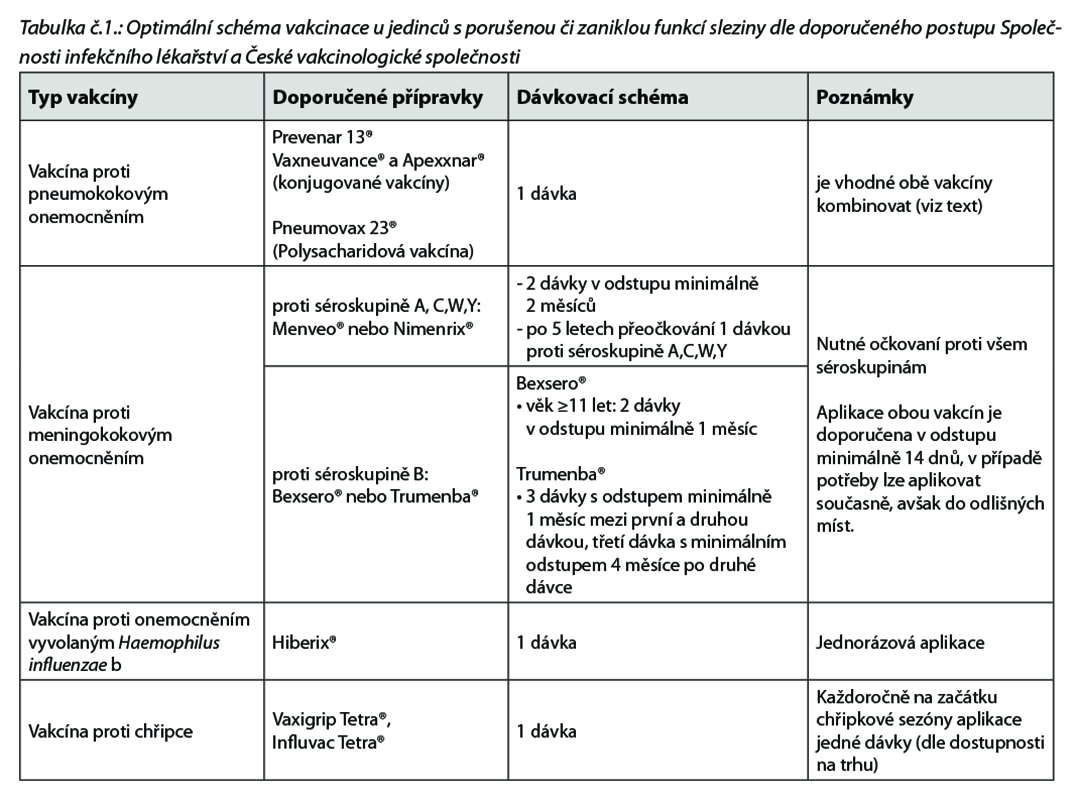
V případě elektivní splenektomie se má vakcinace provádět nejpozději 14 dnů před operací (postoperační vakcinace je již méně účinná). Pokud to nelze provést před výkonem tak aplikujeme vakcíny před propuštěním pacienta po výkonu. Je indikována vakcinace proti pneumokoku, vakcinace proti meningokoku, vakcinace proti hemofilu typu B a každoročně vakcinace proti chřipce (blíže viz tabulka č.1).
Literatura:
- Polák P, Kosina P, Blechová Z, Koten J, Rozsypal H, Chlíbek R, Beneš J. Doporučený postup péče o pacienty s porušenou či zaniklou funkcí sleziny (hyposplenismem/
asplenií). Vakcinologie 2013;7(3):102-107. - Doporučení vydané Českou vakcinologickou společností ČLS JEP: http://www.vakcinace.eu/doporuceni-a-stanoviska
- ESMO STATEMENTS ON VACCINATION AGAINST COVID-19 IN PEOPLE WITH CANCER. https://www.esmo.org/covid-19-and-cancer/covid-19-vaccination.





