4.1 Kolon stadium 0 (Tis, N0, M0)
- chirurgie: lokální excize nebo polypektomie do zdravé tkáně,
- adjuvantní terapie: není indikována.
4.2 Kolon stadium I (T1-2, N0, M0, Dukes´A)
4.2.1 Přístup k pT1 karcinomu odstraněnému endoskopicky
- V případě nálezu karcinomu má histologický popis obsahovat údaje umožňující posoudit úplnost endoskopické resekce a prognostická kritéria.
- V případě kompletní (R0) resekce pT1 karcinomu, má být použito rozdělení na „low-risk“ a „ high-risk“ karcinom.
Low-risk karcinom je definován:
- Hloubka submukózní invaze ≤ 1000 μm
- Dobře nebo středně diferencovaný adenokarcinom (G1, G2)
- Nepřítomnost lymfatické a vaskulární invaze
- Nepřítomnost příznaku pučení (budding) 2. nebo 3. stupně
V případě pozitivity kteréhokoli z uvedených kritérií se jedná o „ high-risk“ karcinom. Význam měření vzdálenosti neoplázie od laterálního resekčního okraje není znám.
Resekci malignizovaného polypu považujeme za kurativní v případě R0 resekce adenokarcinomu omezeného na hlavu nebo stopku a při absenci nepříznivých prognostických faktorů. Resekci malignizované nepolypoidní léze považujeme za kurativní v případě R0 resekce adenokarcinomu invadujícího maximálně do sm1 submukózy a při absenci nepříznivých prognostických faktorů. V případě endoskopické R0 resekce polypu obsahujícího „low-risk “ pT1 karcinom není indikována žádná další resekce k zajištění onkologické radikality.
Je-li „low-risk“ karcinom odstraněn nekompletně, má následovat kompletní endoskopická nebo chirurgická resekce. Pokud nelze dosáhnout kompletní resekce nebo jsou pochybnosti o stádiu pT1, má následovat chirurgická léčba. V případě „high-risk“ je vždy indikována radikální chirurgické léčba (bez ohledu na R0 resekci).
Po kompletní resekci (R0) „ low-risk“ karcinomu má být endoskopické vyšetření místa resekce (včetně biopsie) provedeno za 6 měsíců a poté za 2 roky.
4.2.2 Karcinomy T2
- chirurgie
- adjuvantní terapie není indikována
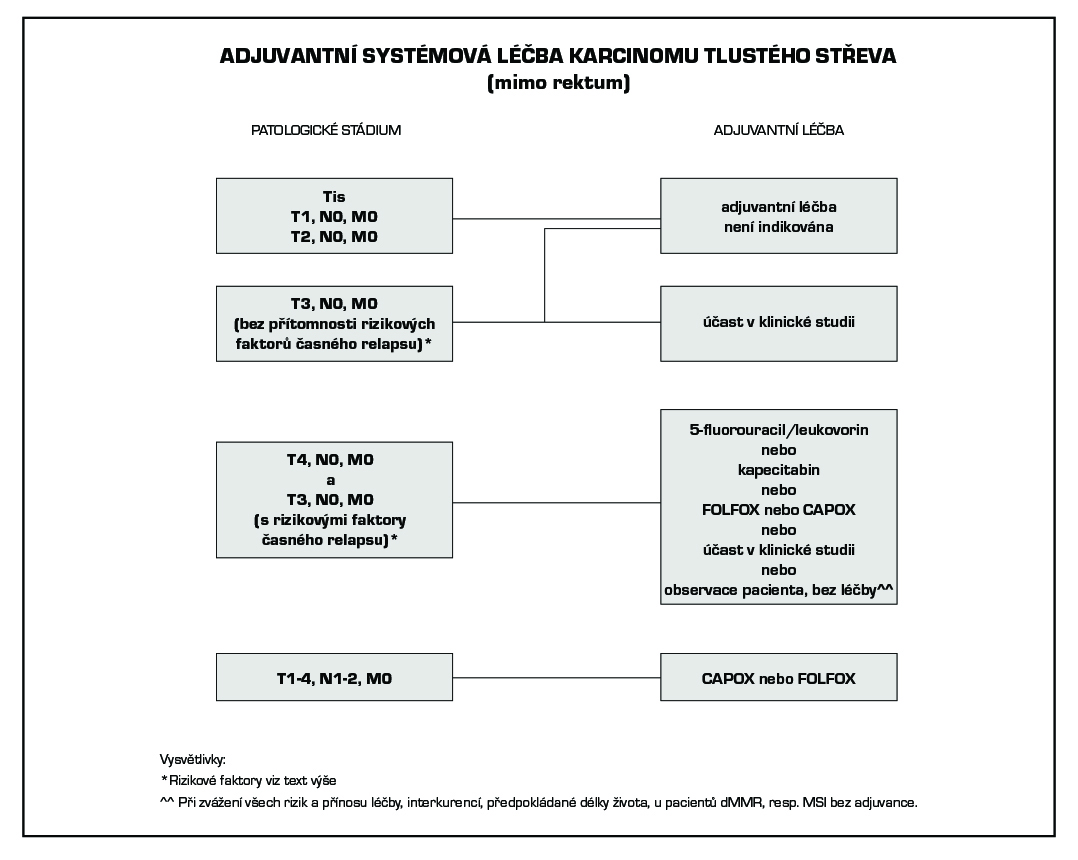
4.3 Kolon stadium II A, B, C (T3 N0 M0, T4 a-b N0 M0)
- chirurgie,
- adjuvantní chemoterapie: (6 měsíců), vyšetření DPD genotypu a MSI/MMR před zahájením
– pT3, N0, M0 bez rizikových faktorů: – adjuvantní chemoterapie není indikována (sledování)
– pT3, N0, M0 intermediate risk podskupina: 5-fluorouracil /LV nebo kapecitabin jsou preferované režimy u vysoce rizikových případů FOLFOX nebo CAPOX (preferován kontinuální režim před bolusovým 5FU).
Hlavní parametry pro zhodnocení intermediate risk podskupiny II. klinického stadia: G3 tumor; vaskulární invaze; lymfatická invaze; perineurální invaze; nádorová obstrukce v době dg; vysoké CEA perioperačně.
– pT4, N0, M0 a pT3, N0, M0 high risk podskupina: FOLFOX (6 měsíců) nebo CAPOX (3 měsíce) jsou preferované režimy před monoterapií fluoropyrimidiny (6 měsíců).
Hlavní parametry pro zhodnocení high risk podskupiny II. Klinického stadia: <12 vyšetřených lymfatických uzlin; pT4 stádium včetně perforace, kumulace rizikových faktorů uvedených pro intermediate risk skupinu.
Pokud je zvažována adjuvantní chemoterapie ve II. klinickém stadiu, je nutné molekulární vyšetření mikrosatelitové instability (MSI), resp. MMR (mismatch repair) v nádorové tkáni. MSI-high (dMMR) je markerem dobré prognózy ve II. klinickém stadiu CRC. Pacienti II. klinického stadia s deficiencí MMR (dMMR, tedy MSI-high) nemají prospěch z adjuvantní chemoterapie.
4.4 Kolon stadium III (jakékoliv T, N1, N2, M0, Dukes´C)
- chirurgie,
- adjuvantní chemoterapie: vyšetření DPD genotypu a MSI/MMR před zahájením:
– kont. 5-fluorouracil/LV nebo kapecitabin nebo FOLFOX nebo CAPOX. Kontinuální režimy preferovány před bolusovými,
– FOLFOX/CAPOX nebo kapecitabin nebo 5-fluorouracil/LV. Kombinované režimy jsou preferovány před monoterapií
Doporučená délka adjuvantní léčby karcinomu colon (neplatí pro rektum)
- U pacientů ve stádiu III s nižším rizikem, definovaným jako pT1-3 pN1, byla prokázaná non-inferiorita režimu CAPOX podávaného 3 měsíce ve srovnání se 6měsíčním podáváním této chemoterapie. Chemoterapie CAPOX podávaná 3 měsíce (tj. 4 cykly) je tudíž standardem pro tuto skupinu pacientů.
- U nemocných s vyšším rizikem (pT4 nebo pN2) nebyla pro režim CAPOX 3 vs 6 měsíců statisticky exaktně prokázaná non-inferiorita, ale vzhledem k minimálnímu rozdílu v přežití bez recidivy a snížené toxicitě lze i v tomto případě zvážit podání 3měsíční léčby CAPOX a po 3 měsících s pacientem probrat možnost prodloužení adjuvance až na 6 měsíců. Prodloužením adjuvance se zdvojnásobuje riziko toxicity, mírně se snižuje riziko relapsu (DFS).
- U režimu FOLFOX nebyla u pacientů pT1-3 pN1 prokázaná non-inferiorita 3měsíčního podávání. Statistický rozdíl v DFS pacientů léčených 3 a 6 měsíců byl však minimální. V tomto případě lze zvážit 3měsíční léčbu po diskusi s pacientem podobě jako v bodu 2.
- V případě pacienta s vysokým rizikem (pT4 nebo pN2) se 3měsíční terapie režimem FOLFOX nedoporučuje, standardem pro tento režim tedy zůstává 6měsíční léčba.
Tříměsíční léčebné režimy výrazným způsobem snižují dlouhodobé nežádoucí následky terapie, zejména potenciálně ireverzibilní neuropatii.
4.5 Rektum
4.5.1 Karcinom rekta – diagnostika
Pro přesnou lokální diagnostiku a staging nádorů konečníku je nutné provedení kolonoskopie a nejlépe také rektoskopie, MRI pánve (nutné u všech pokročilejších nádorů), individuálně EUS, vždy CT hrudníku, břicha (eventuálně PETCT k vyloučení diseminace v případě extensivní EMVI, vysokých hodnot CEA, či nejasnému nálezu na CT). Individuálně gynekologické vyšetření a cystoskopie.
Rektum se podle vzdálenosti tumoru od análního okraje dělí na:
dolní rektum <5 cm
střední rektum 5–10 cm
horní rektum >10–15 cm
V rámci stagingu by měla být stanovena TNM klasifikace, přítomnost/nepřítomnost invaze do mesorektální fascie (MRF +nebo -), extramurální vaskulární invaze (EMVI +nebo -) a pro navržení optimálního postupu je užitečné také zhodnocení radiálního cirkumferenčního okraje (CRM= circumferential resection margin) podle MRI. Doporučujeme vyšetření MMR/MSI především u nádorů, kde hrozí amputace rekta.
4.5.2 Karcinom rekta – možnosti léčby
Plán léčby by měl být stanoven v prostředí multidisciplinárního týmu na pracovišti, kde je komplexní léčba nádorů rekta rutinně prováděna. Při rozhodování o léčbě je potřeba brát v úvahu anatomické poměry konkrétního pacienta, komorbidity a celkový stav.
Terapie nádorů rekta je níže zmíněna jen schematicky. Přesná indikace a popis operačních technik a technik radioterapie je mimo rozsah tohoto doporučení. Je nutno brát v úvahu pacientovy preference a předpokládanou compliance.
- U velmi časných stadií T1sm1 N0 M0 (G1-2, bez cévní invaze)s průměrem do 3 cm zvážit provedení transanální endoskopické mikrochirurgie (TEM), cílem je R0 resekce. Pokud není R0 resekce dosaženo nebo jsou přítomny rizikové faktory (G3, L1, V1, hlubší infiltrace do submukosy – sm ≥ 2) je riziko lokální recidivy vysoké a mělo by následovat radikální resekční řešení (TME).
- U časných nádorů T1-T2; T3a/b středního a horního rekta, N0 (N1 u horního rekta) je varianta primárně chirurgického řešení bez neoadjuvance, ale pouze za předpokladu kvalitně provedené totální mezorektální excize (čisté mezorektální fascie) a pokud není přítomná EMVI. V případě neočekávaných rizikových faktorů v definitivním resekátu (CRM+, extranodální/
N2) se doporučuje adjuvantní CHRT. - U pokročilých nádorů rekta (≥T3 a/nebo N+) je doporučována neoadjuvantní onkologická léčba – chemoradioterapie (50,4 Gy s 5-fluorouracilem, či kapecitabinem) či totální neoadjuvantní terapie (TNT). V rámci tohoto přístupu je předoperačně aplikována kompletní protinádorová léčba, jak radioterapie, tak chemoterapie v různých schématech. Adjuvantní chemoterapie je podávána pak jen individuálně. TNT byla předmětem několika randomizovaných studií. Je důležité, že do studií byli zařazováni pacienti spíše mladšího věku (medián kolem 60 let) a v dobrém výkonnostním stavu ECOG PS 0-1.
Do studie III. fáze RAPIDO byli zařazeni pacienti, kteří splnili nejméně jedno z kritérií (rizikových faktorů): tumor cT4a nebo cT4b nebo extramurální vaskulární invaze (EMVI+) nebo N2 nebo invaze do mezorekta (MRF+) nebo zvětšené laterální pánevní uzliny.
Schéma studie RAPIDO: krátký kurz radioterapie (5×5Gy) následovaný chemoterapií FOLFOX4 (9×) nebo CAPOX (6×) před operačním výkonem. Kontrolním ramenem byla chemoradioterapie.
Do studie III. fáze PRODIGE 23 byli zařazováni pacienti cT3/cT4, postižení uzlin nebo jiný rizikový faktor nebyly podmínkou.
Schéma studie PRODIGE 23: mFOLFIRINOX (3 měsíce) následovaný dlouhým kurzem chemoradioterapie před operačním výkonem, pak možnost adjuvantní chemoterapie mFOLFOX6 nebo kapecitabin 3 měsíce. Kontrolním ramenem byla chemoradioterapie.
Do studie II. fáze OPRA byli zařazeni pacienti klinického stadia II a III. Byli randomizováni do ramene s indukční chemoterapií trvající 16 týdnů (CAPOX 5× nebo FOLFOX 8×) s následnou chemoradioterapií oproti chemoradioterapii následované konsolidační chemoterapií (CAPOX 5× nebo FOLFOX 8×). Medián doby restagingu byl 7,8 týdne po skončení TNT. Pacientům, kteří dosáhli kompletní remise nebo „near-complete response“ byla nabídnuta možnost sledování (78 %), ostatním byla doporučena radikální operace (26 %). Skoro u třetiny pacientů ve sledování došlo k lokální progresi (regrowth), což si vynutilo radikální operaci.
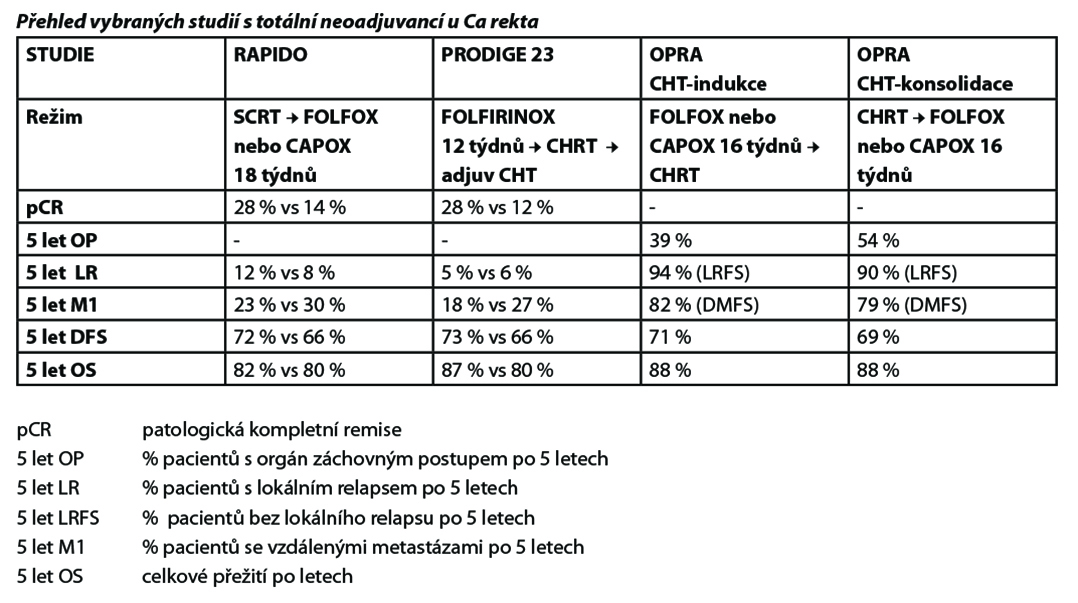
Adaptivní koncept neoadjuvantní léčby karcinomu rekta s možností vynechat chemoradioterapii testovala klinická studie III. fáze PROSPECT. Byli do ní zařazováni pacienti se středně pokročilými nerizikovými karcinomy středního a horního rekta cT2N+, cT3N-, cT3N+, (maximálně 3 zvětšené uzliny). Zařazeni mohli být jen pacienti vhodní pro nízkou přední resekci rekta (LAR). Pacienti byli léčeni 6 cykly chemoterapie mFOLFOX6, pak následovalo přešetření. Pokud došlo k regresi více než 20 %, následovala resekce bez radioterapie. Pokud k takové regresi nedošlo, byla selektivně aplikována chemoradioterapie a pak v obvyklém intervalu operace. Tento postup byl srovnáván s neoadjuvantní chemoradioterapií (50,4 Gy s 5-fluorouracilem, či kapecitabinem) a snahou bylo dokázat noninferioritu FOLFOX chemoterapie se selektivním podáním chemoradioterapie. Primárním cílem bylo přežití bez progrese a tento cíl byl splněn.
Možná schémata léčby pro různě rizikové skupiny pacientů s karcinomem rekta
Nízké riziko: cT1-2, příznivé cT3a/b N0, MRF-, (CRM-)
• samostatná chirurgická léčba.
U pacientů středního a vysokého rizika je nutné zhodnotit komorbidity, věk, symptomy, výkonnostní stav, pohled chirurga, schopnost absolvovat chemoterapii, postoj pacienta a podle toho navrhnout postup:
Střední riziko cT2N+, cT3N-, cT3N+, s maximálně 3 zvětšenými uzlinami, jen střední a horní rektum, předpoklad provedení LAR
• 6 cyklů mFOLFOX6, přešetření a v případě regrese > 20 % operace, v opačném případě chemoradioterapie a operace následně.
Střední riziko T3a/b N1 horní a střední rektum, EMVI-, CRM-
Vysoké riziko: T3c/d, T4, N2, laterální N+, EMVI+, CRM+, těsný vztah nebo infiltrace levátorů
• Totální neoadjuvance podle schématu studie RAPIDO (viz výše) – následuje operace.
• Totální neoadjuvance zahájená systémovou chemoterapií 12-16 týdnů (CAPOX, FOLFOX, případně mFOLFIRINOX) a pak chemoradioterapie – následuje operace.
- Pokud není vhodná totální neoadjuvance, tak chemoradioterapie s kapecitabinem nebo 5-FU.
- U křehkých pacientů (věk, komorbidity), nebo pokud není vhodná ani chemoradioterapie, je vhodný krátký kurz radioterapie následovaný operací
Adjuvantní radioterapie ± chemoterapie je vhodná jen pro jednotlivé případy, kdy předoperační léčba provedena nebyla.
Pokud nebyla provedena totální neoadjuvance, tak podobně jako u karcinomů kolon může být podána adjuvantní chemoterapie u nádorů rekta III. klinického stadia a rizikových nádorů II. klinického stadia, ale úroveň důkazů o účinnosti je zde výrazně menší než u nádorů kolon. V případě podání adjuvantní chemoterapie je celková doporučovaná doba neoadjuvantní chemoradioterapie a adjuvantní chemoterapie 6 měsíců.
Pokud je po neoadjuvantní léčbě dosaženo kompletní odpovědi (klinicky, endoskopicky, MR), tak lze u dobře informovaných a motivovaných pacientů volit pečlivé sledování ve specializovaných centrech. Relativní riziko lokální a vzdálené rekurence oproti obvyklé chirurgické léčbě není přesně stanoveno.
U pacientů s karcinomem rekta dMMR/MSI high (především pokud hrozí amputace rekta s trvalou stomií) je vhodné zvážit možnost neoadjuvantní léčby imunoterapií (checkpoint inhibitory). Je velká pravděpodobnost dosažení kompletní remise a možnost watch and wait strategie. Doposud publikované výsledky menších klinických studií jsou
zcela přesvědčivé. Tato léčba nemá v současnosti stanovenu úhradu z prostředků zdravotního pojištění.

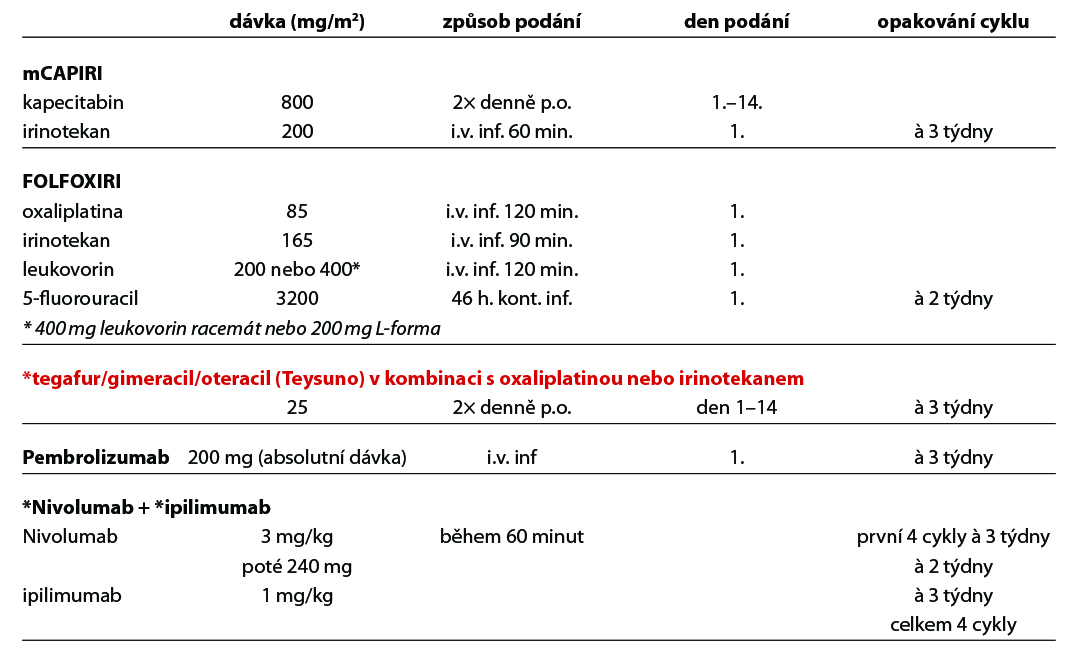
4.5.2 Prevence infuzní rekce při podání cetuximabu
Není žádné jednotné schéma premedikace před podáním cetuximabu, v souladu s SPC jde o kombinaci antihistaminik a kortikoidů, která je podána nejméně hodinu před aplikací cetuximabu.
Uvádíme možné premedikační schéma, na kterém se shodl panel odborníků (kliničtí onkologové, imunolog, klinický farmaceut).
Večer před aplikací cetuximabu:
• dexamethason 8 mg tbl. p.o.
• pokud zapomene, tak podat ráno dexamethazon 8 mg i.v. nejméně 1 h před podáním infuze (optimálně 3–4 h předem).
Premedikace v den aplikace cetuximabu:
Dexamethason 8 mg, i.v. (lze i p.o.), minimálně 1 hodinu před zahájením infuze.
H1 antihistaminika: např. bisulepin (Dithiaden), nejlépe i.v. nebo i.m. 1 mg, případně 2 mg p.o., nebo jiný antagonista H1 receptoru, například levocetirizin (Analergin, Xyzal) 5 mg tbl
H2 antagonista: např. ranitidin (Ranisan) 75 mg p.o. nebo 50 mg i.v. nebo jiný antagonista H2 receptoru – famotidin (Famosan)
COX 2 inhibitor: např. nimesulid 100 mg p.o. Při kontraindikaci COX 2 inhibitoru je vhodné podat paracetamol v dávce 500 mg p.o. (Cyklooxygenáza 2 je enzym, který se podílí na syntéze prostaglandinů a prostacyklinu, působků, které hrají hlavní roli v patogenezi alergické reakce).
Pokud se infuzní reakce neobjeví, lze dávky kortikoidů v následujících cyklech redukovat.
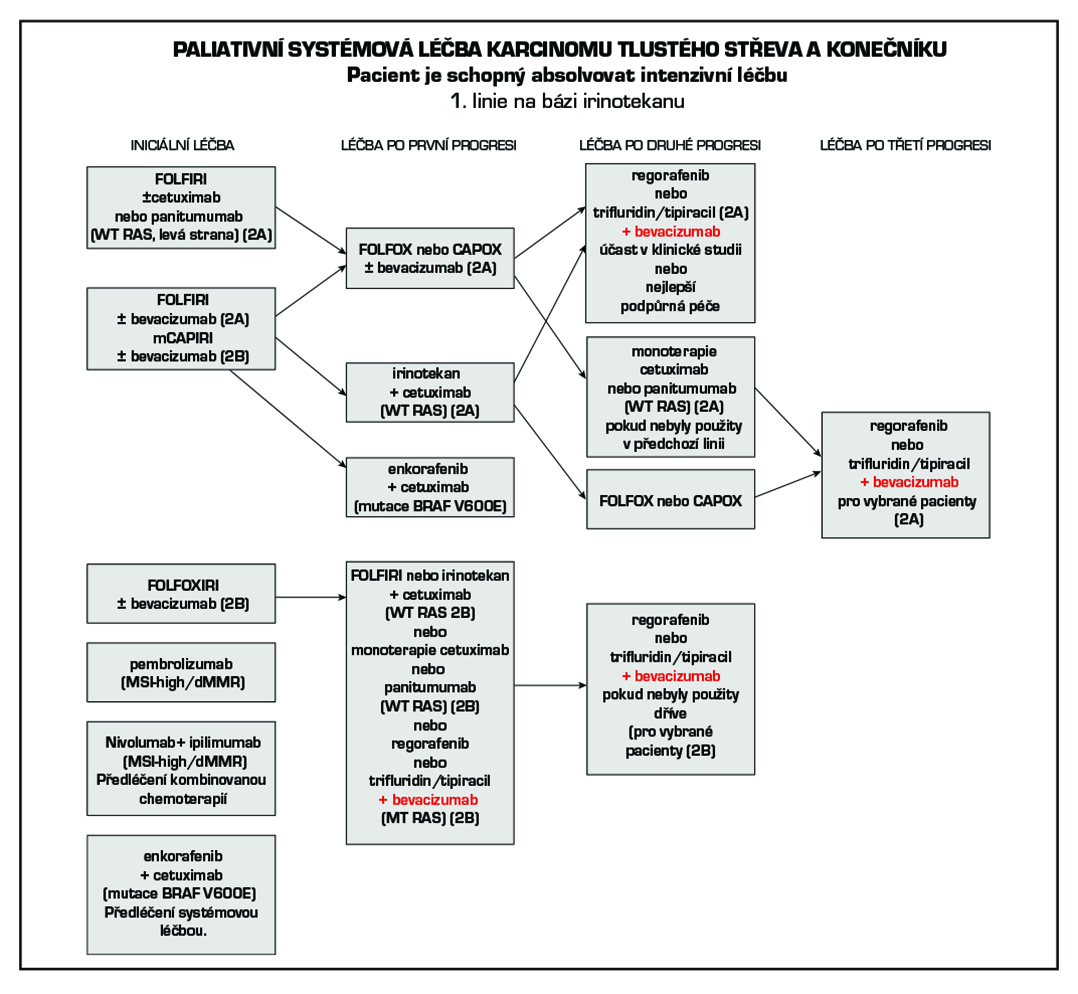
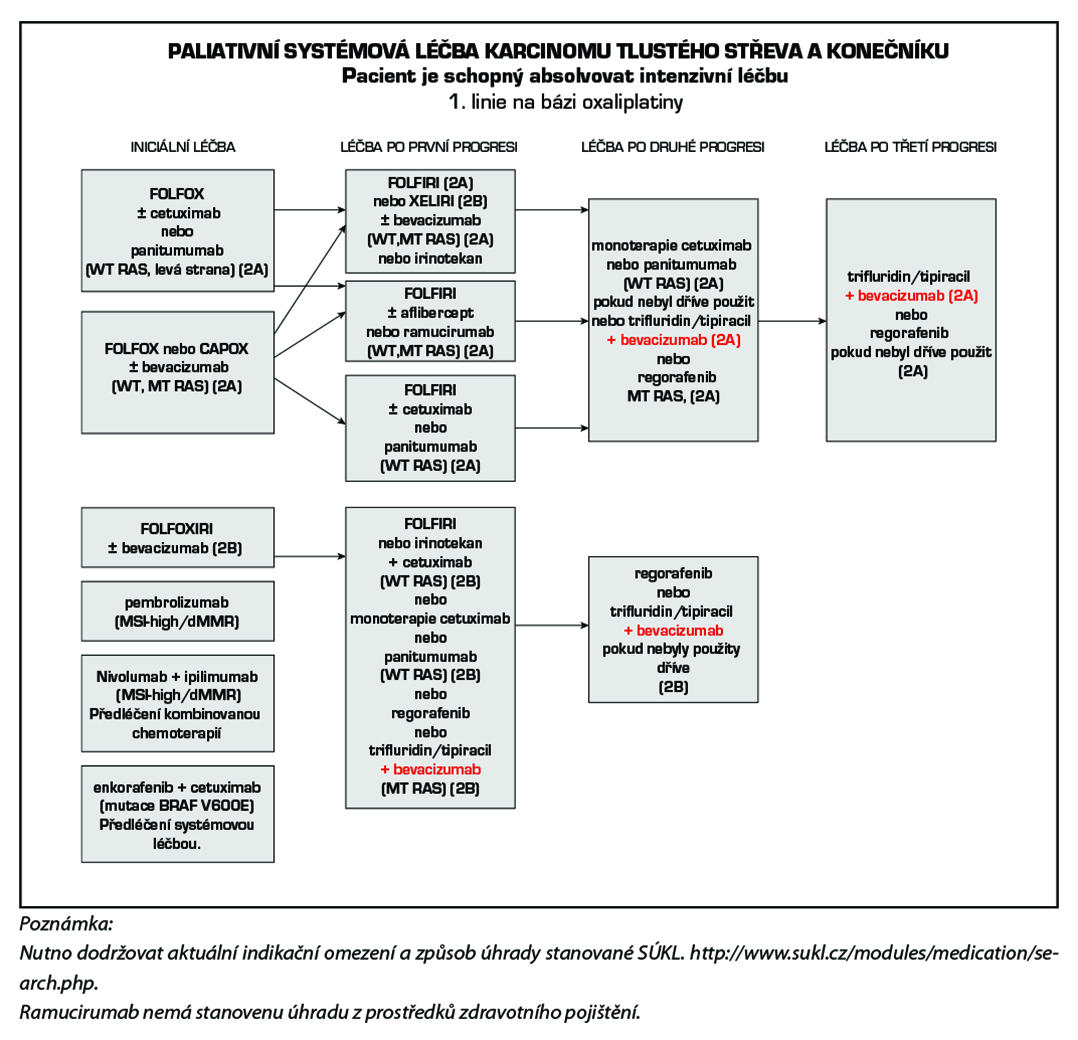
4.6 Stadium IV (jakékoliv T, jakékoli N, M1) + lokálně pokročilé inoperabilní onemocnění
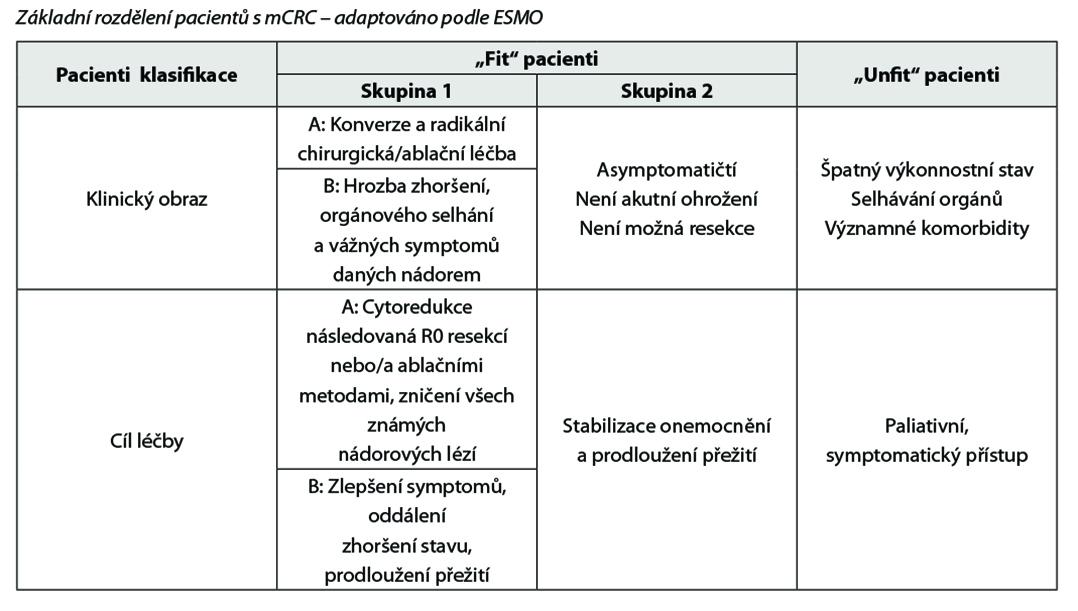
4.6.1 Systémová paliativní terapie
Základním nositelem protinádorového účinku v časných liniích léčby je chemoterapie, cílená léčba tento účinek zvyšuje. Je možné použít režimy s bevacizumabem, cetuximabem, panitumumabem afliberceptem , a ramucirumabem . Cetuximab lze kombinovat s režimy FOLFIRI, FOLFOX nebo irinotekanem v monoterapii. Panitumumab je možné kombinovat v 1. linii s FOLFOX a FOLFIRI a v 2. linii s FOLFIRI. Nevhodná je kombinace cetuximabu a panitumumabu s kapecitabinem. Aflibercept lze kombinovat s FOLFIRI ve 2. linii léčby po progresi na režimu s oxaliplatinou. Pro léčbu ramucirumabem v 2. linii je požadována předléčenost bevacizumabem, oxaliplatinou a fluoropyrimidinem. Podle výsledku studie ML18147 lze po progresi na 1. linii chemoterapie s bevacizumabem podat bevacizumab s chemoterapií také v 2. linii. Pokud z důvodů intolerance dojde v průběhu kombinační léčby k ukončení/přerušení podávání chemoterapie, je léčba bevacizumabem, cetuximabem, panitumumabem nebo afliberceptem možná do progrese.
Při použití režimů s oxaliplatinou a bevacizumabem nebo anti-EGFR je vhodné po 4 měsících léčby zvážit vysazení oxaliplatiny a pokračovat v léčbě udržovací s fluoropyrimidinem a bevacizumabem nebo anti-EGFR. Cílem je redukce neurotoxicity. Režim FOLFIRI s cílenou léčbou používáme obvykle do progrese. Pokud v rámci udržovací terapie dojde k progresi,
lze se vrátit k původně účinnému kompletnímu režimu.
Přípravek tegafur/gimeracil/ oteracil (Teysuno) lze použít v monoterapii nebo v kombinaci s oxaliplatinou nebo irinoteknem, s bevacizumabem nebo bez něj, k léčbě pacientů s metastazujícím kolorektálním karcinomem, u nichž není možné pokračovat v léčbě jiným fluorpyrimidinem kvůli syndromu ruka-noha nebo kardiovaskulární toxicitě, která se objevila při adjuvantní nebo metastatické léčbě.
U pacientů, kteří byli dříve léčeni standardními režimy chemoterapie, anti-VEGF a anti-EGFR léčbou, ev. u pacientů kteří nejsou vhodní pro tyto dostupné terapie, lze použít trifluridin/tipiracil (Lonsurf ) nebo regorafenib (Stivarga) v monoterapii. Efektivitu trifluridin/tipiracilu výrazně zvyšuje kombinace s bevacizumabem (prodloužení OS). Regorafenib a trifluridin/tipiracil mohou být použity sekvenčně, pořadí při sekvenčním podání není určeno, je nutno dodržovat úhradová pravidla.
Pro kvalifikované rozhodnutí o typu cílené léčby pokročilého metastatického kolorektálního karcinomu je nutné znát stav mikrosatelitové instability (MSI), resp. MMR (mismatch repair) v nádorové tkáni. mutační stav onkogenů rodiny RAS (KRAS, NRAS) a BRAF, ke zvážení je testování HER-2 a NTRK. Tato informace umožní plánovat dopředu léčbu ve více liniích. Onkogeny RAS představují negativní prediktivní marker pro použití cílené anti-EGFR léčby, kterou lze podat pouze v případě nemutovaného stavu onkogenů RAS (wild type). Účinnost inhibitorů EGFR cetuximabu a panitumumabu v léčbě metastatického kolorektálního karcinomu je obdobná. V případě progrese na jednom inhibitoru EGFR není indikováno podání druhého. Pro léčbu bevacizumabem, afliberceptem, ramucirumabem, regorafenibem a trifluridin/tipiracil (Lonsurf) prediktivní parametr v praxi zaveden není. Pokud není dostupná nádorová tkáň k testování RAS, lze využít tekuté biopsie.
Mutaci KRAS je vhodné konkretizovat, je předpoklad, že výhledově budou dostupné inhibitory KRAS G12C.
U křehkých pacientů bez mutace RAS, pro které není vhodná kombinovaná chemoterapie, lze zvážit podání anti-EGFR v monoterapii v 1. linii léčby, tato indikace nemá stanovenu úhradu z prostředků zdravotního pojištění.
4.6.2 Zvláštní podskupiny kolorektálního karcinomu ve IV. klinickém stadiu
4.6.2.1 Nádory dMMR/MSI-high
Pembrolizumab je registrován v monoterapii v první linii k léčbě metastazujícího kolorektálního karcinomu s MSI-high, resp. dMMR.
Nivolumab v kombinaci s ipilimumabem je indikován k léčbě pacientů s metastazujícím kolorektálním karcinomem MSI-high, resp. dMMR po předchozí kombinované chemoterapii na bázi fluoropyrimidinu. Po 4 cyklech této kombinace následuje monoterapie nivolumabem.
4.6.2.2 Nádory s mutací V600E BRAF
Prognosticky nepříznivou podskupinou jsou nádory s prokázanou BRAF mutací, kde je u pacientů ve velmi dobrém klinickém stavu upřednostňována jako úvodní léčba triplet FOLFOXIRI plus antiVEGF terapie, případně dublet plus antiVEGF. Pro předléčené pacienty s mutací BRAF V600E je indikována cílená léčba enkorafenib v kombinaci s cetuximabem. Pacientům s mutací BRAF by tedy neměl být podán inhibitor EGFR v první linii a cetuximab by měl být ponechán právě pro kombinaci s enkorafenibem. V případě mutace BRAF V600E nemá lokalizace primárního tumoru prediktivní význam pro léčbu kombinací enkorafenib +cetuximab.
U nádorů s mutací BRAF V600E a zároveň dMMR/MSI-high je preferováno dřívější podání imunoterapie.
4.6.2.3 Nádory s fúzním genem NTRK
Pacienti s nádory s fúzním genem NTRK genu jsou kandidáty terapie NTRK inhibitory *entrektinibem nebo larotrektinibem*.
1. linie
– monoterapie nebo kombinovaná léčba (viz schémata). Volba monoterapie nebo kombinované léčby závisí na komorbiditách, prognostických a prediktivních faktorech. Účinnější jsou kombinované kontinuální režimy. Léčba podaná v 1. linii se hodnotí po 2–3 měsících léčby. Pokud je onemocnění po 3 měsících léčby v kompletní remisi (CR), parciální remisi (PR) nebo stabilní (SD), pak je možné v ní dále pokračovat. Pro 1. linii lze rovnocenně použít cytostatika v intravenózní i perorální formě: 5-fluorouracil, kapecitabin, oxaliplatinu, irinotekan, (výjimečně raltitrexed) a cílenou léčbu: bevacizumab, cetuximab, panitumumab. Nevhodná je kombinace cetuximabu a panitumumabu s kapecitabinem.
Vliv lokalizace primárního tumoru v pravé nebo levé polovině tračníku na volbu cílené léčby.
Lokalizace primárního nádoru je jedním z parametrů, které je potřeba brát v úvahu při volbě cílené léčby. Retrospektivní analýza několika velkých randomizovaných klinických studií prokazuje, že lokalizace primárního nádoru v pravé nebo levé části tračníku má silný prognostický a prediktivní význam. Nádory v pravé části mají prognózu výrazně horší a vyžadují proto agresivní léčbu. Hranice mezi pravou a levou částí tračníku je v oblasti distální třetiny příčného tračníku. Úsek od lienální flexury po rektum (včetně) tvoří levou část. Podkladem rozdílů je pravděpodobně nerovnoměrné zastoupení různých molekulárních subtypů kolorektálního karcinomu v pravé a levé části tračníku. Účinnost inhibitorů EGFR v první linii terapie je v případě nádorů (wt-RAS) v pravé části tračníku u většiny pacientů malá a nemáme v současnosti parametr, který by identifikoval pacienty, kteří prospěch z léčby inhibitory EGFR mají. Naopak v levé části je účinnost inhibitorů EGFR ve srovnání s pravostrannou lokalizací vyšší. Anti-EGFR léčbu lze použít u pravostranných nádorů, pokud je cílem dosažení regrese, typicky před následnou resekcí nebo ablací metastáz. V případě mutace BRAF V600E nemá lokalizace primárního tumoru prediktivní význam pro léčbu kombinací enckorafenib +cetuximab, kterou lze použít u pacientů předléčených systémovou léčbou.
Vyšší linie
Léčbu ve vyšších liniích je třeba posoudit individuálně s ohledem na PS (≤ 2), rozsah onemocnění, předchozí odpověď na léčbu, výskyt nežádoucích účinků, komorbidity. V léčbě se pokračuje do progrese onemocnění. Přešetření účinnosti léčby je indikováno vždy po 2–3 měsících.
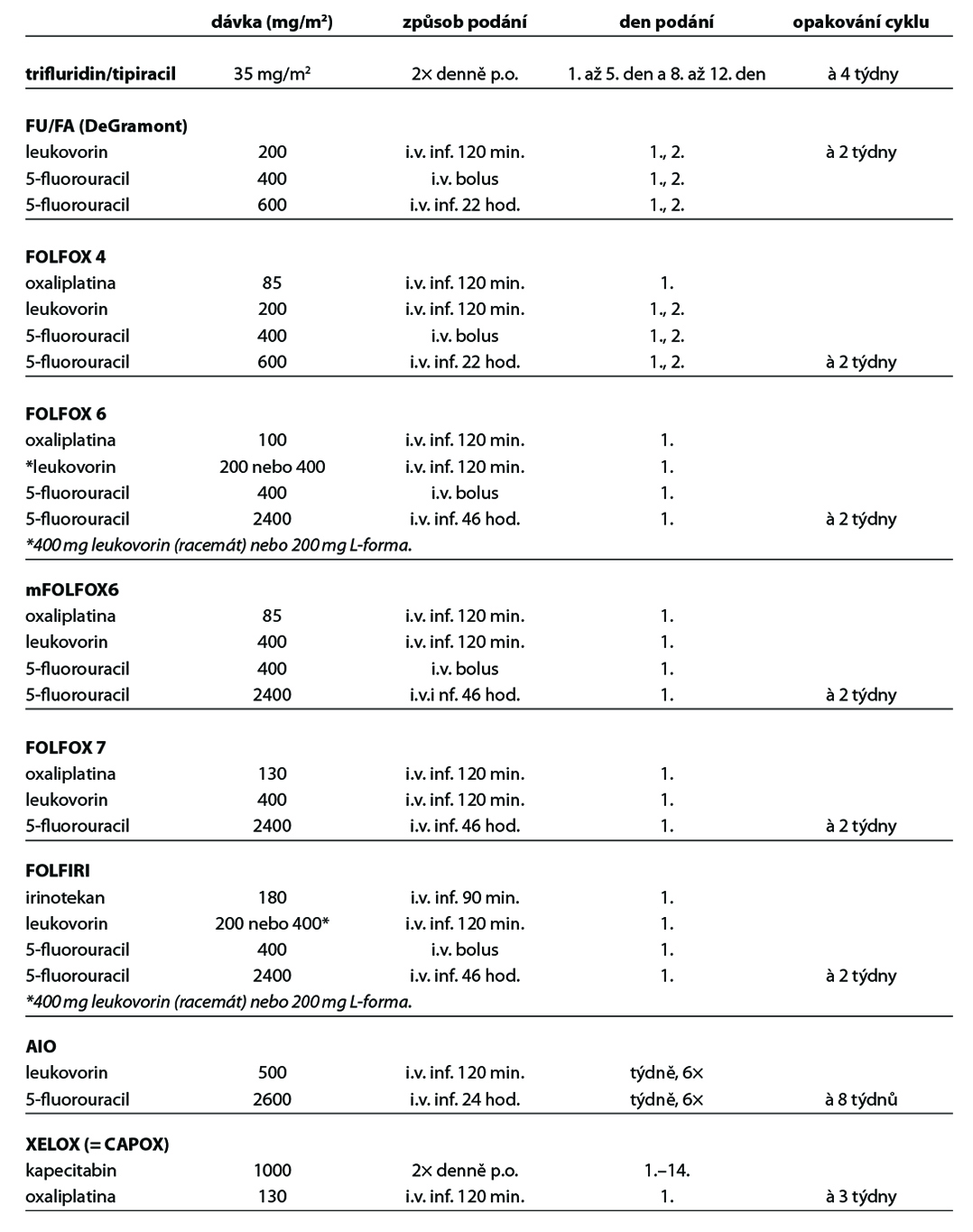
Níže uvedená schémata systémové léčby jsou jen orientační, vycházející ze současných trendů léčby ve světě. Kontinuální režimy s 5-fluorouracilem jsou méně toxické a jsou více účinné proti režimům bolusovým, proto by měly být kontinuální režimy jednoznačně preferovány. Kontinuální 5-fluorouracil lze především v kombinaci s oxaliplatinou nahradit kapecitabinem (CAPOX).
Přesné číselné pořadí dalších linii léčby nelze arbitrárně stanovit a volba léčebné sekvence musí vycházet z konceptu personalizovaného léčebného přístupu kontinuálně podávané léčby (continuum care). Je tak možný např. návrat k původnímu intenzivnímu režimu po progresi na udržovací chemoterapii nebo reindukce již použitého režimu, u kterého byla zaznamenána léčebná odpověď, číselné označování léčebných linií tak ztratilo svůj význam.
U vybraných pacientů, u kterých bylo v předchozích liniích dosaženo léčebné odpovědi lze zvážit možnost rechallenge anti-EGFR na základě testování stavu RAS tekutou biopsií, tato indikace ale nemá stanovenu úhradu z prostředků zdravotního pojištění.
4.6.3 Komplexní léčba metastáz kolorektálního karcinomu
Optimální léčebný postup by měl být stanoven po projednání v multidisciplinárním týmu (MDT) se zápisem závěru v dokumentaci pacienta. U oligometastatického onemocnění a při metastázách pouze v játrech a/nebo v plicích je projednání v MDT nutné. O oligometastatické onemocnění se jedná, pokud jsou metastázy přítomny v jedné nebo dvou lokalizacích
(orgánech) a pokud je počet metastáz maximálně 5 (výjimečně více). Cílem komplexní léčby metastáz je radikální resekce a/nebo ablace všech makroskopicky patrných metastatických ložisek se zachováním dobré funkce resekovaných orgánů. Chirurgická resekce má většinou přednost před ablačními metodami, možná je kombinace. Při zvažování chirurgické léčby metastáz je nutné posoudit jak chirurgická (technická) kritéria výkonu, tak „onkologická“ (prognostická). K prognostickým kritériím patří: počet metastáz a jejich velikost, rozsah extrahepatického postižení, synchronní metastázy, krátký interval do relapsu po resekci primárního nádoru (<12 měsíců), vysoká hladina CEA (>200ug/l).
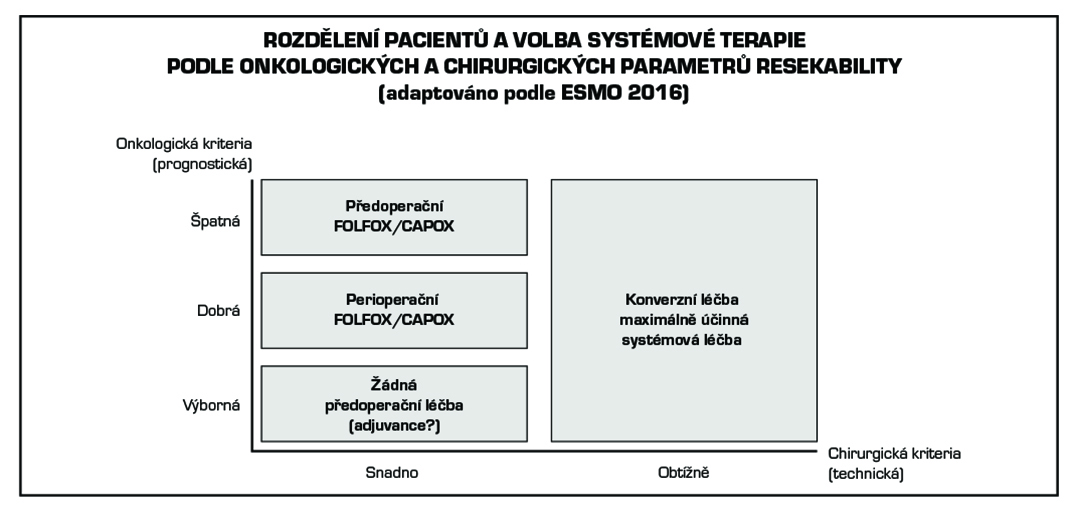
Dále uvedená doporučení mají schématický charakter.
Léčba oligometastatického onemocnění:
Použít maximálně intenzivní léčebný režim s cílem dosáhnout léčebné odpovědi. Přešetření po 2 měsících léčby a posouzení resekability s možným využitím ablačních metod (RFA, MWA, embolizační techniky, SBRT…). Po radikální resekci/ablaci zvážit pokračování v systémové léčbě do celkové doby 6 měsíců. Pokud jsou pouze peritoneální metastázy, tak zvažovat cytoredukční operaci v kombinaci s intraperitoneální hypertermickou chemoterapií (HIPEC) na specializovaném pracovišti.
Resekabilní metastázy
Chirurgická léčba s možností následné „adjuvantní“ chemoterapie (FOLFOX/CAPOX) nebo perioperační chemoterapie (3 měsíce FOLFOX/CAPOX před resekcí a 3 měsíce po resekci). Je nutné přešetření po 6–8 týdnech a resekovat dříve, než dojde k vymizení ložisek na zobrazovacích metodách, protože je velké riziko vitálního rezidua metastáz. V případě jednoznačně resekabilních metachronních metastáz je upřednostňován chirurgický výkon. V adjuvantní ani perioperační indikaci není indikována cílená (biologická) léčba.
Hraničně resekabilní metastázy
Maximálně účinný režim chemoterapie s cílenou léčbou (FOLFOX/CAPOX, FOLFIRI + inhibitor EGFR nebo bevacizumab), FOLFOXIRI ± bevacizumab. Přešetření za 2 měsíce a při dosažení resekability indikovat ihned chirurgickou léčbu. Dlouhodobá chemoterapie zvyšuje morbiditu resekcí.
Neresekabilní metastázy
Agresivitu chemoterapie v kombinaci s cílenou léčbou volit podle léčebného záměru, zda je nebo není důležité dosažení cytoredukce.
Synchronní metastázy
Je nutné posoudit rozsah a symptomy primárního nádoru, především riziko obstrukce případně krvácení a rozsah a resekabilitu metastáz. Podle toho bude volena strategie léčby. Resekce primárního nádoru u metastatického onemocnění může být nutná v případě symptomů z obstrukce střeva nebo při krvácení. Pokud je primární tumor asymptomatický a metastázy jsou hodnoceny jako neresekabilní, tak jeho resekce obvykle nutná není.
Možný je také postup „liver first“, resekce jater a následně resekce primárního nádoru.
Karcinom rekta se synchronními metastázami
Individuálně zvažovat postup podle pokročilosti primárního nádoru a rozsahu metastatického postižení, v prostředí MDT se zápisem rozhodnutí MDT v dokumentaci pacienta. V případě resekabilních nebo hraničně resekabilních metastáz lze zahájit 2–3 měsíci systémové chemoterapie (FOLFOX, CAPOX, FOLFIRI) ± cílená léčba s následnou resekcí primárního nádoru a metastáz (synchronně nebo fázově) nebo před resekcí primárního nádoru vložit radioterapii nebo chemoradioterapii na oblast pánve a chirurgickou léčbu odstupu následně. Lze také zahájit chemoradioterapií s následnou resekcí primárního nádoru a metastáz a adjuvantní chemoterapií. Možný je také postup „liver first“ a před resekcí primárního nádoru zvážit možnost radioterapie ± chemoterapie.
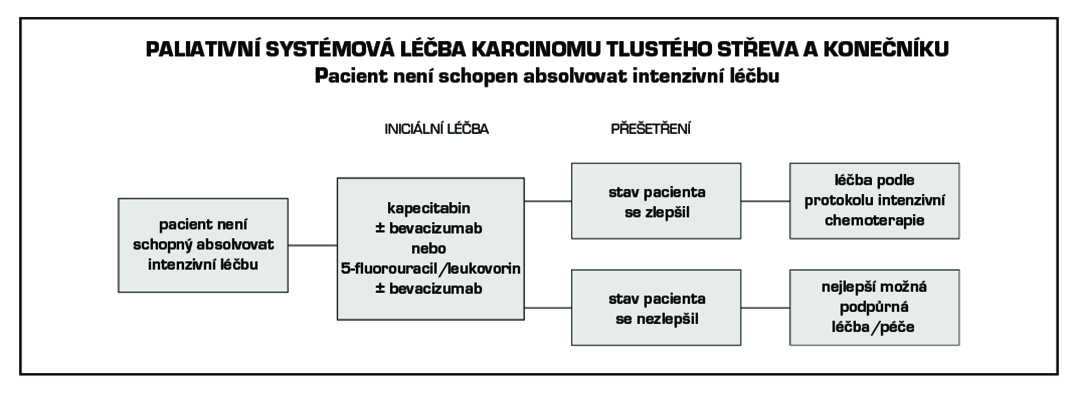
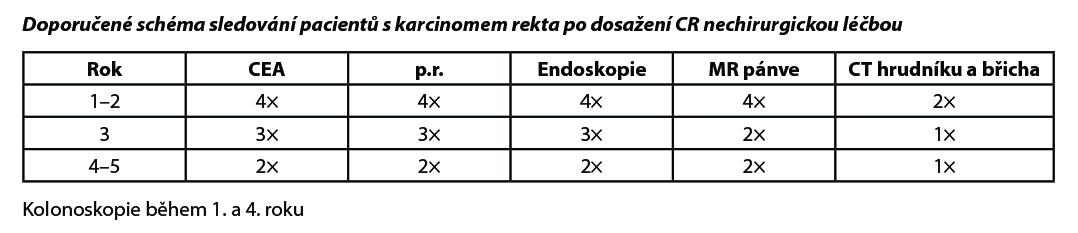
4.7. Doporučené zásady sledování pacientů v CR po radikální léčbě
4.7.1. Sledování pacientů v časných stadiích
Cílem follow up je včasný záchyt relapsu s cílem prodloužení přežití. Volit méně intenzivní sledování u pacientů věku > 75 let a při závažnějších komorbiditách, které vylučují intenzivní léčbu relapsu.
Klinické vyšetření: zaměřit se na možné symptomy relapsu a nežádoucí účinky proběhlé léčby.
V I. klinickém stadiu (T1,T2 N0 M0) indikováno pouze kolonoskopické vyšetření v 1. roce, ve 3. roce a pak každých 5 let. Pokud je zachycen rizikový adenoma, tak opakovat po roce.
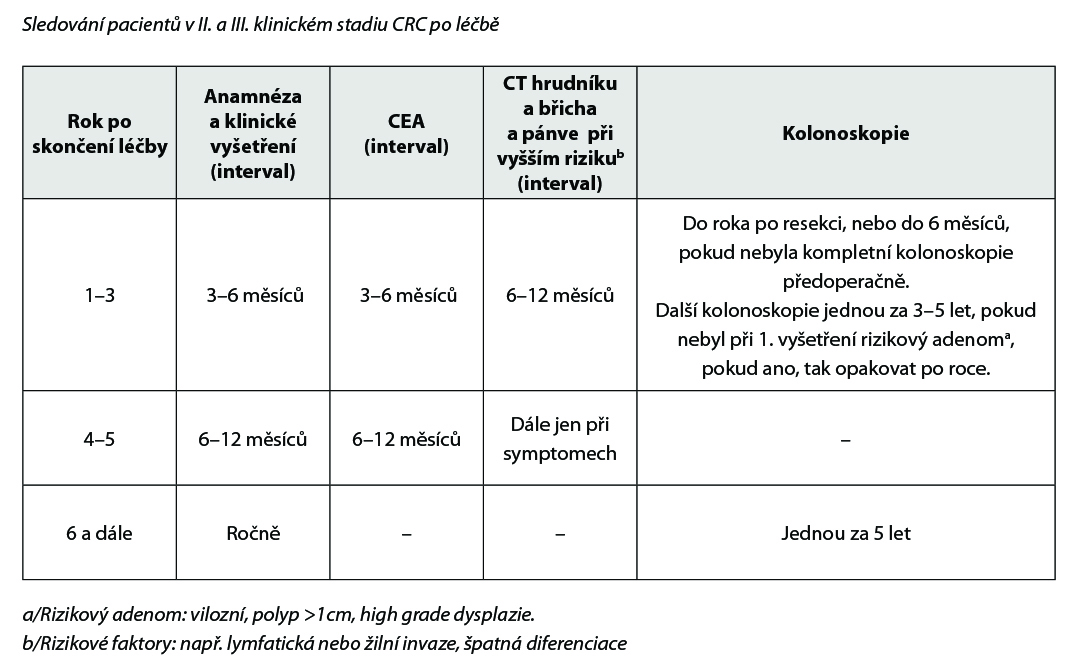
UZ (CEUS) může nahradit CT.
Nebyl prokázán benefit ze sledování jiných laboratorních parametrů. Pokud byl předoperačně vyšší marker Ca 19–9, je vhodné ho sledovat. Další vyšetření volit přísně individuálně se zohledněním symptomů. Po 5 letech není doporučeno sledování žádného laboratorního parametru ani zobrazovacího vyšetření. Vyhovuje klinické vyšetření ročně, kolonoskopie jednou za 5 let, pokud nejsou rizikové polypy.
4.7.2 Sledování pacientů ve IV. klinickém stadiu po radikální metastazektomii
CT hrudníku, břicha a pánve jednou za (3)–6 měsíců 2 roky, pak jednou za 6–12 měsíců do 5 let. Těsné sledování v případě, že by byl pacient schopen další operace.
Sledování CEA jednou za 3–6 měsíců 3 roky, pak jednou za 6 měsíců do 5 let. Kolonoskopie jak u časných stadií. Ošetřující lékař plánuje sledování individuálního pacienta podle potřeby.
4.7.3 Endoskopické sledování pacientů po endoskopickém odstranění adenomů
V případě snesení 1–2 adenomů menších 1 cm bez přítomnosti high-grade intraepiteliální neoplázie je dostačující interval 10 let.
Pacienti, kteří měli 3–10 adenomů nebo nejméně jeden adenom větší 1cm nebo adenom s vilózní histologií mají mít dispensární koloskopii za 3 roky.
Pacienti s adenomem s high grade intraepiteliální neoplázií mají mít dispensární koloskopii za 3 roky.
Pokud není histologicky potvrzená úplná resekce, má být provedena časná endoskopická kontrola za 2–6 měsíců.
V případě více než 10 adenomů má být dispensární interval kratší než 3 roky a má být stanoven individuálně s přihlédnutím k rodinné anamnéze.
Po snesení velkého, plochého nebo sesilního adenomu po částech (piecemeal) je indikována endoskopická kontrola místa resekce (s biopsií) za 2–6 měsíců.
Je-li dispensární koloskopie normální, další kontroly jsou indikovány každých 5 let.
Po kompletní resekci tradičního pilovitého adenomu, smíšeného polypu nebo sesilního pilovitého adenomu má být kontrolní koloskopie za 3 roky.
4.8 Prediktivní vyšetření u kolorektálního karcinomu
Doporučujeme vyšetřit stav MSI/MMR u všech nemocných s pokročilým či metastatickým onemocněním před stanovením strategie léčby, v adjuvantním záměru před nasazením systémové léčby na bázi 5-FU a jeho derivátů.
U všech pacientů ve IV. Klinickém stadiu je doporučeno před zahájením 1. linie systémové léčby vyšetřit aktivační mutace genů rodiny RAS (KRAS, NRAS) a aktivační mutaci V600E genu BRAF. Ke zvážení je testování HER-2.
V individuálních případech lze u pacientů ve IV. klinickém stadiu vyšetřit fúze NTRK (možnost terapie larotrektinibem a entrektinibem) a u pacientů v dobrém stavu při vyčerpání možností standartní léčby testování NGS.
Doporučujeme zavádět do praxe vyšetřování DPYD před nasazením fluoropyrimidinů s cílem minimalizovat riziko toxicity léčby.
Literatura:
- Argiles G, Tabernero J, Labianca R et al. Localised Colon Cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up Ann Oncol . 2020
Oct;31(10):1291-1305. doi: 10.1016/j.annonc.2020.06.022. - Cervantes A, Adam R, Roselló S et al. Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol . 2023
Jan;34(1):10-32. doi: 10.1016/j.annonc.2022.10.003. - KDP-AZV-01-SGO Časný kolorektální karcinom (klinická stádia I. a II.) – diagnostika a léčba
- KDP-AZV-07-SGO Pozdní kolorektální karcinom (klinická stádia III. a IV) – diagnostika a léčba





