Konference: 2007 XIV. Jihočeské onkologické dny
Kategorie: Maligní lymfomy a leukémie
Téma: Diagnostika a léčba maligních lymfomů
Číslo abstraktu: 009
Autoři: Prof. RNDr. Mgr. Marie Jarošová, CSc.; Mgr. Helena Urbánková, Ph.D.; Mgr. Eva Budinská, Ph.D.; doc. MUDr. Tomáš Papajík, CSc.; RNDr. Milena Holzerová, Ph.D.; Mgr. Jana Balcárková, Ph.D.; Mgr. Radek Plachý, Ph.D.; Mgr. Lenka Kučerová; prof. MUDr. Karel Indrák, DrSc.
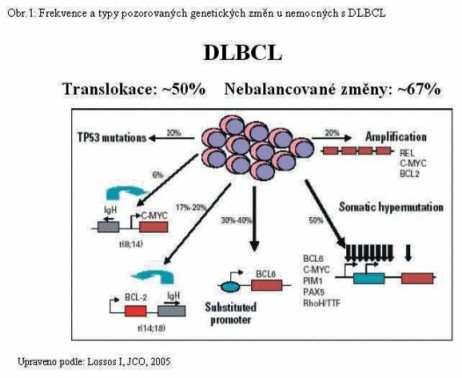
Molekulární patogeneze DLBCL zahrnuje různé chromosomové translokace, aberantní mechanismy somatické hypermutace, genové mutace, delece i amplifikace, které se na vzniku a vývoji DLBCL podílejí (Obr.1).
Cytogenetické studie odhalily vysoké procento výskytu chromosomových změn. Translokace se vyskytují až u 50% nemocných, nebalancované chromosomové změny u 67% nemocných (Obr 1). Snaha o vysvětlení obrovské genetické heterogenity vedla vědecké týmy k aplikaci nejmodernějším metod molekulární biologie.
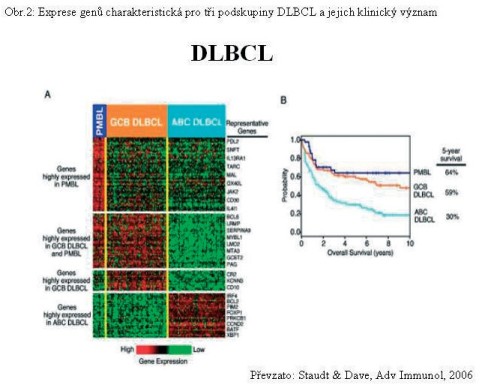
Expresní profilování (Alizadeh et al, 2000; Rosenwald et al, 2002) potvrdilo existenci dvou, později tři expresně rozdílných podskupin DLBCL (Staudt & Dave, 2005). Podskupina označená CGB - DLBCL se vyznačuje expresí genů charakteristických pro normální B buňky germinálních center (GC signature genes), zatím co podskupina ABC DLBCL exprimuje geny charakteristické pro in vitro aktivované periferní B lymfocyty. Třetí podskupinu (5% všech agresivních lymfomů) tvoří nemocní s primárním mediastinálním lymfomem (PMBL) s expresí genů odlišnou od obou podskupin (Obr. 2).
Odlišení těchto tří podskupin je velmi významné z hlediska prognózy nemocných. Zatím co 5leté přežití bylo určeno pro 64% nemocných s PMBL a 59% nemocných s GCB DLBCL, pro skupinu ABC DLBCL bylo pětileté přežití pozorováno pouze u 30% sledovaných nemocných. To znamená, že přesné určení prognózy a následná správná volba léčby je pro tyto nemocné významná.
Je otázkou, zda jsme schopni bez expresního profilování nemocné takto diferencovat. V roce 2005 se pokusil tým pracovníků vedený Silvií Bea (Bea et al, 2005) analyzovat 224 nemocných s DLBCL, kteří byli rozděleni do prognostických podskupin na základě expresních profilů. K analýze chromosomových nebalancovaných změn použili metodu komparativní genomové hybridizace (CGH). Tato molekulárně cytogenetická metoda dovoluje určit nebalancované změny, delece a amplifikace chromosomových oblastí s rozlišením 5-10 Mb (megabazí).
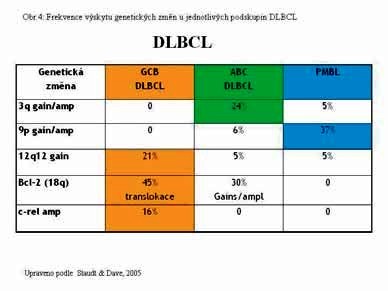
Zjistili, že expresním profilem určené
podskupiny se významně od sebe liší specifickými nebalancovanými
chromosomovými aberacemi (Obr.3). ABC podtyp je spojen s trisomií
chromosomu 3 nebo zmnožením 3q, chromosomu 18q a delecí na
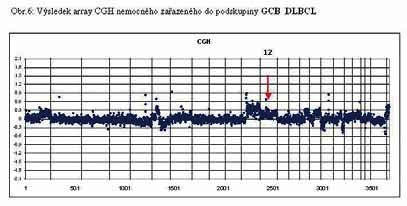
chromosomu 6q21-22. Podtyp CGB má nejčastěji zmnožení genetického
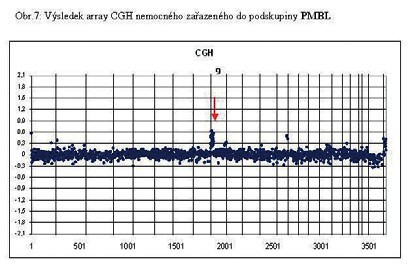
materiálu na dlouhých ramenech chromosomu 12q12 a PMBL má
nejčastěji zmnožení genetického materiálu krátkých ramen chromosomu
9 (9p). Potvrdili, že amplifikace a zmnožení (gains) má významný
vliv na expresi genů lokalizovaných v dané chromosomové oblasti.
Tyto časté nebalancované změny se mohou vyskytovat až u 40%
nemocných.

Na základě výsledků genetických analýz bylo
navrženo rozdělení podskupin DLBCL (Obr. 4). Sledovat časté
nebalancované změny prognostického významu je možné také moderní
čipovou technologii, která se nazývá array komparativní genomová
hybridizace (array CGH).
Array CGH je molekulárně cytogenetická metoda,
která dovoluje určit nebalancované změny (delece, monosomie,
duplikace, trisomie, amplifikace) analýzou celého genomu v jediném
vyšetření. Je založena na společné hybridizaci rozdílně značené
kontrolní a nádorové genomické DNA k hybridizačnímu sklu
(microarray), na kterém jsou umístěny jednořetězcové fragmenty DNA
genů, jejichž změny chceme sledovat.
Metodu array CGH s microarray K3 ( 3674 BAC
klonů pokrývající celý genom, rozlišení ~1Mb, Leiden University
Medical Center, Leiden, The Netherlands) jsme použili k analýze
souboru 25 nemocných s diagnózou DLBCL. Cílem studie bylo
společně s cytogenetikou a metodou FISH, určit navržené
prognostické podskupiny DLBCL, určit nejčastější chromosomové změny
a jejich frekvenci, analyzovat genetické změny u DLBCL vzniklých
transformací FL a pokusit se určit klinický význam cytogenetiky a
molekulární cytogenetiky u DLBCL.
Skupina 25 vyšetřených nemocných byla
histologicky diagnostikována jako DLBCL u 16 nemocných, 3 nemocní
jako PMBL, 3 nemocní jako transformace FL do DLBCL , u tří
nemocných nebyl typ NHL v prvním čtení přesně určen.
Celkem 13 nemocných bylo vyšetřeno z uzliny, 10
z buněk kostní dřeně, jeden nemocný z buněk získaných z výpotku a
jeden z buněk periferní krve.
Molekulárně genetiky byla vyšetřena klonalita a
mutační stav. Klonální populace byla nalezena u 11 nemocných, u
kterých byl vyšetřen mutační stav. Mutovaný stav IgVH byl nalezen u
8 z 11 nemocných, nemutovaný u 3 nemocných. U 14 nemocných byly
vyšetřeny pouze buňky kostní dřeň, ve které nebyla potvrzena
klonální infiltrace dřeně nádorovými buňkami.
Klasické cytogenetické vyšetření bylo provedeno
u 24 nemocných a klonální chromosomové změny byly nalezeny u 15
(62,5%) nemocných. Jednalo se jak o translokace, tak o
nebalancované změny zahrnuté do komplexních změn karyotypu.
Metodou array CGH bylo vyšetřeno všech 25
nemocných. DNA pro vyšetření array CGH byla izolována standardní
metodou z buněk kostní dřeně, uzliny nebo výpotku. Nebalancované
změny byly nalezeny u 19 nemocných. Detailní analýza ukázala
nejčastější delece na chromosomech 1p a 17p, nejčastější zmnožení
genetického materiálu postihovalo chromosomy 1q, 3, 7, 9p, 12 a
18.
Aplikace kritérií pro stratifikaci nemocných do
prognostických podskupin ukázala, že u našich nemocných bylo možné
prognostické podskupiny na základě výsledků metodou array CGH určit
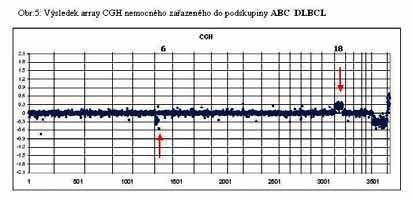
u 60% nemocných (Obr. 4, 5 a 6). Výsledky vyšetření metodu
fluorescenční in situ hybridizace (FISH) určily přestavbu BCL2 genu
u 7 nemocných a tato translokace je kriteriem pro zařazení
nemocných do prognostické podskupiny GCB. Metodou FISH byly dále
odhaleny dvě vzácně se vyskytují inserce, do kterých byl zapojen
onkogen CMYC. I tento nález potvrzuje velkou heterogenitu
genetických změn, které se u DLBCL vyskytují.
Rozdělení nemocných do dvou podskupin, na de
novo a transformované z FL neukázalo významný rozdíl ve frekvenci
přídatných změn. Přídatné změny metodou array CGH byly nalezeny u 5
z 8 transformovaných DLBCL. Vzhledem ke krátkému času sledování
souboru 25 nemocných s DLBCL, s mediánem sledování 48 měsíců, nelze
klinický význam určení prognostických podskupina a nalezených
chromosomových změn hodnotit. Z celkového počtu 25 sledovaných
nemocných zemřelo 7 nemocných, z nic 5 bylo zařazeno do ABC
podskupiny DLBCL, jeden nemocný byl z podskupiny GCB a jeden měl
PMBL.
Cytogenetika a molekulární cytogenetika je
významným nástrojem sledování genetických změn v nádorovém
genomu DLBCL. Řada studií potvrzuje klinický význam chromosomových
změn, avšak v naší studii jsme zatím klinický význam specifických
chromosomových změn pro krátkou dobu sledování souboru nehodnotili.
Získané výsledky jsou základem pro další sledování s cílem potvrdit
klinický význam chromosomových změn i na našem souboru nemocných
nebo odhalit nové, dosud neurčené změny.
Práce je podporována grantem MSM 6198959205 a grantem
Česko-vlámské spolupráce č.1-2006-29.
Literatura:
- Alizadeh AA, Eisen MB, Davis RE, et al.: Nature, 2000;
403,503-511.
- Rosenwald A, Wright G, Chan WC, et al: N Engl J Med, 2002; 346,
1937-1947.
- Staudt LM, Dave S: Adv. Immunol, 2005; 87:163-208.
- Bea S, Zettl A, Wright G, et al: Blood, 2005; 106:3183-3190.
Datum přednesení příspěvku: 12. 10. 2007





