Konference: 2015 XXII. Jihočeské onkologické dny
Kategorie: Maligní melanom a nádory kůže
Téma: Postery
Číslo abstraktu: 28
Autoři: MUDr. Hana Šiffnerová
Karcinom z Merkelových buněk (Merkel cell carcinoma – MCC) je vysoce agresivní neuroendokrinní kožní nádor, jeho incidence je 0,4 případů na 100 000 obyvatel, pětileté přežití pacientů nepřesahuje 65 %.
Nádor primárně vychází z Merkelových buněk lokalizovaných v bazální vrstvě epidermis. Tyto buňky se vyvíjejí z epidermálních kmenových buněk a mají svůj původ v embryonální pokožce. K tomu, aby se z kmenových buněk staly Merkelovy buňky, je nezbytný transkripční faktor atonal homolog 1 (Atoh1). Maligní zvrat Merkelových buněk je podle současných poznatků ve většině případů MCC předcházen integrací DNA sekvencí nedávno objeveného Merkel cell polyomaviru (MCPyV) do buněčného genomu.
Histologicky rozlišujeme trabekulární, intermediární a nejmalignější variantu z malých buněk. MCC má charakteristicky paranukleární bodovou pozitivitu na cytokeratin 20 a rovněž pozitivní barvení na CD56, neuron specifickou enolázu, chromogranin a synaptofyzin.
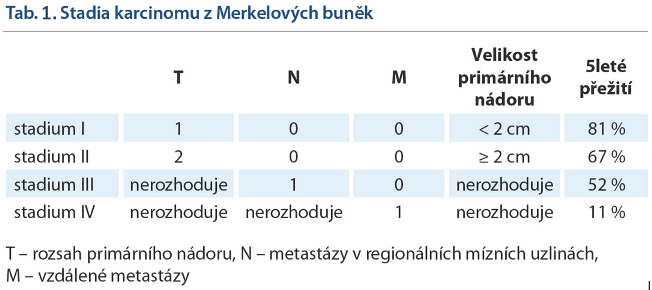
V určení stadia tumoru hraje významnou roli PET/CT vyšetření. S vysokou citlivostí umožňuje odhalit jak postižení regionálních lymfatických uzlin, tak případnou rekurenci či přítomnost vzdálených metastáz. Je rovněž vhodné k plánování a hodnocení účinnosti cílené radioterapie a efektu aplikované chemoterapie.
Klinicky se jeví zpravidla jako tuhý, solidní, polokulovitý, červený až lividně zabarvený, polokulovitě se vyklenující tuber velikosti 1–3 centimetry.
Základem terapie je radikální excize s bezpečnostním lemem 2 až 3 centimetry do zdravé tkáně nebo v případě pozitivních resekčních hranic reexcize tumoru, vždy doplněná o biopsii sentinelové uzliny. V případě její pozitivity je indikována kompletní disekce regionálních lymfatických uzlin.
Následuje adjuvantní radioterapie cílená na místo primárního výskytu a na oblast regionálních drenážních uzlin, a to v případě, byl li primární tumor větší než 2cm, při pozitivních resekčních hranicích nebo blízkosti tumoru k těmto hranicím a při angiolymfatické invazi. Radioterapie je rovněž jednoznačně doporučena při pozitivní biopsii sentinelové uzliny, nebo pokud nebyly uzliny histologicky vyšetřeny a u imunokompromitovaných pacientů.
Adjuvantní chemoterapie je indikována u rozsáhlého uzlinového postižení, při extranodální expanzi a při rekurenci po předchozí terapii. Užívají se protokoly obsahující etoposid a karboplatinu. Efekt této léčby je popisován v 60–75 %, nicméně medián přežití je až na výjimky obvykle jen v řádu měsíců. Zejména u starších pacientů je možné podávání nízkodávkovaného etoposidu. Někteří autoři doporučují i léčbu octreotidem, analogem somatostatinu. Důležitá je léčba symptomatická a suportivní. Pro MCC je typická tendence k časté lokální rekurenci a časnému rozvoji metastáz do regionálních uzlin s následnou generalizací onemocnění v průběhu několika týdnů až měsíců.
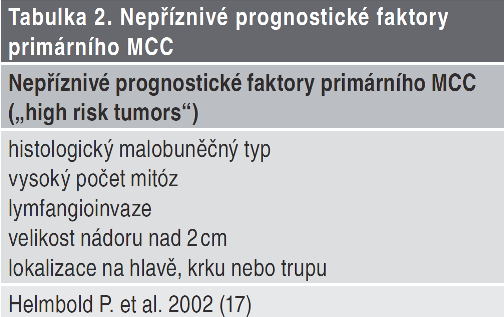
Prognóza záleží na stagingu onemocnění a lokalizaci. Lokalizovaný tumor < 2cm bez uzlinových metastáz má dobrou prognózu. Nádory velikosti > 2cm jsou spojeny s vysokým rizikem generalizace. Léze lokalizované na hýždi a trupu jsou spojovány s vyšším výskytem nodálních metastáz oproti lézím lokalizovaným na hlavě a krku.
V porovnání s melanomem je MCC charakterizován dvojnásobnou letalitou a strměji narůstající incidencí. Po chirurgickém odstranění má nádor tendenci k lokální rekurenci (27– 60 %), k časnému postižení regionálních uzlin (45–91 %) a vzdáleným metastázám (18–52 %). Nádor se nejčastěji vyskytuje na hlavě a krku (40–75 %), naopak na trupu a v gluteální oblasti se vyvíjí jen 10–27 %nádorů.
Je třeba pamatovat i na možnost sdruženého výskytu s jinými nádory, jako například karcinomem prsu nebo ovaria, leukémií, maligním lymfomem, anaplastickým meningeomem.
Závěrem je třeba zdůraznit nutnost pravidelné preventivní inspekce kůže u imunosuprinovaných nemocných a u suspektních lézí indikovat adekvátní chirurgický přístup. V případě potvrzení MCC by návazná terapeutická opatření měla být komplexní a dostatečně intenzivní.
Příloha č. 1:
Kazuistika pacientky
žena 71 let, hypertense, diabetes mellitus
Duplicitní tumor:
1.Stromální sarkom corporis uteri pT1b N 0 M0 low grade,I stadium
* 29.6.2012: Hysterectomie a adnexetomii bilat
Nadále pouze sledování
2. Ca vulvae z Merkelových buněk v oblasti clitoris pT1 pNO (SU 1 negat.) M0, G3 R0
*10. 12. 2012: excize tumoru v oblasti clitoris
Histologicky: karcinom z Merkelových buněk. Nádorová infitlrace zasahuje těsně k okrajům i spodině excize, je přítomna výrazná angio- a lymfangioinvaze.(M-8247/33).
14. 12. 2012: UZ inquin: V obou tříslech neprokazuji zvětšené uzliny splňující kritéria malignity.
*18. 12. 2012: hemivulvectomia anterior + odstranění sentinelové uzliny vlevo.
Histologicky: Maligní nádorové struktury jsme neprokázali ani přímo ani v podobě lymfangioinvaze. Tumor byl pravděpodobně odstraněn při předchozí excizi. Lem zdravé tkáně ve shodě s operatérem cca 8-9 mm.
Uzlina v levém třísle histologicky negativní.
9. 1. 2013: RTG S+P bez meta změn
* 23. 1. 2013: biopsie z pruhovitého infiltrátu v pochvě pod uretrou a více vlevo cca 1 cm za introitem
Histologie: Subepiteliálně jsou ve tkáni čepy malobuněčného nádorového infiltrátu odpovídající již diagnostikovanému karcinomu z Merkelových buněk ( M-8247/33 ).
Přítomná je angio i lymfangioinvaze. Nádorové struktury zasahují k okrajům i spodinám excizí.
29. 1. 2013: UZ břicha: mnohočetný meta proces jaterní, expanze v oblasti hlavy pankreatu 25mm.
31. 1. 2013: ERCP: Stenóza nerovných okrajů, maligního vzhledu, na přechodu hlavy a těla pankreatu. Stenóza distálního choledochu, která byla v průběhu výkonu přemostěna pomocí stentu zavedeného do oblasti distálního ductus hepaticus communis. Biopsie nešla odebrat
21. 2. 2013: CT břicha a pánve: játra s difuzním ložiskovým postižením charakteru metastáz. V hlavě pankreatu TU expanze velikosti 30 x 30 x 23 mm, dilatace pankreatického vývodu v těle a kaudě. Nadledviny, ledviny, moč. měchýř bez patologie. V retroperitoneu četné zvětšené uzliny oboustranně podél břišní aorty, zmnožené uzliny i v oblasti radixu mezenteria a v obou tříslech, více vlevo, kde dosahují velikosti do 10 mm. V oblasti poševního pahýlu expanze velikosti 24 x 16 x 26 mm. V dutině břišní není volná tekutina. V parenchymu zachycených bazí plic vícečetná ložiska velikosti do 6 mm charakteru metastáz.
Vzhledem ke zjištěné generalisaci malignity není indikace k radioterapii na oblast vulvy a inguinálních uzlin.
Vzhledem k nízkým hodnotám markerů CA 19-9 a CEA nehodnotíme nález na hlavě pankreatu jako triplicitní tumor, ale jako generalizaci histologicky ověřeného karcinomu z Merkelových buněk.
Plán: 4 série chemoterapie + restaging
*28. 2. 2013: 1. série chemoterapie Carboplatina + Vepesid s následnou elevací bilirubinu, jaterních testů, anemií, leukopenií a trombopenií Gr 4 .
12. 3. 2013 ERCP: výměna stentu
2.4.2013 Chemoterapie pro excesivní toxicitu ukončena, t. č. dominují bolesti tumoru v pochvě.
*3. 4.-17. 4. 2013 paliativní ozáření na oblast vulvy a tříselných uzlin do celkové dávky 33Gy 17. 6. 2013 nemocná umírá za 6 měsíců po zjištění diagnózy.
Literatura:
- Shaw JH, Rumball E. Merkel cell tumour: clinical behaviour and treatment. Br J Surg 1991; 78(2): 138–142.
- Yiengpruksawan A, Coit DG, Thaler HT et al. Merkel cell carcinoma. Prognosis and management. Arch Surg 1991; 126(12): 1514–1519.
- Krejčí K., Zadražil J., Tichý T., Horák P., Ciferská H., Hodulová M., Zezulová M., Zlevorová M. Kožní Karcinom z Merkelových Buněk, Klin Onkol 2010; 23(4): 210-217
- Vantuchová Y. Karcinom z Merkelových Buněk, Dermatologie pro praxi 2008. 2(1): 23-25
- Fields R.C., Busam, K.J., Chou J.F., Panageas K.S., Pulitzer M.P., Allen P.J., Kraus, D.H.,
- Brady, M. S. Coit D.G. Five hundred patiens with Merkel cell carcinoma evaluated at a Single institution. Lippincott Williams &Wilkins 2011. Annals of Surgery, Vol. 254, No. 3, 465-475
- Becker J.C., Kauczok C.S., Ugurel S., Eib S., Bröcker EB, Houben R Merkel cell carcinoma: molecular pathogenesis, clinical features and therapy. JDDG 9.2008 (Band6), 709-719.
Datum přednesení příspěvku: 16. 10. 2015