Konference: 2007 XIV. Jihočeské onkologické dny
Kategorie: Maligní lymfomy a leukémie
Téma: Diagnostika a léčba maligních lymfomů
Číslo abstraktu: 016
Autoři: doc. MUDr. Tomáš Papajík, CSc.; MUDr. Vít Procházka, Ph.D.; MUDr. Ingrid Vášová; MUDr. David Belada, Ph.D.; doc. MUDr. Tomáš Kozák, Ph.D., MBA; MUDr. Hana Šiffnerová; Mgr. Lenka Kučerová; prof. MUDr. Roman Kodet, CSc.; Prof. MUDr. Marek Trněný, CSc.
V polovině 60. let Lennert popsal ve spektru lymfoidních nádorů germinocytom, který posléze v roce 1974 se svými spolupracovníky přejmenoval na centrocytární lymfom a zařadil do skupiny jednotek s nízkým stupněm malignity Kielské klasifikace ne-hodgkinových lymfomů (NHL). V téže době Berard a Dorfman sjednotili diagnostická kritéria relativně heterogenní skupiny lymfomů z malých naštípených i nenaštípenných lymfocytů pod jednu chorobnou jednotku, nazvanou středně diferencovaný lymfocytární lymfom (lymphocytic lymphoma of intermediate differentiation). Folikulárnímu subtypu tohoto lymfomu věnovali pozornost počátkem 80.let Weisenburger a Palutke, první ze jmenovaných pak užil termín lymfom plášťové zóny (mantle zone lymphoma). V roce 1991 Raffeld a Jaffe shrnuli současné poznatky o molekulární podstatě uvedeného lymfomu a dokumentovali, že centrocytární lymfom a středně diferencovaný lymfocytární lymfom jsou jen dvě pojmenování pro totéž onemocnění. Na základě původu lymfomu z buněk pláště lymfatických folikulů pro něj navrhli pojmenování lymfom z plášťových buněk (mantle cell lymphoma, MCL). O rok později se Banks s kolegy pokusili přehledně utřídit morfologická, imunologická a molekulárně-genetická data charakterizující MCL. Uvedené práce se posléze staly podkladem pro konsensuální diagnostická kritéria MCL, jež byla přijata na pracovní konferenci European Lymphoma Task Force (ELTF) konané v roce 1994. V tomtéž roce publikovaná Revidovaná evropskoamerická klasifikace lymfoidních neoplázií (REAL) pak MCL definovala jako samostatnou jednotku ve spektru NHL.
Epidemiologie
Toto onemocnění reprezentuje v průměru asi 4-6%
ze všech NHL na západní polokouli s incidencí 1-2 nemocných na
100.000 obyvatel a rok. Medián věku při diagnóze choroby bývá
obvykle mezi 60-65 lety, postiženi tímto typem lymfomu jsou
převážně muži (M:Ž = 2-4:1).
Morfologické charakteristiky choroby
Cytologie
Nádorová populace je tvořena většinou malými až
středně velkými lymfoidními buňkami s nepravidelným a
naštípeným jádrem, středně hrubým chromatinem, nenápadnými jadérky
a úzkou cytoplasmou (tzv. klasický subtyp MCL). Asi ve 20% případů
vidíme v mikroskopickém obraze větší buňky se světle modrou
cytoplasmou, jemnějším chromatinem jádra a malými jadérky, četné
jsou mitotické figury. Tyto případy nesou označení blastická, méně
často anaplastická nebo pleomorfní varianta. Celkově je nutno říci,
že nádorová populace vyniká velkou interindividuální variabilitou,
rozmanitost lymfoidních buněk sahá od malých lymfocytů
připomínajících elementy chronické lymfatické leukémie až po obraz,
který při prvním pohledu můžeme zaměnit za diagnózu akutní
leukémie.
Obr.1: Morfologické varianty lymfomu z plášťových
buněk
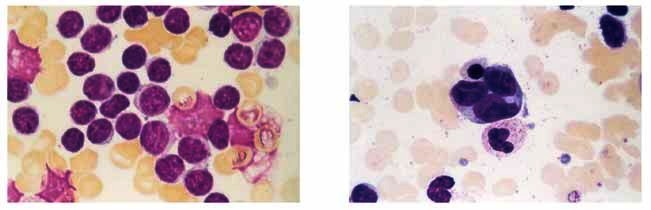
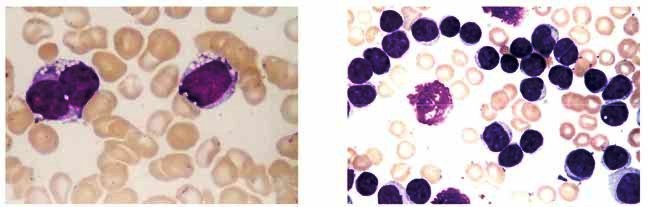
Histologie uzliny
Typ infiltrace uzliny je většinou difúzní, jen
ve 30% je diagnostikován obraz nodulárního postižení, vzácněji
mohou být tyto obrazy kombinovány. Místy mohou infiltráty vytvářet
obraz reaktivních zárodečných center s lemem neoplastických buněk,
tedy jakýmsi pláštěm (mantle zone obraz). Mitotické figury jsou
řídké u malobuněčných „lymfocytárních“ forem, časté jsou naopak u
blastické varianty choroby. V tomto případě bývají nádorové buňky
často doprovázeny benigními histiocyty. Histologická progrese z
nodulárního obrazu do difúzního typu a z dobře diferencovaného
subtypu do formy blastické či anaplastické je poměrně častá a jde
ruku v ruce s klinickou progresí nemoci.
Obr. 2: Histologický obraz postižení uzliny lymfomem z
plášťových buněk
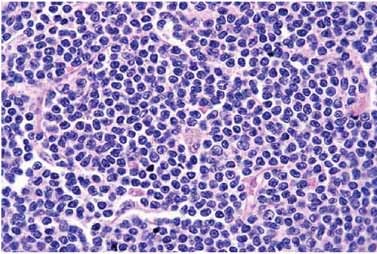
Imunofenotyp
Neoplastický klon charakterizují následující
povrchové znaky: sIgM+, sIgD+, delta > kappa, CD19+, CD20+,
CD79a+, CD5+, CD23-, CD43+,CD10-/+, CD 11c-. Právě pozitivita CD5
antigenu spolu s negativitou CD23 markeru je typická a specifická
pro tento typ lymfomu. Nicméně byly popsány i aberantní fenotypy,
některé s chyběním antigenu CD5, jiné se slabou koexpresí CD23
antigenu.
Cytogenetika a molekulární genetika
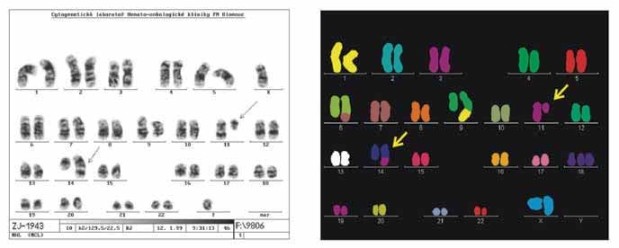
Charakteristickou cytogenetickou změnou je
interchromosomální translokace - t(11;14) (q13;q32). Molekulárně
biologickým ekvivalentem této změny je chyba ve spojení V-D-J genu
pro těžké řetězce imunoglobulinů, která vyúsťuje v přesun
genetického materiálu bcl-1 (11q13) do sousedství „enhancer“
oblasti genu pro těžké řetězce imunoglobulinů (14 q32). Touto
změnou se dereguluje protoonkogen PRAD1 (CCND1) umístěný také v
oblasti 11q13, který kóduje syntézu cyklinu D1. Tento protein hraje
klíčovou roli v regulaci buněčného cyklu a přechodu buněk z G1 do S
fáze. Při jeho nadměrné expresi pak může dojít ke zkrácení G1-fáze
a pak za sebou rychle následují 2 S-fáze bez mitotické dysjunkce
sesterských chromatid. Tato typická translokace je zjistitelná na
úrovni cytogenetické, molekulárně-genetické (FISH) a
molekulárně-biologické (PCR) a slouží jako jedna z cenných
diagnostických charakteristik MCL. Imunohistochemicky pak můžeme
detekovat nadměrnou expresi cyklinu D1 v lymfomových buňkách
postižené tkáně. Ve většině studií je kombinací těchto moderních
metod prokazována výsledná přestavba bcl-1/IgH v 70-100% případů. U
agresivních variant MCL bývají pravidelně detekovány genetické
aberace, které postihují dvě základní regulační dráhy buněčného
cyklu - ARF/MDM2/p53 a p16INK4A/CDK4. Detailní cytogenetické studie
navíc prokázaly, že MCL je lymfom s nejvyšším počtem přídatných
chromosomálních abnormit, které postihují regulaci buněčného cyklu
a iniciují další progresi nádoru. Novější práce ale také
dokumentovaly, že existuje malý počet cyklin D1 negativních MCL,
které nenesou t(11;14)(q13;q32), ale mají nadměrně exprimované
cykliny D2 a D3, které stejně jako hyperexprese cyklinu D1
deregulují G1 fázi buněčného cyklu a ve svém důsledku mají
prakticky stejný obraz genové exprese jako cyklin D1 pozitivní
MCL.
Obr. 3: Genetické charakteristiky lymfomu z plášťových buněk
- obraz klasické cytogentiky a mnohobarevné in situ hynridizace
(M-FISH)
Obr. 4: Molekulárně-biologická charakteristika lymfomu z
plášťových buněk - přestavba bcl-1 (cyklin D1)/IgH
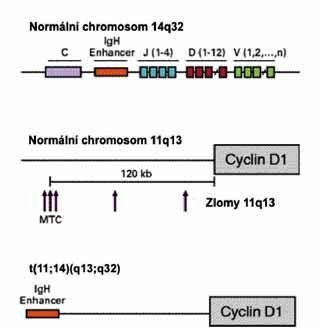
Obr. 5: Imunohistochemická detekce nadměrné exprese cyklinu
D1 buňkami lymfomu z plášťových buněk
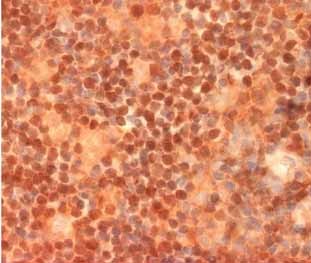
Obr. 6: Obraz genová exprese u lymfomu z plášťových
buněk (Martinez N. et al., Cancer Research 2003).
Klinický obraz
Jedinci s tímto lymfomem přicházejí většinou již
v pokročilém stádiu choroby s velkou nádorovou masou (výrazná
lymfadenomegalie, splenomegalie, hepatomegalie a infiltrace kostní
dřeně - ta je nacházena v 75-85% případů). B symptomatologie,
vysoká hladina LDH, (-2-mikroglobulinu a sérové tymidinkinázy jsou
při diagnóze přítomny u více než poloviny nemocných. Nepříznivou
prognózu choroby podtrhuje vysoká hodnota mezinárodního
prognostického indexu (IPI) a vzhledem k ostatním typům lymfomů i
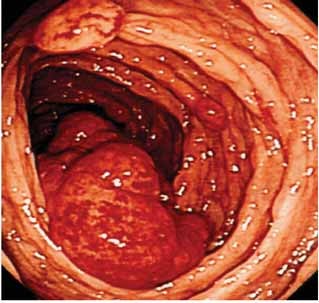
relativně častá anémie. Gastrointestinální trakt a Waldayerův okruh
jsou postiženy až u 1/3 pacientů. Typickou extranodální lokalitou
postiženou infiltrací MCL je střevo. Zde choroba vytváří tzv.
mnohotnou lymfomatózní polypózou, ta se však většinou projevuje jen
nespecifickými příznaky a proto nebývá často diagnostikována.
Hyperleukocytóza a přítomnost monoklonálního paraproteinu jsou méně
časté.
Obr.7: Endoskopický obraz mnohotné lymfomatozní polypózy u
nemocného s infiltrace střeva lymfomem z plášťových
buněk.
Léčba a prognóza
MCL je velmi problematické a léčebně nejméně
vděčné onemocnění z celé kapitoly NHL. Choroba s sebou nese ty
nejhorší vlastnosti lymfomů jak s nízkým, tak s vysokým stupněm
malignity. Průběh nemoci je agresivní a přitom, stejně jako všechny
indolentní lymfomy, není standardní terapií vyléčitelná.
Retrospektivní analýzy nemocných léčených samostatným konvenčním
antracyklinovým režimem ukazují, že počet léčebných odpovědí bývá
kolem 70%, počet kompletních remisí (CR) se pohybuje většinou mezi
20-30%. Medián doby, za kterou dojde k progresi choroby, leží mezi
18-24 měsíci. Pacienti s nodulární infiltrací uzlin mají delší
medián přežití než nemocní s difuzním postižením, celkový medián
přežití však nepřesahuje 3-4 roky.
Graf 1: Celkové přežití nemocných s lymfomem z plášťových
buněk (MC) ve srovnání s nemocnými s periferním T-lymfomem
(PTCL) a T-lymfoblastickým lymfomem (T-LB) (The Non-Hodgkin’s
Lymphoma Classification Project, Blood 1997)
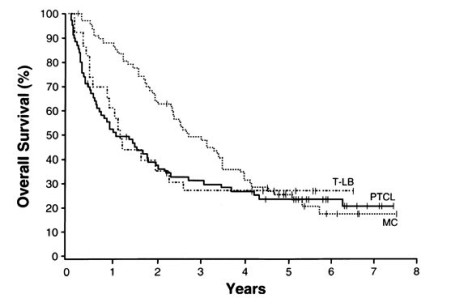
Vzhledem k těmto neuspokojivým léčebným
výsledkům testovala řada světových pracovišť u mladších nemocných
intenzivnější léčebné režimy s cílem dosáhnout větší počet CR a
prodloužit přežití pacientů. Režimy CHOP-DHAP a Hyper-CVAD
alterující s vysoce dávkovaným metotrexátem (MTX) a
cytosin-arabinosidem (AraC) dosahovali v publikovaných studiích
počet CR více jak 80%, resp. 90%, nicméně u většiny nemocných bylo
dále pokračováno v postremisní léčbě vysoce dávkovanou terapií s
autologní transplantací kmenových buněk.
Naděje na zlepšení výsledků standardně dávkované
chemoterapie přinesla její kombinace s rituximabem
(chimerickou anti-CD20 monoklonální protilátkou). Randomizovaný
protokol Německé studijní skupiny pro nízce maligní lymfomy
prokázal, že u nemocných léčených pouze režimem CHOP bylo dosaženo
léčebné odpovědi u 75% pacientů (CR 7%), zatímco u režimu s
přidaným rituximabem (R-CHOP) dosáhl počet odpovědí 94% a počet CR
se zvýšil na 34%. Povzbudivé výsledky byly stejnou skupinou
publikovány u režimu R-FCM, když se počet CR po přidání rituximabu
zvýšil z 0% na 33% a z dlouhodobého hlediska došlo k statisticky
významnému zlepšení celkového přežití (p=0.004).
Graf 2: Srovnání celkového přežití nemocných s lymfomem z
plášťových buněk léčených kombinací FCM a R-FCM (Forstpointner R.
et al., Blood 2004)
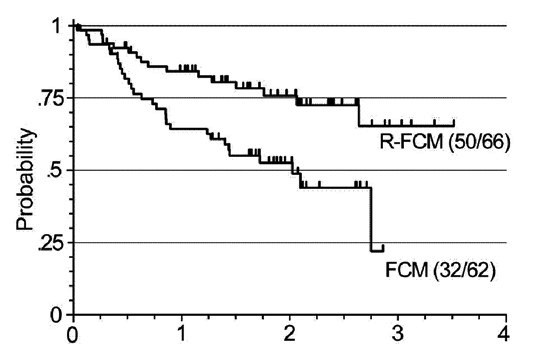
Skupina vědců z texaského Houstonu (M. D.
Anderson Cancer Center) zveřejnila své výsledky kombinace
rituximabu s režimem hyper-CVAD alterujícím s MTX a AraC. Počet
léčebných odpovědí dosáhl 97% (87% CR) a 3leté přežití bez známek
selhání léčby 64% a celkové přežití pak 82%.
Graf 3: Přežití bez známek selhání léčby (failure free) a
celkové přežití (overall) u nemocným s lymfomem z plášťových
buněk léčeným režimem R-hyper-CVAD v kombinaci s metotrexatem a
cytosin-arabinosidem (Romaguera J. E. et al., J. Clin. Oncol.
2005)
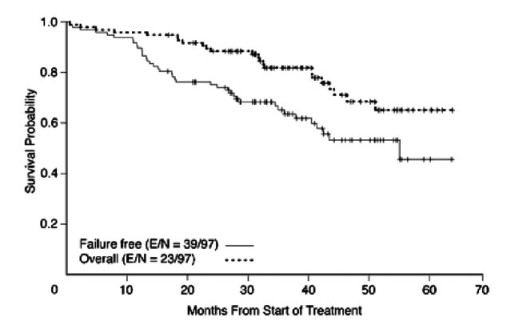
Vysoce dávkovaná terapie následovaná autologní
transplantací (AT) krvetvorných buněk byla u nemocných s MCL
testována v řadě klinických studií. Chemoterapie
hyper-CVAD/MTX-Ara-C s následnou AT zlepšila výrazným způsobem
výsledky přežití pacientů ve srovnání s historickými daty nemocných
léčených režimem CHOP (EFS ve 3 letech 72% vs 28%, p=0,0001; OS ve
3 letech 92% vs 56%, p=0,05). Stejně povzbudivá data byla
publikována ve studiích s režimem CHOP-DHAP a AT nebo při
intenzivní sekvenční terapii zakončené AT. Evropská skupina MCL
Network publikovala data z randomizované studie srovnávající
konsolidaci AT versus udržovací terapii interferonem po indukční
terapii režimem CHOP. V rameni s AT došlo k významnému prodloužení
přežití bez známek progrese onemocnění (p=0,01).
Novější terapeutická schémata využívají indukční
terapii obsahující kombinaci cytostatik a rituximabu ve snaze
zvýšit počet léčebných odpovědí a minimalizovat nádorovou masu před
sběrem kmenových buněk a vlastní AT. Kanadská skupina použila
historického srovnání konvenční léčby a vysoce dávkované terapie v
kombinaci s rituximabem a zjistila významné rozdíly v přežití obou
skupin nemocných (PFS ve 3 letech 89% vs 29%, p=0,00001; OS 88% vs
65%, p=0,05). Režim rituximab-hyper-CVAD/MTX-Ara-C s následnou AT
dosáhl ve 3leté přežití bez známek události a celkové přežití
shodně ve výši 92%!
I přes řadu optimistických údajů o zlepšení
přežití nemocných s MCL při použití moderní imunochemoterapie a
vysoce dávkované terapie s AT kmenových buněk je dnes zřejmé, že
tato terapie nevede k vyléčení nemocných v pokročilém stádiu
choroby. Jedinou potenciálně kurativní terapií se dnes jeví
alogenní transplantace krvetvorných buněk od HLA-identického dárce.
Řada menších prací předložila optimistická data o úspěchu této
léčebné modality u relabovaných nemocných s MCL. Jelikož bylo
prokázáno, že hlavním protinádorovým působením této léčby je reakce
dárcovského štěpu proti lymfomu, novější přípravné režimy akcentují
toto imunologické působení dárcovských buněk a jsou podávány v
redukované intenzitě jako tzv. nemyeloablativní či imunoablativní
režimy s redukovanou intenzitou. Díky tomu se podařilo snížit
časnou úmrtnost nemocných a zlepšit výsledky alogenních
transplantací nejen u MCL. Skupina z M.D.Anderson Cancer Center
referovala o 3letém přežití u 82% alogenně transplantovaných
pacientů s MCL, kteří v minulosti absolvovali řadu
chemoterapeutických režimů (opakovaně relabující pacienti). Podobné
výsledky dosáhli autoři z centra v Seattlu, kdy 2leté přežití
jejich skupiny relabovaných a refrakterních pacientů s MCL alogenně
transplantovaných po nemyeloablativním přípravném režimu činilo
60%.
Graf 4: Přežití bez návratu choroby u relabovaných a
refrakterních nemocných s lymfomem z plášťových buněk léčených
alogenní transplantací po neymeloablativním přípravném režimu
(Maris M. B. et al., Blood 2004)
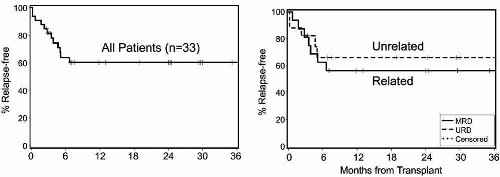
Limitujícím faktorem snižující úspěšnost
alogenních transplantací je stále vysoké riziko potransplantačních
komplikací. I přes nemyeloablativní přípravu řada pacientů trpí
extenzivní chronickou formou reakce štěpu proti hostiteli a
významná část nemocných má opakované zavážné infekty (virové,
bakteriální, mykotické). Tyto komplikace pak znamenají značné
snížení kvality života a zkrácení přežití u alogenně
transplantovaných pro MCL.
Graf 5: Srovnání frekvence relapsů u nemocných po autologní
a po alogenní transplantaci krvetvorných buněk (Ganti A. K. et al.,
Ann. Oncol. 2005)
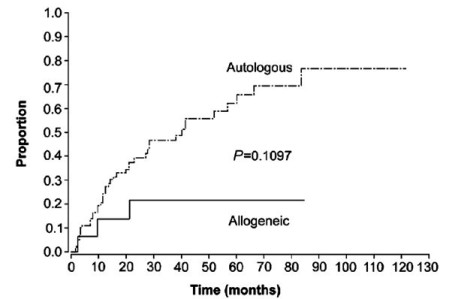
V posledních letech se u nemocných s MCL testuje
řada nových léků a léčebných možností, jež by měli pomoci zlepšit
jejich prognózu. Jde zejména o bortezomib, který je specifickým
inhibitorem buněčného proteasomu a jehož účinnost byla prokázána u
nemocných s mnohotným myelomem. Studie PINNACLE zhodnotila data u
prvních 48 ze 102 zařazených pacientů s relabovaným MCL léčeným
bortezomibem a konstatovala, že 40% z nich dosáhlo léčebnou
odpověď. Fáze II studie kanadského NCI prokázala počet léčebných
odpovědí po monoterapii bortezomibem u nepředléčených i
relabovaných nemocných shodně ve výši 46%. Zdá se, že by bortezomib
ve vhodné kombinaci s ostatními léky (monoklonální protilátky,
proapoptotická a anti-angiogenní farmaka) mohl v budoucnu zlepšit
výsledky léčby MCL. Zajímavé studie probíhají s temsirolimem a
flavopiridolem (blokátorem cyklinu D1). Také protilátky konjugované
s radioizotopem prokázaly svou nadějnou účinnost u nemocných s MCL.
131I tosituomomab (Bexxar(r)) byl aplikován u MCL s úspěchem v
rámci přípravných režimů před AT (3leté celkové přežití 91%),
90Y-ibritumomab tiuxetan (Zevalin(r)) byl testován u relabovaných
nemocných a nověji bývá také zařazován do přípravných režimů před
AT (Z-BEAM).
Závěr
Přesná diagnostika MCL vyžaduje kombinaci řady
dat získaných metodami imunocytologie, imunohistochemie, nádorové
genetiky a molekulární biologie. Jejich současným použití se
snižuje pravděpodobnost chybného zařazení MCL mezi jiné typy
lymfoidních neoplázií (lymfom z malých lymfocytů, folikulární nebo
difúzní velkobuněčný/anaplastický lymfom). Použití rituximabu v
iniciální terapii a vysoce dávkovaná chemoterapie s autologní
transplantací přinášejí prodloužení přežití bez známek relapsu
onemocnění. U relabovaných a refrakterních nemocných je nadějí na
zlepšení jejich prognózy alogenní transplantace nebo experimentální
léčba novými molekulami v právě pobíhajících klinických studiích.
Algoritmus diagnostiky a léčby MCL shrnuje přiložená tabulka.
Tabulka 1: Algoritmus diagnostiky a léčby lymfomu z
plášťových buněk

Doporučená literatura
- Ganti AK, Bierman PJ, Lynch JC, et al.: Hematopoietic stem cell
transplantation in mantle cell lymphoma. Ann. Oncol. 2005; 16:
618-624.
- Hagemeister FB: Mantle cell lymphoma: non-myeloablative versus
dose-intensive therapy. Leuk. Lymphoma 2003; 44 (Suppl 3):
69-75.
- Raffeld M, Jaffe ES: bcl-1, t(11;14), and mantle cell
lymphomas. Blood 1991; 78: 259-263.
- Salaveria I, Perez-Galan P, Colomer D, Campo E: Mantle cell
lymphoma: from pathology and molecular pathogenesis to new
therapeutic perspectives. Hematologica 2005; 90: 11-16.
- Swerdlow SH, Williams ME: From centrocytic to mantle cell
lymphoma: a clinicopathologic and molecular review of 3 decades.
Human Pathol. 2002; 33: 7-20.
- Witzig TE: Current treatment approaches for mantle-cell
lymphoma. J. Clin. Oncol. 2005; 23: 6409-6414.
- Zelenetz AD: Mantle cell lymphoma: an update on management. Ann. Oncol. 2006; 17 (Suppl. 4): 12-14.
Práce je podpořena grantem IGA NR/9453 – 3
Datum přednesení příspěvku: 12. 10. 2007





