Konference: 2007 XIV. Jihočeské onkologické dny
Kategorie: Maligní lymfomy a leukémie
Téma: Diagnostika a léčba maligních lymfomů
Číslo abstraktu: 001
Autoři: prof. MUDr. Pavel Klener, DrSc.
Zájem o lymfadenopatii jako samostatné onemocnění se datuje až do první poloviny 19.století, kdy v r.1832 Thomas Hodgkin (OBR.1) popsal 7 případů v historické práci: „On some morbid appearances of the absorbent glands and spleen“ (8). Později však bylo zjištěno, že jen 3 z popsaných případů by z dnešního hlediska splňovala kriteria Hodgkinova lymfomu.

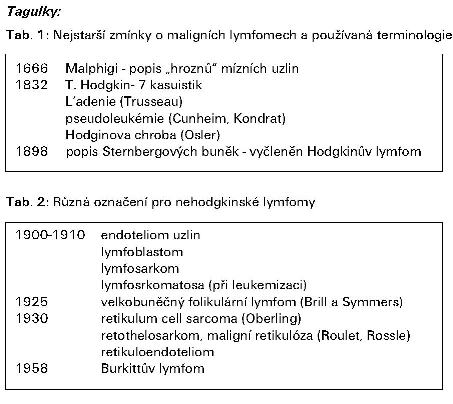
V následujících letech zprávy o uzlinovém onemocnění přibývaly a různí autoři je různě nazývali. (Tab.1) Trousseau používal termínu l’adenie (20), Wunderlich označil své nálezy jako „progresívní hypertrofie mízních uzlin“ (21). Někteří používali termín pseudoleukémie, neboť buňky z punktátu uzlin připomínaly leukémii, bez nálezu leukemických buněk v obvodové krvi. (Termín leukémie zaveden Wirchovem 1845.) Je evidentní, že se jednalo o uzlinová postižení, různého původu, ale Osler ještě v r.1896 používal pro všechny podobné nálezy termín Hodgkinova choroba. Je pozoruhodné, že v domácí lékařské literatuře takové zmínky chybí, ačkoliv byly vydány obsáhlé několikasvazkové monografie vnitřního lékařství (Eiselt, Maixner 1898), kde nebyla o lymfomech ani zmínka Dokonce ani v Pelnářově Patologii a terapii nemocí vnitřních ze 40.let minulého století taková zmínka není. O lymfomech se nezmiňují ve svých publikacích ani další čeští internisté (Syllaba, Hynek). Samostatná kapitola o lymfomech je teprve v Netouškově monografii (13). Systematicky se pak věnoval studii lymfomů Heřmanský a Bednář (6, 7).
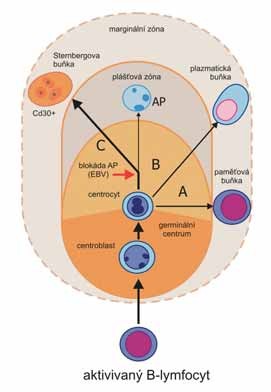
Na přelomu století popsali Sternberg a Reedová v uzlinách zvláštní mnohojaderné buňky, (nazývané po svých objevitelích), které pomohly vyčlenit z heterogenní skupiny uzlinového postižení Hodgkinův lymfom (17). Etiologie i patogeneze onemocnění však zůstávala nejasná, o původu Sternbergových buněk byla vyslovena řada teorií, teprve na počátku 21. století byl prokázán jejich centrofolikulární původ (Obr. 2)
Ostatní, klinicky podobná zhoubná onemocnění lymfatických uzlin, (dnešní nehodgkinské lymfomy) byla označována velmi nejednotnou terminologií, jak ukazuje tab. 2. Rozlišení jednotek bylo možné jen na základě fyzikálního nálezu a jednoduchého histologického vyšetření v panoptickém barvení po fixaci formolem v parafinových řezech.
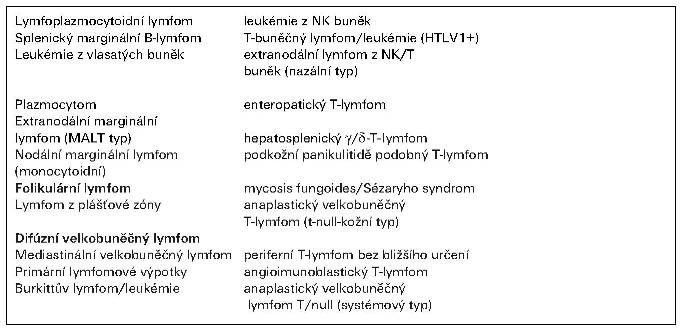
Přesto již ve třicátých letech vznikají první pokusy o klasifikaci lymfomů. (Tab. 3). Čistě morfologické aspekty byly uplatněny i v dalších návrzích klasifikací (Tab. 4). Teprve pokroky imunologie s rozlišením T a B lymfocytů spolu s pokroky molekulární biologie a genetiky přispěly k objasnění patogeneze NHL umožnily i nové pohledy na klasifikaci, což bylo poprvé zohledněno v klasifikaci Lukese a Collinse (11, 16).
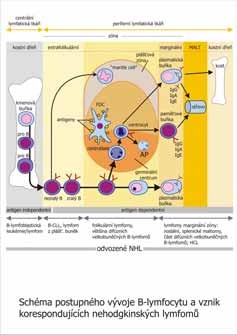
Dnes se považuje za prokázané, že NHL vznikají neoplastickou transformací imunokompetentních buněk resp. lymfocytů na různých etážích jejich postupného vyzrávání a diferenciace (Obr. 3). Nádorově transformovaná buňka jeví klonální expanzi, přičemž si zachovává funkční migrační charakteristiky svých normálních protějšků (12). Není proto překvapením, že NHL se mohou vyskytnout i mimo lymfatické uzliny, neboť lymfocyty jsou přítomny v nejrůznějších extralymfatických orgánech. Příčina maligní transformace není zcela jasná, soudí se, že v patogenezi NHL mají významnou úlohu molekulárně genetické změny. Bylo zjištěno, že téměř u 90% NHL s nízkou malignitou a 30% vysocemaligních NHL se nacházejí charakteristické chromosomální aberace. Nejčastější změnou je translokace t(14:18) u folikulárních lymfomů, při které jen gen bcl-2 přesunut z 18. na 14.chromosom do blízkosti genu pro těžké řetězce. Dostává se tak pod vliv transkripčních enhancerů - urychlovačů sdružených s lokusem IGH. Jejich účinkem dochází k dysregulaci exprese proteinu bcl-2 kódovaného genem bcl-2. Tento protein inhibuje apoptózu patologického klonu lymfocytů, působí jejich akumulaci a snižuje citlivost k nejrůznějším podnětům indukujícím buněčnou smrt, včetně cytostatik. To vysvětluje proč při nízké proliferační aktivitě narůstá pool lymfomových buněk a proč je u NHL omezená citlivost k chemoterapii. Určení příslušnosti nádorových elementů k populaci určitého stupně vývoje je umožněno souborem různých laboratorních metod, mezi nimiž vedle morfologie dominuje vyšetření imunohistochemické umožňující stanovení imunofenotypu patologických elementů a vyšetření molekulárně biologické (Tab 5). Na základě těchto moderních metod mohla být formulována i nová klasifikace NHL, která v plné míře reflektuje nové patogenetické poznatky (Tab 6), a která rozděluje T i B lymfomy na prekurzorové a periferní (5).
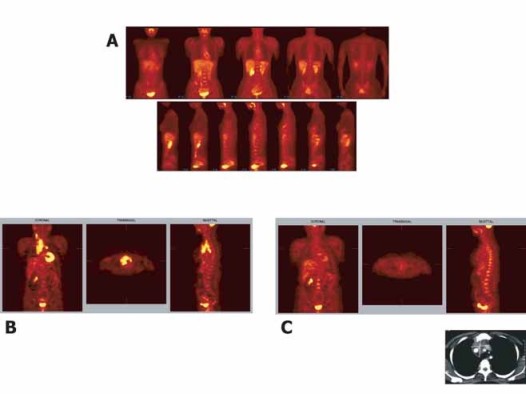
Přesné určení typu lymfomu má význam i pro stanovení prognózy, kde neméně důležitým faktorem je i rozsah postižení v době diagnózy. I zde došlo ve druhé polovině 20.století k významnému pokroku (Tab 7). Velkým přínosem je i možnost kombinace moderních metod, např. CT a PETU, zejména při stanovení úspěšnosti léčby. Jak je patrno na obr. 4, po skončené léčbě ukazuje CT zvětšené uzliny, ale vyšetření PET je negativní, což lze interpretovat jako zvětšení nenádorové.
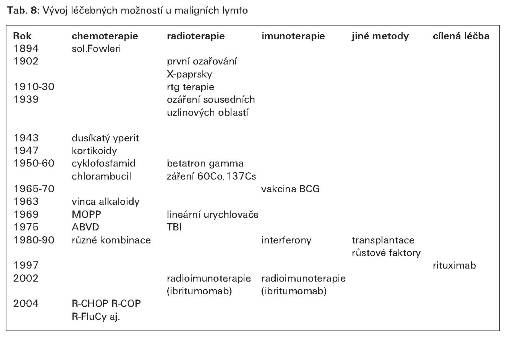
Ruku v ruce s pokroky v diagnostice šly i pokroky v léčebných možnostech (Tab 8). Počátkem 20.století panoval terapeutický nihilismus a ani pokusy ovlivnit chorobu Fowlerovým roztokem nebyly úspěšné. Jistou naději přinesla možnost radioterapie X paprsky, která měla pouze paliativní účinky, nicméně byla jedinou léčebnou metodou. Koncem 30.let navrhl francouzský radioterapeut Gilbert ozáření sousedních polí, což přineslo jisté zlepšení léčebných výsledků. Ozařování rentgenem bylo provázeno častými nežádoucími účinky a i jeho protinádorový účinek byl omezený. Radioterapie nabyla později na významu zavedením vysokoenergetických zdrojů záření (betatron) a s využitím gama záření z cesiové nebo kobaltové ozařovače. Na rozdíl od rentgenových přístrojů pracujících v napěťovém rozsahu 150-400 KeV se napěťový rozsah vysokoenergetických zdrojů pohybuje od 1,25-45 MeV. s dosažením většího poměru hloubkové dávky k dávce povrchové. Propracovala se i taktika ozařování (involved field, extended field, mantle field, obrácené Y, TBI). Radioterapie zůstala sice důležitou léčebnou metodou dodnes, ale s rozvojem chemoterapie v 70.letech poněkud ztratila svůj původní význam.
Po 2.světové válce se začala používat první chemoterapie. Byl to dusíkatý yperit (u nás TS-160), později cyklofosfamid a chlorambucil, dále kortikoidy zavedené v r.1947. Od r.1963 se byly již k dispozici vinca alkaloidy a zejména monoterapie vinblastinem u Hodgkinovy choroby byla velmi populární (10). Zásadní obrat v léčbě Hodgkinova lymfomu nastal zavedením kombinované chemoterapie (1). Byla to zejména DeVitova kombinace MOPP (1969) a její četné modifikace a dále Bonnadonova kombinace ABVD (1975). U NHL se zpravidla podávala kombinace COP nebo CHOP. Posílení účinku v léčbě folikulárních NHL přineslo zavedení nových purinových analogů (fludarabinu). Zkoušely se i jiné metody, např.splenektomie, imunoterapie vakcínou BCG (1975-1980), bez jednoznačného přínosu (9). Poněkud lepší výsledky přinesla léčba interferony, které ovlivnily trvání remisí u NHL (3). Významné posílení efektivity chemoterapie nastalo zaváděním hematopoetických růstových faktorů koncem 60.let, které umožnily lépe využít protinádorového účinku cytostatických kombinací s omezením nežádoucích účinků pramenících s granulocytopenie. Výrazným léčebným pokrokem se stalo zavedení autologní transplantace hematopoetických kmenových buněk, zejména pro NHL (18). Dalším nepochybným přínosem se stalo zavedení cílové léčby v podobě monoklonálních protilátek, zejména rituximabu (1997). Kombinace rituximabu s chemoterapií signifikantně prodloužily bezpříznakové období i celkovou dobu přežití jak u folikulárních NHL, tak i u difúzních lymfomů (19).
Rituximab však nezůstal jedinou monoklonální protilátkou používanou v léčbě lymfomů. Několik desítek protilátek, jak pro NHL tak pro Hodgkinův lymfom je v klinickém zkoušení (Tab 9). Perspektivní mohou být agonistické protilátky mapatumumab a lexatumumab, které stimulují smrtící receptory a spuštěním apoptotické kaskády indukují apoptózu (4).
Další metody cílené léčby jsou předmětem preklinického a klinického testování, z nových cytostatik se zdá u NHL efektivní pralatrexate (Propel) (14), u kožních lymfomů vorinostat (Zolinza) (2). Zajímavou látkou je i multikinázový inhibitor s převážným účinkem na proteinkinázu C - enzastaurin (15). Zkouší se i další látky včetně inhibitorů angiogeneze nebo protisměrných oligonukleotidů.
Jestliže se v průběhu 10 let podařilo dosáhnout kurativního účinku nejen v léčbě Hodgkinova lymfomu, ale i u jistého procenta NHL, lze při dnešním převratném vývoji nových diagnostických a léčebných metod předpokládat, že maligní lymfomy se stanou zcela vyléčitelnou malignitou.
Literatura:
- De Vita, VT, Serpick, AA, Carbone, PP: Combination chemotherapy
for advanced Hodgkin’s disease. Ann int. Med. 1970, 73,
881-887.
- Duvic M, Vu J,: Vorinostat: a new oral histone deacetylase
inhibitor approved for cutaneous T-cell lymphoma. Drugs 2007, 16,
1111-1120.
- Foon, KA, Sherwin, SA, Abrama, PG .et al.: Treatment of
advanced non-Hodgkin’s lymphoma with recombinant leukocyte A
interferon. New Engl.J.Med. 1984, 311, 1148-1152.
- Gajewski ,TF: On the TRAIL toward death receptor-based cancer
therapies. J. Clin. Oncol., 2007, 25, 1305-1307.
- Harris, NL , Jaffe, ES, Diebold J. et al.: Lymphoma
classification-from controversy to consensus: the R.E.A.L. and WHO
classification of lymphoid neoplasms. Ann. Oncol. 2000, 11,
Suppl.1, 3-10.
- Heřmanský F.: Současné problémy maligních lymfomů. Čas.lék.čes
1981, 120, 1217-1223.
- Heřmanský F., Bednář B.: K soudobým problémům v diagnostice a
klasifikaci maligních lymfomů. Čas. lék. čes. 1975, 114,
1050-1053.
- Hodgkin T.: On some morbid appearences of the absorbent glands
and spleen. Trans. Med. Chir. Soc.London, 1832, 17,
68-114.
- Hryniuk W.: A randomized trial of BCG in poor prognosis
non-Hodgkin’s lymphoma Proc. Am. Assoc. Cancer Res. 1982, 23,
112.
- Klener P, Donner L., Neuwirtová R.et al.: Vinblastin treatment
of malignant lymphoma Neoplasma 1971, 5, 505-511
- Lukes RJ,, Collins RD: Immunologic characterisation of human
malignant lymphomas. Cancer 1974, 34, 1488-1503.
- Magrath I.: The non-Hodgkin’s lymphoma, Arnold, London,
1997
- Netoušek M. Klinická hematologie. Státní zdravotnické
nakladatelství, Praha, 1962
- O’Connor OA: Pralatrexate: an emerging new agent with activity
in T-cell lymphomas. Curr. Opin. Oncol. 2006, 18,
591-597
- Robertson, MJ, Kahl, JM, Vose, JM. et al.: Phase II study of
enzastaurin, a protein kinase C beta inhibitor, in patients with
relapsed or refractory diffuse large B-cell lymphoma. J.
Clin.Oncol. 2007, 25, 1741-1746.
- Skarin, AT., Dorfman, D. M.: Non-Hodgkin’s lymphomas: Current
classification and management. CA Cancer J. Clin. 1997, 47,
351-372
- Sternberg, C: Uber ein eigenartige unter dem Bilde der
Pseudoleukemie verlaufende Tuberculose des Lymphatischen Apparates.
Z. Heilk. 1898, 19, 21-90
- Thomas D.: The role of marrow transplantation in the
eradication of malignant disease. Cancer 1982, 40,
1963-1969
- Trněný, M, Klener, P.: Deset let od úspěšného zavedení prvé
monoklonální protilátky (rituximab) do léčby lymfomů. Čas. lék.
čes. 2007,146, 578-585.
- Trousseau, A: De l’adénie. Clin. Méd.l’Hotel-Dieu Paris, 1865,
3, 555-581
- Wunderlich, CA: Zwei falle von progressiven multiplen Lymphdrussenhypertrophien. Arch. Physiol. Heilk. 1858, 12, 122-131
Legendy k obrázkům:
Obr.1: Thomas Hodgkin (1798-1866)
Obr. 2: Znázornění centrofolikulárního původu Sternbergových
buněk. Aktivované B-lymfocyty se po vstupu do germinálního centra
transformují na proliferující centroblasty. Simultánně s jejich
proliferací probíhá jejich diferenciace v centrocyty. Další osud
centrocytu je následující:
- A - mutace a další diferenciace v paměťové nebo plasmatické buňky,
- B - při ztrátě vazebné kapacity pro antigén apoptóza (AP),
- C - je- li apoptóza blokovaná např. účinkem AB viru vzniká Sternbergova buňka.
Obr. 3: Návrh na klasifikaci maligních lymfomů z konce 30. let 20. století
Obr. 4: Schéma postupného vývoje B-lymfocytu a vznik korespondujících nehodgkinských lymfomů. (FDC = folicular dendritic cells, AP = apoptóza)
Obr. 5: Význam vyšetření PET pro posouzení remise
- A = normální PET obraz
- B = vyšetření PET u nemocnéího s Hodgkinovým lymfomem při
úvodním stagingu
Klinicky: stadium IIA (bulky mediastinum) PET: IIIA (uzliny v pánvi) - C = vyšetření po 2 cyklech chemoterapie. Normální PET obraz, na CT perzistující mediastinální uzliny.





Datum přednesení příspěvku: 12. 10. 2007





