Konference: 2012 3. pražské mezioborové onkologické kolokvium Prague ONCO
Kategorie: Ostatní
Téma: Review
Číslo abstraktu: 004
Autoři: prof. MUDr. Pavel Klener, DrSc.
Pokroky molekulární biologie a genetiky na přelomu století umožnily hlubší poznání patogeneze nádorového bujení, které vedlo k identifikaci klíčových struktur podílejících se na maligní transformaci. Tyto objevy významně obohatily naše léčebné možnosti, které vedly nejen k zavedení nových léčebných modalit, ale též k možnostem individualizované léčby. Kromě konvenční (klasické) chemoterapie jsou dnes k dispozici další modality, zejména cílená a biologická léčba. Vzhledem k tomu, že označování jednotlivých modalit je používáno často nepřesně a to nejen v médiích, ale často i v odborném tisku, je cílem tohoto sdělení vysvětlit podrobněji mechanismy účinku zmíněných modalit a terminologii upřesnit.
Konvenční (necílená) chemoterapie byla zavedena do klinické praxe na základě preklinických a klinických zkušeností s protinádorovou účinností určitého přípravku u různých typů nádorových onemocnění. Jen zřídka bylo cytostatikum určeno k léčbě jednoho druhu nádoru. Používaná cytostatika lze označit jako „širokospektrá“. To vyplývá z mechanismu jejich účinku, znázorněného na obrázku 1.
Testování klasických cytostatik vždy předcházelo poznatkům o jejich mechanismech na molekulární úrovni. Např.dusíkatý yperit byl zaveden do klinické praxe dříve, než byla známa struktura DNA. Konvenční cytostatika se vážou na určité buněčné struktury (DNA, RNA, cytoskelet, proteiny) a inhibují jejich funkci, ale jen slabě inhibují interakce mezi proteiny.(1) Jen nepřímo indukují apoptózu (druhotně cestou genotoxického stresu a zástavy buněčného cyklu). Z jejich obecného antiproliferačního účinku vyplývají četné nežádoucí účinky. Podléhají metabolismu, nejčastěji v játrech, metabolity mateřské látky bývají nezřídka aktivní a často vykazují odlišné účinky Po r. 2000 byla sice zavedena některá nová cytostatika, ale mechanismy jejich účinku, farmakokinetika a spektrum nežádoucích účinků se od konvenčních cytostatik prakticky neliší. Také princip jejich účinku je stejný. Za necílená léčiva považujeme také epigenetická chemoterapeutika, která modifikují epigenetické struktury DNA.(2)
Obrázek 1: Schéma mechanismů účinku konvenční chemoterapie
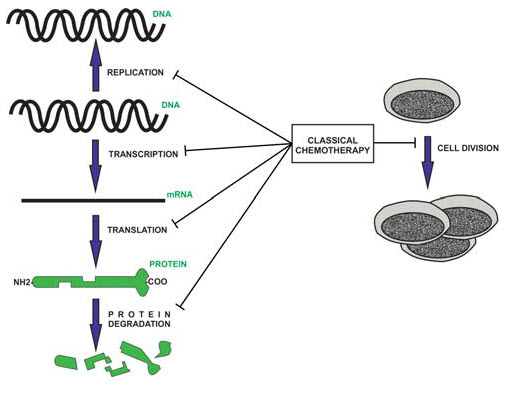
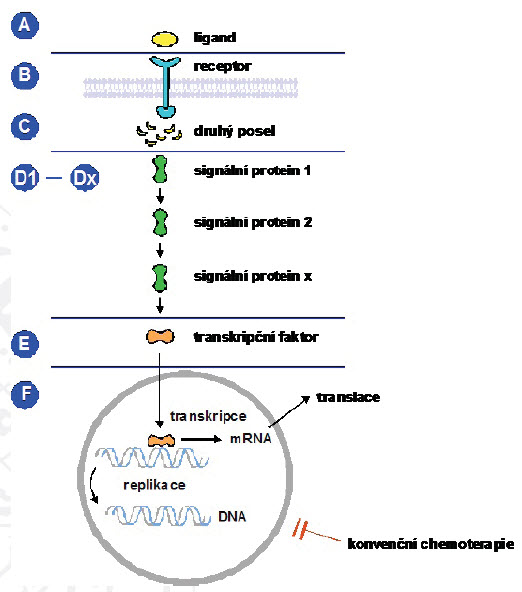
Cílená (molekulární) chemoterapie je konceptuální pojem, který byl navržen na základě znalostí patogeneze daného typu nádorového onemocnění a určení specifických biomarkerů daného onemocnění, kterými jsou buď povrchové znaky exprimované nádorovými buňkami, nebo buňkami mikroprostředí, nebo tzv. druggable molecule, tj. molekuly podílející se na patologických nitrobuněčných reakcích.(3,4) (obrázek 2) Za historický mezník počátku cílené terapie se zpravidla považuje zavedení imatinibu do léčby CML v r. 2000. Nízkomolekulární inhibitor tyrozinkinázy (TK) blokuje aberantní signalizaci ABL TK a proliferační signály.(5) Cílená terapeutika interferují se specifickými proteiny a aberantně aktivovanými kaskádami na různých úrovních, (obrázek 3) mohou přímo indukovat apoptózu (na rozdíl od konvenčních cytostatik)), přerušují onkogenní signály, inhibují sebeobnovu, popř. indukují diferenciaci. Mohou být cíleny i na nemaligní buňky mikroprostředí a interferují s komplexními procesy angiogeneze a metastazování či imunitní odpovědi.(6) Mají úzké spektrum účinnosti více méně na nádorové buňky (on target effect), kdežto toxicita na nemaligní buňky je relativně omezena (of target effect). Protože se v médiích ale i v odborných sděleních často zavádějícím způsobem používá jako synonymum pro cílenou léčbu označení léčba biologická, je vhodné uvést, že mezi cílená terapeutika patří nejen syntetické nízkomolekulární látky, ale také biologická léčiva (proteinové makromolekuly (rituximab).(7) Cílená a biologická léčba jsou sice dva odlišné pojmy, ale s výrazným překryvem. Ne každé biologické léčivo je cílené, ne každé cílené léčivo je biologické.
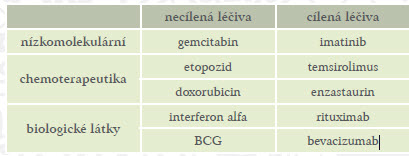
Tabulka 1: Příklady cílených a necílených léčiv v kategorii nízkomolekulárních a biologických látek
Biologická léčba zahrnuje skupinu léčiv odvozených od biomolekul, většinou proteinových makromolekul (cytokiny, růstové faktory, protilátky). Tyto makromolekuly obsahují 5 000-50 000 atomů a jsou definovány nejen svou primární strukturou (tj. sekvencí aminokyselin), ale i sekundární modifikací aminokyselinové sítě, zejména extenzivní glykosylací.(8) Rozsah glykosylace a typ cukerné složky nemůže být 100% predikován a je do značné míry nahodilým procesem. Výroba biologických léčiv je extrémně technologicky i finančně náročná, obvykle za použití transgenních linií.(9) Biomolekuly jsou zřídka metabolizovány, podléhají degradaci a eliminaci. Na rozdíl od syntetických chemických látek účinně inhibují vazby mezi proteiny. Biologické látky reprezentují v paletě protinádorových léčiv především monoklonální protilátky, které mají obvykle velmi malý of target účinek a mívají omezené nežádoucí účinky. Nově vyráběná verze již používané monoklonální protilátky se nazývá biosimilar.(10) Biosimilar musí s referenční protilátkou sdílet nejen primární strukturu (identickou sekvenci aminokyselin), ale též strukturální modifikaci (rozsah a typ glykosylace). V případě, že biosimilar dosáhne statisticky významným způsobem lepších klinických výsledků než referenční látka ve 3. fázi klinického zkoušení, je navrženo označení biobetter.
Obrázek 2: Schéma mechanismu účinku cílené léčby

Obrázek 3: Obecné schéma přenosu signálu z membránového receptoru do nitra buňky a různé úrovně možného terapeutického zásahu u aberantně aktivovaných drah.
Nově zavedené léčebné modality cílené a biologické léčby spolu s hlubším poznáním charakteru jednotlivých typů nádorů, u nichž byly nalezeny v rámci stejné histopatologické klasifikace odlišnosti v cytogenetickém, farmakogenetickém či metabolomickém profilu, umožnily formulovat koncept individualizované terapie pro vybrané nemocné. (11) Určení specifických prognostických a prediktivních markerů umožňuje podle těchto znaků výběr různě intenzivní konvenční léčby nebo racionální aplikaci cílené léčby. Tak např. nemocní s CLL bez mutace genu IgVH a exprese proteinkinázy ZAP-70 mají špatnou prognózu a vyžadují intenzivnější terapii. Příkladem prediktivního markeru může být mutace genu KRAS, která vypovídá o necitlivosti k cílené léčbě cetuximabem. V případě mutace genu KRAS je totiž signální dráha, na jejímž počátku stojí receptor pro růstový faktor EGFR/ERBB1/HER1, trvale stimulována, bez ohledu na blokádu tohoto receptoru cetuximabem. Uvedené příklady ukazují, že po pečlivé analýze lze pro každého nemocného vybrat individuálně optimální léčbu.
Závěr
Předpokladem pro individualizovanou léčbu je cytogenetické vyšetření, stanovení biomarkerů a farmakogenetické a metabolomické studie. Na základě uvedených vyšetření lze pak určit optimální léčebnou modalitu pro konkrétního nemocného a vybrat druh cílené nebo biologické léčby a jejich vhodnou kombinaci s konvenční chemoterapií.
prof. MUDr. Pavel Klener, DrSc. 1.interní klinika 1. LF a ÚHKT, Praha e-mail: Pavel.Klener@vfn.czLiteratura
- Airley R. Cancer chemotherapy. Willey-Blackwell, Chichester 2009.
- Esteller M. Epigenetics in cancer. New Engl J Med 2008;358:1148-1159.
- Mladosievičová B, et al. Molekulové mechanizmy patogenézy nádorov. SAP, Bratislava 2011.
- Klener P, Klener P. Jr. Nová protinádorová léčiva a léčebné strategie. Grada Publishing, Praha 2010.
- Druker BJ. Imatinib as a paradigm of targeted therapies. Adv. Cancer Res 2004;91:1-30.
- Druker BJ. Perspectives on the development of a molecularly targeted agent. Cancer Cell 2002;1:31-36.
- Cartron G, Watier H, Golay J., Solal-Celigny P. From the bench to the bedside: ways to improve rituximab efficacy. Blood 2004;104:2635-2642.
- Schiestl M, Stangler T, Torella C,et al. Acceptable changes in quality attributes of glycosylated biopharmaceuticals. Nat Biotechnol 2011;29:310-312.
- Ledford H. Biotechs go generic: the same but different. Nature 2007;449:274-276.
- Weise M, Bielsky M C, De Smet K, et al. Biosimilars-why terminology matters. Nat Biotechnol 2011;29:690-693.
- Hamburg M A, Collins FS. The path to personalized medicine. N Engl J Med 2010;363:301-304.
Datum přednesení příspěvku: 26. 1. 2012





