Konference: 2005 XII. Jihočeské onkologické dny
Kategorie: Nádory hlavy a krku
Téma: Konference bez tematických celků
Číslo abstraktu: 031
Autoři: Prof. MUDr. Petr Vlček, CSc., MHA; MUDr. Pavel Racek 1966-
V programu pod názvem: Diagnostika nádorů štítné žlázy
Nádory štítné žlázy lze zařadit mezi vzácné choroby. Mezi všemi karcinomy mají zastoupení necelým 1%, roční incidence se pohybuje kolem 50 nových případů na 1 milión obyvatel.(5) Karcinom štítné žlázy však představuje početně nejrozsáhlejší skupinu onkologických onemocně ní v endokrinologii, kde tvoří kolem 90% všech diagnostikovaných nádorů. Mortalita se pohybuje na 100 000 obyvatel obecně nepřevyšuje 1% úmrtí na karcinom v běžné populaci. Přes svoji vzácnost patří ve věku 15 - 45 let mezi 5 nejčastějších karcinomů. Nádory štítné žlázy představují nehomogenní skupinu tumorů s širokým spektrem biologické aktivity. Může jít o nádory téměř neškodné až po velice agresivní, rychle usmrcující svého hostitele. Prognóza onemocnění závisí na mnoha faktorech, z toho vyplývá nutnost individuálního přístupu ke všem léčebným postupům. Benigní i maligní nádory štítné žlázy vycházejí z folikulárního epitelu, jsou hormálně aktivní, vyskytují se 5x častěji u žen než u mužů ve všech věkových skupinách. Většina diferencovaných forem si ponechává schopnost vychytávat jod.
Nádory z folikulárních buněk jsou ve dvou možných variantách, a to jako karcinom folikulární nebo papilární o různém stupni diferenciace. Zvlášní postavení v tyreoidální onkologii pak má medulární karcinom štítné žlázy.
Papilární karcinom (PTC) štítné žlázy představuje přibližně 44-81% tyreoidálních nádorů, zpravidla se vyskytuje ve 4. 6. dekádě věku nemocných, je však poměrně častným nálezem i u dětí a dospívajících. Tento karcinom často zakládá mikrometastázy do druhého laloku a recidivy z nich vznikají až ve 20 %. Pokročilý papilární karcinom se šíří přes pouzdro štítné žlázy do okolních struktur. V době stanovení diagnózy se extratyreoidální invaze vyskytuje v 5-35%(10). Lokální invaze papilárního karcinomu může postihovat dýchací cesty, ale také další struktury, jakož i jícen, krční cévy, nervové struktury, svaly, kůži. Lokální invaze do kůže je charakteristická pevnou fixací kůže k nádoru. U infiltrativních a méně diferencovaných forem se karcinom může projevovat jednostranným i oboustranným útlakem dýchacích cest, NLR i jícnu.Většinou však onemocnění zůstává omezeno na štítnou žlázu a projevuje se jako tumor na přední straně krku či jako lymfadenopatie. Postižení lymfatických uzlin je častější u dětí a dospívajících a nemá vztah k velikosti primárního nádoru. Častý je i multicentrický vznik papilárního karcinomu, čím je tumor větší, tím větší je pravděpodobnost lokální invazivity a častějších recidiv. Nález nádorového uzlu ve žláze s pozitivními jednostrannými regionálními lymfatickými uzlinami je velmi suspektní i z kontralaterálního uzlinového i intratyreoidálního šíření. Agresivita papilárního karcinomu je poměrně nízká, rovněž u starších pacientů je jeho průběh mírnější. Lepší prognózu mají ženy než muži.
Folikulární karcinom (FTC) je druhým nejčastějším maligním nádorem štítné žlázy. Zaujímá přibližně 15 % maligních tyreoidálních nádorů. V oblastech deficitu jódu je jeho výskyt častější , až 40 %. Typické je jeho maximum výskytu v 5. 6. dekádě věku nemocného. Jeho šíření do regionálních lymfatických uzlin je méně časté než u papilárního karcinomu, udává se v rozmezí 3-15%. Má však větší sklon k tvorbě vzdálených metastáz v plicích a kostech (15-20%), šíří se hematogenní cestou. Metastázy tohoto nádoru dobře akumulují radiojód. Jako variantu folikulárního karcinomu lze považovat inzulární karcinom, který obvykle tvoří hnízda malých folikulárních buněk, často s patrnými nekrózami s příměsí kolagenu, imunohistochemický nález je pozitivní na tyreoglobulin. Jde o vysoce agresivní typ nádoru, který sice akumuluje radiojod, ale často recidivuje a metastazuje. Onkocytární karcinom (Hürthleho karcinom, karcinom z oxyfilních buněk) je považován za variantu folikulárního karcinomu, někteří autoři jej uvádějí jako samostatnou jednotku. Je charakteristický nepředvídatelným klinickým průběhem. Může se chovat vysloveně agresivně s rychlou manifestací metastáz v kostech a plicích. Pro léčbu je značně nevýhodný, vzhledem k malé akumulaci radiojódu, a proto při jeho léčbě je kladen důraz na radikalitu chirurgických výkonů. Nádory z jasných buněk rovněž hůře akumulují radiojod.
Anaplastický karcinom (ATC) je nediferencovaný, velmi agresivní nádor s tvorbou bizardních buň ěk s několika jádry a je pro svůj vyslověně zhoubný průběh oprávněně řazen mezi nejagresivnější lidské nádory. Jeho frekvence naštěstí klesá s výjimkou míst výskytu endemických strum, vyskytuje se převážně u straších osob. Typicky se vyskytuje u nemocných s dlouhodobou anamnézou strumy, která se začala náhle progresivně zvětšovat. Karcinom se šíří jak hematogenní, tak lymfatickou cestou. V léčbě anaplastického karcinomu je metodou volby chemoterapie a zevní ozáření, jejichž kombinace zlepšila přežívání v průměru o 2 roky. Chirurgický výkon bývá indikován pouze za situace, může-li být zcela radikální, či jako vitální výkon pro zprůchodnění dýchacích cest při dušení.
Medulární karcinom (MTC) je čtvrtou základní histopatologickou formou karcinomů štítné žlázy. Vychází z parafolikárních (C buněk), jeho embryologický základ pochází z neurální lišty, a proto neakumuluje radiojód. Nádor tvoří vřetenovité či polygonální buň ky s nepravidelnou trámčinou, cytoplasma je světlá s granuly pozitivními na kalcitonin (iCT), kterého se využívá jako nádorového markeru, ve stromatu bývá přítomen amyloid (u 25% MTC chybí). Medulární karcinom tvoří kolem 8% všech nádorů štítné žlázy. Pro tento karcinom je charakteristický jak jeho sporadický výskyt (75-80 %), tak i možnost familiární formy (20-25 %). Pro familiární medulární karcinom je typický autozomálně dominantní typ dědičnosti, i když se objevují práce, které poukazují na recesivní typ přenosu vlohy. Pokud se v rodině vyskytuje pouze MTC, pak hovoříme o familiárním MTC (FMTC), pokud je s MTC asociován feochromocytom a hyperparatyreóza, jde o syndrom MEN 2A. Nejtěžší formou je syndrom MEN 2B, kdy je MTC spojen s typickým marfanoidním habitem, feochromocytomem, ganglioneuromatózou a dalšími symptomy. U těchto forem je typický multicentrický a bilaterální výskyt. Ten byl však pozorován asi u třetiny nemocných se sporadickou formou onemocnění. Na rozdíl od folikulárního či papilárního karcinomu, MTC poměrně brzy a často (až ve 25-30% případů) metastazuje do jater.Léčba obou forem MTC spočívá v úplném odstranění štítné žlázy. V případě lokálního metastzování do lymfatických uzlin je provádějí modifikované krční disekce. U recidiv medulárního karcinomu vždy v prvé řadě indikujeme reoperaci.(10) V současné době v diagnostice MTC kromě stimulačního kalcitoninového testu, máme možnost odebrat krev na genetické vyšetření. Je-li u pokrevných příbuzných prokázána zárodečná bodová mutace na RET-protoonkogenu, je vždy indikována TTE, vzhledem k vysokému riziku možného vzplanutí onemocnění. Často bývá histologický nález s obrazem hyperplázie C buněk, což z hlediska onkologického nutno považovat za prekancerózu.
S dalšími nádory, které se ve štítné žláze mohou vyskytovat, se setkáváme vzácněji. Může jít o nádory z lymfatické tkáně-lymfomy, které vznikají obvykle na bazi autoimunní thyreoidity. Primární Hodgkinský lymfom je však ve štítné žlázy naprostou raritou. Neepitelové maligní nádory jako sarkomy, či hemanigiomy se vyskytují rovněž poměrně vzácně. Jedná se o rychle rostoucí tumory, které postihují především obyvatelstvo vyšších věkových skupin a většinou ženy. Rozlišení od anaplastického karcinomu není často jednoduché. V léčbě těchto nádorů je metodou volby zevní aktinoterapie, radikální chirurgie se provádí u nálezů lokalizovaných pouze na štítnou žlázu. Lymfomy štítné žlázy mají příznivější prognózu než lymfomy jiné lokalizace.
Sekundární nádory štítné žlázy se vyskytují méně často. Metastázy nádorů do štítné žlázy vznikají přímým šířením z okolních orgánů (larynx, trachea, pharynx, oesophagus), dále retrográdním lymfatickým šířením (trachea, bronchus). Hematogenní cestou mohou do štítné žlázy metastazovat prakticky všechny nádory (např. z colon, z melanomu).
Etiopatogenéze
karcinomu štítné žlázy je značně bohatá a uplatň uje se zde i celá řada rizikových faktorů. S karcinomem se můžeme setkat asi u 10-15% nemocných, u kterých bylo v minulosti provedeno zevní ozáření. Tyto, tzv. radiogenní karcinomy (většinou jde o papilární formy) se objevují řadu let po ozáření krku (např. pro benigní lymfadenopatie, hyperplazii thymu apod). Rovněž v oblastech, kde došlo k jaderným katastrofám, je prokazatelně pozorován vyšší výskyt karcinomů, zejména u dětí a mladistvých.
Některé méně časté familiární syndromy jsou sdruženy s častějším výskytem tyreoidálních uzlů a karcinomů. Pacienti s Gardnerovým syndromem či familiární adenomatózní polypózou střev mají 100x vyšší riziko rozvoje papilárního karcinomu štítné žlázy než ostatní populace.
Byl pozorován častější výskyt karcinomu štítné žlázy u nemocných, kteří podstoupili strumektomii pro beningní onemocnění štítné žlázy, ale kde nebyla nasazena substituce tyreoidálními hormony. Udává se, že asi 1 až 7 % recidiv eufunkčních strum (po operacích před více jak pěti lety) je maligních. Tyto nádory jsou navíc typické svojí vysokou biologickou agresivitou(2).
Také byl zaznamenán vyšší záchyt karcinomů u Hashimotovy autoimunní tyreoiditis, Graves Basedowova choroby či u tyreotoxikózy (tedy u metabolicky aktivních stavů).
Obyvatelstvo oblastí s deficitem jódu bývá častěji postiženo folikulárním karcinomem. Tento fakt byl pozorován i u nás, zejména v polovině minulého století. Po zavedení jodové profylaxe došlo postupně ke změně poměru vysokého zastoupení folikulárního a anaplastického karcinomu ve prospěch méně agresivního papilárního karcinomu štítné žlázy.
Molekulární biologie, zejména v poslední dekádě, se výraznou měrou podílí na znalostech o tumorogenéze a nádorové transformaci folikulární buňky.
V polovině 80. let se podařilo u nemocných s medulárním karcinomem štítné žlázy lokalizovat pericentromerickou oblast 10. chromozomu (10q11) a byl v této oblasti identifikován RET proto-onkogen, jehož mutace jsou zodpovědné za toto onemocnění. RET proto-onkogen je tvořen 21 exony. Normální RET kóduje tyrozinkinázový receptor v buň kách vycházejících z neurální lišty a urogenitálních prekurzorových buň kách a je nezbytný pro normální vývoji jedince, v proliferaci, diferenciaci a přežívání buněk, v morfogenezi ledvin, maturaci periferního nervového systému ale i pro diferenciaci spermatogonií.
Familiární formy medulárního karcinomu štítné žlázy jsou většinou spojeny se zárodečnými bodovými substitučními mutacemi v jednom ze šesti cysteinových kodonů v extracelulární doméně RET proteinu. Jde o kodony 609, 611, 618 a 620 v 10. exonu a kodony 630 a 634 v 11. exonu. Všechny tyto varianty byly identifikovány u 95% MEN2A rodin, některé z nich u FMTC rodin. U 95% rodin s MEN 2B dochází k mutaci v kodonu 918 v 16. exonu, rovněž byly nalezeny mutace v kodonu 883 v 15. exonu. Kromě patogenních mutací jsou popisovány v RET proto-onkogenu i běžné polymorfismy, především ve 13., 14. a 15. exonu. Nejagresivnější jsou mutace v kodonu 918, 922 a 883, přítomnost mutace v kodonu 634 bývá spojována s výskytem feochromocytomu a hyperparatyreózy. Naopak mutace v kodonech 609, 618 a 620 v 10. exonu bývají spojovány s menším rizikem vzniku feochromocytomu a hyperparatyreózy. Předpokládá se, že mutacev 13., 14. a 15. exonu mají méně agresivní fenotyp než u mutací v exonech 10, 11 a 16.(6,7)
Genetický screening má význam pro rizikové osoby v presymptomatickém stavu, kdy lze včasnou intervencí značně snížit morbiditu a mortalitu. Na základě identifikovaných mutací lze rovněž odhadnout další progresi onemocnění a včasně zasáhnout.
Většina pacientů s MTC nemá familiární historii, nicméně z několika rozsáhlých studií vyplynulo, že asi u 3-20% těchto „sporadických“ forem MTC bylo způsobeno buď okultní či nově vzniklou zárodečnou bodovou mutací RET protoonkogenu. V našem souboru „sporadických“ MTC jsme zachytili u 10% rodin zárodečné, tedy na potomstvo přenosné mutace! Je proto nezbytné u všech pacientů, kdy jde o první záchyt MTC v rodině, provádět screening zárodečných mutací RET proto-onkogenu (1).
Klinický obraz
karcinomu štítné žlázy má několik typických forem. Nejběžnějším nálezem je obraz solidního, lokálně rostoucího uzlu. Diferenciální diagnóza uzlu ve štítné žláze bez výraznější růstové aktivity je věcí značně složitou. V současné době jednoznačně před prostou palpací uzlu dáváme přednost sonografickému vyšetření a cílené aspirační biopsii. Cytologické vyšetření z uzlu, v případě papilárního karcinomu, nečiní obtíže. Diagnostika folikulárního karcinomu je obtížnější i pro zkušeného cytologa. Je užitečné i v případě nesuspektního cytologického nálezu, pacienta sonograficky kontrolovat a při růstové progresi uzlu zvážit chirurgické řešení.
Dalším typickým obrazem karcinomu štítné žlázy je lokální uzlinový syndrom. Ten se manifestuje nejčastěji ve spádovém lymfatickém jugulárním řečišti laterálně od velkých cév. Uzlinový syndrom může být zachycen i v nadklíčkové oblasti či v jugulu. Nález zvětšených lymfatických uzlin na krku, často oboustranně, je pro papilární karcinom u dětí a mladistvých velmi častý. Je-li současně nalezen zvětšený lalok či uzel ve štítné žláze, pak takový nález je vysloveně suspektní z malignity. U dospělých bývá uzlin méně, jsou však tuhé a ke spodině fixované. Z nádorů štítné žlázy nejčastěji do krčních lymfatických uzlin metastazuje papilární karcinom. Současným léčebným trendem je ústup od radikálních výkonů na uzlinách a přechod k modifikovaným krčním disekcím, kdy jsou šetřeny důležité struktury (m. sternocleidomastoideus, v. jugularis interna, ansa cervicalis a n. accesorius). Výkony na lymfatických uzlinách jsou nemyslitelné bez přesného sonografického vyšetření, které dosahuje téměř 100% spolehlivosti, je-li provedeno zkušeným sonografistou.
Třetím základním klinickým obrazem karcinomu štítné žlázy je nález vzdálených metastáz. Děti s nálezem plicních metastáz papilárního karcinomu mívají většinou příznivou prognózu, plicní metastázy mají převážně miliární rozsev a velmi ochotně reagují na léčbu radiojodem. U dospělých je plicní metastatický proces charakteru malouzlových a velkouzlových metastáz, prognóza onemocnění je zde poněkud horší(10). Folikulární karcinomy metastazují typicky do kostí a jejich výskyt výrazně zhoršuje prognózu onemocnění. Často bývají diagnostikovány pozdě, prvním příznakem mohou být až patologické zlomeniny či bolesti v zádech při spinálních metastázách. Méně často byly pozorovány metastázy do mozku. Při nálezu vzdálených metastáz je nezbytné v prvé řadě provést totální tyreoidektomii s odstraněním primárního tumoru a následně se pak pokusit ovlivnit nádorový proces radiojodem. V případě nálezu solitární metastázy, je plně indikováno její chirurgické odstranění. Mnohočetné metastázy chirurgicky bohužel ovlivnit nelze.
Za zvláštní zmínku stojí nález tzv. minimálního karcinomu štítné žlázy, tzv. mikrokarcinomu. Podle současné TNM klasifikace (viz tabulka 1) z r. 2002, je termín mikrokarcinom vyhrazen pro nádor v největším rozměru do 2 cm (dříve do 1 cm), který je omezen na štítnou žlázu. Většinou není klinicky zřejmý a je objeven až při histologickém vyšetření(3). Pro splnění definice mikrokarcinomu je nutné, aby byl nádor obklopen normální tkání štítné žlázy. Nádorová invaze do pouzdra žlázy a jeho extratyreoidální šíření mění klasifikaci nádoru. U nás mikrokarcinom štítné žlázy představuje asi 15% všech nově diagnostikovaných karcinomů. Jeho prognóza bývá hodnocena jako velmi dobrá s malou biologickou aktivitou. Na léčbu mikrokarcinomu však panuje stále značná nejednostnost. Na jedné straně se soudí, že nádor ani jeho regionální lymfatické metastázy svého hostitele neohrožují, na druhé straně se uvažuje o možné lokální invazivitě, bilaterálním šíření a výskytu regionálních i vzdálených metastáz. Z toho vyplývají i rozdílné přístupy k léčbě, které vycházejí od pouhé dispenzarizace, přes totální tyreoidektomii až k výkonům na regionálních lymfatických uzlinách při jejich postižení a následné aplikaci radiojodu.Asi u 5% nemocých s mikrokarcinomem byly zachyceny lokální či vzdálené metastázy, proto obvykle doporučujeme provedení preventivní totální tyreoidektomie u všech pacientů s diagnostikovaným mirkokarcinomem.
Léčba
karcinomu štítné žlázy má komplexní interdisciplinární přístup, kdy se na jejím úspěšném průběhu podílejí kromě endokrinologů, rovněž chirurgové a specialisté v oboru nukleární medicína. Prvním krokem při léčbě karcinomu štítné žlázy je provedení radikálního chirurgickém výkonu, t.j. oboustranné totální tyreoidektomie (TTE). Rozpracováním nových operačních technik TTE včetně krčních a mediastinálních lymfadenoektomií, se zvýšil počet radikálních výkonů, nicméně nebývají vždy zcela úplné. Pouze u 5% všech deklarovaných TTE bývá skutečně negativní scintigrafický nález. Mnozí chirurgové se obávají radikálních výkonů pro množství případných komplikací především parézy n. laryngeus recurrens a uchylují se proto k výkonům méně radikálním. Většina autorů riziko paréz rekurentu v souvislosti s rozsahem výkonu u karcinomu štítné žlázy odmítá a uvádí, že u TTE nemají vyšší procento komplikací než subtotálního či téměř totálního výkonu. Je jistě nezbytné, aby operaci prováděl zkušený chirurg zaměřený na tyreoonkologii. Počet paréz rekurentu kolísá od 2.5-15% dle jednotlivých pracovišť.(4)
Za 6-8 týdnů po chirurgické léčbě navazuje na pracovišti nukleární medicíny doléčení radiojodem. Díky obvykle dobré schopnosti diferencovaného karcinomu akumulovat radiojód je provedeno radiojodové odstranění zbytkové tkáně štítné žlázy. Využívá se přitom radionuklidu 131I, což je smíšený beta a gama zářič s poločasem rozpadu 8 dnů. Obvykle se podává tyreoablační aktivita 3.7 GBq 131I, v případě průkazu lokálních či vzdálených metastáz jsou podané aktivity vyšší -kolem 7-10 GBq. Za několik dní po terapii se provádí celotělová posterapeutická scintigrafie. Asi u 10% nemocných se zobrazí patologická akumulace radionuklidu v místě nádorové tkáně, která nebyla na předchozím diagnostickém scintigramu patrná. Celá radiojodová léčba se provádí u pacientů, kteří jsou v metabolickém stavu hluboké hypotyreózy s výrazným vzestupem endogenního TSH. Jen tak je možno získat potřebnou akumulaci. Hypotyreóza je však špatně pacienty tolerována, proto se hledaly jiné možnosti, jak docílit vhodných podmínek pro podání radiojodu. V poslední době se zavádí jak do diagnostiky, tak i do terapie aplikace rekombinantního lidského TSH (rhTSH). Podstata využití rhTSH spočívá v tom, že nemocný nemusí být v měsíční hypotyreóze, přichází k radiojodové diagnostice či léčbě eutyreoidní. Po 2 injekcích rhTSH je dosaženo k výraznému vzestupu TSH, čímž jsou vytvořeny podmínky pro vychytání podaného radiojodu v normální i nádorové tyreoidální tkáni. První klinické studie byly provedeny již v r.1994 a na základě získaných poznatků z navazujících studií bylo doporučeno využít tuto metodu jednak u pacientů, kterými je dlouhodobá hypotyreóza špatně tolerována, jednak u nemocných s perzistující nádorovou tkání, kde dlouhodobá endogenní stimulace TSH je nežádoucí, vzhledem k možnosti růstové progrese nádorové tkáně. V České republice v současné době probíhá registrace preparátu Thyrogen, ale vzhledem k jeho poměrně vysoké ceně, lze předpokládat, že bude k dispozici jen v omezené míře.
Po podání radiojodu bývají obvykle za 24 hodin nasazeny tyreoidální hormony, a to v supresní dávce. Dosažení hladin TSH pod dolní hranici normy (TSH kolem 0,03 mIU/l) je léčebným záměrem.
Karcinom štítné žlázy je nádor, který nezřídka recidivuje i po řadě let. Je proto nezbytné všechny pacienty s touto diagnózou doživotně sledovat a v pravidelných intervalech u nich provádět sonografii, kontrolovat hladinu tyreoglobulinu a jednou za 5-10 let (dle TNM a histologie) provést celotělovou scintigrafii radiojodem. Kromě radiojodu lze u nemocných s málo pokročilým karcinomem provádět kontrolní izotopové vyšetření pomocí 99mTc značeného MIBI (methoxyisobutylisonitril). Toto radiofarmakum je vhodné pro vyhledávání uzlinových, popř.vzdálených metastáz. Negativní scintigrafie MIBI společně s negativní sonografií a nulovou hladinou tyreoglobulinu s vysokou spolehlivostí vylučuje recidivu nádorového onemocnění.
U medulárního karcinomu štítné žlázy, který nemá schopnost akumulovat radiojod, vycházíme z jiných diagnostických a léčebných algoritmů. Při podezření na generalizaci nádorového procesu je zobrazovací modalitou první volby scintigrafie radiojodem 123I či 131I značeným metaiodobenzylguanidinem (MIBG). V diagnostice MTC upřednostň ujeme radiojod 123, vzhledem k jeho nižší radiační zátěži a možnosti získat kvalitnější snímky. MIBG je syntetický analog norepinefrinu a guanetidinu. Vyšetření probíhá podle dvoudenního protokolu, snímky se provádějí za 4 a 24 hodin po i.v. aplikaci radiofarmaka. Senzitivita metody pro MTC je poměrně nízká, pohybuje se kolem 25-40%, nejlepších výsledků je dosahováno u nemocných s familiární formou MTC a s hyperkalcitoninémií. Scintigrafie MIBG má však výhodu, že při pozitivní akumulaci radioframaka v nádorové tkáni, je možné podat terapeutické aktivity podáním131I-MIBG (terapeutický efekt beta záření). Aplikuje se obykle 3,7-7,4 GBq. 131I-MIBG se rovněž může použít k terapii radiofarmakum dobře akumulujících neuroblastomů, feochromocytomů a karcinoidů.
MTC má asi ve 40 % receptory proti somatostatinu, což umožňuje provedení diagnostické scintigrafie 111 In pentetreoitidem (Octreoscanem). Tento analog somatostatinu se váže na receptory, zejména na subtypy 2 a 5. Je vhodný pro detekci vzdálených metastáz, uzlin v oblasti mediastina a krku. Octreoscanu se dá využít rovněž v detekci karcinoidu, zkouší se v diagnostice endokrinních orbitopatií. Z dalších radiofarmak stojí za zmínku ještě 99mTc značená alkalická dimerkaptojantarová kyselina ( DMSA). Toto vyšetření je vhodné pro pacienty s recidivami na krku a pro detekci kostních a jaterních metastáz, zejména u pacientů, kde po chirurgickém výkonu došlo k vzestupu kalcitoninémie. Bohužel žádného z těchto radiofarmak nelze využít v terapii. Léčba medulárního karcinomu tedy v prvé řadě závisí na dokonale provedeném chirurgickém výkonu. V případě nálezu uzlin na krku, jsou-li přístupné, pak je nezbytné jejich chirurgické odstranění s následným zajištěním zevní aktinoterapií. Chemoterapie, která obecně v tyreoidální onkologii má pouze omezený efekt,je zvažována v případě nálezu MIBG nekumulujících mnohočetných metastáz, které nelze již chirurgicky odstranit.
Prognóza onemocnění
Hodnocení 5ti letého přežívání nemocných s karcinomem štítné žlázy nemá takový význam jako u jiných karcinomů. U tyreoidálního karcinomu hodnotíme přežití v odstupu 20 a více let. Jsou známy pozdní recidivy, za 30 i více let, od diagnózy nádoru. Biologické chování jednotlivých forem diferencovaného karcinomu se liší. Mezi důležité prognostické faktory, které se přímo podílejí na přežití nemocných, patří věk a pohlaví nemocného, histologický typ karcinomu, jeho velikost, prorůstání mimo pouzdro tumoru, vytváření lokálních či vzdálených metastáz, jakož i schopnost provedení radikálního chirurgického výkonu na štítné žláze, popř. na uzlinách. Rovněž závisí na akumulační schopnosti tyreoidální tkáně vychytávat radiojod. Řada autorů se zabývá biologickým chováním jednotlivých variant karcinomu štítné žlázy a prognózou onemocnění a pro jeho hodnocení byla vypracována řada skórovacích systémů, kterými se snaží určit a předpovědět další pravděpodobný průběh onemocnění 8). U papilárního karcinomu jsou nejdůležitějšími prognostickými faktory: věk, pohlaví, invazivní růst mimo pouzdro ž lázy, velikost tumoru a TNM klasifikace. Nejméně agresivním se zdá papilární karcinom štítné žlázy, více folikulární, pak medulární a nejagresivnější průběh onemocnění, brzy vedoucí k smrti, je patrný u anaplastického karcinomu. Nález vzdálených plicních metastáz je závažným prognostickým ukazatelem. U nemocných se scintigrafickým průkazem plicních metastáz bez současného rtg korelátu je přežití výrazně delší, na rozdíl od nemocných již s manifestním rentgenovým nálezem. Nejhorší prognózu v přežití mají nemocní se současně přítomnými kostními metastázami.
Na tomto místě nutno vyzdvihnout význam tyreoglobulinu, a to jak v průběhu supresní léčby tyreoidálními hormony, tak jeho stanovení během hypotyreózy. Je-li dlouhodobě hladina tyreoglobulinu nízká, pak je i nízké riziko recidivy onemocnění. 40ti-leté přežití dle studie Němce a spol. je u papilárního karcinomu kolem 85%, u folikulárního kolem 46% a medulárního kolem 25%. Pokud jde o přežití nemocných s mikrokarcinomem, většina autorů se shoduje na tom, že biologická agresivita tohoto typu nádoru je velmi nízká, nevyžadující léčbu radiojódem. Jsou však známy ojedinělé případy, kdy při histologickém nálezu mikrokarcinomu byly v odstupu několika let nalezeny vzdálené kostní metastázy. To se týká i intratyreoidálního rozsevu mikrokarcinomu.(9)
Shrnutí:
Doporučený postup při sledování tyreoidálního karcinomu:
klinické vyšetření každé 3-6 měsíců v prvních dvou letech od radiojodové tyreoablace. Dále pak 1x ročně, nejsou-li známky recidivy onemocnění. Tyreoglobulin je měřen v 6 měsíčních intervalech, v případě chybění klinických známek recidivy jsou dostačující kontroly 1x ročně.
Diagnostická scintigrafie radiojodem je prováděna každý rok do dosažení po sobě 2 negativních skenů. Tyto skeny mohou být prováděny jak po vysazení hormonů, tak po podání rhTSH.
Pro podání rhTSH je doporučován následující postup: 1. a 2. den nemocný obdrží vždy 0,9 mg rhTSH, třetí den je podán radiojod, 5. den je provedena diagnostická celotělová scintigrafie radiojodem a je stanovena hladina tyreoglobulinu. Léčba radiojodem je indikována vždy v případě vyššího tyreoglobulinu či při pozitivní scintigrafii. Je-li tyreoglobulin zvýšen nad 10 ug/l a diagnostická radiojodová scinigrafie je přitom negativní, je doporučováno provést PET či MIBI vyšetření, popř podání 3,7-5,5 GBq radiojodu s provedením posterapeutické scintigrafie.
Je-li prokázána lokální recidiva na krku, je upřednostň ována resekce uzlin, stejně tak, jsou-li přítomny izolované vzdálené metastázy, je snaha je rovněž chirurgicky odstranit (např. CNS metastáza) s /nebo následnou radiojodovou léčbou, nejlépe po podání rhTSH a steroidní profylaxí. Tuto léčbu je možné doplnit o zevní aktinoterapii a podání bisfosfonátů. V případě diseminace metastáz je radiojodová léčba doplněna systémovou chemoterapií.
Pacienty s medulárním karcinomem po TTE při nízkém kalcitoninu pouze sledujeme, provádí se sonografické vyšetření, diagnostická scintigrafie MIBG, monitorování kalcitoninu a dalších nádorových markerů. Vždy se provádí genetické vyšetření k vyloučení familární formy MTC. V případě pozitivního DNA testu je nutné vyšetřit všechny pokrevné příbuzné nemocného.
Tab. 1 TNM klasifikace pro zhoubné nádory štítné žlázy
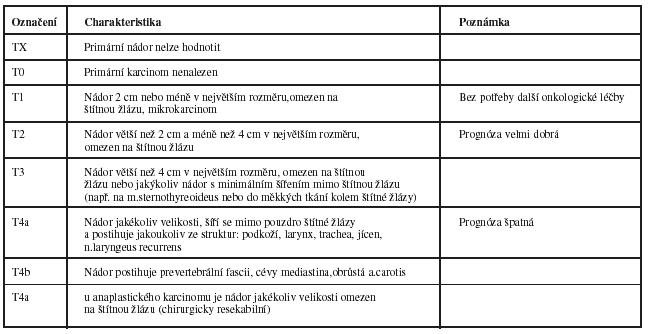
Tab. 1 TNM klasifikace pro zhoubné nádory štítné žlázy

Postupy ke stanovení kategorií T,N,M:
Klinické vyšetření a zobrazovací vyšetřovací metody, endoskopie u kategorie T.
Multifokální nádory všech histologických forem označit písmenem (m), např. T2(m).
Literatura:
Nádory štítné žlázy lze zařadit mezi vzácné choroby. Mezi všemi karcinomy mají zastoupení necelým 1%, roční incidence se pohybuje kolem 50 nových případů na 1 milión obyvatel.(5) Karcinom štítné žlázy však představuje početně nejrozsáhlejší skupinu onkologických onemocně ní v endokrinologii, kde tvoří kolem 90% všech diagnostikovaných nádorů. Mortalita se pohybuje na 100 000 obyvatel obecně nepřevyšuje 1% úmrtí na karcinom v běžné populaci. Přes svoji vzácnost patří ve věku 15 - 45 let mezi 5 nejčastějších karcinomů. Nádory štítné žlázy představují nehomogenní skupinu tumorů s širokým spektrem biologické aktivity. Může jít o nádory téměř neškodné až po velice agresivní, rychle usmrcující svého hostitele. Prognóza onemocnění závisí na mnoha faktorech, z toho vyplývá nutnost individuálního přístupu ke všem léčebným postupům. Benigní i maligní nádory štítné žlázy vycházejí z folikulárního epitelu, jsou hormálně aktivní, vyskytují se 5x častěji u žen než u mužů ve všech věkových skupinách. Většina diferencovaných forem si ponechává schopnost vychytávat jod.
Nádory z folikulárních buněk jsou ve dvou možných variantách, a to jako karcinom folikulární nebo papilární o různém stupni diferenciace. Zvlášní postavení v tyreoidální onkologii pak má medulární karcinom štítné žlázy.
Papilární karcinom (PTC) štítné žlázy představuje přibližně 44-81% tyreoidálních nádorů, zpravidla se vyskytuje ve 4. 6. dekádě věku nemocných, je však poměrně častným nálezem i u dětí a dospívajících. Tento karcinom často zakládá mikrometastázy do druhého laloku a recidivy z nich vznikají až ve 20 %. Pokročilý papilární karcinom se šíří přes pouzdro štítné žlázy do okolních struktur. V době stanovení diagnózy se extratyreoidální invaze vyskytuje v 5-35%(10). Lokální invaze papilárního karcinomu může postihovat dýchací cesty, ale také další struktury, jakož i jícen, krční cévy, nervové struktury, svaly, kůži. Lokální invaze do kůže je charakteristická pevnou fixací kůže k nádoru. U infiltrativních a méně diferencovaných forem se karcinom může projevovat jednostranným i oboustranným útlakem dýchacích cest, NLR i jícnu.Většinou však onemocnění zůstává omezeno na štítnou žlázu a projevuje se jako tumor na přední straně krku či jako lymfadenopatie. Postižení lymfatických uzlin je častější u dětí a dospívajících a nemá vztah k velikosti primárního nádoru. Častý je i multicentrický vznik papilárního karcinomu, čím je tumor větší, tím větší je pravděpodobnost lokální invazivity a častějších recidiv. Nález nádorového uzlu ve žláze s pozitivními jednostrannými regionálními lymfatickými uzlinami je velmi suspektní i z kontralaterálního uzlinového i intratyreoidálního šíření. Agresivita papilárního karcinomu je poměrně nízká, rovněž u starších pacientů je jeho průběh mírnější. Lepší prognózu mají ženy než muži.
Folikulární karcinom (FTC) je druhým nejčastějším maligním nádorem štítné žlázy. Zaujímá přibližně 15 % maligních tyreoidálních nádorů. V oblastech deficitu jódu je jeho výskyt častější , až 40 %. Typické je jeho maximum výskytu v 5. 6. dekádě věku nemocného. Jeho šíření do regionálních lymfatických uzlin je méně časté než u papilárního karcinomu, udává se v rozmezí 3-15%. Má však větší sklon k tvorbě vzdálených metastáz v plicích a kostech (15-20%), šíří se hematogenní cestou. Metastázy tohoto nádoru dobře akumulují radiojód. Jako variantu folikulárního karcinomu lze považovat inzulární karcinom, který obvykle tvoří hnízda malých folikulárních buněk, často s patrnými nekrózami s příměsí kolagenu, imunohistochemický nález je pozitivní na tyreoglobulin. Jde o vysoce agresivní typ nádoru, který sice akumuluje radiojod, ale často recidivuje a metastazuje. Onkocytární karcinom (Hürthleho karcinom, karcinom z oxyfilních buněk) je považován za variantu folikulárního karcinomu, někteří autoři jej uvádějí jako samostatnou jednotku. Je charakteristický nepředvídatelným klinickým průběhem. Může se chovat vysloveně agresivně s rychlou manifestací metastáz v kostech a plicích. Pro léčbu je značně nevýhodný, vzhledem k malé akumulaci radiojódu, a proto při jeho léčbě je kladen důraz na radikalitu chirurgických výkonů. Nádory z jasných buněk rovněž hůře akumulují radiojod.
Anaplastický karcinom (ATC) je nediferencovaný, velmi agresivní nádor s tvorbou bizardních buň ěk s několika jádry a je pro svůj vyslověně zhoubný průběh oprávněně řazen mezi nejagresivnější lidské nádory. Jeho frekvence naštěstí klesá s výjimkou míst výskytu endemických strum, vyskytuje se převážně u straších osob. Typicky se vyskytuje u nemocných s dlouhodobou anamnézou strumy, která se začala náhle progresivně zvětšovat. Karcinom se šíří jak hematogenní, tak lymfatickou cestou. V léčbě anaplastického karcinomu je metodou volby chemoterapie a zevní ozáření, jejichž kombinace zlepšila přežívání v průměru o 2 roky. Chirurgický výkon bývá indikován pouze za situace, může-li být zcela radikální, či jako vitální výkon pro zprůchodnění dýchacích cest při dušení.
Medulární karcinom (MTC) je čtvrtou základní histopatologickou formou karcinomů štítné žlázy. Vychází z parafolikárních (C buněk), jeho embryologický základ pochází z neurální lišty, a proto neakumuluje radiojód. Nádor tvoří vřetenovité či polygonální buň ky s nepravidelnou trámčinou, cytoplasma je světlá s granuly pozitivními na kalcitonin (iCT), kterého se využívá jako nádorového markeru, ve stromatu bývá přítomen amyloid (u 25% MTC chybí). Medulární karcinom tvoří kolem 8% všech nádorů štítné žlázy. Pro tento karcinom je charakteristický jak jeho sporadický výskyt (75-80 %), tak i možnost familiární formy (20-25 %). Pro familiární medulární karcinom je typický autozomálně dominantní typ dědičnosti, i když se objevují práce, které poukazují na recesivní typ přenosu vlohy. Pokud se v rodině vyskytuje pouze MTC, pak hovoříme o familiárním MTC (FMTC), pokud je s MTC asociován feochromocytom a hyperparatyreóza, jde o syndrom MEN 2A. Nejtěžší formou je syndrom MEN 2B, kdy je MTC spojen s typickým marfanoidním habitem, feochromocytomem, ganglioneuromatózou a dalšími symptomy. U těchto forem je typický multicentrický a bilaterální výskyt. Ten byl však pozorován asi u třetiny nemocných se sporadickou formou onemocnění. Na rozdíl od folikulárního či papilárního karcinomu, MTC poměrně brzy a často (až ve 25-30% případů) metastazuje do jater.Léčba obou forem MTC spočívá v úplném odstranění štítné žlázy. V případě lokálního metastzování do lymfatických uzlin je provádějí modifikované krční disekce. U recidiv medulárního karcinomu vždy v prvé řadě indikujeme reoperaci.(10) V současné době v diagnostice MTC kromě stimulačního kalcitoninového testu, máme možnost odebrat krev na genetické vyšetření. Je-li u pokrevných příbuzných prokázána zárodečná bodová mutace na RET-protoonkogenu, je vždy indikována TTE, vzhledem k vysokému riziku možného vzplanutí onemocnění. Často bývá histologický nález s obrazem hyperplázie C buněk, což z hlediska onkologického nutno považovat za prekancerózu.
S dalšími nádory, které se ve štítné žláze mohou vyskytovat, se setkáváme vzácněji. Může jít o nádory z lymfatické tkáně-lymfomy, které vznikají obvykle na bazi autoimunní thyreoidity. Primární Hodgkinský lymfom je však ve štítné žlázy naprostou raritou. Neepitelové maligní nádory jako sarkomy, či hemanigiomy se vyskytují rovněž poměrně vzácně. Jedná se o rychle rostoucí tumory, které postihují především obyvatelstvo vyšších věkových skupin a většinou ženy. Rozlišení od anaplastického karcinomu není často jednoduché. V léčbě těchto nádorů je metodou volby zevní aktinoterapie, radikální chirurgie se provádí u nálezů lokalizovaných pouze na štítnou žlázu. Lymfomy štítné žlázy mají příznivější prognózu než lymfomy jiné lokalizace.
Sekundární nádory štítné žlázy se vyskytují méně často. Metastázy nádorů do štítné žlázy vznikají přímým šířením z okolních orgánů (larynx, trachea, pharynx, oesophagus), dále retrográdním lymfatickým šířením (trachea, bronchus). Hematogenní cestou mohou do štítné žlázy metastazovat prakticky všechny nádory (např. z colon, z melanomu).
Etiopatogenéze
karcinomu štítné žlázy je značně bohatá a uplatň uje se zde i celá řada rizikových faktorů. S karcinomem se můžeme setkat asi u 10-15% nemocných, u kterých bylo v minulosti provedeno zevní ozáření. Tyto, tzv. radiogenní karcinomy (většinou jde o papilární formy) se objevují řadu let po ozáření krku (např. pro benigní lymfadenopatie, hyperplazii thymu apod). Rovněž v oblastech, kde došlo k jaderným katastrofám, je prokazatelně pozorován vyšší výskyt karcinomů, zejména u dětí a mladistvých.
Některé méně časté familiární syndromy jsou sdruženy s častějším výskytem tyreoidálních uzlů a karcinomů. Pacienti s Gardnerovým syndromem či familiární adenomatózní polypózou střev mají 100x vyšší riziko rozvoje papilárního karcinomu štítné žlázy než ostatní populace.
Byl pozorován častější výskyt karcinomu štítné žlázy u nemocných, kteří podstoupili strumektomii pro beningní onemocnění štítné žlázy, ale kde nebyla nasazena substituce tyreoidálními hormony. Udává se, že asi 1 až 7 % recidiv eufunkčních strum (po operacích před více jak pěti lety) je maligních. Tyto nádory jsou navíc typické svojí vysokou biologickou agresivitou(2).
Také byl zaznamenán vyšší záchyt karcinomů u Hashimotovy autoimunní tyreoiditis, Graves Basedowova choroby či u tyreotoxikózy (tedy u metabolicky aktivních stavů).
Obyvatelstvo oblastí s deficitem jódu bývá častěji postiženo folikulárním karcinomem. Tento fakt byl pozorován i u nás, zejména v polovině minulého století. Po zavedení jodové profylaxe došlo postupně ke změně poměru vysokého zastoupení folikulárního a anaplastického karcinomu ve prospěch méně agresivního papilárního karcinomu štítné žlázy.
Molekulární biologie, zejména v poslední dekádě, se výraznou měrou podílí na znalostech o tumorogenéze a nádorové transformaci folikulární buňky.
V polovině 80. let se podařilo u nemocných s medulárním karcinomem štítné žlázy lokalizovat pericentromerickou oblast 10. chromozomu (10q11) a byl v této oblasti identifikován RET proto-onkogen, jehož mutace jsou zodpovědné za toto onemocnění. RET proto-onkogen je tvořen 21 exony. Normální RET kóduje tyrozinkinázový receptor v buň kách vycházejících z neurální lišty a urogenitálních prekurzorových buň kách a je nezbytný pro normální vývoji jedince, v proliferaci, diferenciaci a přežívání buněk, v morfogenezi ledvin, maturaci periferního nervového systému ale i pro diferenciaci spermatogonií.
Familiární formy medulárního karcinomu štítné žlázy jsou většinou spojeny se zárodečnými bodovými substitučními mutacemi v jednom ze šesti cysteinových kodonů v extracelulární doméně RET proteinu. Jde o kodony 609, 611, 618 a 620 v 10. exonu a kodony 630 a 634 v 11. exonu. Všechny tyto varianty byly identifikovány u 95% MEN2A rodin, některé z nich u FMTC rodin. U 95% rodin s MEN 2B dochází k mutaci v kodonu 918 v 16. exonu, rovněž byly nalezeny mutace v kodonu 883 v 15. exonu. Kromě patogenních mutací jsou popisovány v RET proto-onkogenu i běžné polymorfismy, především ve 13., 14. a 15. exonu. Nejagresivnější jsou mutace v kodonu 918, 922 a 883, přítomnost mutace v kodonu 634 bývá spojována s výskytem feochromocytomu a hyperparatyreózy. Naopak mutace v kodonech 609, 618 a 620 v 10. exonu bývají spojovány s menším rizikem vzniku feochromocytomu a hyperparatyreózy. Předpokládá se, že mutacev 13., 14. a 15. exonu mají méně agresivní fenotyp než u mutací v exonech 10, 11 a 16.(6,7)
Genetický screening má význam pro rizikové osoby v presymptomatickém stavu, kdy lze včasnou intervencí značně snížit morbiditu a mortalitu. Na základě identifikovaných mutací lze rovněž odhadnout další progresi onemocnění a včasně zasáhnout.
Většina pacientů s MTC nemá familiární historii, nicméně z několika rozsáhlých studií vyplynulo, že asi u 3-20% těchto „sporadických“ forem MTC bylo způsobeno buď okultní či nově vzniklou zárodečnou bodovou mutací RET protoonkogenu. V našem souboru „sporadických“ MTC jsme zachytili u 10% rodin zárodečné, tedy na potomstvo přenosné mutace! Je proto nezbytné u všech pacientů, kdy jde o první záchyt MTC v rodině, provádět screening zárodečných mutací RET proto-onkogenu (1).
Klinický obraz
karcinomu štítné žlázy má několik typických forem. Nejběžnějším nálezem je obraz solidního, lokálně rostoucího uzlu. Diferenciální diagnóza uzlu ve štítné žláze bez výraznější růstové aktivity je věcí značně složitou. V současné době jednoznačně před prostou palpací uzlu dáváme přednost sonografickému vyšetření a cílené aspirační biopsii. Cytologické vyšetření z uzlu, v případě papilárního karcinomu, nečiní obtíže. Diagnostika folikulárního karcinomu je obtížnější i pro zkušeného cytologa. Je užitečné i v případě nesuspektního cytologického nálezu, pacienta sonograficky kontrolovat a při růstové progresi uzlu zvážit chirurgické řešení.
Dalším typickým obrazem karcinomu štítné žlázy je lokální uzlinový syndrom. Ten se manifestuje nejčastěji ve spádovém lymfatickém jugulárním řečišti laterálně od velkých cév. Uzlinový syndrom může být zachycen i v nadklíčkové oblasti či v jugulu. Nález zvětšených lymfatických uzlin na krku, často oboustranně, je pro papilární karcinom u dětí a mladistvých velmi častý. Je-li současně nalezen zvětšený lalok či uzel ve štítné žláze, pak takový nález je vysloveně suspektní z malignity. U dospělých bývá uzlin méně, jsou však tuhé a ke spodině fixované. Z nádorů štítné žlázy nejčastěji do krčních lymfatických uzlin metastazuje papilární karcinom. Současným léčebným trendem je ústup od radikálních výkonů na uzlinách a přechod k modifikovaným krčním disekcím, kdy jsou šetřeny důležité struktury (m. sternocleidomastoideus, v. jugularis interna, ansa cervicalis a n. accesorius). Výkony na lymfatických uzlinách jsou nemyslitelné bez přesného sonografického vyšetření, které dosahuje téměř 100% spolehlivosti, je-li provedeno zkušeným sonografistou.
Třetím základním klinickým obrazem karcinomu štítné žlázy je nález vzdálených metastáz. Děti s nálezem plicních metastáz papilárního karcinomu mívají většinou příznivou prognózu, plicní metastázy mají převážně miliární rozsev a velmi ochotně reagují na léčbu radiojodem. U dospělých je plicní metastatický proces charakteru malouzlových a velkouzlových metastáz, prognóza onemocnění je zde poněkud horší(10). Folikulární karcinomy metastazují typicky do kostí a jejich výskyt výrazně zhoršuje prognózu onemocnění. Často bývají diagnostikovány pozdě, prvním příznakem mohou být až patologické zlomeniny či bolesti v zádech při spinálních metastázách. Méně často byly pozorovány metastázy do mozku. Při nálezu vzdálených metastáz je nezbytné v prvé řadě provést totální tyreoidektomii s odstraněním primárního tumoru a následně se pak pokusit ovlivnit nádorový proces radiojodem. V případě nálezu solitární metastázy, je plně indikováno její chirurgické odstranění. Mnohočetné metastázy chirurgicky bohužel ovlivnit nelze.
Za zvláštní zmínku stojí nález tzv. minimálního karcinomu štítné žlázy, tzv. mikrokarcinomu. Podle současné TNM klasifikace (viz tabulka 1) z r. 2002, je termín mikrokarcinom vyhrazen pro nádor v největším rozměru do 2 cm (dříve do 1 cm), který je omezen na štítnou žlázu. Většinou není klinicky zřejmý a je objeven až při histologickém vyšetření(3). Pro splnění definice mikrokarcinomu je nutné, aby byl nádor obklopen normální tkání štítné žlázy. Nádorová invaze do pouzdra žlázy a jeho extratyreoidální šíření mění klasifikaci nádoru. U nás mikrokarcinom štítné žlázy představuje asi 15% všech nově diagnostikovaných karcinomů. Jeho prognóza bývá hodnocena jako velmi dobrá s malou biologickou aktivitou. Na léčbu mikrokarcinomu však panuje stále značná nejednostnost. Na jedné straně se soudí, že nádor ani jeho regionální lymfatické metastázy svého hostitele neohrožují, na druhé straně se uvažuje o možné lokální invazivitě, bilaterálním šíření a výskytu regionálních i vzdálených metastáz. Z toho vyplývají i rozdílné přístupy k léčbě, které vycházejí od pouhé dispenzarizace, přes totální tyreoidektomii až k výkonům na regionálních lymfatických uzlinách při jejich postižení a následné aplikaci radiojodu.Asi u 5% nemocých s mikrokarcinomem byly zachyceny lokální či vzdálené metastázy, proto obvykle doporučujeme provedení preventivní totální tyreoidektomie u všech pacientů s diagnostikovaným mirkokarcinomem.
Léčba
karcinomu štítné žlázy má komplexní interdisciplinární přístup, kdy se na jejím úspěšném průběhu podílejí kromě endokrinologů, rovněž chirurgové a specialisté v oboru nukleární medicína. Prvním krokem při léčbě karcinomu štítné žlázy je provedení radikálního chirurgickém výkonu, t.j. oboustranné totální tyreoidektomie (TTE). Rozpracováním nových operačních technik TTE včetně krčních a mediastinálních lymfadenoektomií, se zvýšil počet radikálních výkonů, nicméně nebývají vždy zcela úplné. Pouze u 5% všech deklarovaných TTE bývá skutečně negativní scintigrafický nález. Mnozí chirurgové se obávají radikálních výkonů pro množství případných komplikací především parézy n. laryngeus recurrens a uchylují se proto k výkonům méně radikálním. Většina autorů riziko paréz rekurentu v souvislosti s rozsahem výkonu u karcinomu štítné žlázy odmítá a uvádí, že u TTE nemají vyšší procento komplikací než subtotálního či téměř totálního výkonu. Je jistě nezbytné, aby operaci prováděl zkušený chirurg zaměřený na tyreoonkologii. Počet paréz rekurentu kolísá od 2.5-15% dle jednotlivých pracovišť.(4)
Za 6-8 týdnů po chirurgické léčbě navazuje na pracovišti nukleární medicíny doléčení radiojodem. Díky obvykle dobré schopnosti diferencovaného karcinomu akumulovat radiojód je provedeno radiojodové odstranění zbytkové tkáně štítné žlázy. Využívá se přitom radionuklidu 131I, což je smíšený beta a gama zářič s poločasem rozpadu 8 dnů. Obvykle se podává tyreoablační aktivita 3.7 GBq 131I, v případě průkazu lokálních či vzdálených metastáz jsou podané aktivity vyšší -kolem 7-10 GBq. Za několik dní po terapii se provádí celotělová posterapeutická scintigrafie. Asi u 10% nemocných se zobrazí patologická akumulace radionuklidu v místě nádorové tkáně, která nebyla na předchozím diagnostickém scintigramu patrná. Celá radiojodová léčba se provádí u pacientů, kteří jsou v metabolickém stavu hluboké hypotyreózy s výrazným vzestupem endogenního TSH. Jen tak je možno získat potřebnou akumulaci. Hypotyreóza je však špatně pacienty tolerována, proto se hledaly jiné možnosti, jak docílit vhodných podmínek pro podání radiojodu. V poslední době se zavádí jak do diagnostiky, tak i do terapie aplikace rekombinantního lidského TSH (rhTSH). Podstata využití rhTSH spočívá v tom, že nemocný nemusí být v měsíční hypotyreóze, přichází k radiojodové diagnostice či léčbě eutyreoidní. Po 2 injekcích rhTSH je dosaženo k výraznému vzestupu TSH, čímž jsou vytvořeny podmínky pro vychytání podaného radiojodu v normální i nádorové tyreoidální tkáni. První klinické studie byly provedeny již v r.1994 a na základě získaných poznatků z navazujících studií bylo doporučeno využít tuto metodu jednak u pacientů, kterými je dlouhodobá hypotyreóza špatně tolerována, jednak u nemocných s perzistující nádorovou tkání, kde dlouhodobá endogenní stimulace TSH je nežádoucí, vzhledem k možnosti růstové progrese nádorové tkáně. V České republice v současné době probíhá registrace preparátu Thyrogen, ale vzhledem k jeho poměrně vysoké ceně, lze předpokládat, že bude k dispozici jen v omezené míře.
Po podání radiojodu bývají obvykle za 24 hodin nasazeny tyreoidální hormony, a to v supresní dávce. Dosažení hladin TSH pod dolní hranici normy (TSH kolem 0,03 mIU/l) je léčebným záměrem.
Karcinom štítné žlázy je nádor, který nezřídka recidivuje i po řadě let. Je proto nezbytné všechny pacienty s touto diagnózou doživotně sledovat a v pravidelných intervalech u nich provádět sonografii, kontrolovat hladinu tyreoglobulinu a jednou za 5-10 let (dle TNM a histologie) provést celotělovou scintigrafii radiojodem. Kromě radiojodu lze u nemocných s málo pokročilým karcinomem provádět kontrolní izotopové vyšetření pomocí 99mTc značeného MIBI (methoxyisobutylisonitril). Toto radiofarmakum je vhodné pro vyhledávání uzlinových, popř.vzdálených metastáz. Negativní scintigrafie MIBI společně s negativní sonografií a nulovou hladinou tyreoglobulinu s vysokou spolehlivostí vylučuje recidivu nádorového onemocnění.
U medulárního karcinomu štítné žlázy, který nemá schopnost akumulovat radiojod, vycházíme z jiných diagnostických a léčebných algoritmů. Při podezření na generalizaci nádorového procesu je zobrazovací modalitou první volby scintigrafie radiojodem 123I či 131I značeným metaiodobenzylguanidinem (MIBG). V diagnostice MTC upřednostň ujeme radiojod 123, vzhledem k jeho nižší radiační zátěži a možnosti získat kvalitnější snímky. MIBG je syntetický analog norepinefrinu a guanetidinu. Vyšetření probíhá podle dvoudenního protokolu, snímky se provádějí za 4 a 24 hodin po i.v. aplikaci radiofarmaka. Senzitivita metody pro MTC je poměrně nízká, pohybuje se kolem 25-40%, nejlepších výsledků je dosahováno u nemocných s familiární formou MTC a s hyperkalcitoninémií. Scintigrafie MIBG má však výhodu, že při pozitivní akumulaci radioframaka v nádorové tkáni, je možné podat terapeutické aktivity podáním131I-MIBG (terapeutický efekt beta záření). Aplikuje se obykle 3,7-7,4 GBq. 131I-MIBG se rovněž může použít k terapii radiofarmakum dobře akumulujících neuroblastomů, feochromocytomů a karcinoidů.
MTC má asi ve 40 % receptory proti somatostatinu, což umožňuje provedení diagnostické scintigrafie 111 In pentetreoitidem (Octreoscanem). Tento analog somatostatinu se váže na receptory, zejména na subtypy 2 a 5. Je vhodný pro detekci vzdálených metastáz, uzlin v oblasti mediastina a krku. Octreoscanu se dá využít rovněž v detekci karcinoidu, zkouší se v diagnostice endokrinních orbitopatií. Z dalších radiofarmak stojí za zmínku ještě 99mTc značená alkalická dimerkaptojantarová kyselina ( DMSA). Toto vyšetření je vhodné pro pacienty s recidivami na krku a pro detekci kostních a jaterních metastáz, zejména u pacientů, kde po chirurgickém výkonu došlo k vzestupu kalcitoninémie. Bohužel žádného z těchto radiofarmak nelze využít v terapii. Léčba medulárního karcinomu tedy v prvé řadě závisí na dokonale provedeném chirurgickém výkonu. V případě nálezu uzlin na krku, jsou-li přístupné, pak je nezbytné jejich chirurgické odstranění s následným zajištěním zevní aktinoterapií. Chemoterapie, která obecně v tyreoidální onkologii má pouze omezený efekt,je zvažována v případě nálezu MIBG nekumulujících mnohočetných metastáz, které nelze již chirurgicky odstranit.
Prognóza onemocnění
Hodnocení 5ti letého přežívání nemocných s karcinomem štítné žlázy nemá takový význam jako u jiných karcinomů. U tyreoidálního karcinomu hodnotíme přežití v odstupu 20 a více let. Jsou známy pozdní recidivy, za 30 i více let, od diagnózy nádoru. Biologické chování jednotlivých forem diferencovaného karcinomu se liší. Mezi důležité prognostické faktory, které se přímo podílejí na přežití nemocných, patří věk a pohlaví nemocného, histologický typ karcinomu, jeho velikost, prorůstání mimo pouzdro tumoru, vytváření lokálních či vzdálených metastáz, jakož i schopnost provedení radikálního chirurgického výkonu na štítné žláze, popř. na uzlinách. Rovněž závisí na akumulační schopnosti tyreoidální tkáně vychytávat radiojod. Řada autorů se zabývá biologickým chováním jednotlivých variant karcinomu štítné žlázy a prognózou onemocnění a pro jeho hodnocení byla vypracována řada skórovacích systémů, kterými se snaží určit a předpovědět další pravděpodobný průběh onemocnění 8). U papilárního karcinomu jsou nejdůležitějšími prognostickými faktory: věk, pohlaví, invazivní růst mimo pouzdro ž lázy, velikost tumoru a TNM klasifikace. Nejméně agresivním se zdá papilární karcinom štítné žlázy, více folikulární, pak medulární a nejagresivnější průběh onemocnění, brzy vedoucí k smrti, je patrný u anaplastického karcinomu. Nález vzdálených plicních metastáz je závažným prognostickým ukazatelem. U nemocných se scintigrafickým průkazem plicních metastáz bez současného rtg korelátu je přežití výrazně delší, na rozdíl od nemocných již s manifestním rentgenovým nálezem. Nejhorší prognózu v přežití mají nemocní se současně přítomnými kostními metastázami.
Na tomto místě nutno vyzdvihnout význam tyreoglobulinu, a to jak v průběhu supresní léčby tyreoidálními hormony, tak jeho stanovení během hypotyreózy. Je-li dlouhodobě hladina tyreoglobulinu nízká, pak je i nízké riziko recidivy onemocnění. 40ti-leté přežití dle studie Němce a spol. je u papilárního karcinomu kolem 85%, u folikulárního kolem 46% a medulárního kolem 25%. Pokud jde o přežití nemocných s mikrokarcinomem, většina autorů se shoduje na tom, že biologická agresivita tohoto typu nádoru je velmi nízká, nevyžadující léčbu radiojódem. Jsou však známy ojedinělé případy, kdy při histologickém nálezu mikrokarcinomu byly v odstupu několika let nalezeny vzdálené kostní metastázy. To se týká i intratyreoidálního rozsevu mikrokarcinomu.(9)
Shrnutí:
Doporučený postup při sledování tyreoidálního karcinomu:
klinické vyšetření každé 3-6 měsíců v prvních dvou letech od radiojodové tyreoablace. Dále pak 1x ročně, nejsou-li známky recidivy onemocnění. Tyreoglobulin je měřen v 6 měsíčních intervalech, v případě chybění klinických známek recidivy jsou dostačující kontroly 1x ročně.
Diagnostická scintigrafie radiojodem je prováděna každý rok do dosažení po sobě 2 negativních skenů. Tyto skeny mohou být prováděny jak po vysazení hormonů, tak po podání rhTSH.
Pro podání rhTSH je doporučován následující postup: 1. a 2. den nemocný obdrží vždy 0,9 mg rhTSH, třetí den je podán radiojod, 5. den je provedena diagnostická celotělová scintigrafie radiojodem a je stanovena hladina tyreoglobulinu. Léčba radiojodem je indikována vždy v případě vyššího tyreoglobulinu či při pozitivní scintigrafii. Je-li tyreoglobulin zvýšen nad 10 ug/l a diagnostická radiojodová scinigrafie je přitom negativní, je doporučováno provést PET či MIBI vyšetření, popř podání 3,7-5,5 GBq radiojodu s provedením posterapeutické scintigrafie.
Je-li prokázána lokální recidiva na krku, je upřednostň ována resekce uzlin, stejně tak, jsou-li přítomny izolované vzdálené metastázy, je snaha je rovněž chirurgicky odstranit (např. CNS metastáza) s /nebo následnou radiojodovou léčbou, nejlépe po podání rhTSH a steroidní profylaxí. Tuto léčbu je možné doplnit o zevní aktinoterapii a podání bisfosfonátů. V případě diseminace metastáz je radiojodová léčba doplněna systémovou chemoterapií.
Pacienty s medulárním karcinomem po TTE při nízkém kalcitoninu pouze sledujeme, provádí se sonografické vyšetření, diagnostická scintigrafie MIBG, monitorování kalcitoninu a dalších nádorových markerů. Vždy se provádí genetické vyšetření k vyloučení familární formy MTC. V případě pozitivního DNA testu je nutné vyšetřit všechny pokrevné příbuzné nemocného.
Tab. 1 TNM klasifikace pro zhoubné nádory štítné žlázy

Tab. 1 TNM klasifikace pro zhoubné nádory štítné žlázy

Postupy ke stanovení kategorií T,N,M:
Klinické vyšetření a zobrazovací vyšetřovací metody, endoskopie u kategorie T.
Multifokální nádory všech histologických forem označit písmenem (m), např. T2(m).
Literatura:
- Aiello D. P., Manni A.: Thyroglobulin measurement versus
iodine-131 total-body scan for follow-up of well-differentiated
thyroid cancer. Arch Intern Med, 1990, 150, s. 437-439
- Correa P., Chen V. W.: Endocrine gland cancer. Cancer, 1995,75,
s. 338-352
- Dvořák J., Němec J., Veselý J., Neumann J., Racek P, Zeman V.:
Mikrokarcinom štítné žlázy. Prakt Lék, 1995, 75, s. 105
106
- Dvořák J., Neumann J.: Chirurgická léčba karcinomu štítné žlázy
Čas Lék čes, 1995, 134, s. 374 377
- Dvořák J.: Rakovina štítné žlázy.Libri, Praha, 1997
- Eng, C., Clayton, D., Schuffenecker, I.et al.: The relationship
between specific RET proto-oncogene mutations and disease phenotype
in multiple endocrine neoplasia type 2. International RET mutation
consortium analysis. Jama, 276, 1996, č. 19, s.
1575-1579.
- Mulligan, L.M., Marsh, D.J., Robinson, B.G.et al.:
Genotypephenotype correlation in multiple endocrine neoplasia type
2: report of the International RET Mutation Consortium. J Intern
Med, 238, 1995, č. 4, s. 343-346.
- Němec J., Zamrazil V., Dvořák J., Zeman V., Neradilová M.,
Vlček P., Chytrý P.: Survival of thyroid cancer patients in a group
of 3285 patients followed for up to 40 years. Eur J Endocrinol,
1994, 130, s. 240
- Němec J., Zamrazil V.: Karcinom štítné žlázy u dětí a
mladistvých . Čas Lék čes, 1994, 133, s. 525
- Schlumberger M, Pacini F. Thyroid Tumors. Nucleon 1999, s. 317
Datum přednesení příspěvku: 15. 10. 2005





