Konference: 2005 XXIX. Brněnské onkologické dny a XIX. Konference pro sestry a laboranty
Kategorie: Ostatní
Téma: Vitamíny a nutraceutika
Číslo abstraktu: 242
Autoři: Doc. PharmDr. Petr Babula, Ph.D.; R. Mikelová; J. Víteček; doc.Ing. René Kizek, Ph.D.; MUDr. Libor Havel; Z. Sladký
1. Úvod
Naftochinony jsou látky přírodního původu; ve většině případů se jedná o barevné pigmenty. V buňkách jsou deponovány ve vakuolách, kde jsou rozpuštěny (ve formě glykosidů). Naftochinony jako skupina sekundárních metabolitů se v přírodě vyskytují v rámci různých čeledí rostlin[2-5] a rovněž u hub a mikroorganismů (Streptomyces, Fusarium)[6]. Biosyntéza naftochinonů probíhá šesti možnými biosyntetickými cestami, některé jsou charakteristické pro určité čeledi nebo rody rostlin. Bylo zjištěno, že základním prekurzorem biosyntézy většiny naftochinonů je kyselina šikimová.
Základní přehled biosyntézy naftochinonů
Při biosyntéze naftochinonů dochází ke kondenzaci molekuly akyseliny šikimové a kyseliny -ketoglutarové za přítomnosti enzymu thiaminpyrofosfázy (schéma 1). Vzniká kyselina osukcinylbenzoová, ze které vzniká naftochinon typu juglonu nebo droseronu.
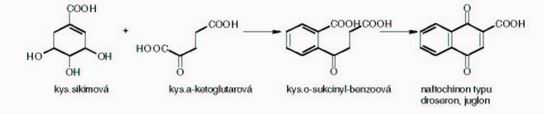
Schéma 1 Biosyntéza naftochinonů první cesta
Druhá nejrozšířenější biosyntetická cesta je rovněž zahájena reakcí kyseliny šikimové, která se fosforyluje na kyselinu 3-fosfošikimovou. Ta reaguje s kyselinou 2-fosfoenolpyrohroznovou za vzniku kyseliny chorismové, která přesmykem poskytuje kyselinu prefenovou. Sledem reakcí vznikají meziprodukty kyselina arogenová, L-tyrosin, kyselina homogentisová a toluchinol. Toluchinol kondenzuje s izoprenovou jednotkou (C5) a dává vzniku naftochinonům typu plumbaginu a methyljuglonu.
Jsou známy také specifické biosyntetické cesty vzniku naftochinonů, ty jsou však typické pro jednotlivé čeledi, případně rody rostlin (Nepenthaceae, Boraginaceae, Plumbaginaceae).
Využití naftochinonů v medicíně
Naftochinony se již dlouhou dobu používají v tradičních medicínách různých národů, a to většinou ve formě extraktů, které je obsahují. V Číně a některých dalších asijských zemích se používají rostliny rodu olověnec (Plumbago; P. zeylanica, P. rosea a P. europaea) ve formě extraktů k léčbě rakoviny, revmatoidní artritidy a bolestivé menstruace, zevně pak při léčbě otoků a zhmožděnin[10]. Ve Francii se dosud používá Plumbago europaea ke zmírnění bolestí zubů[11]. Plumbago zeylanica se v lidovém léčitelství využívá pro své diaforetické účinky[11], v Indii má používání tohoto druhu širokou tradici na různé nemoci, jako je průjem, poruchy trávení a různé kožní problémy; používání této drogy může vést k trvalé sterilitě a používá se i k vyvolání potratu[13].
Při kašli a nachlazení se používá v ČR schválený přípravek Tussilen® kapky, který obsahuje extrakt z druhu Drosera rotundifolia[20]. Jiné zdroje doporučují homeopatické zpracování Drosera rotundifolia na nemoci dýchacích cest[21]. Jsou schválená homeopatika z Drosera rotundifolia v četných lékových formách – tablety, roztok, globule, čípky, masti v několika potencích – homeopatických ředěních. V Německu se vyrábí přípravek Carnivora® – extrakt z mucholapky v lékových formách kapky a injekce – použití jako imunomodulans při malignitách, jako imunostimulans, podpůrná léčba Crohnovy nemoci a ulcerózní kolitis, není zde však schválen a registrován[23].
Experimentální část
2. Materiál a metody
Rostliny Dionaea muscipula Ell. pocházely z tkáňových kultur (Ústav přírodních léčiv, Farmaceutické fakulty, Veterinární a farmaceutické univerzity v Brně), kde byla kultivována na médiu Murasshige Skoog Medium (MS)[25] s přídavkem sacharózy (30 g/l) a aktivního uhlí. Drosera rotundifolia a Drosera spathulata pocházely z explantátových kultur PřF MU v Brně.
Chemikálie
Jako standarty čistoty p.a. byly použity naftochinony 1,4-naftochinon, juglon (5-hydroxy-1,4-naftochinon), lawson (2-hydroxy-1,4-naftochinon) a plumbagin (5-hydroxy-2-methyl-1,4-naftochinon) (Sigma-Aldrich, St. Louis, USA). Methanol pro HPLC a ostatní analytická činidla byla ACS čistoty (Sigma-Aldrich, St. Louis, USA). Standardní roztoky mnaftochinonů byly připraveny o koncentraci 100 µg.ml–1 ACS methanolu (Sigma Aldrich, St. Louis, USA) a uchovávány ve tmě mpři 4 °C. Všechny roztoky byly filtrovány přes 0,45 µm teflonové membránové filtry (MetaChem, Torrance, CA, USA) před dávkováním do HPLC systému.
HPLC analýza
HP 1100 chromatografický systém (Hewlett-Packard, Waldbronn, Germany) byl vybaven vakuovým degaserem (G1322A), kvartérní pumpou (G1311A), autosamplerem (G13113A), kolonovým termostatem (G1313A) a detektorem diodového pole (model G1315B). ChemStation software (Rev A07.01) řídí celý kapalinový chromatografický systém. Naftochinony byly separovány na chromatografické koloně Zorbax C18-AAA (150 mm x 4,6 mm, velikosti částic 3,5 µm, Agilent Technologies USA, reverzní fáze) izokratickou elucí. Mobilní fází A byla 0,1 % kyselina octová a mobilní fází B metanol (35:65%). Průtok byl 0,8 ml/min. Teplota na koloně byla nastavena na 40 °C. Spektra byla snímána v rozmezí 190-400 nm.
Příprava reálného vzorku
Části rostlin byly lyofilizovány při teplotě –51°C po dobu 48 hodin. Po té byly jednotlivé části rostlin nahrubo drceny v třecí misce a najemno zhomogenizovány pomocí mlýnku Ika A11 basic. 0,02-0,1 g biologického vzorku bylo přeneseno do 5 ml 100% methanolu a sonikováno při 38 kHz, 150 W (K5, Kraintek) za laboratorní teploty 30 minut.
3. Výsledky
Naftochinony mají pro své výrazné cytotoxické účinky nepochybně budoucnost v terapii různých onemocnění, včetně nádorových[26-29]. Je jen otázkou času, kdy budou vhodnou technologickou úpravou jejich nežádoucí účinky omezeny a naopak se zvýší jejich terapeutická účinnost, tj. terapeutický index. Proto je velmi důležité vytvořit a optimalizovat metody jejich izolace a identifikace, neboť se v rostlinách nevyskytují nikdy samostatně, ale v komplexu celé řady látek různé povahy (flavonoidy, třísloviny, organické kyseliny atd.).
Stanovení naftochinonů
Pro separaci naftochinonů (lawson, 1,4-naftochinon, juglon a plumbagin) byla vybrána kyselina octová. Byl studován vliv koncentrace kyseliny octové na průběh separace. Zjistili jsme, že koncentrace 0,1 mol.l–1 byla nejvhodnější, a to jak při změně průtoku, tak i při změně poměru mobilních fází. Retenční časy separovaných naftochinonů byly u stejných poměrů organická/vodná fáze přibližně stejné, symetrie píků však byla nízká, píky byly malé a široké.
V případě, že byly zvoleny všechny optimální podmínky separace naftochinonů (lawson, 1,4-naftochinon, juglon a plumbagin), získali jsme velmi dobře separované a symetrické píky (jak je ukázáno na Obr. 1).
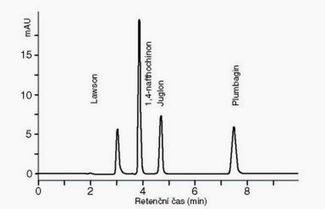
Graf 1. Chromatogram analýzy naftochinonů lawsonu, 1,4-naftochinonu, juglonu a plumbaginu
Závislost absorbance snímané pomocí detektoru s diodovým polem (DAD) při vlnové délce 254 nm na koncentraci jednotlivých naftochinonů byly ve sledovaném intervalu lineární. Relativní střední chyba (R.S.D.) se pohybovala do 2,86 % (n = 5). Limity detekce byly pro lawson 65 ng/ml, 1,4-naftochinon 50 ng/ml, juglon 75 ng/ml a plumbagin 39 ng/ml.
Určení obsahu naftochinonů vrostlinách
Po optimalizaci stanovení, byla metoda použita pro studium obsahu naftochinonů u několika rostlinných druhů. U masožravé rostliny mucholapky podivné (Dionaea muscipula; Droseraceae) byl určen obsah naftochinonů v jednotlivých rostlinných orgánech – list, kořen a květ. Zjistili jsme, že nejvíce plumbaginu obsahovaly list – 5338 µg/g. Na obsah plumbaginu byly rovněž analyzovány tři druhy rodu rosnatka (Drosera) – D. roundifolia, rostoucí i v ČR, D. spathulata a D. capensis. Na základě našich analýz byl detekován nejvyšší obsah plumbaginu v případě D. rotundifolia – 18 µg/g, dále pak u D. spathulata – 16 µg/g. Nejnižší obsah plumbaginu byl detekován v případě D. capensis – 8 µg/g. Ve všech druzích byl detekován rovněž derivát juglonu, pravděpodobně 7-methyljuglon (porovnáním spekter juglonu a ostatních naftochinonů). Nejvyšší obsah tohoto naftochinonu byl zjištěn u D. rotundifolia – 1297 µg/g. Obsah juglon-derivátu v případě D. spathulata a D. capensis byl vyrovnaný – 623 µg/g a 608 µg/g. Předpokládáme, že námi stanoveným derivátem juglonu je 7-methyljuglon. Z dostupné literatury je také patrno, že dosud nebyl potvrzen výskyt plumbaginu v případě in vitro pěstované D. rotundifolia, který se nám však podařilo detekovat. Dříve bylo popsáno, že druhy D. rotundifolia a D. capensis obsahují majoritní podíl plumbaginu. My jsme však zjistili majoritní podíl 7-methyljuglonu.
4. Závěr
Nejvyšší obsah plumbaginu byl jednoznačně detekován v listech Dionaea muscipula. I když je jeho obsah v dalších rostlinných orgánech byl nižší, stále svou koncentrací převyšuje koncentrace plumbaginu u dalších testovaných rostlin. V případě tohoto druhu nebyly další naftochinony detekovány. Překvapením je, že majoritním naftochinonem v případě D. rotundifolia a D. capensis není plumbagin, ale juglonderivát, s největší pravděpodobností 7-methyljuglon.
Literatura
- Wagner, H. Pharmaceutische Biologie. Drogen und ihre
Inhaltsstoffe (Gustav Fischer, Stuttgart, 1993).
- Zhong, S. M., Waterman, P. G. & Jeffreys, J. A. D.
Naphthoquinones and triterpenes from african Diospyros species.
Phytochem. 23, 1067-1072 (1984).
- Zakaria, M. B., Jeffreys, J. A. D., Waterman, P. G. &
Zhong, S. M. Naphthoquinones and triterpenes from some asian
Diospyros species. Phytochem. 23, 1481-1484 (1984).
- Dinda, B., Das, S. K. & Hajra, A. K. Chemical constituents
of Plumbago indica roots. Indian J. Chem. Sect. B. 37,
672-675
(1998). - Binder, R. G., E., B. M. & Flath, R. A. Eight
1,4-naphthoquinones from juglans. Phytochem. 28 (1989).
- Moore, S. B. & Hopke, N. J. Discovery of New Bacterial
Polyketide Biosynthetic Pathway. Chem. Biochem. 2, 35-38
(2001).
- Rischer, H., Hamm, A. & Bringman, G. Nepenthes insignis
uses a C2-portion of the carbon skelet of L-alanine acquired via
its carnivorous organs, to build up the alleochemical plumbagin.
Phytochem. 59, 603-609 (2002).
- Anonymous. (www.biologie.uni-hamburg.de/b-online/e20/20.htm,
2004).
- Bruneton, J. Pharmacognosy, Phytochemistry, Medicinal Plants
(England UK, Andover, 1995).
- Anonymous.
(http://bodd.cf.ac.uk/BotDermFolder/BotDermP/PLUM.html,
1999).
- Grieve, M.
(http://www.botanical.com/botanical/mgmh/p/plumba54.html,
2004).
- Satyavati, G. V., Gupta, A. K. & Tandon, N. in Indian
Council of Medicinal Research 472 (New Delhi, 1987).
- Premakumari, P., Rathinam, K. & Santhakumari, G.
Antifertility activity of plumbagin. Ind. J. Med. Res. 65, 829-838
(1977).
- Fournet, A. et al. Biological and chemical studies of Pera
benensis, a Bolivian plant used in folk medicine as a treatment of
cutaneous leishmaniasis. J. Ethnopharmacol. 32, 159-164
(1992).
- Grieve, M.
(http://www.botanical.com/botanical/mgmh/w/walnut06.html#recpre,
2004).
- Grieve, M.
(http://www.botanical.com/botanical/mgmh/b/butnut98.html,
2004).
- Czygan, F. C. Sonnentaukraut. In Teedrogen und Phytopharmakd
(Wissenschaftliche Verlagsgellschaft, Stuttgart, 1989).
- Janča, J. & Zentrich, J. Herbář – 6 díl (Eminem, Praha,
1998).
- Grieve,
M.(http://www.botanical.com/botanical/mgmh/s/sundew99.html,
2004).
- Švihovec, J., Novotná, H., Kašparová, L. & all., e.
Pharmindex brevíř (MediMedia Information, spol. s. r. o., Praha,
2002).
- Janča, J. Praktická homeopatie – cesta ke zdraví, rádce pro
celou rodinu (Praha, 1992).
- MEDI stránky – katalog pro zdravotnictví (Mediatel, Praha,
2002).
- FDA. (http://www.fda.gov/ora/fiars/ora_import_ia6663.html,
1992).
- Anonymous. (http://users.quake.net/xderlab/hp/venus.html,
1999).
- Murashige, T. & Skoog, F. Physiol. Plant 15, 473
(1962).
- Thangaraju, M., Kaufmann, S. H. & Couch, F. J. BRCA1
facilitates stress-induced apoptosis in breast and ovarian cancer
cell lines. J. Biol. Chem. 275, 33487-22496 (2000).
- Tala, R. H. & Kendall, B. W. Differential mechanismus of
cell killing by redox cycling and arylating quinones. Arch.
Toxicol. 70, 482-489 (1996).
- Babula, P., Havel, L., Strnad, M., Sladký, Z. & Kizek, R.
in XXVIII. Brněnské onkologické dny (eds. Vyzula, R. &
Žaloudík, J.) 273-277 (Masarykův onkologický ústav, Brno,
2004).
- Babula, P., Kizek, R., Havel, L., Strnad, M. & Sladký, Z.
in VIII. Pracovní setkání biochemiků a molekulárních biologů (eds.
Wimmerová, M., Beneš, P., Trnkova, L. & Zbořil, P.) 10
(Masarykova univerzita v Brně, Brno, 2004).
- Lobstein, A. et al. Quantitative Determination of
Naphthoquinones of Impatiens species. Phytochem. Anal. 12, 202-205
(2001).
- Anonymous. (http://bodd.cf.ac.uk/BotDermFolder/BotDermP/DROS.html, 1999).
Poděkování
Příspěvek vznikl za podpory IGA FaF VFU IG342012, IGA MZLU 250061/2005 a GAČR č. 525/04/P132.
Datum přednesení příspěvku: 26. 5. 2005





