Konference: 2008 XVI. Západočeské pneumoonkologické dny
Kategorie: Zhoubné nádory plic a průdušek
Téma: Konference bez tematických celků
Číslo abstraktu: 2008_08
Autoři: prof. MUDr. Jana Skřičková, CSc.; MUDr. Marcela Tomíšková; MUDr. Jana Kaplanová; MUDr. Lenka Jakubíková, Ph.D.
Úvod
Bronchogenní karcinomy dělíme podle biologického chování, podle histologického složení a podle lokalizace. Pro praxi má největší význam dělení na skupinu malobuněčných karcinomů (20–25 %) a skupinu nemalobuněčných karcinomů (přibližně 75–80 %), protože z rozdílných biologických vlastností malobuněčných a nemalobuněčných karcinomů vyplývá i rozdílný přístup k léčbě. Nemalobuněčné bronchogenní karcinomy rostou pomaleji, metastazují později, k radioterapii a protinádorové chemoterapii jsou však málo citlivé.
Hlavní roli při vzniku NSCLC nepochybně hrají faktory exogenní: biologické (viry), fyzikální (ionizující záření) a zejména chemické (karcinogeny). Epidemiologické studie nezvratně prokázaly zvýšené riziko bronchogenního karcinomu u kuřáků. Na druhé straně však je pravda, že k rozvoji plicního karcinomu může dojít i u celoživotního nekuřáka; jde o tzv. spontánní karcinom. Většinou mladých žen se objevuje specifický typ plicního karcinomu (bronchoalveolární karcinom – BAC).
Existují expozice v zevním a pracovním prostředí, které mohou riziko karcinomu zvyšovat: azbest, těžké kovy jako rtuť, nikl, chróm, arzén, nikl; chlorované uhlovodíky, polycyklické aromatické uhlovodíky, nitrozoaminy, ionizující záření (u horníků v uranových dolech je karcinom plic uznáván jako choroba z povolání) a UV záření, chronická expozice různým prachům či radonu.
Příznaky nemoci
Všechny symptomy již znamenají nemoc relativně pokročilou; neexistují časné varovné signály, které by umožnily zachycení choroby v počátečním stadiu. Jakmile se příznaky nemoci objeví, je už karcinom ve stadiu pokročilém. Pro přehlednost dělíme příznaky do tří skupin:
- Intratorakální neboli lokální plicní příznaky. Jejich výskyt závisí především na lokalizaci nádoru.
- Extratorakální neboli metastatické příznaky.
- Paraneoplastické příznaky.
Stanovení diagnózy Při objektivním vyšetření bývá fyzikální nález na hrudníku u nemocných s bronchogenním karcinomem často normální. Někdy se však můžeme setkat s oslabeným až vymizelým dýcháním, zkráceným poklepem, trubicovým dýcháním, přízvučnými chrůpky. Vymizelé dýchání a zkrácený poklep svědčí pro přítomnost pleurálního výpotku. Nálezem nepříliš vzácným jsou i pískoty a vrzoty, které mohou být slyšitelné nad jednou nebo či oběma plícemi. Cílevědomě musíme vyšetřovat i lymfatické uzliny, především nadklíčkové, za kývači a v podpažních jamkách. Na základě nálezu zvětšených jater, někdy s nerovným okrajem, můžeme usuzovat na metastatické postižení. Symptomatologie pak odpovídá rozsahu a propagaci nádoru.
Nádorová infiltrace se často zobrazuje jako zastínění buď v plicním parenchymu, nebo lokalizovaná centrálně v oblasti hilu. Zastínění nemusí být vždy homogenní a ostře ohraničené. Lze se setkat s projasněním, což svědčí pro přítomnost rozpadu. Nádor může také podmiňovat rozšíření mediastina, deviace struktur mediastina, zúžení hemitoraxu, vyšší postavení bránic i bez přítomnosti vlastní nádorové infiltrace. Obraz nádoru může být kombinován s jinými nálezy, jako je pleurální (spíše výjimečně i perikardiální) výpotek, obraz atelektázy, zánětlivá infiltrace plicní tkáně. Při hodnocení skiagramu je potřebné zhodnotit i stav zobrazeného skeletu, především žeber. „Necharakteristický“ skiagram (bez zjevné infiltrace) je vždy vhodné porovnat se starší dokumentací. Pokud je nádor menší velikosti, než je rozlišovací schopnost rentgenového přístroje, nebo při endobronchiálním růstu tumoru, nemusí být nádor zobrazen. Provedení skiagramu v bočné projekci umožňuje určit lokalizaci nádoru v jednotlivých segmentech příslušného plicního laloku, což je důležité před bronchoskopickým vyšetřením nebo před posouzením možnosti diagnostické transparietální punkce.
CT vyšetření plic a mediastina by mělo být provedeno nejen jako nativní, ale i s použitím kontrastní látky. Je důležité pro stanovení přesného rozsahu tumoru, umožňuje zjistit případné prorůstání nádoru mimo plicní tkáň do struktur mediastina, pleury či do hrudní stěny. Je nezastupitelné pro zhodnocení velikosti hilových a mediastinálních uzlin. Uzliny do velikosti 1 cm se považují za nepatologické. Pomocí CT však nelze jednoznačně prokázat uzliny infiltrované nádorovými buňkami, protože ne každé zvětšení uzlin znamená nádorovou infiltraci. Uzliny mohou být zvětšené v důsledku reaktivní hyperplazie, antrakózy či zánětu. Naopak uzliny postižené mikroskopickými metastázami nemusí být zvětšené. Modifikací je spirální CT vyšetření, které umožňuje dosáhnout přesnější trojrozměrné zobrazení.
Magnetická rezonance hrudníku (MR) umožňuje přesnější rozlišení nádorové infiltrace od měkkých tkání. Poskytuje lepší informaci o rozsahu tumoru, je-li kontraindikováno podání kontrastní látky při CT vyšetření. Toto vyšetření je vhodné k posouzení prorůstání tumoru do hrudní stěny nebo ke stanovení rozsahu nádoru lokalizovaného v plicním hrotě (Pancoastův tumor).
Pozitronová emisní tomografie (PET) využívá radionuklidů s krátkým poločasem, jejichž rozpadem se uvolňuje kladně nabitá částice – pozitron. Základním principem PET je detekce dvou anihilačních fotonů gama vzniklých ve tkáni při interakci pozitronu s elektronem. Tyto dva fotony, které vzniknou ve stejný okamžik, mají stejnou energii a emitují v opačných směrech (v úhlu 180 stupňů) do okolního prostoru a dopadnou na dva protilehlé detektory. Nejčastěji užívaným radiofarmakem je fluorovaná deoxyglukóza (18FDG). Toto radiofarmakum je po aplikaci z krve vychytáváno stejně jako glukóza metabolicky aktivními tkáněmi – v patologických tkáních je vychytáváno v lymfatických uzlinách postižených granulomatózním onemocněním, regionální reakcí při lokalizovaném infekčním procesu, k hromadění dochází i v ložiscích bronchopneumonie a abscesech. Důležitým místem akumulace 18FDG jsou maligní nádory. PET již má svoji úlohu v diagnostice a při určování rozsahu plicního tumoru, stejně tak v zjišťování jeho recidivy a progrese v rámci kontrol. Dosud spolehlivé prospektivní důkazy dokládají, že přínos tohoto vyšetření pro správné rozpoznání recidivy plicního karcinomu je významné.
Ještě modernější metodou je možnost hybridního zobrazování pozitronovou emisní tomografií v kombinaci s výpočetní tomografií (PET/CT). Možnost kombinace metabolického a anatomického morfologického obrazu tkání během jednoho vyšetření zvyšuje senzitivitu a specifiku obou metod.
Sonografické vyšetření břicha je základním vyšetřením k detekci metastáz v orgánech břišní dutiny, především jater a orgánů retroperitonea. Sonografie též poskytuje informace o parenchymu ledvin a dutém systému ledvin. CT dutiny břišní je vhodné v nejasných případech, neboť přece jen je rozlišení větší a výsledný obraz názornější. K průkazu metastatické infiltrace se v nejasných případech používá CT zobrazením vedené biopsie patologické oblasti.
Scintigrafie skeletu slouží ke stanovení kostních metastáz. Indikace záleží na typu bronchogenního karcinomu. U malobuněčného karcinomu je součástí základního stagingu. U nemalobuněčného se provádí jen u pacientů s podezřením na metastázy.
U nemalobuněčného karcinomu je CT mozku indikováno až tehdy, jsou-li přítomné klinické známky poškození mozku (závratě, nevolnost, zvracení, parézy a jiné). Novým, zatím experimentálním přístupem je vyšetřování mikrometastáz v kostní dřeni s využitím monoklonálních protilátek u těch nemocných, jimž byl radikálně resekován nemalobuněčný bronchogenní karcinom.
Je-li zvažována resekce bronchogenního karcinomu, je nutno vyloučit vzdálené metastázy na základě vyšetření uvedených výše a posoudit operabilitu dle rozsahu onemocnění v plicích. Pokud operace připadá v úvahu, tak se musí určit maximální možný rozsah resekce plicní tkáně na základě spirometrického vyšetření a analýzy krevních plynů. Na základě zjištěných výsledků stanoví odborník, jak velký resekční zákrok je možno provést.
Uvedená vyšetření se v indikovaných případech doplňují o vyšetření difuzní kapacity, případně ventilačně perfuzní scintigrafií plic. U rizikových pacientů může být k posouzení operačního a pooperačního rizika přínosné spiroergometrické vyšetření. Vyšetření srdce sonograficky nebo radioizotopovou ventrikulografií je indikováno u nemocných s kardiovaskulárním onemocněním.
Bronchoskopie umožňuje odebrání materiálu na histologické vyšetření speciálními klíštkami nebo odebrání materiálu k cytologickému hodnocení pomocí speciálního kartáčku či bronchoalveolární laváže. Makroskopicky lze zhodnotit změny v bronchiálním stromu, monitorovat průběh nemoci a provádět paliativní terapeutické zákroky. Relativně novou bronchoskopickou metodou, která je využívána k zpřesnění diagnostiky karcinomu plic, je endobronchiální ultrazvuk, pomocí kterého cíleně odebíráme materiál z lézí, které naléhají na bronchiální stěnu zvenčí. Pomocí CT navigované bronchoskopie jsme schopni pod kontrolou odebírat matriál z periferních nádorů a také punktovat relativně malé uzliny.
Autofluorescenční bronchoskopie využívá poruchy v autofluorescenci sliznice, ke které dochází během vzniku zhoubných nádorů v období, kdy nádor ještě není patrný v bílém světle. Další bronchoskopické netidy využívají i možností lepšího zobrazení cévní sítě nádoru.
Torakoskopie je metodou užívanou v diagnostice i terapii patologických procesů respiračního traktu – kromě odběru vzorků z parietální a viscerální pleury, které jsou navíc dobře přístupné vizuálnímu zhodnocení, umožňuje provést biopsii, případně resekci části plicního parenchymu a v omezené míře jsou přístupny i mediastinální struktury. Je tedy možné provést cílenou diagnostickou biopsii či kurativní resekci solitárního útvaru nebo (u diseminovaných procesů) biopsii části plicního parenchymu, případně cílený odběr z pleurálního nebo mediastinálního postižení.
Cílená transparietální biopsie se provádí pod
rentgenologickou kontrolou, s výhodou pod CT. Dříve šlo o odběry
cytologické, rozvoj instrumentária však nyní umožňuje získat
histologicky hodnotitelný vzorek. Umožňuje diagnostikovat solitární
intrapulmonální útvary či infiltráty.
Vzhledem k nízké výtěžnosti cytologického vyšetřování
sputa nyní tato metoda pozbyla na významu. Uplatnění snad
může najít u nemocných neschopných podstoupit náročnější
diagnostické výkony. V tom případě obvykle odebíráme několik (3–5)
vzorků.
Morfologická diagnostika karcinomu plic
Porucha regulace diferenciace pluripotentní kmenové buňky může vést k rozvoji epiteliální dysplazie, metaplazie, hyperplazie nebo ke vzniku maligního epiteliálního nádoru. Bronchogenní karcinom je většinou heterogenní nádor obsahující maligní buňky v různém stupni diferenciace nebo rozdílné histologické typy. Nádor se označuje jako kombinovaný karcinom tehdy, nachází-li se v nádorovém ložisku současně kombinace jednotlivých typů nemalobuněčného karcinomu, nebo elementy jak nemalobuněčného, tak malobuněčného karcinomu. Morfologická klasifi kace bronchogenního karcinomu byla vypracována v roce 1982 Světovou zdravotnickou organizací. Tato klasifi kace již byla revidována. Současná klasifi kace používaná americkým National Cancer Institute (NCI) je uvedená v následující tabulce.
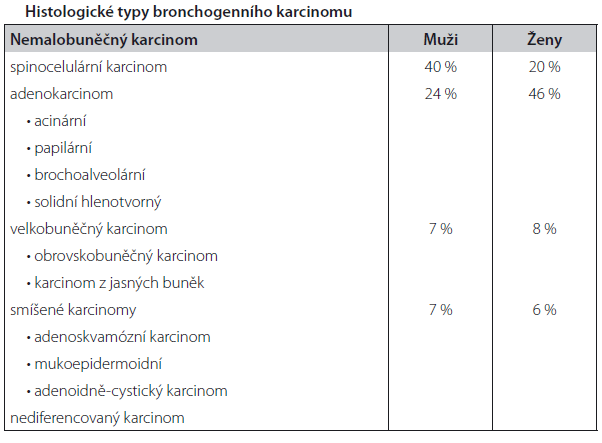
Spinocelulární karcinom představuje 30–40 % epiteliálních nádorů bronchiální sliznice. Jeho incidence v současnosti nevzrůstá. Předstupněm jeho vzniku je dlaždicobuněčná metaplazie bronchiální sliznice. V časném stadiu karcinoma in situ nevykazuje invazivní růst přes bazální membránu epitelu. Často obsahuje maligní buňky v různém stupni diferenciace, což svědčí o heterogenitě nádoru. Spinocelulární karcinom je pomalu rostoucí nádor. Odhaduje se, že stadium invazivního růstu nastává až za 3–4 roky. Dle některých studií vykazuje menší potenciál vytvářet vzdálené metastázy a má příznivější prognózu než jiné typy nemalobuněčného karcinomu, je-li v časném klinickém stadiu provedena radikální resekce tumoru. Adenokarcinom tvoří asi 40 % bronchiálních nádorů. V poslední době vykazuje vzrůstající incidenci. Častěji bývá diagnostikován i u nekuřáků a u žen.
Adenokarcinom je charakterizován přítomností glandulárních elementů nebo hlenu. Jedná se o výrazně heterogenní nádor, takže určení jednotlivých typů adenokarcinomu může být obtížné.
Bronchoalveolární karcinom (BAC) se svým biologickým chování odlišuje od ostatních typů adenokarcinomu. Jeho charakteristickým rysem je růst podél stěn plicních alveolů. Nevykazuje invazivní růst do nádorového stromatu. Z hlediska způsobu šíření se lze setkat se solitárním nádorem, multifokální přítomností plicního tumoru nebo s rychle progredující difuzní pneumonickou formou, jež často postihuje obě plíce. Rozlišuje se hlenotvorná a nehlenotvorná varianta bronchoalveolárního karcinomu. Nehlenotvorná varianta bývá obvykle spojována s příznivější prognózou. Velmi příznivá prognóza bývá u solitárního, nehlenotvorného bronchoalveolárního karcinomu, jehož průměr nepřesahuje 3 cm.
Velkobuněčný karcinom se vyskytuje v 10–15 %. Charakteristickým rysem tohoto nádorového typu je nepřítomnost diferenciace nádorových buněk ať už dlaždicového, nebo glandulárního typu. Dle WHO klasifikace se rozlišují 2 histologické varianty (obrovskobuněčný karcinom a karcinom ze světlých buněk). Některé z velkobuněčných karcinomů obsahují neurosekreční granula. Tento rys je společný i některým malobuněčným karcinomům. Prognóza velkobuněčného karcinomu se přibližuje adenokarcinomu.
Léčba nemalobuněčného karcinomu plic
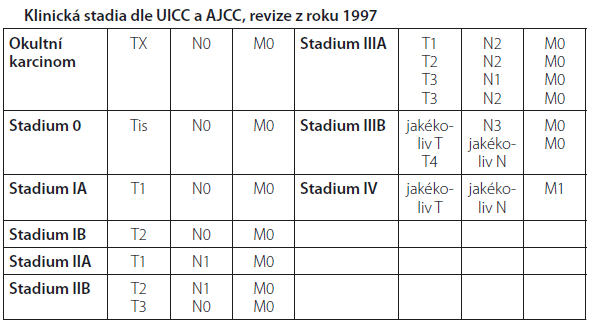
Před zahájením léčby je zapotřebí znát rozsah nádorového onemocnění, který se hodnotí dle mezinárodně platného systému TNM klasifikace a z něho odvozených klinických stadií. Klasifikace TNM, která se používá pro nemalobuněčný karcinom je uvedena v následujících tabulkách. V poslední době je diskutována její revize, ale v platnosti ještě není.
TNM klasifikace bronchogenního karcinomu dle UICC a
AJCC, revize z roku 1997
| T | |
| TX |
Primární tumor nelze hodnotit nebo byla prokázána přítomnost
maligních buněk ve sputu či bronchiálním výplachu, ale nádor nebyl prokázán zobrazovacími vyšetřeními nebo bronchoskopicky. |
| T0 | Primární tumor neprokázán. |
| T1 |
Tumor dosahující maximální velikosti 3 cm nebo méně v největším
rozměru. Tumor je obklopen plicní tkání či viscerální pleurou. Bronchoskopické šíření proximálním směrem nepřesahuje lobární bronchus (tzn. tumor se nešíří do hlavního bronchu). |
| T2 |
Tumor, který má jednu z následujících charakteristik, co se
týká velikosti či rozsahu:
|
| T3 |
Nádor jakékoliv velikosti, jenž přímým invazivním růstem
postihuje následujících struktury:
|
| T4 |
Tumor jakékoliv velikosti, který prorůstá do následujících
struktur:
přítomný maligní pleurální výpotek. |
| N | |
| NX | Postižení regionálních uzlin nelze nestanovit. |
| N0 | Bez přítomnosti metastáz v regionálních uzlinách. |
| N1 |
Metastázy v ipsilaterálních peribronchiálních a/nebo
ipsilaterálních hilových uzlinách a intrapulmonálních uzlinách včetně postižení přímým prorůstáním prim. tumoru. |
| N2 | Metastázy ipsilaterálních mediastinálních a/nebo subkarinních lymfatických uzlin. |
| N3 |
Metastázy kontralaterálních mediastinálních a/nebo hilových
uzlin. Metastázy ipsilaterálních nebo kontralaterálních skalenových nebo supraklavikulárních lymfatických uzlin. |
| M | |
| MX | Vzdálené metastázy nelze prokázat. |
| M0 | Vzdálené metastázy nejsou přítomny. |
| M1 | Vzdálené metastázy jsou přítomny. |
Léčba stadia II, T1-2 N0-1 M0
Kurativní léčbou je chirurgická resekce. Za radikální zákrok je nutno považovat resekci alespoň v rozsahu anatomické lobektomie. Klínovitou resekci (segmentektomii) lze použít v případě kontraindikací rozsáhlejšího operačního výkonu. U nemocných po segmentektomii byla prokázaná vyšší incidence lokálních recidiv. Kratší přežití bylo zaznamenáno jen u nádorů > 3 cm (T2).
Radioterapie s kurativním záměrem je indikována u nemocných s kontraindikacemi k resekci plicního nádoru. Celková aplikovaná dávka by měla činit alespoň 60 Gy při konveční frakcionaci. U pacientů s nádory T1 N0 bylo v klinických studiích zaznamenáno 5leté přežití 32–60 %. U pacientů s resekovanými nádory stadia I/II bylo metaanalýzou randomizovaných studií zjištěno snížení 2letého přežití o 7 % (55 % vs 48 %), pokud byla léčba doplněna o adjuvantní radioterapii. Adjuvantní radioterapie dle randomizované studie u pacientů ve stadiích II nebo IIIA vedla ke snížení četnosti lokálních recidiv, ale ne k prodloužení přežití. S ohledem na dosud dostupné důkazy není adjuvantní radioterapie u pacientů po resekci nádoru ve stadiu I / II indikována.
Léčba lokálně pokročilého, operabilního onemocnění (T3-4 N0-1 M0)
T3 N0-1 M0 – apikálně lokalizovaný (Pancoastův tumor)
Onemocnění vykazuje menší tendenci k systémovému metastázování.
Kurativní léčba nádorů nepostihující okolní tkáně sestává buď ze
samostatné radioterapie, nebo chirurgické resekce po předchozí
radioterapii. Samostatnou resekci lze zvažovat ve speciálně
vybraných případech. U nádorů prorůstajících do okolních struktur
(T4) není většinou chirurgická resekce nádoru přínosná. Onemocnění
je léčeno radioterapií a chemoterapií. U vybraných nemocných lze
zvažovat konkomitantní chemoradioterapii s následnou resekcí
reziduálního onemocnění.
Léčba stadia T3-4 N0-1 M0
U indikovaných nemocných je možné zvažovat radikální resekci primárního tumoru. Za potenciálně resekabilní lze považovat následující rozsah onemocnění:
- satelitní tumor ve stejném laloku (při N0 nebo N1)
- postižení kariny, srdeční síně, velkých cév
- prorůstání do hrudní stěny
- prorůstání do obratle
- prorůstání do bránice
Operace se obvykle indikuje až po pečlivém individuálním zvážením rozsahu nádoru a klinického stavu nemocného. Chirurgickou léčbu je vhodné doplnit o chemoterapii* nebo radioterapii Vzájemné časování (konkomitantní, sekvenční) doplňující chemoterapie a radioterapie je individuální. U nemocných nevhodných k chirurgické operaci je indikována léčba chemoterapií a radioterapií. Používá se stejných chemoterapeutických režimů jako u stadia IV. Chemoterapie by měla obsahovat platinový derivát. Kombinace chemoterapie a radioterapie vede k delšímu přežití ve srovnání se samostatnou radioterapií.
Léčba stadia IIIA – N2 M0
Léčba závisí na rozsahu postižení mediastinálních uzlin N2. Je možné rozlišovat tyto stupně postižení N2 uzlin
- minimální N2 onemocnění
- mikroskopické metastatické postižení pouze v 1 etáži lymfatických uzlin ověřené histologickým vyšetřením. Obvykle nelze prokázat zobrazovacími vyšetřeními před operačním zákrokem.
- klinické N2 onemocnění
- mediastinální lymfadenopatie prokazatelná zobrazovacími vyšetřeními (CT, NMR, PET)
- „bulky“ N2 onemocnění
- masivní metastatické postižení mediastinálních uzlin zřetelné na RTG hrudníku.
Minimální N2 postižení uzlin bývá většinou diagnostikováno histologicky v resekátu. Operace může být následně doplněna radioterapií, která snižuje četnost lokálních recidiv, ale neprodlužuje celkové přežití. Zatím nejsou k dispozici důkazy o přínosu adjuvantní chemoterapie, která by měla být indikována v rámci klinických studií.
Dlouhodobé přežití resekovaných nemocných s N2 onemocněním je nízké. Pětileté přežití všech resekovaných nemocných s N2 postižením se udává v rozmezí 2–5 %. V případě resekovaných nemocných s minimálním N2 postižením činí 5leté přežití 15–30 %. U potenciálně operabilních pacientů bává zvažována neoadjuvantní chemoterapie s platinovým derivátem, i když výsledky studií nejsou jednoznačné. Adjuvantní radioterapie snižuje četnost výskytu lokálních recidiv, ale nebylo prokázáno prodloužení celkového přežití. U operabilních nemocných v dobrém klinickém stavu je možné aplikovat konkomitantní chemoradioterapii před operací tumoru. Při kombinované neoadjuvantní léčbě lze očekávat lepší léčebnou odpověď, ale současně i závažnější toxicitu. Příznivý efekt neoadjuvantní léčby na přežití a čas do progrese lze očekávat jen tehdy, jestliže došlo k jednoznačnému ponížení klinického stadia primárního nádoru a uzlin.
U neradikálně resekovaných nemocných (mikroskopické nebo
makroskopické reziduum – R1, R2) je vhodná lokální radioterapie
nebo chemoterapie, pokud tato již nebyla podána před vlastní
operací.
Masivní „bulky“ postižení N2 uzlin nebo postižení N3 uzlin je
považováno za inoperabilní onemocnění. Léčebný postup je shodný
jako ve stadiu IIIB.
Adjuvantní chemoterapie po radikální resekci primárního tumoru
Až do roku 2004 nebyly k dispozici dostatečné důkazy z randomizovaných klinických studií, které by prokazovaly příznivý vliv adjuvantně podávané chemoterapie. V roce 2004 byly publikovány výsledky několika randomizovaných studií fáze 3, které prokázaly zlepšení přežití a času do relapsu nemoci u pacientů léčených adjuvantní chemoterapií. Ve 2 studiích (JBR.10, CALGB 9633) byli randomizováni pacienti v klinických stadiích 1B a 2. Zde byla použita kombinovaná chemoterapie ve složení cisplatina a vinorelbin nebo karboplatina a paklitaxel. Ve studii IALT byli randomizováni pacienti po radikální resekci tumoru ve stadiích 1, 2 a 3. Pacienti byli léčeni cisplatinou v kombinaci s vinorelbinem, vinblastinem, vindesinem nebo etoposidem. Přestože adjuvantní chemoterapie zatím není obecně uznávána jako standardní postup, nově publikované randomizované studie fáze 3 prokázaly statisticky významné prodloužení času do relapsu a celkového přežití u pacientů léčených adjuvantní chemoterapií.
Léčba stadia IIIB, jakékoliv T N3 M0, T4 jakékoliv N M0
Ve stadiu IIIB nebyl prokázán přínos resekce tumoru ve vztahu k celkovému přežití. Pouze ve výjimečných případech lze zvažovat resekci nádoru, pokud se jedná o T4 N0-1 M0 (viz výše). Kombinovaná chemoterapie s následnou (nebo konkomitantní) radioterapií vede k delšímu přežití ve srovnání se samotnou radioterapií. Samotná radioterapie by měla být vyhrazena těm nemocným, u nichž není chemoterapie vhodná. Nemocní s maligním pleurálním výpotkem nejsou obvykle vhodní k léčbě radioterapií, pokud výpotek během chemoterapie neustoupil nebo se nezmírnilo jeho doplňování. U těchto pacientů platí stejné zásady pro léčbu chemoterapií jako ve stadiu IV.
Léčba klinického stadia IV
Kombinovaná chemoterapie obsahující cisplatinu nebo karboplatinu vede k mírnému prodloužení přežití a lepší kontrole symptomů nemoci ve srovnání se symptomatickou léčbou. Chemoterapie je přínosem jen u nemocných v dobrém klinickém stavu, bez výrazného váhového úbytku (< 10 % původní hmotnosti). Za standardní režim je považována dvojkombinace platinového derivátu (cisplatiny nebo karboplatiny) s jedním z následujících cytostatik:
- docetaxel
- gemcitabin
- paklitaxel
- vinorelbin
Účinnost jednotlivých režimů s cisplatinou nebo karboplatinou byla studována v různých randomizovaných studiích fáze III. Jejich účinnost je vzájemně srovnatelná. Monoterapii je vhodné zvažovat u pacientů s kontraindikacemi k podání karboplatiny nebo cisplatiny a také u starších nemocných (70–75 let věku). V monoterapii jsou používána stejná cytostatika jako v kombinaci s platinovými deriváty.
Chemoterapie 2. linie (2. řady)
Chemoterapie 2. linie u nemocných v dobrém klinickém stavu zlepšuje symptomatickou kontrolu onemocnění. V randomizovaných klinických studiích bylo ve srovnání s podpůrnou léčbou prokázáno delší přežití. V současné době se jako nejvhodnější preparáty jeví docetaxel, pemetrexed. Jsou k dispozici výsledky randomizovaných studií fáze 3 hodnotící přínos chemoterapie ve 2. linii. Ve studiích byl srovnáván docetaxel oproti vinorelbinu, ifosfamidu nebo symptomatické léčbě (best supportive care). Docetaxel v dávce 75 mg/m2 v 3týdenním podání vykázal 1leté přežití 32–37 %, objektivní léčebná odpověď byla zaznamenána u 6–7 % léčených pacientů. U pacientů léčených vinorelbinem, ifosfamidem nebo u nemocných se symptomatickou léčbou bylo zaznamenáno 1leté přežití 19–21 %. Nové cytostatikum pemetrexed (Alimta) bylo testováno ve 2. linii léčby nemalobuněčného bronchogenního karcinomu. V randomizované studii fáze 3 byl srovnáván pemetrexed a docetaxel ve 2. linii léčby nemalobuněčného bronchogenního karcinomu. U obou skupin byla zjištěna srovnatelná léčebná odpověď (9,1 % u pemetrexedu a 8,8 % u docetaxelu) a taktéž srovnatelný medián přežití (8,3 měsíce pro pemetrexed a 7,9 měsíců pro docetaxel). Pemetrexed vykázal příznivější profil toxicity. Na základě této randomizované studie je pemetrexed (Alimta) společně s docetaxelem vhodným lékem ve 2. linii.
Doba trvání chemoterapie
U pacientů s lokoregionálně pokročilým onemocněním, kde se používá chemoterapie a radioterapie v jakémkoliv časování, by nemělo být podáno více než 4 cykly chemoterapie. U nemocných s pokročilým onemocněním, kde není součástí léčebného plánu radioterapie, by nemělo být podáno více než 6 cyklů chemoterapie.
Biologická léčba nemalobuněčného karcinomu plic
Preparáty biologické léčby působí na nádorové buňky jiným mechanismem než standardní chemoterapie. Ukazuje se totiž, že v chemoterapii již bylo dosaženo maximum a žádná nová cytostatika ani nové kombinace již nepřispějí k významnému zlepšení léčebného efektu a přežívání nemocných. Biologická léčba se někdy nazývá také jako tzv. cílená molekulární terapie, protože lépe vyjadřuje skutečnost, že zasahuje selektivněji do intracelulárních pochodů v nádorové buňce.
Většinou se jedná o nízkomolekulární látky, které vazbou např. na receptory pro epiteliální růstový faktor (EGFR), jež jsou ve vysokém procentu exprimovány na povrchu nádorových buněk, blokují signální dráhy do buněčného jádra. Ty ve svém důsledku ovlivňují vlastnosti buňky, které ji činí maligní, jako jsou:
- inhibice apoptózy (u nádorové buňky nedochází ke kontrolované buněčné smrti tak jako u fyziologické buňky)
- schopnost novotvorby cév a vlastního zásobování nádoru živinami,
- nekontrolovaná proliferace nádorové buňky
- schopnost nádorové buňky metastazovat.
V léčbě pokročilého NSCLC byly z této skupiny zkoušeny inhibitory tyrozinkinázy – erlotinib a gefitinib. Zdá se však, že prospěch z této léčby mají jen určití nemocní, u nichž na povrchu nádorové buňky je nejen tento receptor pro epiteliální růstový faktor exprimován ve vysokém procentu, ale navíc je nositelem určitých mutací. V klinických studiích byly nalezeny čtyři klinické faktory, které predikují léčebnou odpověď. Je to asiatská rasa, ženské pohlaví, nekuřáctví a histologický typ – adenokarcinom. Jednoznačné prediktivní faktory pro léčebnou odpověď jsou však stále ve fázi usilovného výzkumu. Na základě výsledku randomizované studie s placebem je v naší republice kategorizován pro II. A III. linii léčby NSCLC erlotinib (Tarceva). Je indikován u nemocných v dobrém klinickém stavu (PS 0,1) s pokročilým nemalobuněčným bronchogenním karcinomem po selhání první nebo druhé linie chemoterapie. Současně je vhodné, aby nemocný splňoval aspoň dva z výše uvedených předpokládaných prediktivních faktorů. Jedná se o léčbu perorální, která je především staršími nemocnými velmi dobře tolerována ve srovnání s konvenční chemoterapií. Byla dokumentována i účinnost erlotinibu u nemocných s mozkovými metastázami.
Dalším biologickým preparátem nadějným v léčbě NSCLC je protilátka, která blokuje receptor vaskulárního endoteliálního růstového faktoru VEGFR. Jedná se o bevacizumab (Avastin). Jeho zvýšená exprese je považována za negativní prognostický faktor, který zhoršuje přežívání nemocných s NSCLC. V klinických studiích byly prokázány slibné léčebné výsledky v kombinaci s konvenční chemoterapií u nemocných s pokročilým nedlaždicobuněčným NSCLC již v první linii po stanovení diagnózy. Tato léčba však není doporučována u nemocných s metastatickým postižením mozku.
Prognóza nemocných s NSCLC
Nejlepší prognózu mají ti nemocní, u nichž byl nádor diagnostikován v operabilním stadiu a provedena úspěšná resekce plicního tumoru. Podíl radikálně operovaných nemocných ze skupiny všech pacientů s nemalobuněčným bronchogenním karcinomem je poměrně nízký a v jednotlivých regionech České republiky může být odlišný. V celé České republice nepřesahuje 20 %. Dle zahraničních údajů podíl operovaných činí 25–30 %. U menšiny radikálně operovaných pacientů je prognóza závislá na TNM klasifikaci. Nejlepší prognózy dosahují nemocní, jejichž nádor byl klasifikován jako T1 N0, u nichž bývá zaznamenáno 5leté přežití větší než 60 %. I v případě, že je provedena radikální resekce nádoru a postižených uzlin, u většiny nemocných dochází k recidivě (lokální nebo vzdálené) do 2 let. Prognóza u pacientů s neoperabilním lokoregionálně pokročilým onemocněním či generalizovaným onemocněním je i přes aplikovanou léčbu špatná. Medián přežití těchto nemocných obvykle nepřesahuje 18–24 měsíců, jedná-li se o místně pokročilý nádor, a 12–18 měsíců, byl-li v době stanovení diagnózy plicní nádor již diseminovaný .
Literatura:
- Ginsberg RJ. Lung Cancer. BC Decker Hamilton, London, 2002: 175
- Zatloukal P, Petruželka L. Karcinom plic. Grada, Praha, 2001: 367.s
- Pešek M. et al. Bronchogenní karcinom. Galén, Praha, 2002: 235.
- Goldstraw P. Crowley J, Chanski K. et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Griupings in the Forthcoming (Seventh) Edition of the TNM Classification of Malignant Tumours. J Thorac Oncol. 2007; 2: 706–714
- Martins SJ, Pereira JR. Clinical Factors and Prognosis in Non-Small Cell Lung Cancer. Am J Clin Oncol 22; 1999: 453–457.
- Kolek, V., Grygárková, I., Hajdúch, M. et al. Neoadjuvantní chemoterapie u hraničně operabilních stádií IIIA nemalobuněčného karcinomu plic kombinací vinorelbin a karboplatina. Následná cílená adjuvantní chemoterapie. Klinická onkologie 2001; 14: 55–58.
- Le Chevalier T, Scagliotti G, Natale R et al. Efficacy of gemcitabine plus platinum chemotherapy compared with other platinum containing regimens in advanced non-small cell lung cancer: a metaanalysis of survival outcomes. Lung Cancer 2005; 47:69–80
- Sirohi B, Ashley S, Bortin A. et al. Early Response to Platinum – Based First – Line Chemotherapy in Non-Small Cell Lung Cancer May Predict Survival. J thorac Oncol. 2007; 2:735–740
- Pfister DG, Johnson DH, Azzoli CG, Sause W, Smith TJ, Baker S, Olak J, Stover D, Strawn JR, Turrisi AT, Somerfield MR. American Society of Clinical Oncology treatment of unresectable non-small cell lung cancer guideline: update 2003. J Clin Oncol 2004; 22:330–63
- Altuang O, Stewart D, Fossella F Vet al. Many Patients over 80 Years and Older with Advanced Non-small Cell Lung Cancer (NSCLC) Can Tolerate Chemotherapy. J Thorac Oncol. 2007; 2: 141-146
- Molina JR, Dusi AA, Jett JR. Advances in Chemotherapy of Non-small Cell Lung Cancer. CHEST 2006; 130:1211–1219
- Hanna NH, Shepherd FA., Rosell R. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22:1589–97
- Bonomi P. Clinical studies with non-iressa EGFR tyrosine kinase inhibitors. Lung Cancer 2003; 41: S43–S48
- Shepherd FA, Pereira JR, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer. N Engl J Med 2005; 353:123–32
- Lynch TJ, Bell DW, Sordella R et al. Activating Mutations in the Epidermal Growth Factor Receptor Underlying Responsiveness of Non-Small-Cell Lung Cancer to Gefitinib. N Engl J Med 2004; 350: 2129–2139.
Datum přednesení příspěvku: 13. 11. 2008





