Konference: 2009 XVI. Jihočeské onkologické dny
Kategorie: Radioterapie
Téma: Radioterapie
Číslo abstraktu: 029
Autoři: prof. MUDr. Jiří Petera, Ph.D.; Ing. Petr Paluska; Ing. Linda Kašaová, Ph.D.; MUDr. Veronika Molnárová; doc. MUDr. Milan Vošmik, Ph.D.
Využití CT k plánování radioterapie a tvarování svazku záření vykrývacími bloky a později mnoholistovým kolimátorem umožnily zrod třídimensionální konformní radioterapie, při níž oblast vysokých dávek záření kopíruje nádor s bezpečnostním lemem. Bylo opuštěno profylaktické ozařování makroskopicky nepostižených uzlinových oblastí, neboť pouze zvyšovalo objem ozářených zdravých tkání a problémem nebyly recidivy onemocnění v oblastech s možným mikroskopickým postižením, ale zcela nedostatečná lokální kontrola makroskopického tumoru. Studie publikované na počátku nového tisíciletí prokázaly možnost eskalace dávky se snížením rizika radiační pneumonitidy a zlepšením přežití při ozařování pouze makroskopického tumoru zobrazeného na CT (involved field radiotherapy - IFRT)(3,4).
Významné zlepšení výsledků radioterapie přinesla kombinace s chemoterapií. Konkomitantní chemoradioterapie založená na platinových derivátech a trojdimensionálních technikách je v současné době novým standardem radikální radioterapie plicních nádorů(5). Výsledky však zdaleka nejsou uspokojivé. K selhání léčby dochází u 80% pacientů, na čemž se shodně podílejí lokální recidivy, vzdálené metastázy a jejich kombinace.
Snížení rizika vzdálených metastáz vyžaduje zdokonalení systémové léčby. Zlepšení lokální kontroly lze dosáhnout dávkovou eskalací, použitím alternativních frakcionačních režimů (ozařování 2-3krát denně) či konkomitantní chemoradioterapií. Limitujícím faktorem ve všech případech je však zvýšená toxicita léčby. Proto zásadním krokem je redukce toxicity radioterapie.
Redukce toxicity radioterapie lze dosáhnout zpřesněním určení cílového objemu (PET-CT), zpřesněním ozáření cílového objemu (trojdimensionální radioterapie, radioterapie s modulovanou intenzitou, extrakraniální stereotaktická radioterapie) a redukcí lemů nutných ke kompenzaci respirační pohyblivosti cílového objemu.
Při plánování radioterapie se rozlišují tři cílové objemy. Gross tumor volume (GTV) zaujímá primární tumor a makroskopicky postižené lymfatické uzliny. Clinical tumor volume (CTV) zahrnuje GTV a lem pro mikroskopickou nádorovou invazi. Studie provedené na histologických preparátech operovaných pacientů prokazují, že tento lem by měl být 8 mm u adenokarcinomů, 6 mm u spinocelulárních karcinomů, 3 mm pro lymfatické uzliny menší než 20 mm a 8 mm pro uzliny větší než 20 mm. Planning target volume (PTV) zaujímá CTV a lem pro pohyb struktury a pro nejistotu nastavení ozařovacích polí.
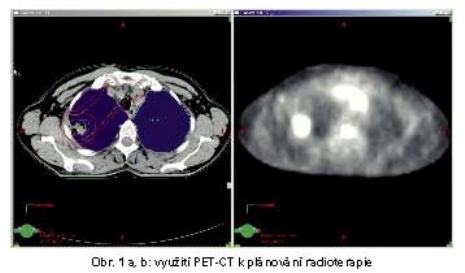
Pro určení GTV je velkým přínosem u NSCLC využití PET-CT. PET-CT zpřesňuje i stanovení stadia, u 20% pacientů detekcí vzdálených metastáz posunuje klasifikaci do stadia IV. Je signifikantně přesnější pro průkaz metastaticky postižených uzlin v mediastinu než CT. Senzitivita PET v porovnání s CT je 0,79 vs 0,60 a specificita je 0,91 vs 0,77. PET-CT umožňuje redukci GTV u 15-30% pacientů a naopak brání opominutí postižených mediastinálních uzlin u 10-25% pacientů (obr. 1). Výrazně snižuje variabilitu zakreslení GTV různými lékaři.
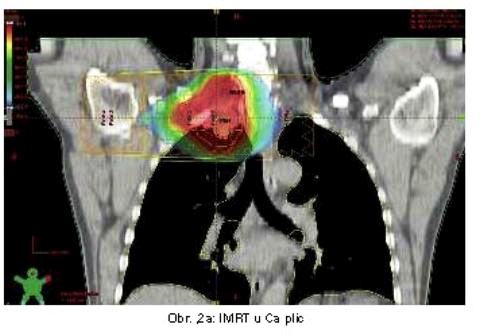
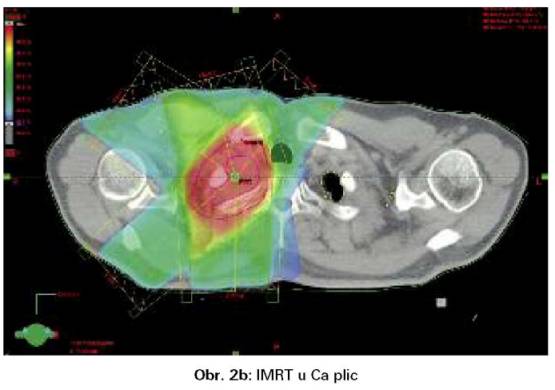
Významným zlepšením přesnosti ozáření se stala radioterapie s modulovanou intenzitou (IMRT). IMRT rozkládá svazek záření na jednotlivé paprsky s proměnlivou intenzitou. Výsledkem je programové kolísání fluence záření napříč ozařovacím polem a zpřesnění ozáření i velmi nepravidelných cílových objemů. IMRT může zlepšit pokrytí cílového objemu a redukovat dávku na plíce (obr. 2a,b). Indikací jsou zejména nádory v těsné blízkosti jícnu a míchy (6,7).
Největší problém při radioterapii plicních nádorů představuje jejich respirační pohyb. Aby nedošlo k minutí nádoru v různých fázích respiračního cyklu, je nutné ozařovat nejen nádor, ale celou oblast, ve které se při dýchání pohybuje. Tak se zároveň ozáří velký objem zdravé plíce a je nutné redukovat dávku záření. Řešení přináší čtyřdimensionální radioterapie, která vnáší do procesu radioterapie časový faktor. Nejjednodušší možností je kontrolované dýchání (respiratory control). Pacient je instruován, aby zadržel dech v inspiriu či expiriu a v této fázi se provede ozáření. Tato metoda je náročná na spolupráci pacienta a protože řada pacientů má dechové obtíže způsobené tumorem, tak je poměrně málo spolehlivá. Nejrozšířenějším způsobem je tzv. gating. Pacient může dýchat normálně a ozáření se provede jen v určitém sektoru respiračního cyklu (window). Technologicky nejnáročnější je tracking, kdy ozařovací paprsky sledují respirační pohyb tumoru.
Největšímu zájmu se těší gating. Řešení, které přináší firma Varian, je založeno na infračervené kameře, která snímá reflexní marker umístěny na hrudníku nebo břichu pacienta. Snímání respiračních exkurzí v průběhu CT vyšetření umožňuje synchronizaci CT snímků do fází respiračního cyklu. Při prospektivním gatingu je sektor respiračního cyklu (window), ve kterém bude probíhat ozáření, určeno před získáním CT snímků. CT snímky jsou provedeny pouze v rozmezí window. Limitujícím faktorem je dlouhá doba získávání CT dat. Při retrospektivním gatingu jsou CT data získávána v každé pozici stolu po dobu trvání minimálně jednoho respiračního cyklu. Každý CT snímek je přidělen do specifické fáze respiračního cyklu (bin). Výsledkem je zpravidla 10 CT binů, z nichž každý odpovídá 10% respiračního cyklu. Provedení 4D CT hrudníku trvá asi 90s. Lze tak dosáhnout signifikantní redukce PTV, velikosti ozařovacích polí a objemu ozářené zdravé plicní tkáně.
K preciznímu ozáření periferních plicních nádorů T1 a T2 se používá extrakraniální stereotaktická radioterapie s i bez použití stereotaktického rámu. Principem metody je použití mnohočetných ozařovacích polí k dosažení strmých dávkových gradientů, precizní lokalizace (IGRT) a vysoké dávky na jednotlivé frakce. Tento přístup dovoluje aplikaci dávek s vysokou biologickou účinností do cílového objemu s minimalizací vedlejších účinků, což má naději na zlepšení lokální kontroly a přežití. Obvyklé užívané dávky jsou 7x10 Gy, 3x20 Gy, 2x 24 Gy. Jako zdroje záření se užívají lineární urychlovače vybavené pro IGRT, tomoterapie či cyberknife. Publikované studie udávají lokální kontrolu 70%-100% u nádorů stadia I - II (8, 9,10).
Závěr:
Moderní technologie radiační onkologie jsou
příslibem zlepšení výsledků léčby nemalobuněčného karcinomu plic. K
jejich uvádění do širší klinické praxe je nutné přistupovat s
opatrností, protože mají vysoké nároky jak na radiologické fyziky a
dokonalé propracování metody, tak na radiační onkology a určení
nároky jak na radiologické fyziky a dokonalé propracování metody,
tak na radiační onkology a určení cílových objemů a dávkových
limitů.
Literatura:
- Perez C, Stanley K, Rubin P, et al.: A prospective randomized
study of various irradiation doses and fractionation schedules in
the treatment of inoperable non-oat-cell carcinoma of the lung.
Preliminary report by the Radiation Therapy Oncology Group. Cancer
1980, 45, 2744 – 2753
- Arrigada R, Le Chevalier T, Quoix E, et al.: Effect of
chemotherapy on locally advanced non-small cell lung carcinoma: a
randomized study of 353 patients. Int J Radiat Oncol Biol Phys
1991, 20, 1183–1189
- Yuan S, Yu J, Sun X et al.: Three dimensional conformal
involved-field RT for stage III NSCLC. J Clin Oncol 2006, 24(18
suppl), 375
- Senan S., De Ruysscher D, Giraud P et al.: Literature based
recommendations for treatment planning and execution in high-dose
radiotherapy for lung cancer. Radiother Oncol 2004, 71,
139–146
- Blackstock AW, Govindan R. Definitive chemoradiation for the
treatment of locally advanced non small-cell lung cancer. J Clin
Oncol 2007, 25, 4146–4152
- Yom SS, Liao Z, Liu HH et al.: Initial evaluation of treatment
- related pneumonitis in advanced - stage non-small-call lung
cancer patients treated with concurrent chemotherapy and
intensity-modulated radiotherapy. Int J Radiat Oncol Biol Phys
2007, 68, 94-102.
- Sura S, Gupta V, Yorke E, Jackson A, et al.:
Intensity-modulated radiation therapy (IMRT) for inoperable
non-small cel lung cancer: the Memorial Sloan-Kettering Cancer
Center (MSKCC) experience. Radiother Oncol, 2008, 87,
17-23.
- Fritz P, Kraus HJ, Mhlnickel W, et al.: Stereotactic,
single-dose radiotherapy of stage I non-small-cell lung cancer and
lung metastases. Radiat Oncol 2006, 1. 30.
- Nagata Y, Takayam K, Matsuo Y et al.: Clinical outcomes of a
phase I/II study of 48 Gy of stereotactic body radiotherapy in 4
fractions for primary lung cancer using a stereotactic body frame.
Int J Radiat Oncol Biol Phys 2005, 63, 1427 - 1431.
- Uematsu M, Shioda A, Suda A, et al.: Computed tomography- guided frameless stereotactic radiotherapy for stage I non-small cell lung cancer: A 5-year experience. Int J Radiat Oncol Biol 2001, 51, 666 – 670
Datum přednesení příspěvku: 24. 10. 2009





