Konference: 2011 2. pražské mezioborové onkologické kolokvium
Kategorie: Gastrointestinální nádory
Téma: Prezentace
Číslo abstraktu: 008
Autoři: MUDr. Zdeněk Linke; Doc. MUDr. Jana Prausová, Ph.D., MBA
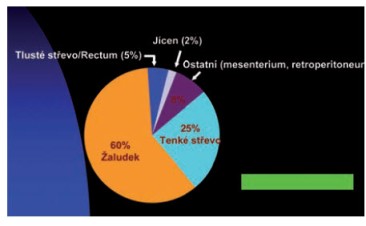
Incidence
Gastrointestinální stromální nádor není příliš častý nádor
zažívacího traktu a tvoří asi 2-5 % nádorů GITu, na druhou stranu
jeho podíl v rámci mezenchymálních nádorů GITu činí více než 70 %,
nejčastěji je lokalizován extramurálně v oblasti žaludku a tenkého
střeva, primární lokalizace v oblasti retroperitonea, omenta, rekta
a jícnu jsou vzácné.
Obrázek 1 Primární lokalizace gastrointestinálního stromálního
nádoru
Diagnostika a léčba
Nádor metastazuje zejména do jater, do měkkých částí břišní dutiny
(omentum, peritoneum), do retroperitonea, na druhou stranu
generalizace do plic a skeletu je vzácná. Jedním z diagnostických
kritérií je stanovení tyrozinkinázového receptoru c-KIT (CD117).
Dle literárních údajů je 90-97 % nádorů c-KIT (CD 117) pozitivních,
z tohoto počtu přes 80 % nádorů má detekovaný mutovaný KIT
gen.
Imatinib, malá molekula, která blokuje tyrozinkinázy (c-KIT,
BCR-ABL), osvědčil svoji výraznou účinnost v léčbě pokročilého
GISTu v celé řadě klinických studií. Zejména klinická studie fáze 2
B2222 prokázala přínos v paliativní indikaci pokročilého GISTu – a
to nejen počtem léčebných odpovědí, prodloužením periody bez
progrese (DFS), ale zejména prodloužením celkového přežití – v této
studii medián celkového přežití dosáhl 57 měsíců. Oproti tomu
historické kontroly před érou imatinibu udávaly přežití okolo 19
měsíců!(1,2,13). Imatinib mesylát vedl u studie B2222 k
68 % klinických léčebných odpovědí a u 84 % ke klinickému benefitu.
Díky studii BFR14 byl celkem jednoznačně prokázán původní
předpoklad; a to, že při kompletní či parciální remisi pokročilé
nemoci během léčby imatinibem je pro pacienta přínosné pokračování
protinádorové biologické léčby. Po jejím přerušení dochází u
většiny pacientů k rychlým recidivám.(5,6) Klinické studie S 0033 a
EORTC 60025 prokázaly přínos z eskalace – při primární progresi
pokročilého GISTu na iniciální dávce imatinibu má pacient velkou
šanci na další efektivitu imatinibu při jeho
eskalaci.(3,4)
Pro případ rezistence na imatinib je indikováno nasadit 2. linii
terapie – sunitinib.(8,9) Z hlediska porovnání času do
progrese (TTP) – v rameni se sunitinibem dosáhl TTP 6,3 měsíců
(27,3 týdnů), v rameni s placebem TTP 1,5 měsíce (6,4 týdne), v
rameni se sunitinibem došlo ke snížení rizika úmrtí v prvém roce
follow-up o 51 %. Po 6 měsících přežívalo v rameni se sunitinibem
79 % pacientů, kdežto v rameni s placebem přežívalo 57 % pacientů,
v rameni se sunitibem bylo docíleno 2 % parciálních léčebných
odpovědí a 57 % stabilizací nemoci.
V případě další progrese při léčbě imatinibem i suninitibem lze
většinou v rámci klinických studií nasadit nové inhibitory
tyrozinkinázy – nilotinib(12), sorafenib, inhibitor
mTOR(10), inhibitor heat shock proteinu Hsp 90
(IPI-504).(11) Zejména nilotinib je aktuálně nasazován v
klinických studiích – je porovnáván s imatinibem v 1. linii,
případně je porovnávána kombinace imatinibu a nilotinibu oproti
imatinibu samotnému, ve vyšších liniích pak oproti podpůrné
péči.
Primární léčbou by měla být radikální chirurgická
resekce.(14) Standardem pro pacienty s radikální
chirurgickou resekcí byla observace a dispenzarizace, s ohledem na
dobrý paliativní efekt imatinibu u metastatické choroby se však dal
předpokládat benefit z adjuvantní léčby, a to zejména u skupiny
pacientů s vysokým rizikem recidivy.
Tabulka 1 Riziko recidivy s ohledem na velikost, mitotický index a
primární lokalizaci základního nádoru dle Miettinena a Lasoty
| Mitózy | Velikost | Žaludek | Jejunum/ileum | Duodenum | Rectum |
| <5/50 HPF | <2cm | Žádné | Žádné | Žádné | Žádné |
| >2cm<5cm | Velmi nízké | Nízké | Nízké | Nízké | |
| >5cm<10 cm | Nízké | Střední | Vysoké | Vysoké | |
| >10 cm | Střední | Vysoké | |||
| >5/50 HPF | <2cm | Žádné | Vysoké | Neznámé | Vysoké |
| >2cm<5cm | Střední | Vysoké | Vysoké | Vysoké | |
| >5cm<10 cm | Vysoké | Vysoké | Vysoké | Vysoké | |
| >10 cm | Vysoké | Vysoké |
Asi nejvýznamnější studie týkající se adjuvantní aplikace jsou
stěžejní ACOSOG Z9000 a ACOSOG Z9001. Pro gastrointestinální
stromální nádor není vytvořen TNM systém, základem pro stanovení
míry rizika recidivy nádoru jsou zejména velikost primárního nádoru
a počet mitóz při histologickém vyšetření nádoru. Jsou definovány 4
stupně rizika recidivy – velmi nízké, nízké, střední a
vysoké.
Klinická studie fáze 2 U.S. Intergroup ACOSOG Z9000 je otevřená,
jednoramenná klinická studie.(15) V rámci této studie
bylo léčeno 107 pacientů s vysokým rizikem recidivy - zařazení
pacientů předpokládalo jednak vysokou expresi KIT receptoru a
jednak větší velikost primárního tumoru (>10 cm), rupturu
nádorové pseudokapsuly nebo radikální resekci primárního tumoru při
současné metastatické chorobě na peritoneu (<5 peritoneálních
metastáz). Pacienti absolvovali roční adjuvantní terapii imatinibem
s iniciální dávkou 400 mg/den. V průběhu 3 let bylo dosaženo
celkové přežití (OS) v 1. roce, ve 2. roce, resp. ve 3. roce od
ukončení adjuvantní léčby imatinibem: 99 %, 97 %, resp. 97 %.
Přežití bez známek recidivy (RFS) dosáhlo v 1. roce, ve 2. roce,
resp. ve 3. roce: 94 %, 73 %, resp. 61 %. V porovnání s
historickými kontrolami, kde 2leté celkové přežití (OS) dosahovalo
u subjektů s vysokým rizikem jen 50 %, imatinib prokázal předchozí
hypotézu. A to - pakliže imatinib dosahoval vysoký počet regrese
metastatické a KIT-pozitivní pokročilé nemoci, dá se předpokládat
také snížení rizika recidivy u radikálně resekovaných rizikových
případů KIT-pozitivních nádorů při následné adjuvantní aplikaci
imatinib mesylátu.
Na základě nadějných výsledků studie ACOSOG Z9000 byla koncipována
další klinická studie North American Intergroup Phase III ACOSOG
Z9001.(16) Podkladem této studie se stala pilotní studie
Nilsona et al o adjuvantní aplikaci imatinibu. Do 04/2007 bylo do
klinické studie zařazeno 708 pacientů s primárním nádorem GISTu nad
3 cm s expresí KIT receptoru, kteří byli randomizováni do dvojitě
slepé studie – do prvního ramene s účinnou látkou imatinibem s
aplikací po dobu 1 roku, nebo do druhého ramene s placebem. Pro
případy progrese byla studie odslepena, v rameni s adjuvantní
aplikací imatinibu 400 mg/den byla dávka eskalována pro případ
paliace na 800 mg/den a v rameni s placebem proběhla léčba pro
případ paliace s iniciální dávkou imatinibu 400 mg/den. Interim
analýza 644 zařazených pacientů prokázala medián do případné
progrese 1,2 roku, dále počet pacientů bez progrese v 1. roce
(jednoroční PFS) dosáhl v rameni s účinným imatinibem 97 %, kdežto
v rameni s placebem pouze 83 %, hazard ratio dosahoval 0,325 (95%
CI 0,198-0,534) (p = 0,0000014). Rozdíl v celkovém přežití (OS) po
dobu relativně krátkého sledování zatím potvrzen nebyl (mimo jiné z
důvodu logického a plně etického nasazení imatinibu v případě
progrese na placebu, což obecně zkresluje data o celkovém přežití).
Rozdíl v ročním přežití bez progrese (PFS) byl zde natolik
podstatný, že se tato studie stala pokladem pro zařazení adjuvance
imatinibem po dobu 1 roku v dávce 400 mg/den u KIT-pozitivních
nádorů středního a vysokého rizika v řadě států - zejména USA,
Kanadě a některých západoevropských zemích.
Nový pohled na míru rizika recidivy představil na Gastrointestinal
Cancers Symposiu 2007 Gold se spolupracovníky.(19) Nastínil deviaci
křivek po radikální resekci s a bez adjuvantní aplikace imatinibu-
jako rizikové a prognostické faktory uvedl jen velikost a mitotický
index. Později Takahashi a spolupracovníci(20) přidali k
prognostickým kritériím nádoru kromě velikosti nádoru a mitotického
indexu i případnou peritoneální, nebo další resekovanou
metastatickou chorobu, invazi nádoru nebo peroperační rupturu
pseudokapsuly nádoru. Tyto faktory se u KIT-pozitivních nádorů
staly prediktorem k adjuvantní léčbě imatinibem.
V současné době probíhají nábory do celé řady adjuvantních studií s
imatinibem – skandinávsko-německá studie SSG
XVIII/AIO(21) je otevřená, multicentrická, randomizovaná
studie, která porovnává krátkou adjuvanci imatinibem (1 rok) oproti
dlouhodobé adjuvanci imatinibem (3 roky). Nově jednoramenná studie
PERSIST fáze 2 dokonce nasazuje adjuvanci imatinibem na dobu 5 let!
Na výsledky těchto studií netrpělivě čekáme.
Klinická studie EORTC 62024 je otevřená klinická
studie(22) porovnávající pacienty středního a vysokého
rizika po radikální resekci GISTu, kteří byli léčeni buď 24 měsíců
adjuvantní aplikací imatinibu, nebo byli po radikální chirurgii jen
dispenzarizováni. Podmínkou je KIT-pozitivita, plánuje se zařazení
760 subjektů klinického hodnocení, primárním cílem je zhodnocení
celkového přežití (OS), sekundárními cíly jsou poté bezpečnost a
přežití bez progrese (PFS).
Studie RTOG - S - 0132 byla otevřená klinická studie(23)
s nedávno ukončeným náborem pacientů. Jednalo se o neoadjuvantní
aplikaci imatinibu u nádorů potenciálně operabilních (≥ 5 cm) nebo
u recidiv či metastatické nemoci s primárním nádorem ≥ 2 cm. Celkem
bylo zařazeno 63 pacientů, 10 týdnů pacienti absolvovali léčbu
imatinibem 600 mg/den, následoval restaging, radikální resekce a
poté adjuvantní aplikace imatinibu 600 mg/den po dobu 2 let. Cíli
neoadjuvantní studie jsou počet léčebných odpovědí (RR), případy
bez progrese v neoadjuvantní a později v adjuvantní fázi léčby
imatinibem a bezpečnost aplikace. Podobné neoadjuvantní studie fáze
2 pro lokálně pokročilý nemetastatický GIST probíhají t.č. v
Německu a v Kanadě.
Závěr
Dosavadní studie o adjuvantní či neoadjuvantní aplikaci imatinibu
plně opravňují k jeho užití v adjuvantním podání. Jeho aplikace u
radikálně resekovaných GISTů vysokého rizika, nebo u inoperabilních
lokálně pokročilých nemetastatických GISTů je v dnešní době
podepřena natolik klinicky silnými daty, že o její oprávněnosti již
nejsou pochybnosti.
Tabulka 2: Přehled trialů s adjuvantní aplikací imatinibu po
radikální resekci rizikového GISTu
| Studie | Design studie |
| Phase II Study of Adjuvant Imatinib Mesylate in Patients With Completely Resected High-RiskPrimary GIST (ACOSOG – Z9000) | Primární cíl: celkové přežití; 2letý a 5letý počet relapsů, toxicita; terapie imatinibem do 84 dnů od resekce, aplikace po dobu 1 roku, nábor ukončen, N=110 |
| Phase III Randomized Study of Adjuvant Imatinib Mesylate in Patients With Resected PrimaryGIST (ACOSOG – Z9001 | Primární cíl: celkové přežití; celková doba přežití bez relapsu (RFS), terapie imatinibem nebo placebopooperačně po dobu 1 roku a v případě relapsu v placebo rameni převod k paliativní terapiiimatinibem, ukončený nábor N=708 |
| EORTC Soft Tissue and Bone Sarcoma Group | Primární cíl: celkové přežití; celková doba přežití bez relapsu (RFS), randomizace po radikálníresekci – poté terapie imatinibem mesylátem po dobu 2 let, plánovaný nábor N=400 |
| Scandinavian Sarcoma Group Trial SSGXVIII | Primární cíl: celková doba přežití bez relapsu (RFS), celkové přežití, plánovaný nábor N=80 |
| Phase II Study of Neoadjuvant and Adjuvant Imatinib Mesylate in Patient With Primary or RecurrentPotentially Resectable Malignant GIST (RTOG-S0132) | Primární cíl: celková doba přežití
bez relapsu (RFS), objektivní léčebná odpověď (RR), bezpečnost,8
týdnů terapie imatinibem, poté co nejradikálnější resekce a
následně pooperační aplikaceimatinibu po dobu 2 let; plánovaný
nábor N=63 |
Literatura
- Blanke C, Demetri G, et al. Efficacy and Safety of Imatinib Mesylate in Advanced Gastrointestinal Stromal Tumors. NEJM,347;472-480,2002.
- Verweij J, Casali PG, Zalcberg J, Le Cesne A, Reichardt P, Blay JY. Progression free survival in gastrointestinal stromal tumor with high a low dose imatinib: randomised trial. Lancet 2004;364:1127-34.
- Rankin C, Von Mehren M, Blanke C, Benjamin R, Fletcher ClD, Bramwell V. Dose effect of imatinib in patients with metastatic GIST: Phase III Sarcoma Group Study S0033 (abstract 9005), Proc ASCO 2004;23:815.
- Van Glabbeke MM, Owzar K, Rankin C, et al. Comparison of two doses of imatinib for the treatment of unresectable or metastatic gastrointestinal stromal tumors (GIST): A meta - metaanalysis based on 1.640 patients. ASCO Ann Meet 2007, abstract 10004.
- Heindrich MC, Maki RG, Corless CL, et al. Sunitinib response in imatinib - resistant GIST correlates with KIT and PDGFR mutation status. J Clin Oncol 2006;24:9502.
- Demetri GD, van Oosterom AT, et al. Efficacy and safety of sunitinib in patients with advanced gastointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 2006;6736-6746.
- Van Oosterom AT, Dumez H, Desai J, et al. Combination signal transduction inhibition: A phase I/II trial of the oral m-TOR-inhibitor everolimus (E, RAD001) and imatinib mesylate in patients with gastrointestinal stromal tumors refractory to imatinib mesylate. J Clin Oncol 2004,22:3002.
- Demetri GD. Inhibition of the Heat Shock Protein 90 (Hsp90) chaperone with the novel agent IPI-504 to overcome resistance to tyrosine kinase inhibitors (TKIs) in metastatic GIST: Updated results of a phase I trial. 2007 ASCO Annual Meeting, Sarcoma.
- Von Mehren M, Reichardt P, Casali PG, Blay J. A phase I study
of AMN107 alone and in combination with imatinib in patients (pts)
with imatinib-resistant gastrointestinal stromal tumors (GIST) -
Study Update.
2007 ASCO Meeting. - Data on file, Novartis UK Ltd. Study No STI571B2222. Open, randomized, phase II study of Glivec in patients with unresectable or metastatic malignant gastrointestinal stromal tumors expressing c-kit. Report 15th December 2003.
- Chandrajit PR, DeMatteo RP. Prognostic Factors for Primary GIST: Prime Time for Personalized Therapy? Annals of Surgical Oncology 15(1):4-6.
- De Matteo RP, Antonescu CR, et al. Adjuvant imatinib mesylate in patients with primary high risk gastrointestinal stromal tumor (GIST) following complete resection: Safety results from the U.S. Intergroup Phase II trial ACOSOG Z9000; ASCO 2008.
- De Matteo RP, Owzar K, et al. Adjuvant imatinib mesylate
increases recurrence free survival (RFS) in patients with
completely resected localized primary gastrointestinal stromal
tumor (GIST): North American Intergroup
Phase III trial ACOSOG Z9001;ASCO 2008. - Zhan WH. Efficacy and safety of adjuvant post-surgical therapy with imatinib in patients with high risk of relapsing GIST. JCO Vol 25 No 18S.
- Nilsson B, Sjolund K, Kindblom LC, et al. Adjuvant imatinib treatment improves recurrence-free survival in patients with high - risk gastrointestinal stromal tumours (GIST). Br J Cancer 2007;96:1656-8.
- Gold JS, Gonen MI, Maki RG, et al. A nomogram to predict recurrence after resection of primary gasatrointestinal stromal tumor (GIST). Gastorintestinal Cancer Symposium; Jan 19-21,2007.Orgando.
- Takahashi T, Nakajima K, Nishitani A, et al. An enhamced
risk - group stratification system for more practical prognostication of clinically malignant gastrointestinal stromal tumors. Int J Clin Oncol 2007;12:369-74. - Scandinavian Sarcoma Group. Study comparing 12 months versus 36 months of imatinib in the treatment of gastrointestinal stromal tumor (GIST). SSGXVIII/AIO. http:www.clinicaltrials.gov/ct/show/NCT00116935?order=1. Accessed October 25, 2007.
- European Organisation for Research and Treatment of Cancer. Imatinib mesylate or observation only in treating patients who have undergone surgery for localized gastrointestinal stromal tumor- RORTC-62024. http:www.clinicaltrials.gov/ct/show/NCT00103168?order=1. Accessed October 25, 2007.
- RTOG S-0132 protocol. A phase II trial of neoadjuvant/adjuvant STI-571 (Gleevec NSC 716051) for primary and recurrent operable malignant GIST expressing the KIT receptor tyrosine kinase (CD117). www.rtog.org/members/protocols/s0132/s0132.pdf. AccessedOctober 3,2007.
MUDr. Zdeněk Linke, MUDr. Jana Prausová
Radioterapeuticko-onkologické oddělení FN Motol
e-mail:zdenek.linke@fnmotol.cz
Datum přednesení příspěvku: 28. 1. 2011





