Konference: 2005 XII. Jihočeské onkologické dny
Kategorie: zhoubné nádory mozku a CNS
Téma: Konference bez tematických celků
Číslo abstraktu: 009
Autoři: prof. MUDr. Pavel Šlampa, CSc.; MUDr. Petr Pospíšil; MUDr. Tomáš Novotný
v programu pod názvem: Obecně ozáření +
chemoradioterapie
Léčebná strategie
Chirurgická léčba je základním léčebným přístupem u
mozkových nádorů. Radikalita a úspěšnost výkonu je rozhodujícím
prognostickým faktorem. Parciální výkon má vždy horší léčebné
výsledky. Histologické ověření nádoru, i při neradikálním výkonu,
je pro další léčbu rozhodující. Při zjevné inoperabilitě je nutné
zvážit provedení verifikační stereotaktické biopsie.
Radioterapie má v léčbě nádorů CNS stále nezastupitelnou
roli. Zvláště po nekompletně provedených exstirpacích významně
zlepšuje léčebné výsledky u astrocytomů a gliomů. Ozáření celé
mozkovny je nutným zákrokem u lymfomů lokalizovaných v mozkovně.
Jen ve výjimečných případech lze onkologickou terapii
(radioterapii, event. chemoterapii) indikovat u neověřených tumorů,
např. při neúnosném riziku provedení bioptické punkce v oblasti
mozkového kmene.
Adjuvantní chemoterapie může zlepšit výsledky léčby u
astrocytomů s vyšším stupněm malignity („high grade“),
ependymomů a PNET tumorů. Určité zlepšení léčebných výsledků
ukazují studie s použitím vysokodávkované chemoterapie s
transplantací kostní dřeně (u PNET a germinomů) a aplikace nových
preparátů s vyšší možností průniku přes hematoencefalickou
membránu, např. fotemustin, temozolomid. Léčba imunopreparáty se v
léčbě mozkových nádorů zatím pro standardní využití
neosvědčila.
Nízká propustnost hematoencefalické membrány však limituje použití
cytostatik i při kombinované současně podávané konkomitantní
chemoradioterapii. Z preparátů se nejčastější používají
deriváty platiny, cyklofosfamid, CCNU, prokarbazin, etoposid,
ifosfamid, thiotepa, metotrexát, vinkristin. Určité zlepšení
léčebných výsledků ukazují studie s použitím perorálního
alkylačního cytostatika druhé generace, temozolomidu, u
anaplastických astrocytomů (temozolomid Temodal®, 75
mg/m2/den p.o. po celou dobu ozařování standardní
frakcionací u nemocných v dobrém celkovém stavu).
U rozsahem malých nádorů nebo pooperačních reziduí (o průměru 1-3
cm), především vysoce diferencovaných histologických typů, je
vhodné konzultovat stereotaktický radioterapeutický zákrok
(jednorázový radiochirurgický zákrok nebo frakcionovaná
stereotaktická radioterapie).
Astrocytomy, glioblastom
Pooperační radioterapie významně prodlužuje pěti i desetileté
přežívání (o 17-33%) po inkompletně provedené exstirpaci
„low-grade“ astrocytomů. U pacientů s „low-grade“
astrocytomy je nutno indikaci radioterapie pečlivě zvažovat, neboť
u těchto nemocných se předpokládá déletrvající přežívání. Tím
případné chronické ireverzibilní změny mozkové tkáně následkem
ozáření (porucha kognitivních funkcí) jsou jedním z kriterií při
zvažování indikace pooperační radioterapie. Adjuvantní radioterapie
u low-grade astrocytomů je indikována především u pacientů s horší
prognózou (diagnosticky reziduální tumor, starší věk,
symptomatologický nemocný). Také u inoperabilních „low-grade“
astrocytomů je někdy obtížné zvolit správnou dobu (timing)
provedení radioterapie z důvodů rizika vzniku chronických změn u
normální mozkové tkáně po ozáření. U asymptomatických pacientů lze
se zahájením radioterapie vyčkávat. Riziko vzniku pozdních změn
mozkové tkáně po ozáření lze snížit frakcionací 5x1,8 Gy/týden.
Celkově se doporučuje aplikovat dávka 50,4-54 Gy.
Pooperační radioterapie prokazuje zlepšení léčebných výsledků po
exstirpaci maligních gliomů. Bez provedení pooperační radioterapie
se udává medián přežívání u anaplastických gliomů 3,5 měsíce, po
aplikaci záření 9 měsíců. Aplikace dávky 65 Gy je spojeno až s 18%
rizikem vzniku radionekrózy mozkové tkáně, toto riziko je při
aplikaci dávek do 57 Gy nízké.
Pilocytický astrocytom G I, fibrilární, protoplazmický,
gemistocytární astrocytom G II
Základní metodou léčby je neurochirurgická exstirpace, v případě
totální resekce není radioterapie indikována. Léčba zářením je
indikována po subtotální resekci a u inoperabilního tumoru.
Radioterapie: Plánovací cílový objem (PTV) je určen lůžkem
tumoru (nebo objemem tumoru) podle předoperačního CT nebo MR
vyšetření s bezpečnostním lemem 2 cm. Dávka záření v ICRU bodě se
doporučuje 50-54 Gy standardní frakcionací 5x1,8-2,0 Gy/týden v
případě pooperačního ozařování, u inoperabilních tumorů lze dávku
zvýšit cíleným ozářením za maximálního šetření okolní zdravé
mozkové tkáně.
Anaplastický astrocytom, glioblastoma multiforme,
oligodendrogliom
Tyto primární mozkové nádory jsou vysoce maligní s
histopatologickým stupněm diferenciace (grading) G 3-4 („high
grade“ gliomy). Metodou volby je chirurgický zákrok.
Radioterapie je indikována vždy (i po totální resekci), pokud to
celkový stav pacienta dovolí. V případě inoperabilního nádoru je
prognóza pacienta nesmírně vážná, jakákoliv radioterapie je pouze
paliativního charakteru. Oligodendrogliom se pokládá za relativně
chemosenzitivnější než ostatní gliomy, proto je adjuvantně
používaná v jeho léčbě používána intenzivnější kombinace
chemoterapie PCV.
Radioterapie: Plánovací cílový objem (PTV) zahrnuje u
pooperační radioterapie lůžko tumoru podle předoperačního CT nebo
MR vyšetření s bezpečnostním lemem 2-4 cm. PTV u inoperabilního
tumoru, rezidua je tvořen: PTV 1 objem tumoru (tumor nebo reziduum)
s oblastí edému a bezpečnostním lemem 2-4 cm; PTV 2 objem tumoru
(rezidua) s lemem 2-3 cm. Ozařování probíhá standardní frakcionací
5x1,8-2,0 Gy/týden, lze však zvolit i akcelerované režimy. Dávka
záření v ICRU bodě se doporučuje 56-60 Gy (pooperační PTV), 46-50
Gy (inoperabilní PTV 1),10-20 Gy (inoperabilní PTV 2), celková
dávka 60-64 Gy.
Chemoterapie (konkomitantní, adjuvantní): Aplikaci
temozolomidu (Temodal(r)) lze zvážit v adjuvantní terapii u
pacientů po exstirpaci anaplastického astrocytomu či glioblastomu
stejně jako konkomitantní aplikaci s radioterapií u inoperabilního
či reziduálního tumoru. Aplikaci lze zvážit u nemocných v dobrém
celkovém stavu, Karnofského index (KI) min. 70%, u nichž je
zaručena spolupráce a nejsou jiné kontraindikace podání. Adjuvantně
se také aplikuje kombinace chemoterapie PCV (lomustin, prokarbazin,
vinkristin) nebo karmustin v monoterapii.
Embryonální nádory (primitivní neuroektodermové nádory,
PNET)
Tyto nádory jsou typické pro dětský věk. Současná WHO klasifikace
rozlišuje pět hlavních morfologických diagnóz: meduloblastom,
ependymoblastom, supratentoriální primitivní neuroektodermální
nádor, meduloepiteliom a atypický teratoid/rabdoidní nádor.
Podrobněji je v textu kapitoly popis dvou nejčastějších nádorů PNET
meduloblastomu a ependymomu.
Meduloblastom
Radioterapie je součástí léčebných protokolů, neboť se jedná o
radiosenzitivní nádor. Jako dostačující se uvádí pooperačně
aplikovaná dávka 54-55 Gy na oblast zadní jámy lební a 30-36 Gy na
oblast kraniospinální osy standardní frakcionací. U nízce
rizikových PNET nádorů u dětí se dnes dává přednost nižším dávkám
záření na oblast kraniospinální osy (24 Gy).
Chemoterapie je součástí léčebných protokolů. Vysokodávkovaná
chemoterapie s transplantací kostní dřeně u PNET tumorů patří mezi
metody klinických studií, které mají za cíl zlepšení léčebných
výsledků u těchto nádorů.
Ependymomy
Pooperační radioterapie zlepšuje léčebné výsledky. Jako minimální
se uvádí dávka záření 45 Gy, většinou se doporučuje dávka 50-55 Gy.
Při reziduálním nálezu lze dávku záření zvýšit na oblast zbytku
nádoru až do výše 60 Gy. Velikost ozařovaného objemu je často
kontroverzní otázkou, zvláště při rozhodování o profylaktickém
ozáření spinální osy. Vysoce maligní ependymoblastomy jsou léčeny
podle protokolů pro PNET s ozářením kraniospinální osy.
Kraniospinální ozáření je indikováno vždy při pozitivní cytologii
mozkomíšního moku a při nejasném MR nálezu vyšetření páteřního
kanálu. Na oblast míšního kanálu, s kaudální hranicí ozařovaného
pole v úrovni těl obratlů S2-3, a objem celé mozkovny se doporučuje
aplikovat dávka 30-36 Gy.
Pooperační ozáření se doporučuje i u spinální formy
ependymomu. U vysoce maligních forem lokalizovaných v oblasti
krční a hrudní páteře se doporučuje profylaktické ozáření celé
kraniospinální osy (30 Gy) a doozáření lůžka tumoru v rozsahu dvou
obratlů nad a pod hranicemi nádoru (některé práce uvádí lem čtyř
obratlů) do celkové dávky 45 Gy. Při umístění ependymomu v oblasti
kaudy se doporučuje ozáření míšního kanálu v rozsahu obratlů
Th6-S2-4 dávkou 40 Gy, pak doozáření lůžka tumoru na celkovou dávku
50 Gy. Popisované dávky záření u ependymomu jsou pro standardní
frakcionaci.
Výsledky chemoterapie u ependymomů nejsou přesvědčivé, nicméně
léčebné protokoly standardně chemoterapii doporučují.
Meningeomy
Adjuvantní radioterapie je indikována po exstirpaci
nediferencovaných forem a anaplastického meningeomu (G3-4), po
subtotální resekci maligní formy tumoru, u recidivujících
meningeomů a individuálně se zvažuje po totální exstirpaci
rozsáhlých tumorů maligní varianty.
Radioterapie: Plánovací cílový objem (PTV) je určen lůžkem
tumoru (nebo objemem tumoru) podle předoperačního CT nebo MR
vyšetření s bezpečnostním lemem 2 cm. Standardní frakcionací
5x1,8-2,0 Gy/týden se doporučuje aplikovat dávku záření v ICRU bodě
50-54 Gy, (pooperačně) nebo 56-60 Gy (inoperabilní tumor).
Pinealocytomy, pinealoblastomy
Adjuvantní radioterapie je indikována po subtotální resekci
pinealocytomů a po subtotální a totální exstirpaci pinealoblastomu.
Rutinní profylaktické ozáření kraniospinální osy(25-35 Gy) je však
kontroverzní otázkou. Plně indikované je u pinealoblastomů při
pozitivním cytologickém nálezu z vyšetření mozkomíšního moku nebo v
případě nejasného nálezu při MR vyšetření míšního kanálu, v jiných
případech je zvážení profylaktického ozáření kraniospinální osy
individuální. Plánovací cílový objem (PTV), frakcionace, dávka,
technika a plánování jsou obdobné jako u meduloblastomu, PNET
tumorů.
Germinom
V pineální oblasti (50-60% případů) a supraselárně (v 30-35%) se
dále často vyskytují germinální nádory, germinomy. Histologická
skladba těchto germinomů se nápadně podobá nádorům varlat.
Významnou vlastností některých germinomů je produkce biochemických
markerů: alfa-1fetoproteinu a choriogonadotropinu. Monitorování
jejich hladin má velký význam v průběhu léčby i při následném
dlouhodobém sledování. U germinomů je 10% riziko kraniospinálního
šíření nemoci. V případě germinomů CNS je zkoušena v klinických
studiích i vysokodávkovaná chemoterapie s transplantací kostní
dřeně.
Rutinní profylaktické ozáření kraniospinální osy (25-35 Gy) je také
kontroverzní otázkou. Plně indikované je při pozitivním
cytologickém nálezu z vyšetření mozkomíšního moku nebo v případě
nejasného nálezu při MR vyšetření míšního kanálu. Při supraselární
lokalizaci germinomu se popisuje vyšší riziko spinálního šíření
nemoci (30-37%) než při umístění nádoru v pineální oblasti (6-10%
riziko leptomeningeální diseminace). Indikace adjuvantní
radioterapie je obdobná jako u pinealocytomů, při určení cílového
objemu je vhodné zvážit ozáření celého komorového systému.
Chorioid plexus tumory
Pooperační ozáření se indikuje v případě parciální exstirpace. Při
pozitivním cytologickém nálezu z mozkomíšního moku a vzhledem k
povaze tumoru a jeho lokalizaci je indikováno pooperační ozáření
kraniospinální osy; při inoperabilitě tumoru lze individuálně
indikovat kurativní radioterapii. Frakcionace, dávka, technika jsou
obdobné jako u ependymomu.
Kraniopharyngeom
Radioterapie je indikována po parciální resekci tumoru nebo v
případě recidivujícího nálezu. Plánovací cílový objem (PTV) je
určen objemem tumoru s bezpečnostním lemem 1-2 cm. Dávka záření
standardní frakcionací je limitována tolerančními dávkami
kritických orgánů (schiasma opticum, prodloužená mícha) v blízkosti
tumoru. V ICRU bodě se aplikuje dávka 50-54 Gy, 5x1,8-2,0
Gy/týden.
Nádory hypofýzy
V oblasti hypofýzy se vyskytuje řada nádorů. Dělí se a nazývají se
obvykle podle druhu produkujícího hormonu. Nejčastějším je nádor
produkující prolaktin, prolaktinom. Základní léčebnou metodou je
chirurgické odstranění (transsfenoidální nebo transkraniální
hypofyzektomie), dále léčba dopaminovými agonistami. Radioterapie
je využívána při jinak inkurabilních makroprolaktinomech.
Dalším je nádor produkující růstový hormon. Léčbou volby
je také chirurgické odstranění; farmakologickou léčbou je podávání
ergolinových přípravků a somatostatinových analogů. Farmakologická
léčba se podává předoperačně nebo u inoperabilních nádorů.
Radioterapie je aplikována po subtotálním odstranění nádoru, zvl.
při přetrvávajících zvýšených hodnotách růstového faktoru
(IGF-I).
U hypofyzárních nádorů produkující gonadotropní hormony je
indikováno primárně chirurgické řešení, radioterapie má význam v
adjuvanci při přetrvávání zvýšených hladin hormonů. Symptomaticky
je podávána farmakologická léčba (dopaminové agonisty, luteinizační
hormon, somatostatinové analogy).
Adenomy hypofýzy představují asi 10-15% nádorů mozku.
Podle mikrostruktury a imunohistochemických vlastností se dělí do
sedmi skupin (laktotropní, somatotropní, kortikotropní,
tyreotropní, gonadotropní, nulabuňkové a plurihormonální). Většina
hypofyzárních adenomů roste pomalu a má benigní charakter. Můžou
infiltrovat paraselární struktury včetně skeletu. U invazivně
rostoucích adenomů je indikována radioterapie.
Hypofyzární karcinomy jsou vzácné, jejich incidence se
udává 0,13% z hypofyzárních nádorů. Asi 2/3 z nich jsou hormonálně
aktivní. Vzácně mohou hematogenně diseminovat. Léčba spočívá v
neurochirurgickém zákroku, subtotální výkon je doplněn
radioterapií. Perioperačně se podává hydrokortizon, který se podává
do pooperačního vyšetření hypofyzární rezervy.
Radioterapie: Léčba zářením v oblasti hypofýzy je
limitována blízkostí chiasma opticum. Standardní frakcionací lze
aplikovat dávku 45-46 Gy. Dávka 50 Gy a vyšší znamená již vysoké
riziko ireverzibilního poškození chiasma. V léčbě nádorů hypofýzy
je vhodné zvážit aplikaci stereotaktické radioterapie a
radiochirurgie, nebo kombinaci stereotaktické radioterapie a
IMRT.
Nádory hlavových nervů
Schwannomy (neurinomy, neurilemomy) se nejčastěji nacházejí
intrakraniálně na osmém hlavovém nervu. Základ léčby u neurinomu
akustiku je mikrochirurgická exstirpace. Asi ve 20% se nepodaří
tumor zcela resekovat, odstranění 90 až 99% tumoru se však považuje
za téměř totální. Méně jak 90% je klasifikováno jako subtotální
resekce. Riziko lokální recidivy je u této skupiny subtotálně
operovaných více jak 30%. Adjuvantní radioterapie (50-55 Gy) může
redukovat toto riziko na míru rovnající se riziku při totální
resekci (méně než 10%). Jako pozdní nežádoucí účinky radioterapie
jsou popisovány neuropatie 5. a 7. hlavového nervu téměř v jedné
třetině případů. Radiochirurgie může být alternativou
mikrochirurgického zákroku. V porovnání s konvenční radioterapií má
výhodu v nižším riziku poškození funkce hlavových nervů a sluchu,
srovnatelném nebo převyšujícím výsledky mikrochirurgické
resekce.
Radioterapie
Zevní radioterapie
Zdrojem záření je nejčastěji brzdný svazek (4-6 MV) lineárních
urychlovačů. V indikovaných případech lze použít i radiokobaltový
ozařovač. Protonové ozařování se v ČR neprovádí, ve fázi klinického
zkoušení je aplikace neutronové záchytové terapie v léčbě
glioblastoma multiforme a intersticiální brachyradioterapie.
Výhledově lze očekávat využití i IMRT techniky radioterapie a zvl.
v kombinaci se stereotaktickou radioterapií. Nejčastějšími
technikami radioterapie mozkových nádorů jsou kombinace 2-4 polí,
jejichž tvar je upraven individuálními bloky nebo vícelamelovým
kolimátorem (obr. 1, 2). Plánování na RTG simulátoru, CT přístroji
(nejlépe za i.v. kontrastní aplikace) a vlastní ozařování se
provádí za fixace hlavy umělohmotnou maskou. Moderním způsobem
plánování cílového objemu je využití fúze CT/MR obrazů (obr. 3
a-d). Dávky záření a frakcionace jsou uvedeny v léčebné strategii u
jednotlivých diagnóz. Frakcionace 5x1,8 Gy/týden proti
5x2,0Gy/týden snižuje riziko pozdních ireverzibilních změn mozkové
tkáně zvl. u rozsáhlejších cílových objemů.
Obr. 1: Izodózní plán pooperačního ozáření lůžka tumoru
glioblastomu po totální exstirpaci brzdným svazkem lineárního
urychlovače 6 MV, a) technika dvou protilehlých laterolaterálních
polí, b) technika dvou protilehlých předozadních polí
Obr. 3: Určení plánovacího cílového objemu s využitím fúze obrazů u
pětiletého pacienta s inoperabilním pilocytickým astrocytomem: a)
pomocí CT vyšetření, b) fúze CT-MR obrazů, c) zobrazení z pohledu
svazku záření BEV, d) simulační snímek s obrysy lamel
vícelamelového kolimátoru o šířce lamel 5 mm v izocentru (Clinac,
Millenium 120 multileaf collimator).
a) 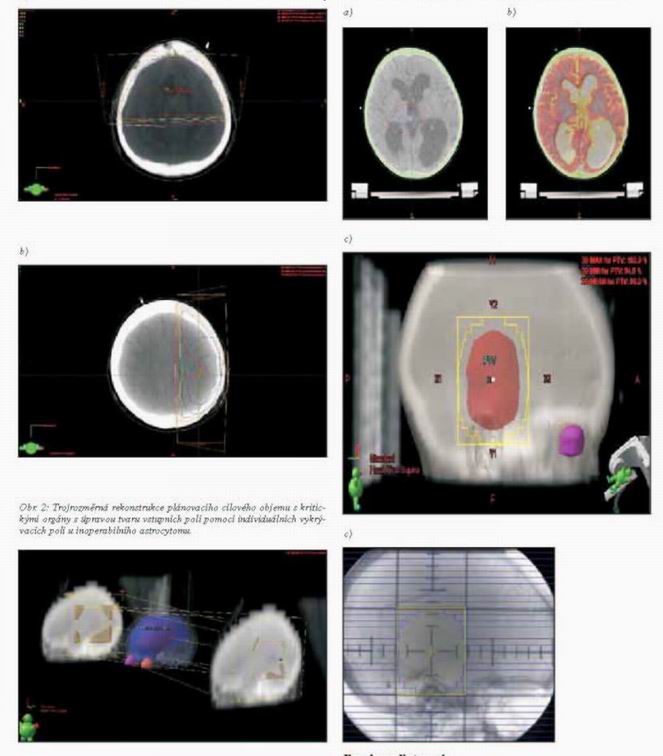
Brachyradioterapie
Jednou z možností cíleného ozáření reziduálních nádorů a recidiv
maligních gliomů (např. po předchozím zevním ozářením) v mozku je
použití stereotaktické intersticiální brachyradioterapie. Zdroje
HDR brachyradioterapie jsou speciálními aplikátory zavedeny přímo
do nádoru. Plánování radioterapie je nutné provádět trojrozměrným
plánovacím systémem za využití CT a MR snímků. Metodu lze za
určitých okolností považovat za alternativní řešení stereotaktické
radioterapie. Invazivní výkon je zatížen rizikem především infekce,
dále krvácením a rozsevem nádoru do dalších oblastí mozku. Celková
aplikovaná dávka 30-50Gy je rozložena do 3-4 dní s 2x denní
aplikací. Během aplikace se profylakticky podávají antibiotika a
antiepileptika.(obr. 7a, b)
Obr. 7: Intersticiální brachyradioterapie mozku: a) na fixační
masce připevněn vodící můstek pro aplikátory template, vyznačen
cílový objem; b) isodózní plán (izodózy 100%, 70%, 20%).
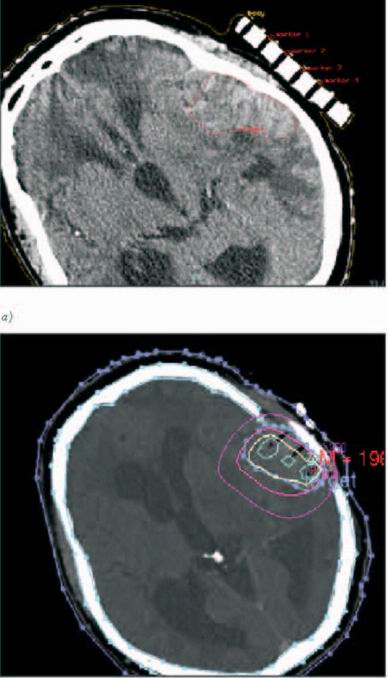
Záchytová neutronová terapie
Jednou z léčebných modalit glioblastomu multiforme, která je
intenzívně klinicky zkoušena, je neutronová záchytová
terapie (BNCT). Nádorové buň ky vychytávají během infuze borové
sloučeniny ve zvýšené koncentraci bór. Maximální hladiny bóru v
nádorových buňkách je dosaženo asi po 12 hodinách od infuze bórové
sloučeniny (borondodekaborát sodný, BSH). Po ozáření těchto buněk
epitermálními neutrony dochází k následující reakci. Bórová částice
se rozpadá na 4 He a 7 Li.
10 B + n —7 Li (0,84 MeV) + 4 He (1,47 MeV) + gama(0,48 MeV)
Tyto částice předávají svojí energii na vzdálenost 9 a 5 um, což
jsou rozměry buňky a současně se i uvolňuje gama záření. Dochází
tak k selektivní a vysoce efektivní destrukci nádorových buněk,
které v okamžiku ozáření obsahují bór resp. jeho izotop 10B.
Produkty reakce mají totiž vysokou relativní biologickou účinnost
(RBÙ) způsobenou vyšším přenosem energie na jednotku délky dráhy
(LET). Při ozáření tumoru se tak využívá zejména rozdílné
koncentrace bóru v nádorové tkáni a minimálních hodnot ve tkáni
zdravé. Tím se dosahuje selektivního ozáření nádoru a okolí s
maximálním šetřením zdravých struktur. Nicméně v současnosti tuto
metodu radioterapie nelze pokládat za standardní způsob léčby
glioblastomu multiforme.
Závěr
Základní metodu léčby mozkových nádorů je neurochirurgický zákrok.
Radikalita výkonu je základním prognostickým faktorem. Radioterapie
je aplikována u primárních mozkových nádorů především v adjuvantním
charakteru a přináší v řadě případů významné prodloužení lokální
kontroly onemocnění. Dlouhodobé kurativní výsledky přináší u
primárních mozkových lymfomů a germinomů. V léčbě mozkových
metastáz se aplikuje paliativní radioterapie.
Při ozařování centrální nervové soustavy je preferován externí
způsob radioterapie moderními ozařovacími přístroji zajišťující
konformní způsob ozáření (lineární urychlovače s vícelamelovými
kolimátory). Brachyterapii a neutronovou záchytovou terapii v
současnosti nelze pokládat za standardní způsoby léčby mozkových
nádorů.
Základní literatura
- ADAM, Z., VORLÍČEK J., VANÍČEK J., a kol. Diagnostické a léčebné postupy u maligních chorob. 2. vydání, Praha, Grada, 2004, s. 13-26
- BRANDES, AA. When to treat ? Perspectives in central nervous system malignancies. Presentation Summaries, Praha, 2005, p. 31-38
- CHANANA, J. CAPALA, M. CHADA, JA., et al. Boron neutron capture therapy for gliblastoma multiforme: Interin results from the phase I/II dose-escalation studies. Neurosurgery, 44, 1999, p. 1182-1192
- HONOVÁ, H., ŠAFANDA, M., PETRUŽELKA, L. et al. Neutronová záchytová terapie v léčbě glioblastoma multiforme. První zkušenosti v České republice. Časopis lékařů českých, 143, 2004, 1, s. 44-47
- KAUŠITZ, J., ALTANER, Č., a kol. Onkológia. 1. vydání, Bratislava, Veda, 2003, s. 507-536
- PEREZ, CA., BRADY, LW., et al. Principles & Practice of Radiation Oncology. 4rd ed., Philadephia, LippincotWilliams &Wilkins, 2004, p. 791-896
- RAMPLING, R. Use of radiation therapy for low-grade gliomas. Perspectives in central nervous system malignancies. Presentation Summaries, Praha, 2005, p. 39-46
- ŠLAMPA, P., a kol., Radiační onkologie v praxi. MOÙ, Brno, 2004, s. 143-156
- ŠLAMPA, P. Terapie a prognostické faktory ependymomů u dětských pacientů. Čes.-slov. Pediatrie, 53, 1998, 8, s. 502-505
- SLAMPA, P., BURKON, P., STERBA, J., et al. The technique of craniospinal irradiation in the management of intracranial ependymomas. Journal of BUON, 2002, 7, s. 131-136
- ZÁMEČNÍK, Ľ., HAJTMANOVÁ, E., ABOUHARB, A., et al. Plánovanie intersticiálnej brachyterapie recidivujících tumorov mozgu. Klinická onkologie, 2005, v tisku
Datum přednesení příspěvku: 14. 10. 2005





