Konference: 2005 VIII. setkání Klubu mladých onkologů
Kategorie: Nádory v seniu
Téma: Konference bez tematických celků
Číslo abstraktu: 15
Autoři: MUDr. Radka Lohynská, Ph.D.
Přepis prezentace z Microsoft PowerPoint
Mechanismus účinku radioterapie
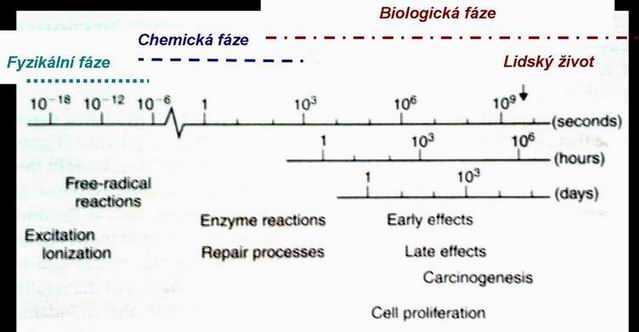
Časový sled změn v biologické tkáni po ozáření
(Basic Clinical Radiobiology, Steel GG, 3rd edition, 2002).
DNA

Velikosti elementárních částic
Elektron … 10-18m ... 0,000 000 001 nm
Proton, neutron – velikost cca 1000x větší než elektron ... 10-15 m
Dávka 1-2 Gy (D0) způsobí v buňce 105 ionizací
Po této dávce lze zaznamenat v buňce:
- přes 1000 poškozených bází
- cca 1000 jednovláknových zlomů
- jen cca 30-40 dvouvláknových zlomů
Proteiny kóduje 1-2% DNA.
Nicméně cca 1/3 buněk po D0 IZ dále přežívá
Vlastní metabolismus buňky způsobí >10 000 ssb a poškození bazí/den
Basic Clinical Radiobiology, Steel GG, 3rd edition, 2002
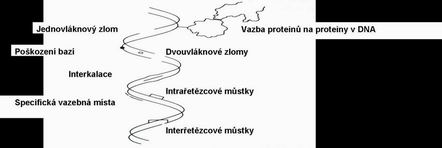
Cílovou strukturou IZ je DNA
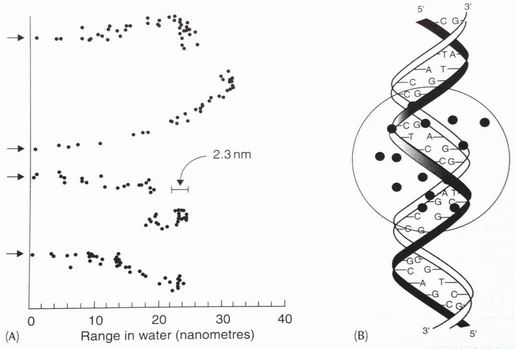
Počítačově simulovaná dráha elektronu, ke konci dráhy vzniká „hotspot“ ve kterém se v okruhu několika nm vyskytne větší množství ionizací a ty mohou způsobit DSB a řadu SSB a poškození bazí= „místo znásobeného poškození“.
(Basic Clinical Radiobiology, Steel GG, 3rd edition, 2002)
Biologický efekt ionizace je ovlivněn 3 hlavními faktory
1.počtem ionizací v dostatečné blízkosti DNA
2.vznikem volných radikálů
3.buněčnými reparačními procesy – reparace DNA
inducibilní proces - po RT dochází k aktivaci genů pro reparaci (fibroblast growth factor FGF, TNF-...)
ss DNA breaks - oprava podle druhého vlákna
excisní reparací - jednoduchá záměna báze v DNA
„mismatch“ reparací - chyba v párování
ds DNA breaks – také lze opravit !!!
„non-homologní end-joining“ (NHEJ) - cílem je zachování kontinuity DNA, která je dosyntetizována a spojena náhodně (80% dsb, T1/2 hodiny)
homologní rekombinační reparace (HRR) - vytvoření homologní kopie DNA podle vlákna druhého z páru chromozomů v jádře a zreparování příslušného místa; HRR je rychlejší v období S fáze (obě molekuly DNA poblíž sebe = důvod proč je S fáze nejresistentnější fází cyklu) – 20% dsb, T1/2 den
Mechanismus účinku radioterapie
&Nedojde-li k reparaci DNA, následuje smrt buňky (interfázická smrt u leukemických a normálních leukocytů) nebo fixace poškození - buňky mohou prodělat i několik mitotických dělení, než odumřou – mitotická smrt.
&2 základní způsoby buněčné smrti v závislosti na průběhu a morfologii procesu - apoptóza a nekróza.
Buněčný cyklus
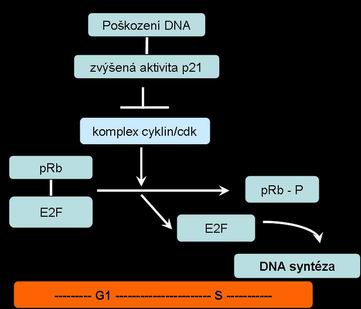
Hlavní kontrolní uzel buněčného cyklu je umístěn cca ve 2/3 G1 fáze - poškození DNA blokuje vstup do S fáze zajištěním transkripčního faktoru ve vazbě na Rb protein přes protein p53
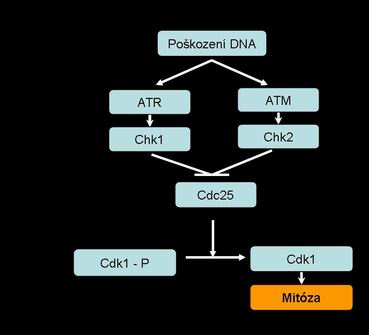
G2 kontrolní uzel - poškození DNA blokuje vstup do mitózy zabráněním aktivace cdk1. Proteiny ATR a ATM fosforylují proteiny chk1 a chk2, které aktivují cdc25c, což je aktivační kináza nutná pro přechod buněčného cyklu v G2/M fázi
Chemoradioterapie solidních nádorů
1.Přidání CHT k RT není důvodem ke snížení celkové plánované dávky RT!
2.Netřeba modifikovat cílový objem pro RT kvůli konkomitantní CHRT!
3.Konkomitantní CHRT zvyšuje akutní toxicitu oproti samotné RT (nikoliv pozdní)!
(CAVE 1. a 2. neplatí pro dětské nádory, lymfomy a NSCLC!)
- neoadjuvantní CHT
- konkomitantní CHRT
- adjuvantní CHT
Přehled indikací konkomitantní CHRT
Nádory hlavy a krku – R, A
Ca colli uteri - R
Anální ca - R
Bronchogenní ca – R
GB+AA cerebri – R, A
Ca recti – N, A, R
Ca žaludku – A
Ca jícnu – N, R
Ca močového měchýře – R
...
Přehled užívaných cytostatik
cisplatina, carboplatina
5-FU, kapecitabin
taxany
temozolomid
MTX
BLM
mitomycin C
cetuximab
Důvody k CHRT
- Překonání resistence k 1 druhu léčby
- Radiosenzibilizace (snížení reparace DNA)
- „spatial co-operation“ – ovlivnění mikrometa mimo ozařovaný objem – NPC, BCA…
- Příznivá změna radiobiologie tumoru – reoxygenace, redistribuce bun. cyklu
Mechanismus účinku CHRT
Fáze cyklu Působení chemických látek a fyzikálních metod:
G0 hypertermie
G1 alkylační látky, prednison, TMX, VCR, BCNU, MTX
S 5-FU, HU, AraC, mmC, alkylační látky, hypertermie
G2 BLM, alkylační látky
M BLM, VBL, VCR, kolchicin, tenipozid
Radiosenzitivní části buněčného cyklu:
G1/S
G2/M
Terapeutický poměr
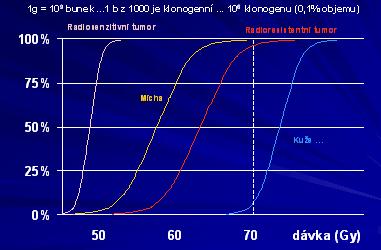
Význam neoadjuvantní chemoterapie před radikální radioterapií
zmenšení tu masy
→↑prokrvení (zlepšení distribuce CHT)
→↑reoxygenace (↓hypoxických bb),
→↑repopulace (↓G0 bb)
systémové působení CHT (prevence meta – NPC, BCA...)
zjištění citlivosti tu k CHT předpovídá efekt RT (larynx ca)
zmenšení velikosti ozařovacího pole (lymfomy)
snížení celkové dávky RT (dětské nádory)
„čekací doby na RT“ (HN ca)
Rizikové orgány specifické pro konkomitantní CHRT
ledviny – cisplatina, carboplatina, etoposid, ifosfamid, MTX, BLM
srdce – antracykliny, 5-FU, taxany
plíce – BLM, ADM
játra – antracykliny, vinca-alkaloidy, taxany
NS – MTX, cisplatina, taxany, ifosfamid
Stanovení dávky CHT
Dle tělesného povrchu (cispt, FU, docetaxel...)
- Mosteller
BSA (m²) = { [Výška(cm) x Váha(kg) ] / 3600 }0,5
- Du Bois
BSA (m²) = 0.20247 x Výška(m)0.725 x Váha(kg)0.425
- Haycock formula
BSA (m²) = 0.024265 x Výška(cm)0.3964 x Váha(kg)0.5378
U obézních vzít jako horní hranici pro určení dávky 2,0-2,2 m2 (doporučení RCR UK)
Dle GF (u carboplatiny)
Výpočet ideální tělesné váhy pro redukci dávek CHT u obézních pacientů
Ideální váha pro muže (Divinova formule)
= 50,0 + [0,906 x (výška – 152,4)]
Ideální váha pro ženy (Robinsonova formule)
= 45,5 + [0,906 x (výška – 152,4)]
Kintzel PE, Cancer Treat rev 1995;21;33-64
BMI = váha (kg) / výška2 (m)
Nadváha = BMI > 25
Obezita = BMI > 30
Výpočet GF
Dynamická scintigrafie ledvin – EDTA
Wrightova formule
GF = {[6580 – (38,8 x věk)] x BSA x [1-(0,168 x pohlaví)]} / kreatinin v séru
muž = 0, žena = 1; GF (ml/min), věk (roky), BSA (m2), plasma kreatinin (µmol/l)
Cockcroftův-Gaultův vzorec
Muži: GF = 1,23 x (140-věk) x váha / kreatinin v séru
Ženy: GF = 1,04 x (140-věk) x váha / kreatinin v séru
GF (ml/min), věk (roky), váha (kg), výška (cm), plasma kreatinin (mol/l)
Standartní redukce dávky dle GF (doporučení RCR UK)

Cisplatina, karboplatina
alkylační látky
DNA crosslinks ... inhibice reparace DNA
... preferenční účinek v G1
RT zvyšuje transport Pt do buňky (a tím zvyšuje sama svůj účinek)
hypoxie může zvýšit radiosenzibilizaci Pt
poločas třífázový (8-50 min, 16 hod-dny, několik dní)
podat před RT
Dávka konkomitantní CHRT: (hydratační režim, Pt nikdy do G5%, ale do FR či Ringerlaktátu)
- 40 mg/m2 1x týdně
- 100 mg/m2 1x za 3 tý
potenciace Pt též s FU, cytA, VBL, VCR, ADM, eto
Indikace kCHRT: ORL, ca colli uteri, BCA, ca m.m., ca jícnu, ca anu
Cisplatina vs karboplatina
Cisplatina má vyšší účinek než karboplatina u nádorů hlavy a krku
DeAndres et al, JCO 1995; 13:1493-1500
Forastiere et al, JCO 1992; 10:1245-1251
Jacobs et al, JCO 1992; 10:257-263
Redukce dávky cisplatiny
Dle GF
- GF > 50 ml/min (0,9 ml/s) … netřeba redukce
- GF 30-50 ml/min …podat nižší dávku úměrnou snížení GF
100 ml/min = norma, při 40 ml/s podat 40% dávky
- GF < 30 ml/min (0,6 ml/s) … nepodávat cisplatinu
Dle KO
- Odložit další cyklus dokud ANC > 1,0
- Odložit další cyklus dokud trombocyty > 75
Při neurotoxicitě – ukončit CHT s cisplatinou
Dávka karboplatiny
Calvertova formule:
Dávka karboPt = cílové AUC x (GF+25)
GF v ml/min
JCO 1989;7;1748-56.
Při GF < 20 ml/min karboplatinu nepodávat
Dle KO
- Odložit další cyklus dokud ANC > 1,0
- Odložit další cyklus dokud trombocyty > 75
MACH NC 2, 2004 – SCC H&N
87 randomizovaných studií 1965-2000 (16640 pts)
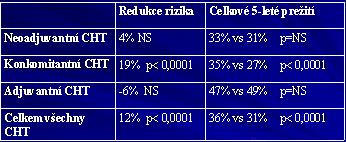
Prokázán celkový 5% benefit přidání CHT k RT, nejvyšší přínos má konkomitantní CHRT (absolutní benefit 8% v 5 letech – se samotnou cisPt 11% benefit)
MACH NC 2, 2004
Přínos CHT dle složení
Druh CHT redukce rizika
Pt bez FU 26% ± 5
Pt + FU 23% ± 5
FU bez Pt 19% ± 5
CHT bez Pt a FU 10% ± 4
PolyCHT s Pt 23% ± 5
PolyCHT bez Pt 20% ± 6
MonoCHT s Pt 26% ± 5
MonoCHT bez Pt 11% ± 4
5-fluorouracil
5-FU je fázově specifický antimetabolit - S fáze (fluorovaný pyrimidin strukturálně podobný uracilu)
Mechanismus účinku:
1. 5-fluoro-2'-deoxyuridin-5'-fosfát FdUMP inhibuje tymidilát syntetázu, čímž inhibuje metylaci kyseliny deoxyuridylové na kyselinu tymidilovou (blok syntézy DNA)
2. FUTP ... inkorporace do DNA
3. Navíc je fluorouracil v malém rozsahu inkorporován do RNA, čímž vzniká nepřirozená RNA.
4. inhibuje utilizaci preformovaného uracilu při syntéze RNA blokádou uracilfosfatázy.
...synchronizace buněčného cyklu
Střední poločas eliminace z plazmy = cca 16 minut (8-20 minut) - za 3 hodiny i.v. bolusu již nelze lék v plazmě detekovat
V kombinaci s RT ideální kontinuální infuze
Dávka
- C.I.V.: 225 mg/m2/den 7 dní v týdnu nebo 300 mg/m2/den 5 dní v týdnu
- Bolus FU 425 mg/m2 první a poslední 3-4-5 dní
Cca 15% 5-FU je vylučováno ledvinami, 60-80% se vyloučí respiračním traktem ve formě CO2 (vzhledem k pomalé renální exkreci není nutno snižovat dávky 5-FU u pacientů se zhoršenými renálními funkcemi, redukce pouze v případě anúrie)
Indikace kCHRT: Ca GIT ...
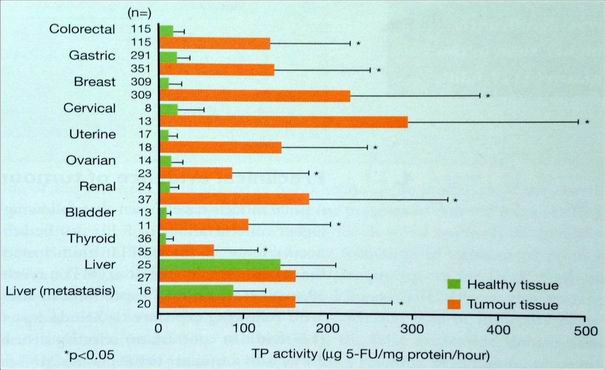
kapecitabin
koncentrace tymidin fosforylázy (TP) vyšší v nádoru
Schüller et al, Cancer Chemother Pharmacol. 2000;45(4):291-7
Miwa et al, J Cancer 1998;34(8): 1274-81
Enzymatická konverze kapecitabinu
prodrug 5-FU
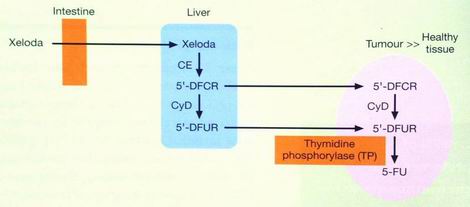
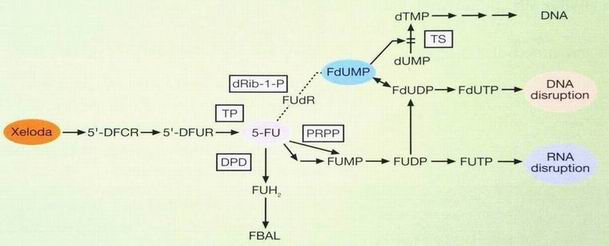
kapecitabin
tymidin fosforyláza (TP) indukována RT
- až 13x vyšší aktivita TP po ozáření
Sawada, Clin Cancer Res 1999; 5:2948-53
Koncentrace 5-FU u CRC v nádorové tkáni byly 3.2x vyšší než v přilehlé zdravé tkáni a 21x vyšší než v plasmě
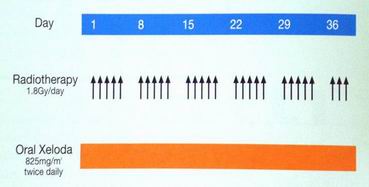
Kapecitabin - dávka
konkomitantně s RT 2x denně 825 mg/m2 po celou dobu RT včetně víkendů (German trial)
Dunst J et al, JCO 2002;20(19):3983-91
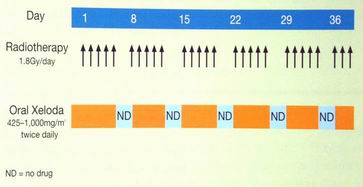
konkomitantně s RT 2x denně 900 mg/m2 jen všední dny po celou dobu RT (Australian trial)
Ngan SY et al, Br J Cancer 2004;91(6):1019-24
Kapecitabine - redukce dávky
hematotoxicita –
- G2 NCIC – 2. výskyt redukce na 75%, nedojde-li ke zlepšení na G0-1, tak redukce na 50% dávky a ev. EX
- G3 NCIC – snížení dávky na 75%, nedojde-li ke zlepšení pak na 50% a ev. ukončit CHT
- G4 NCIC – trvale přerušit léčbu
kožní reakce
renální insuficience
- GF < 30 ml/min - KONTRAINDIKACE (těžké CHRI)
- GF 30-50 ml/min 75% redukce dávky
- GF > 50 ml/min 100% dávky
jaterní insuficience
- u mírné a střední insuficience netřeba redukce
Temozolomid 1
Indikace konkomitantní CHRT: High grade gliomy mozku (AA, GB, AO)
Biologická dostupnost po p.o. podání téměř 100%
Aktivace bez účasti hepatálního a renálního metabolismu, při fyziol. pH spontánní degradace na MTIC (alkylační látka podobná DTIC)
Stabilní distribuce v různých tkáních – proniká HEB
Poločas vylučování dvoufázový 1,1 hod a 8,4 hod.
Aditivní až synergistický efekt s RT ! (Stupp, JCO 2002, 20(5): 1375-1382)
Toxicita: nauzea a vomitus, myelosuprese (nadir mezi 21. a 28. dnem, rychlá úprava k normě obvykle v průběhu 1-2 týdnů)
Temozolomid 2
Mechanismus účinku: MTIC metyluje celou řadu nukleotidů v DNA, RNA a cytosolických proteinů ... kritickou roli sehrává methylguanin (O6-MG) ... neschopnost DNA nalézt komplementární bázi … vznik zlomů v DNA → zástava buněčného cyklu v G2/M kontrolním bodě → synchronizace buněk v radiosenzitivní fázi (Hirose, Cancer Res 2001, 61:1957-1963)
Reparace DNA ... AGT (O6-alkylguanin-DNA-alkyltransferáza) přenáší methylovou skupinu z G na vnitřní doménu své molekuly ... tím se však ireverzibilně inaktivuje ... kontinuální expozice TMZ vede k depleci AGT (Friedman, JCO 1998, 16:3851-3857)
... proto podávat TMZ bez víkendových pauz !
Temozolomid 3
Dávkování: p.o. 75 mg/m2 1x denně konkomitantně s RT 60-65 Gy, TMZ včetně víkendů; + 6 cyklů adjuvantně 200 mg/m2 5 dní á 28 dní (nebo do progrese)
- G3+4 trombocytopenie a neutropenie u ≤ 10% pts
Redukce dávek při hematologické toxicitě (neu<1500/mm3, tro <100000/mm3)…odložení o týden do normalizace a byl-li pokles neu<1000/mm3, tro <50000/mm3… pak redukce denních dávek v dalším cyklu o 50 mg/m2 . Nedojde-li k úpravě KO do 4 týdnů, či by bylo nutno snížit dávku pod 100 mg/m2, pak ukončit CHT
Podávat nalačno - s potravou vede k poklesu Cmax o 33% a zmenšení AUC o 9%.
Adjuvantní chemoradioterapie s TMZ
Stupp R, N Engl J Med. 2005; 352(10):987-96
MTX
- antimetabolit, působí hlavně v S-fázi kompetitivní inhibicí dihydrofolát reduktázy ... zástava syntézy DNA
- nerozpustný v tucích – velmi pomalá resorpce po intratekálním podání do cirkulace (vylučuje se ledvinami a jen malá část játry - poločas 8-10 hod.)
- CAVE je-li v ozařovaném objemu mícha, či mozek, po intratekálním podání !
- Antidotum Ca folinát p.o., i.m. a i.v. (v dávce/hod. stejné nebo vyšší jako bylo množství MTX)
- Dávka: 40-60 mg/m2 1x týdně
- NÚ limitující RT: stomatitis, erytematosní vyrážka, pruritus, změny pigmentace, fotosenzitivita (až epidermální nekrolýza a Stevens-Johnsonův sy)
Gelmanova a Taylorova formule k redukci dávky dle GF:
D MTX= dávka pro normální GF x (GF ml/min / 70)
Gelman, JCO 1984;2;1404-1413
U dávek nad 1 g/m2 – hydratace + alkalizace moči
BLM
látka s radiomimetickým účinkem
DNA ss breaks a ds breaks, vazba Fe2+ na jeden konec molekuly a spontánní oxidace na 3+ ... peroxidace
inhibice G2 fáze
Poločas 10-20 min – 2-3 hod.
kombinace CHT režimů u ORL tu
Dávka 5 mg 2x týdně během RT
Zvýšená pneumotoxicita u GF pod 35 ml
Plicní fibroza po překročení c.d. 300mg/m2
Snížit D na 50% u GF pod 30 ml/min.
CAVE současně BLM + RT hrudníku a oxygenoterapie!
Mitomycin C
alkylační látka
více toxický pro hypoxické než aerobní buňky
(Rockwell, Semin Oncol 1992)
podání 15 min-24 hod před RT - supraaditivní efekt ... podání po RT jen aditivní efekt
(Gran, IJROBP 1991; Seiman, NCI 1988)
Indikace: ca ORL (1x 15 mg/m2), ca anu
Taxany
inhibice mitosy blokem G2/M- stabilizace mikrotubulů proti depolymeraci (inhibice jejich funkce v bun. cyklu) ... synchronizace buněčného cyklu
Indukce apoptózy po RT
větší efekt 48 hodin před RT než 24 hod před RT
Hennequin C. Cancer Radiother. 2004;8 Suppl 1:S95-105
Dávka taxanů
Monoterapie – paklitaxel 40 mg/m2 1x týdně konkomitantně s RT
Indikace monoterapie: u renální insuficience – ca colli uteri, SCC ORL oblasti
Kombinace u BCA, ca moč. měchýře, ca jícnu …
Antracykliny
ca prsu .. konkomitantně se CHRT již neužívá (FAC, AC, mitoxantron…)
inhibitor mitochondriální respirace
ss breaks DNA
„Recall fenomén“ – vyvolání kožní reakce podáním CHT s antracykliny i týdny po odeznění akutní reakce po ukončení RT
Tamoxifen + RT ?
Zvyšuje hladinu TGF beta (systémově)
TMX = systémová léčba vs RT = lokální
Bentzen SM. J Natl Cancer Inst. 1996;88(13):918-22.
- 84 postmenopauzálních žen po ME – randomizovaná studie – adjuv. RT vs adjuv. RT + tamoxifen RT na (regionální lymfatika + hrudní stěnu; X 8 MV + E) – hodnocena optická densita na RTG plic před a po RT– plicní fibrosa zvýšena u RT+TMX (relative risk = 2.0; 95% confidence interval [CI] = 1.2-3.5; P =0.01)
Koc M. Radiother Oncol. 2002 Aug;64(2):171-5.
- 104 žen, ME + adjuv. RT (Co60) +/- TMX - hodnocena optická densita na CT plic před a po RT – plicní fibrosa vyšší u TMX+RT (P<0,01) zvláště u starých a postmenopauzálních žen
Huang EY. Radiother Oncol. 2000 Oct;57(1):91-6.
- 109 žen – adjuv. RT hrudní stěny a reg. lymfatik – prediktory vzniku plicní fibrosy - tamoxifen (P=0.03), BMI (P<0.01), krátká celková ozařovací doba (P=0,03)
Minimalizovat ozářený objem plíce – 3D plánování
Nepodávat současně TMX u starých žen ozařovaných na oblast hrudní stěny/prsu a regionálních lymfatik.
Inhibitory EGFR
Cetuximab + RT (SCC ORL oblasti)
Počátečná D 400 mg/m2 a poté 1x týdně 250 mg/m2
Poločas eliminace 97 hod
Redukce dávky o 50 mg/m2 při těžké toxicitě (při 4. výskytu toxicity ukončit)
MÚ: overexprese EGFR u 80-100% ORL tu → radiosenzibilizace inhibicí reparace DNA blokádou DNA PK a tím zábrana NHEJ; zvyšuje apoptozu inhibicí AKT proteinu (PI3K-AKT survival pathway)
imunoterapie – IFN-α, IL-2
interferon alfa – zvyšuje akutní reakci
- antagonista PDGF a TGF beta
- ovlivnění S fáze buněčného cyklu
- Inhibice reparace DNA
Radioprotekce
Amifostin … 500 mg s.c. maximálně 30 min. před ozářením .. Protekce slinných žláz – NÚ: nauzea, hypotenze, kožní exyntém …
Hypoxie - Snížená hladina Hb !
Nejdostupnější radioprotekce je pečlivé vykrytí rizikových orgánů a orgánů, které netřeba zářit (3D RT, IMRT, IGRT …)
.. Inhibitory apoptózy bb normální tkáně…
Mechanismus účinku radioterapie

Časový sled změn v biologické tkáni po ozáření
(Basic Clinical Radiobiology, Steel GG, 3rd edition, 2002).
DNA

Velikosti elementárních částic
Elektron … 10-18m ... 0,000 000 001 nm
Proton, neutron – velikost cca 1000x větší než elektron ... 10-15 m
Dávka 1-2 Gy (D0) způsobí v buňce 105 ionizací
Po této dávce lze zaznamenat v buňce:
- přes 1000 poškozených bází
- cca 1000 jednovláknových zlomů
- jen cca 30-40 dvouvláknových zlomů
Proteiny kóduje 1-2% DNA.
Nicméně cca 1/3 buněk po D0 IZ dále přežívá
Vlastní metabolismus buňky způsobí >10 000 ssb a poškození bazí/den
Basic Clinical Radiobiology, Steel GG, 3rd edition, 2002


Cílovou strukturou IZ je DNA

Počítačově simulovaná dráha elektronu, ke konci dráhy vzniká „hotspot“ ve kterém se v okruhu několika nm vyskytne větší množství ionizací a ty mohou způsobit DSB a řadu SSB a poškození bazí= „místo znásobeného poškození“.
(Basic Clinical Radiobiology, Steel GG, 3rd edition, 2002)
Biologický efekt ionizace je ovlivněn 3 hlavními faktory
1.počtem ionizací v dostatečné blízkosti DNA
2.vznikem volných radikálů
3.buněčnými reparačními procesy – reparace DNA
inducibilní proces - po RT dochází k aktivaci genů pro reparaci (fibroblast growth factor FGF, TNF-...)
ss DNA breaks - oprava podle druhého vlákna
excisní reparací - jednoduchá záměna báze v DNA
„mismatch“ reparací - chyba v párování
ds DNA breaks – také lze opravit !!!
„non-homologní end-joining“ (NHEJ) - cílem je zachování kontinuity DNA, která je dosyntetizována a spojena náhodně (80% dsb, T1/2 hodiny)
homologní rekombinační reparace (HRR) - vytvoření homologní kopie DNA podle vlákna druhého z páru chromozomů v jádře a zreparování příslušného místa; HRR je rychlejší v období S fáze (obě molekuly DNA poblíž sebe = důvod proč je S fáze nejresistentnější fází cyklu) – 20% dsb, T1/2 den
Mechanismus účinku radioterapie

&Nedojde-li k reparaci DNA, následuje smrt buňky (interfázická smrt u leukemických a normálních leukocytů) nebo fixace poškození - buňky mohou prodělat i několik mitotických dělení, než odumřou – mitotická smrt.
&2 základní způsoby buněčné smrti v závislosti na průběhu a morfologii procesu - apoptóza a nekróza.
Buněčný cyklus
Hlavní kontrolní uzel buněčného cyklu je umístěn cca ve 2/3 G1 fáze - poškození DNA blokuje vstup do S fáze zajištěním transkripčního faktoru ve vazbě na Rb protein přes protein p53

G2 kontrolní uzel - poškození DNA blokuje vstup do mitózy zabráněním aktivace cdk1. Proteiny ATR a ATM fosforylují proteiny chk1 a chk2, které aktivují cdc25c, což je aktivační kináza nutná pro přechod buněčného cyklu v G2/M fázi

Chemoradioterapie solidních nádorů
1.Přidání CHT k RT není důvodem ke snížení celkové plánované dávky RT!
2.Netřeba modifikovat cílový objem pro RT kvůli konkomitantní CHRT!
3.Konkomitantní CHRT zvyšuje akutní toxicitu oproti samotné RT (nikoliv pozdní)!
(CAVE 1. a 2. neplatí pro dětské nádory, lymfomy a NSCLC!)
- neoadjuvantní CHT
- konkomitantní CHRT
- adjuvantní CHT
Přehled indikací konkomitantní CHRT
Nádory hlavy a krku – R, A
Ca colli uteri - R
Anální ca - R
Bronchogenní ca – R
GB+AA cerebri – R, A
Ca recti – N, A, R
Ca žaludku – A
Ca jícnu – N, R
Ca močového měchýře – R
...
Přehled užívaných cytostatik
cisplatina, carboplatina
5-FU, kapecitabin
taxany
temozolomid
MTX
BLM
mitomycin C
cetuximab
Důvody k CHRT
- Překonání resistence k 1 druhu léčby
- Radiosenzibilizace (snížení reparace DNA)
- „spatial co-operation“ – ovlivnění mikrometa mimo ozařovaný objem – NPC, BCA…
- Příznivá změna radiobiologie tumoru – reoxygenace, redistribuce bun. cyklu
Mechanismus účinku CHRT
Fáze cyklu Působení chemických látek a fyzikálních metod:
G0 hypertermie
G1 alkylační látky, prednison, TMX, VCR, BCNU, MTX
S 5-FU, HU, AraC, mmC, alkylační látky, hypertermie
G2 BLM, alkylační látky
M BLM, VBL, VCR, kolchicin, tenipozid
Radiosenzitivní části buněčného cyklu:
G1/S
G2/M

Terapeutický poměr

Význam neoadjuvantní chemoterapie před radikální radioterapií
zmenšení tu masy
→↑prokrvení (zlepšení distribuce CHT)
→↑reoxygenace (↓hypoxických bb),
→↑repopulace (↓G0 bb)
systémové působení CHT (prevence meta – NPC, BCA...)
zjištění citlivosti tu k CHT předpovídá efekt RT (larynx ca)
zmenšení velikosti ozařovacího pole (lymfomy)
snížení celkové dávky RT (dětské nádory)
„čekací doby na RT“ (HN ca)
Rizikové orgány specifické pro konkomitantní CHRT
ledviny – cisplatina, carboplatina, etoposid, ifosfamid, MTX, BLM
srdce – antracykliny, 5-FU, taxany
plíce – BLM, ADM
játra – antracykliny, vinca-alkaloidy, taxany
NS – MTX, cisplatina, taxany, ifosfamid
Stanovení dávky CHT
Dle tělesného povrchu (cispt, FU, docetaxel...)
- Mosteller
BSA (m²) = { [Výška(cm) x Váha(kg) ] / 3600 }0,5
- Du Bois
BSA (m²) = 0.20247 x Výška(m)0.725 x Váha(kg)0.425
- Haycock formula
BSA (m²) = 0.024265 x Výška(cm)0.3964 x Váha(kg)0.5378
U obézních vzít jako horní hranici pro určení dávky 2,0-2,2 m2 (doporučení RCR UK)
Dle GF (u carboplatiny)
Výpočet ideální tělesné váhy pro redukci dávek CHT u obézních pacientů
Ideální váha pro muže (Divinova formule)
= 50,0 + [0,906 x (výška – 152,4)]
Ideální váha pro ženy (Robinsonova formule)
= 45,5 + [0,906 x (výška – 152,4)]
Kintzel PE, Cancer Treat rev 1995;21;33-64
BMI = váha (kg) / výška2 (m)
Nadváha = BMI > 25
Obezita = BMI > 30
Výpočet GF
Dynamická scintigrafie ledvin – EDTA
Wrightova formule
GF = {[6580 – (38,8 x věk)] x BSA x [1-(0,168 x pohlaví)]} / kreatinin v séru
muž = 0, žena = 1; GF (ml/min), věk (roky), BSA (m2), plasma kreatinin (µmol/l)
Cockcroftův-Gaultův vzorec
Muži: GF = 1,23 x (140-věk) x váha / kreatinin v séru
Ženy: GF = 1,04 x (140-věk) x váha / kreatinin v séru
GF (ml/min), věk (roky), váha (kg), výška (cm), plasma kreatinin (mol/l)
Standartní redukce dávky dle GF (doporučení RCR UK)

Cisplatina, karboplatina
alkylační látky
DNA crosslinks ... inhibice reparace DNA
... preferenční účinek v G1
RT zvyšuje transport Pt do buňky (a tím zvyšuje sama svůj účinek)
hypoxie může zvýšit radiosenzibilizaci Pt
poločas třífázový (8-50 min, 16 hod-dny, několik dní)
podat před RT
Dávka konkomitantní CHRT: (hydratační režim, Pt nikdy do G5%, ale do FR či Ringerlaktátu)
- 40 mg/m2 1x týdně
- 100 mg/m2 1x za 3 tý
potenciace Pt též s FU, cytA, VBL, VCR, ADM, eto
Indikace kCHRT: ORL, ca colli uteri, BCA, ca m.m., ca jícnu, ca anu
Cisplatina vs karboplatina
Cisplatina má vyšší účinek než karboplatina u nádorů hlavy a krku
DeAndres et al, JCO 1995; 13:1493-1500
Forastiere et al, JCO 1992; 10:1245-1251
Jacobs et al, JCO 1992; 10:257-263
Redukce dávky cisplatiny
Dle GF
- GF > 50 ml/min (0,9 ml/s) … netřeba redukce
- GF 30-50 ml/min …podat nižší dávku úměrnou snížení GF
100 ml/min = norma, při 40 ml/s podat 40% dávky
- GF < 30 ml/min (0,6 ml/s) … nepodávat cisplatinu
Dle KO
- Odložit další cyklus dokud ANC > 1,0
- Odložit další cyklus dokud trombocyty > 75
Při neurotoxicitě – ukončit CHT s cisplatinou
Dávka karboplatiny
Calvertova formule:
Dávka karboPt = cílové AUC x (GF+25)
GF v ml/min
JCO 1989;7;1748-56.
Při GF < 20 ml/min karboplatinu nepodávat
Dle KO
- Odložit další cyklus dokud ANC > 1,0
- Odložit další cyklus dokud trombocyty > 75
MACH NC 2, 2004 – SCC H&N
87 randomizovaných studií 1965-2000 (16640 pts)

Prokázán celkový 5% benefit přidání CHT k RT, nejvyšší přínos má konkomitantní CHRT (absolutní benefit 8% v 5 letech – se samotnou cisPt 11% benefit)
MACH NC 2, 2004
Přínos CHT dle složení
Druh CHT redukce rizika
Pt bez FU 26% ± 5
Pt + FU 23% ± 5
FU bez Pt 19% ± 5
CHT bez Pt a FU 10% ± 4
PolyCHT s Pt 23% ± 5
PolyCHT bez Pt 20% ± 6
MonoCHT s Pt 26% ± 5
MonoCHT bez Pt 11% ± 4
5-fluorouracil
5-FU je fázově specifický antimetabolit - S fáze (fluorovaný pyrimidin strukturálně podobný uracilu)
Mechanismus účinku:
1. 5-fluoro-2'-deoxyuridin-5'-fosfát FdUMP inhibuje tymidilát syntetázu, čímž inhibuje metylaci kyseliny deoxyuridylové na kyselinu tymidilovou (blok syntézy DNA)
2. FUTP ... inkorporace do DNA
3. Navíc je fluorouracil v malém rozsahu inkorporován do RNA, čímž vzniká nepřirozená RNA.
4. inhibuje utilizaci preformovaného uracilu při syntéze RNA blokádou uracilfosfatázy.
...synchronizace buněčného cyklu
Střední poločas eliminace z plazmy = cca 16 minut (8-20 minut) - za 3 hodiny i.v. bolusu již nelze lék v plazmě detekovat
V kombinaci s RT ideální kontinuální infuze
Dávka
- C.I.V.: 225 mg/m2/den 7 dní v týdnu nebo 300 mg/m2/den 5 dní v týdnu
- Bolus FU 425 mg/m2 první a poslední 3-4-5 dní
Cca 15% 5-FU je vylučováno ledvinami, 60-80% se vyloučí respiračním traktem ve formě CO2 (vzhledem k pomalé renální exkreci není nutno snižovat dávky 5-FU u pacientů se zhoršenými renálními funkcemi, redukce pouze v případě anúrie)
Indikace kCHRT: Ca GIT ...
kapecitabin
koncentrace tymidin fosforylázy (TP) vyšší v nádoru
Schüller et al, Cancer Chemother Pharmacol. 2000;45(4):291-7
Miwa et al, J Cancer 1998;34(8): 1274-81

Enzymatická konverze kapecitabinu
prodrug 5-FU


kapecitabin
tymidin fosforyláza (TP) indukována RT
- až 13x vyšší aktivita TP po ozáření
Sawada, Clin Cancer Res 1999; 5:2948-53
Koncentrace 5-FU u CRC v nádorové tkáni byly 3.2x vyšší než v přilehlé zdravé tkáni a 21x vyšší než v plasmě
Kapecitabin - dávka
konkomitantně s RT 2x denně 825 mg/m2 po celou dobu RT včetně víkendů (German trial)
Dunst J et al, JCO 2002;20(19):3983-91

konkomitantně s RT 2x denně 900 mg/m2 jen všední dny po celou dobu RT (Australian trial)
Ngan SY et al, Br J Cancer 2004;91(6):1019-24

Kapecitabine - redukce dávky
hematotoxicita –
- G2 NCIC – 2. výskyt redukce na 75%, nedojde-li ke zlepšení na G0-1, tak redukce na 50% dávky a ev. EX
- G3 NCIC – snížení dávky na 75%, nedojde-li ke zlepšení pak na 50% a ev. ukončit CHT
- G4 NCIC – trvale přerušit léčbu
kožní reakce
renální insuficience
- GF < 30 ml/min - KONTRAINDIKACE (těžké CHRI)
- GF 30-50 ml/min 75% redukce dávky
- GF > 50 ml/min 100% dávky
jaterní insuficience
- u mírné a střední insuficience netřeba redukce
Temozolomid 1
Indikace konkomitantní CHRT: High grade gliomy mozku (AA, GB, AO)
Biologická dostupnost po p.o. podání téměř 100%
Aktivace bez účasti hepatálního a renálního metabolismu, při fyziol. pH spontánní degradace na MTIC (alkylační látka podobná DTIC)
Stabilní distribuce v různých tkáních – proniká HEB
Poločas vylučování dvoufázový 1,1 hod a 8,4 hod.
Aditivní až synergistický efekt s RT ! (Stupp, JCO 2002, 20(5): 1375-1382)
Toxicita: nauzea a vomitus, myelosuprese (nadir mezi 21. a 28. dnem, rychlá úprava k normě obvykle v průběhu 1-2 týdnů)
Temozolomid 2
Mechanismus účinku: MTIC metyluje celou řadu nukleotidů v DNA, RNA a cytosolických proteinů ... kritickou roli sehrává methylguanin (O6-MG) ... neschopnost DNA nalézt komplementární bázi … vznik zlomů v DNA → zástava buněčného cyklu v G2/M kontrolním bodě → synchronizace buněk v radiosenzitivní fázi (Hirose, Cancer Res 2001, 61:1957-1963)
Reparace DNA ... AGT (O6-alkylguanin-DNA-alkyltransferáza) přenáší methylovou skupinu z G na vnitřní doménu své molekuly ... tím se však ireverzibilně inaktivuje ... kontinuální expozice TMZ vede k depleci AGT (Friedman, JCO 1998, 16:3851-3857)
... proto podávat TMZ bez víkendových pauz !
Temozolomid 3
Dávkování: p.o. 75 mg/m2 1x denně konkomitantně s RT 60-65 Gy, TMZ včetně víkendů; + 6 cyklů adjuvantně 200 mg/m2 5 dní á 28 dní (nebo do progrese)
- G3+4 trombocytopenie a neutropenie u ≤ 10% pts
Redukce dávek při hematologické toxicitě (neu<1500/mm3, tro <100000/mm3)…odložení o týden do normalizace a byl-li pokles neu<1000/mm3, tro <50000/mm3… pak redukce denních dávek v dalším cyklu o 50 mg/m2 . Nedojde-li k úpravě KO do 4 týdnů, či by bylo nutno snížit dávku pod 100 mg/m2, pak ukončit CHT
Podávat nalačno - s potravou vede k poklesu Cmax o 33% a zmenšení AUC o 9%.
Adjuvantní chemoradioterapie s TMZ
Stupp R, N Engl J Med. 2005; 352(10):987-96

MTX
- antimetabolit, působí hlavně v S-fázi kompetitivní inhibicí dihydrofolát reduktázy ... zástava syntézy DNA
- nerozpustný v tucích – velmi pomalá resorpce po intratekálním podání do cirkulace (vylučuje se ledvinami a jen malá část játry - poločas 8-10 hod.)
- CAVE je-li v ozařovaném objemu mícha, či mozek, po intratekálním podání !
- Antidotum Ca folinát p.o., i.m. a i.v. (v dávce/hod. stejné nebo vyšší jako bylo množství MTX)
- Dávka: 40-60 mg/m2 1x týdně
- NÚ limitující RT: stomatitis, erytematosní vyrážka, pruritus, změny pigmentace, fotosenzitivita (až epidermální nekrolýza a Stevens-Johnsonův sy)
Gelmanova a Taylorova formule k redukci dávky dle GF:
D MTX= dávka pro normální GF x (GF ml/min / 70)
Gelman, JCO 1984;2;1404-1413
U dávek nad 1 g/m2 – hydratace + alkalizace moči
BLM
látka s radiomimetickým účinkem
DNA ss breaks a ds breaks, vazba Fe2+ na jeden konec molekuly a spontánní oxidace na 3+ ... peroxidace
inhibice G2 fáze
Poločas 10-20 min – 2-3 hod.
kombinace CHT režimů u ORL tu
Dávka 5 mg 2x týdně během RT
Zvýšená pneumotoxicita u GF pod 35 ml
Plicní fibroza po překročení c.d. 300mg/m2
Snížit D na 50% u GF pod 30 ml/min.
CAVE současně BLM + RT hrudníku a oxygenoterapie!
Mitomycin C
alkylační látka
více toxický pro hypoxické než aerobní buňky
(Rockwell, Semin Oncol 1992)
podání 15 min-24 hod před RT - supraaditivní efekt ... podání po RT jen aditivní efekt
(Gran, IJROBP 1991; Seiman, NCI 1988)
Indikace: ca ORL (1x 15 mg/m2), ca anu
Taxany
inhibice mitosy blokem G2/M- stabilizace mikrotubulů proti depolymeraci (inhibice jejich funkce v bun. cyklu) ... synchronizace buněčného cyklu
Indukce apoptózy po RT
větší efekt 48 hodin před RT než 24 hod před RT
Hennequin C. Cancer Radiother. 2004;8 Suppl 1:S95-105
Dávka taxanů
Monoterapie – paklitaxel 40 mg/m2 1x týdně konkomitantně s RT
Indikace monoterapie: u renální insuficience – ca colli uteri, SCC ORL oblasti
Kombinace u BCA, ca moč. měchýře, ca jícnu …
Antracykliny
ca prsu .. konkomitantně se CHRT již neužívá (FAC, AC, mitoxantron…)
inhibitor mitochondriální respirace
ss breaks DNA
„Recall fenomén“ – vyvolání kožní reakce podáním CHT s antracykliny i týdny po odeznění akutní reakce po ukončení RT
Tamoxifen + RT ?
Zvyšuje hladinu TGF beta (systémově)
TMX = systémová léčba vs RT = lokální
Bentzen SM. J Natl Cancer Inst. 1996;88(13):918-22.
- 84 postmenopauzálních žen po ME – randomizovaná studie – adjuv. RT vs adjuv. RT + tamoxifen RT na (regionální lymfatika + hrudní stěnu; X 8 MV + E) – hodnocena optická densita na RTG plic před a po RT– plicní fibrosa zvýšena u RT+TMX (relative risk = 2.0; 95% confidence interval [CI] = 1.2-3.5; P =0.01)
Koc M. Radiother Oncol. 2002 Aug;64(2):171-5.
- 104 žen, ME + adjuv. RT (Co60) +/- TMX - hodnocena optická densita na CT plic před a po RT – plicní fibrosa vyšší u TMX+RT (P<0,01) zvláště u starých a postmenopauzálních žen
Huang EY. Radiother Oncol. 2000 Oct;57(1):91-6.
- 109 žen – adjuv. RT hrudní stěny a reg. lymfatik – prediktory vzniku plicní fibrosy - tamoxifen (P=0.03), BMI (P<0.01), krátká celková ozařovací doba (P=0,03)
Minimalizovat ozářený objem plíce – 3D plánování
Nepodávat současně TMX u starých žen ozařovaných na oblast hrudní stěny/prsu a regionálních lymfatik.
Inhibitory EGFR
Cetuximab + RT (SCC ORL oblasti)
Počátečná D 400 mg/m2 a poté 1x týdně 250 mg/m2
Poločas eliminace 97 hod
Redukce dávky o 50 mg/m2 při těžké toxicitě (při 4. výskytu toxicity ukončit)
MÚ: overexprese EGFR u 80-100% ORL tu → radiosenzibilizace inhibicí reparace DNA blokádou DNA PK a tím zábrana NHEJ; zvyšuje apoptozu inhibicí AKT proteinu (PI3K-AKT survival pathway)
imunoterapie – IFN-α, IL-2
interferon alfa – zvyšuje akutní reakci
- antagonista PDGF a TGF beta
- ovlivnění S fáze buněčného cyklu
- Inhibice reparace DNA
Radioprotekce
Amifostin … 500 mg s.c. maximálně 30 min. před ozářením .. Protekce slinných žláz – NÚ: nauzea, hypotenze, kožní exyntém …
Hypoxie - Snížená hladina Hb !
Nejdostupnější radioprotekce je pečlivé vykrytí rizikových orgánů a orgánů, které netřeba zářit (3D RT, IMRT, IGRT …)
.. Inhibitory apoptózy bb normální tkáně…
Datum přednesení příspěvku: 5. 6. 2005





