Konference: 2012 3. pražské mezioborové onkologické kolokvium Prague ONCO
Kategorie: Ostatní
Téma: Review
Číslo abstraktu: 009
Autoři: prof. MUDr. Petra Tesařová, CSc.
Diabetes mellitus je nejčastější metabolické onemocnění ve světě i v České republice. Populace diabetiků stále narůstá. V současnosti trpí diabetem asi 250 milionů lidí. Příčinou jejich úmrtí jsou často komplikace – kardiovaskulární onemocnění a také zhoubné nádory. Vztah zhoubných nádorů a diabetu je v poslední době intenzivně zkoumán.
Karcinom a diabetes mellitus jsou dvě heterogenní, multifaktoriální, závažné a často chronické nemoci. Epidemiologické studie dokazují, že riziko vzniku některých zhoubných nádorů, například pankreatu, jater, prsu, tlustého střeva, močových cest a ženských pohlavních orgánů je u diabetiků vyšší. U diabetiků je lehce vyšší i mortalita zhoubných onemocnění.(1,2)
Řada klinických studií i výsledků jejich metaanalýz dokazuje vyšší riziko různých nádorů solidních (nádory jater, pankreatu, kolorekta, ledvin, močového měchýře, endometria i karcinomu prsu) i hematologických (hodgkinské a non-hodgkinské lymfomy) právě u diabetiků.(tabulka 1) Výsledky klinických studií zkoumajících riziko karcinomu prsu u diabetu nejsou zcela konzistentní, je to pravděpodobně způsobené tím, že diabetesje vlastně směs různých nozologických jednotek, které spojuje jen nález hyperglykemie. (2)
Tabulka 1: Metaanalýzy studií s informacemi o relativním riziku různých zhoubných nádorů u diabetu
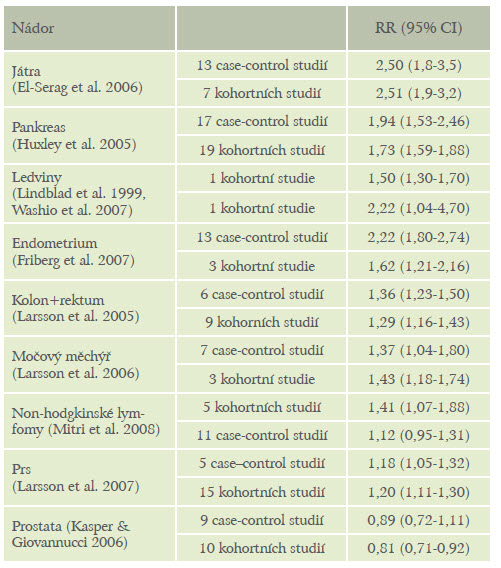
Vyšší incidence zhoubných onemocnění
Metaanalýzy klinických studií ukazují souvislost mezi diabetem a rizikem zhoubného nádoru ve vztahu ke dvěma klíčovým orgánům, játrům a pankreatu. Vysoká koncentrace inzulinu v portálním řečišti se považuje za jednu z možných příčin vyšší incidence hepatocelulárního karcinomu. Týká se to především pacientů s inzulin rezistentním diabetem 2. typu.(3)
Epidemiologické studie ukazují dvoj- až trojnásobnou incidenci hepatocelulárního karcinomu u diabetiků. Důvodem může být i obezita, vyskytující se až u 80 % diabetiků 2. typu, doprovázená často steatózou jater. Pacienti s diabetem mají také častěji cirhózu i infekci virem hepatitidy B a C. Vlastní mechanismus kancerogeneze souvisí se zánětem a reparativními procesy.
Výsledky časných studií vztahu karcinomu pankreatu a diabetu byly zavádějící, protože neodlišovaly premorbidní diabetes, předcházející vzniku nádoru, a diabetes jako důsledek destrukce slinivky již vzniklým nádorem. Na základě výsledků pozdějších studií byl ale u pacientů s diabetem diagnostikovaným mezi 45. a 50. rokem doporučován skrínink karcinomu pankreatu. Starší diabetici mají oproti stejně starým nediabetikům riziko karcinomu pankreatu až 8x vyšší. Laboratorní a klinické nálezy ukazují, že diabetes způsobený nádorem pankreatu vzniká prostřednictvím cytokinů, které nádor produkuje, spíše než přímou destrukcí endokrinní pankreatické tkáně nádorem. To odpovídá pozorování, že hyperglykemie se objevuje i u časných karcinomů pankreatu a neodpovídá jejich velikosti a stadiu.
Biologická souvislost mezi karcinomem pankreatu a cukrovkou je nejasná. Předpokládá se vyšší expozice inzulinu, který je uvolňován z endokrinní části pankreatu a vylučován ve vyšší koncentraci do krve. Tento mechanismus ale nevysvětluje značný výskyt tohoto nádoru u inzulinem léčených diabetiků nebo pacientů s diabetem I. typu.
Zvýšená incidence a mortalita diabetiků spojená s nádorem ledvin souvisí také patrně s obezitou, častější hypertenzí a diabetickou nefropatií. U vyššího výskytu karcinomu močového měchýře hraje kromě hyperinzulinemie pravděpodobně roli i častá močová infekce diabetiků.
Vyšší výskyt zhoubných nádorů ženských reprodukčních orgánů je u diabetiků nezávislý na obezitě, která je významným rizikovým faktorem pro karcinom prsu i endometria. Hyperinzulinemie zvyšuje také hladinu estrogenů a snižuje naopak hladinu plazmatických globulinů, na které se volné estrogeny váží. Zároveň může stimulovat sekreci androgenů v ovariích. Diabetičky jsou také častěji nullipary s poruchami menstruace i fertility.(3)
V některých studiích je diabetes II. typu spojen se zvýšeným rizikem kolorektálního karcinomu jak u mužů, tak u žen. Z dalších etiologických mechanismů je podezříván zpomalený průchod potravy střevem a vysoká koncentrace žlučových kyselin ve stolici pozorovaná právě u diabetiků.(4)
S imunologickou dysfunkcí, poruchou aktivity neutrofilů i buněčné humorální imunity diabetiků souvisí pravděpodobně vyšší incidence non-hodgkinských lymfomů.
Snížená incidence karcinomu prostaty
Naopak v řadě studií byl pozorován nižší výskyt karcinomu prostaty v subpopulaci diabetických mužů, průměrně o 16 %, související patrně se sníženou hladinou testosteronu u těchto nemocných.(5)
Vyšší mortalita diabetiků s malignitou
Souvislost mezi diabetem a vyšší úmrtností na zhoubné nádory prokázaly 3 z 5 studií s relativním rizikem RR 1,24 (95% CI = 0,95-1,62). V největší z nich s 588 321 nemocnými diabetem, z nichž 4 346 zemřelo na zhoubný nádor, bylo RR úmrtí na zhoubný nádor 1,27 (1,11-1,45) v porovnání s populací jedinců bez diabetu, srovnatelných v ostatních parametrech. Ve studii srovnávající úmrtnost na karcinom prsu v pětiletém sledování bylo riziko úmrtí na něj také statisticky významně vyšší (hazard ratio 1,39; 95% CI = 1,22-1,59, P < 0,0001). Jako hlavní důvod shledali autoři vyšší agresivitu nádorů diabetiček a také komorbidity a komplikace diabetu.
I mortalita na kolorektální karcinom je u diabetiků vyšší. Ze 6 studií to dokazují 4 (RR = 1,26; 95% CI = 1,05-1,50), ale heterogenita studiové populace výsledek trochu zpochybňuje. Také Meynhardtova studie dokazuje, že diabetes je spojen s vyšší mortalitou na kolorektální karcinom (3 759 patientů, 287 diabetiků). Pacienti s cukrovkou měli významně sníženu nejen dobu bez nemoci (DFS), ale i celkové přežití (OS) (DFS = 48 % vs. 59 %, P < 0,0001; OS = 57 % vs. 66 %, P < 0,0001). Medián přežití diabetiků byl 6 let a nemocných bez diabetu 11,3 let. Také rekurence byla častější mezi diabetiky (doba bez rekurence 56 % vs. 64 % u nediabetiků, P < 0,012).
Baronova studie z roku 2008 dokazuje, že úmrtnost u pacientů s nádory se liší, pokud mají zároveň i cukrovku – HR 1,41 (95% CI = 1,28-1,55). Vyšší úmrtnost se týká karcinomu prsu, endometria, tlustého střeva a konečníku. Spekuluje se o tom, že pacienti s diabetem nedostávají stejně radikální léčbu zhoubného nádoru, a to vzhledem ke komorbiditám porušujícím funkci ledvin nebo jater, případně i o možnosti horší odpovědi na chemoterapii při diabetu.(5)
Diabetes I. a II. typu a riziko nádoru
Cukrovka je soubor nemocí, které se projevují hyperglykemií. U diabetu I. typu (5-10 % všech diabetiků) je hyperglykemie způsobená absolutní poruchou sekrece endogenního inzulinu. Pacienti jsou zcela závislí na jeho zevní substituci. U diabetu II. typu (90 % pacientů) se společně diagnostikuje hyperglykemie a hyperinzulinemie, protože důvodem metabolické poruchy je necitlivost periferních tkání k endogennímu inzulinu. Teprve když buňky β zcela vypovědí svoji funkci, je nutné diabetes II. typu léčit exogenním inzulinem. Vzhledem k počtu pacientů probíhá většina klinických studií u diabetiků II. typu. Jejich výsledky ale nejsou pravděpodobně přenositelné na populaci diabetiků typu I.
Ty z mála studií věnovaných diabetikům typu I ukazují, že i tato populace má vyšší riziko vzniku nádorů oproti nediabetikům (RR 1,3): riziko karcinomu žaludku (SIR = 2,3; 95% CI = 1,1-4,1), endometria (SIR = 2,7; 95% CI = 1,4-4,7) a děložního čípku (1,6; CI = 1,1-2,2). Jiná studie prokazuje dvojnásobné riziko vzniku karcinomu pankreatu u diabetiků I. typu.
Další studie ale svými výsledky nepotvrdily statistickou významnost rizika zhoubného nádoru u diabetiků I. typu.
Role hyperinzulinemie
V rámci embryonálního vývoje plní inzulin nejen funkci metabolickou, proteoanabolickou, ale také mitogenní se stimulací proliferace. To potvrzují studie in vitro i pokusy na zvířecích modelech. Diabetici I. typu jsou vystaveni vyšší expozici exogenního inzulinu podávaného léčebně, u diabetiků II. typu je charakteristická hyperinzulinemie v důsledku rezistence na inzulin.
U diabetiků I. typu nemůže exogenní inzulin zcela kopírovat fyziologické cesty endogenního inzulinu, který se dostává nejprve do jater a zde je z 80 % degradován. Exogenní inzulin přichází cestou cirkulace k periferním tkáním ve dvou- až pětinásobné koncentraci oproti fyziologické hodnotě a zároveň ve stejné chvíli i do jater.
Naopak u diabetu II. typu jsou tkáně tělesných orgánů po dlouhou dobu vystaveny endogenní hyperinzulinemii a hyperglykemii. Teprve v situaci, kdy dojde postupně ke snížení a vyhasnutí funkce β buněk, dostává se pacient s diabetem II. typu do stejné situace jako diabetici typu I. Hyperinzulinemie může hrát roli v progresi nádoru a souvisí s vyšším výskytem zhoubných onemocnění u diabetiků.
Hyperinzulinemie zvyšuje také hladinu aromatázy v tukové tkáni a zároveň snižuje množství vazebného proteinu pro estrogeny, které činností aromatázy vznikají. Zvýšená expozice estrogenům vede ke zvýšení rizika vzniku hormondependentních karcinomů prsu.(6)
Inzulin a IGF-1
Inzulin se po aplikaci váže na inzulinový receptor (IR) a aktivuje receptor pro inzulinu podobný růstový faktor typu 1(IGF-1), který vykazuje s IR 80% homologii, ale jeho aktivace má větší mitogenní a transformační dopady. Většina nádorových buněk má zvýšené množství IR ve dvou izoformách: A a B. Především vazba inzulinu na receptor IR-A, který v nádorových buňkách převažuje, vede k aktivaci růstu nádorové tkáně.(7) Mitogenní účinek inzulinu může být ještě posílen postreceptorovým molekulárním mechanismem, především aktivací AMP – aktivovanou proteinkinázou (AMPK) a nebo aktivací mammalian target of rapamycin (mTOR) metabolické cesty s širším působením v regulaci tělesné nutrice.
IGF-1 a IGF-2 se váží na podjednotku α IGF-1R. To způsobuje fosforylaci substrátu inzulinového receptoru (IRS) s fosforylací p85 regulační podjednotky fosfatidylinositol 3-kinázy (PI3K) a aktivaci p110 katalytické podjednotky. To vede k formaci fosfatidylinositol 3,4 fosfátu (PIP2) a fosfatidylinositol 3,4,5 fosfátu (PIP3). PIP3 potom aktivuje Akt tumor supresorová fosfatáza, tenzinový homolog odstraněný z chromozomu 10 (PTEN), inhibuje PI3K. Akt inhibuje apoptózu aktivací antagonisty BCL-2 buněčné smrti (BAD) a stimuluje syntézu proteinů aktivací mammalian target of rapamycin (mTOR). mTOR aktivuje ribozomální S6 kinázu (S6K) a eukaryotický iniciační faktor 4E vážící protein 1 (4E-BP-1), což vede k syntéze proteinů. Aktivace mTOR je inhibovaná komplexem tuberózní sklerózy a TSC1/TSC2. V nepřítomnosti buněčné výživy se zvyšují hladiny AMPK a inhibují syntézu proteinů ovlivněním TSC1/2 a mTOR. Signalizace prostřednictvím IGF-1R také aktivuje adaptační proteiny Shc a GRB2, což vede k aktivaci mitogen- -aktivované proteinové kinázy (MAPK). Výsledkem je buněčná proliferace. Hyperinzulinemie zvyšuje koncentraci IGF-1 a IGF-2, což zvyšuje růst nádoru. Pravděpodobným důvodem nepříznivého vlivu diabetu na růst a progresi nádoru je vyšší hladina inzulinu, jaký je ale klinický dopad tohoto metabolického stavu, není zatím zcela jasné.(7)
DALŠÍ FAKTORY SOUVISEJÍCÍ S DIABETEM I RIZIKEM NÁDORU
Obezita
Skoro 90 % pacientů s diabetem II. typu je obézních, přitom obezita je spojena s rizikem řady zhoubných nádorů. Také úmrtnost pacientů se zhoubným nádorem statisticky významně roste s rostoucím BMI. Mužský – centrální typ obezity – je přitom pro riziko i horší výsledky léčby nepříznivější. Je tedy pochopitelné, že studie sledující výskyt zhoubných nádorů u diabetiků jsou již primárně zkresleny vysokým podílem obézních pacientů v rameni s diabetem. Přímá souvislost byla prokázána mezi obezitou, hladinou cirkulujících estrogenů a rizikem vzniku karcinomu prsu, zvláště u postmenopauzálních pacientek. Rostoucí počet obézních žen v rozvinutých i rozvojových zemích by mohl vysvětlit nárůst hormonálně dependentních karcinomů prsu. Preklinická data také ukazují, že leptin a adipocytový cytokin (adipocyte- derived cytokine), které jsou vysoce exprimovány u obézních lidí, mohou podporovat proliferaci buněk karcinomu prsu. Naopak jiný z rodiny adipokininů, adiponektin, jehož hladina koreluje s množstvím tuku v těle nepřímo úměrně, má protektivní efekt na epiteliální buňky ženského prsu. Obezita se vyznačuje také zvýšenou produkcí prozánětlivých cytokinů.(8)
Hyperglykemie
Většina diabetiků má hyperglykemii i hyperinzulemii, takže je těžké odlišit jejich podíl na riziku. Nicméně studie prokazují, že rizikovým faktorem řady nádorů je už jen porucha glukózové tolerance a hyperglykemie je nezávislým rizikovým faktorem. Porucha metabolismu cukrů porušuje i metabolismus kyseliny askorbové v buňce a funkci imunitního systému. Také vztah metabolismu glukózy a genů odpovědných za oxidativní stres je úzký. Hyperglykemie totiž souvisí se vznikem reaktivních kyslíkových radikálů. Vychytávání glukózy zhoubným nádorem se využívá v diagnostice pomocí PET (pozitronová emisní tomografie). Nádory, zdá se, mají velice efektivní systém vychytávání glukózy, kterou potřebují pro svůj růst, a ten je zřejmě na inzulinu nezávislý. Přesto pravděpodobně růst nádoru ovlivňuje více hyperinzulinemie a interakce inzulinu a IGF-1. Metanalýza studií u 11 140 pacientů s diabetem II. typu ale nepotvrdila souvislost mezi kompenzací diabetu a mírou rizika zhoubného nádoru a úmrtí na něj.(9)
Volné mastné kyseliny Porucha regulace syntézy volných mastných kyselin (FASN), která katalyzuje biogenezi mastných kyselin de novo v játrech, může také hrát významnou roli při vzniku inzulinové rezistence, diabetu a nádoru. Aktivita FASN je zvýšena jak u diabetiků, kde koreluje s mírou rezistence na inzulin, tak i v nádorových buňkách, kde je zvýšená syntéza mastných kyselin podmínkou pro remodelaci buněčné membrány při proliferaci a migraci nádorových buněk. Nádorové buňky exponované ceruleninu, blokátoru FASN, vykazují in vitro poruchy růstu s navozením apoptózy v důsledku cytostatického efektu blokátoru. U diabetiků může vyšší aktivita FASN potencovat tedy i růst nádorových buněk, které ji potřebují pro svoji proliferaci.(9)
Chronický zánět a oxidativní stres Diabetes, zvlášť špatně kontrolovaný, je ve většině případů doprovázen různými metabolickými poruchami, které často vedou k chronickému zánětu a oxidativnímu stresu. Volné radikály vznikající v rámci oxidativního stresu mohou poškozovat DNA buněk, nebo porušovat reparační mechanismy DNA. Reaktivní formy kyslíku (ROS) mohou také reagovat s intracelulárními proteiny i lipidy a porušovat buněčnou homeostázu s kumulací mutací iniciujících proces kancerogeneze. Také porucha mitochondrií, která vede k úbytku energetických schopností buňky, může narušit její reparační schopnosti. V tukové tkáni vzniká v rámci rozvoje inzulinové rezistence rovněž větší množství TNFα, který přímo působí na vznik a vývoj zhoubných nádorů, nejčastěji prostřednictvím aktivace nuclear factor-kappa B (NF-κB). 10)
Protinádorová terapie ovlivňuje diabetes
Kortikoidy využívané v klinické onkologii i hematoonkologii nejen jako kauzální, ale i podpůrná léčba, mohou zvyšovat inzulinovou rezistenci, působit hyperglykemii a indukovat prediabetes, který se předpokládá u 15-20 % dospělé populace. Také androgeny ovlivňují metabolismus glukózy. Jejich deprivace způsobená antiandrogenní léčbou u pacientů s karcinomem prostaty snižuje citlivost k inzulinu a způsobuje změny v lipidovém profilu, tím zvyšuje kardiovaskulární riziko těchto nemocných. Podle studie na 70 000 pacientech s karcinomem prostaty zvyšuje podávání LH-RH inhibitorů riziko vzniku diabetu ve 44 % a zvyšuje cholesterol, triglyceridy a HDL.
Léčba diabetu a nádor
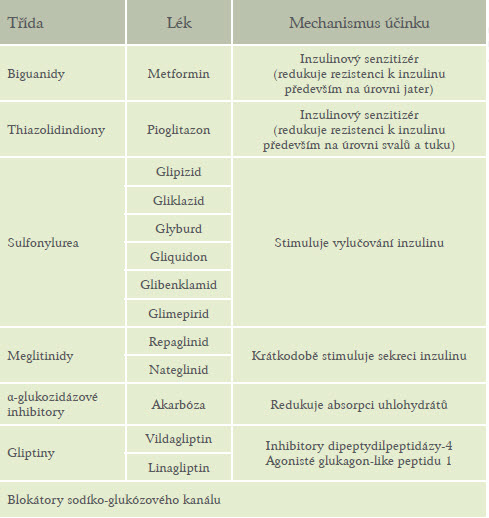
Většina diabetiků vystřídá v průběhu léčby řadu léků v rozdílném dávkování. Antidiabetika lze rozdělit podle ovlivnění hladiny inzulinu na ty, které zvyšují hladinu endogenního inzulinu – sekretagoga glinidy, deriváty sulfonylurey, léky snižující inzulinovou rezistenci a tím i hladinu inzulinu – biguanid metformin, thiazolidindiony, exogenně podávané inzuliny a inkretinová emetika (GLP 1 agonisté a inhibitory DPP4).(tabulka 2)
Tabulka 2: Perorální antidiabetika užívaná u diabetiků II.typu
Biguanid metformin, široce užívaný přes 30 let, nyní v první linii léčby diabetu II. typu, opravdu prokázal příznivý vliv na redukci malignit (odds ratio = 0,86) ve srovnání sneléčenou populací. Nadto může protinádorový efekt metforminu kromě snížení hyperinzulinemie spočívat i ve stimulaci AMPK (enzymu zvyšujícího vychytávání glukózy ve svalech) a jeho protisměrného regulátoru LKB1, známého tumor supresorového proteinu. AMPK aktivátory působí antiproliferativně, protože snižují aktivaci IR a IGF-1 receptoru a tím inzulinem stimulovaný růst buněk.(11)
Ve studiích s buněčnými liniemi lidského karcinomu prsu (MCF-7, BT-474 a SKBR-3) prokázal metformin inhibiční vliv na buněčnou proliferaci, redukoval formaci buněčných kolonií a způsoboval zástavu buněčného cyklu v nádoru. Tento proces probíhá většinou cestou MAPK, ATK a mTOR inhibice a opakuje se i v erbB2 pozitivních buňkách. Na základě těchto výsledků probíhají klinické studie. Ve fázi III adjuvantní studie Metformin Hydrochloride in Treating Patients With Early-Stage Breast Cancer NCIC MA.32 byla posuzována adjuvantní léčba metforminem oproti standardní terapii v adjuvanci časného karcinomu prsu stadia I a II u 3 500 žen. V observačních studiích u diabetiků je metformin spojen se statisticky významnou 31% redukcí rizika zhoubných nádorů a 30% statisticky nevýznamnou redukcí karcinomu prsu v porovnání s nediabetickou populací. Rutinní využívání metforminu pro léčbu pacientek s karcinomem prsu v adjuvanci je ještě předčasné a bude možná vhodné pro určitou podskupinu nemocných. Například pro nemocné s latentním diabetem. Pokud se odhalí diabetes II. typu u nemocných se zhoubným nádorem, je metformin vhodnou volbou pro jeho léčbu.(12)
Informace o protinádorovém účinku dalších perorálních antidiabetik jsou kontroverzní. Inzulin a zhoubný nádor Signální systém využívající inzulin se u obratlovců vyvinul před miliony let. V této době měl daleko méně specializovanou úlohu, ovlivňoval totiž osud buňky a její přežití v souvislosti s nutricí a byl nezbytný pro embryogenezi, jak ukazuje výzkum některých ryb. V roce 1922 byl inzulin poprvé použit k léčbě 12letého diabetického chlapce, pouhý rok po jeho objevení. První informace o mitogenní aktivitě inzulinu ve vztahu k nádorům se objevily v roce 1960. V roce 1980 byly objeveny geny pro IGF-1 a IGF-2 a jejich receptory. V roce 1984 byla prokázána mitogenní aktivita inzulinu u buněk karcinomu prsu.
Inzulinová potenciační léčba (IPT), kdy byl využíván inzulin ke zvýšení účinku dalších protinádorových léků, byla vyvinuta v Mexiku doktorem Donato Perez Garciou ve 30. letech 20. století a byla využívána řadu let. Zastánci této terapie předpokládali, že nádorové buňky potřebují spoustu glukózy, a proto jsou značně citlivé k inzulinu. Inzulin měl navodit propustnost jejich buněčné stěny a ulehčit cytotoxický účinek protinádorové léčby. Podle této teorie aktivace nádorových buněk inzulinem, s chemoterapií v redukovaných dávkách, může mít stejný protinádorový efekt jako chemoterapie samotná, ale s menšími nežádoucími účinky. Neproběhla ale žádná klinická studie a nebyl vyloučen předpoklad, že podobný účinek by mohla mít léčba i na buňky zdravé. Existují jen ojedinělé kasuistiky dokumentující příznivý přínos této léčby. Tato terapie byla vždy považována za „of labell“ a postupně zpochybněna stále přibývajícími informacemi o její nejisté bezpečnosti.
Některé studie dokazují, že používání inzulinu glargine (Lantus; Sanofi -aventis) může být spojeno s vyšším rizikem zhoubných nádorů. Výsledky jsou ale nekonzistentní a podle US Food and Drug Administration (FDA) nelze v současné době jednoznačně říci, že inzulin glargine riziko zhoubného nádoru zvyšuje.
Informace vycházejí ze 4 observačních studií, z nichž 3 prokázaly statisticky významnou souvislost mezi užitím inzulinu glargine a rizikem zhoubných nádorů. Klinická data ale tyto závěry nepotvrzují. Světlo by do této problematiky mohla vnést kardiologická studie Origin, v jejímž rámci je sledováno více než 12 000 pacientů po dobu delší než 5 let.(13)
Další prověřování bezpečnosti a dlouhodobého rizika v rámci studie probíhá v režii FDA ve spolupráci s výrobcem inzulinu glargine a s US Department of Veterans Affairs. Výhledově by měly být známy výsledky 3 epidemiologických studií iniciovaných výrobcem glarginu, přímo zaměřené na riziko zhoubného nádoru u pacientů, kteří používají glargine v léčbě diabetu. Vzhledem k tomu, že dosavadní výsledky studií jsou neprůkazné, nemění se tedy nic na dosavadní preskripční praxi inzulinu ve všech jeho formách.(14)
IGF-1 systém jako cíl protinádorové léčby V roce 1989 byl zaznamenán protinádororový účinek protilátek proti IGF-1 in vivo. Od roku 2000 byla vyvinuta řada léků s cílem blokovat IGF-1. Od roku 2008 probíhají studie fáze I a II. V souvislosti s možností ovlivnit růst nádoru hyperinzulinemií jsou objeveny tumorsupresivní účinky metforminu a naopak vzrůstají pochybnosti o bezpečnosti léčby inzulinem.
Proč je role inzulinu a IGF-1 v kancerogenezi jiná než ostatních růstových faktorů, jakými jsou EGF nebo PDGF, souvisí pravděpodobně se skutečností, že inzulin i IGF-1 mají na rozdíl od jmenovaných růstových faktorů působnost nejenom lokální, ale ovlivňují růst tkání a energetický metabolismus v celém těle.
IGF-1 a inzulin, jejich receptory a jejich nitrobuněčné signální dráhy mají mnoho společného. Metabolický i mitogenní efekt obou hormonů se prakticky překrývají. Protože funkce IGF-1 v progresi nádoru je již dlouhou dobu známá, zdálo se rozumné zaměřit se na blokádu jeho funkce u pacientů se zhoubným nádorem. Tato blokáda ale ovlivňuje metabolismus glukózy třemi mechanismy: ruší mimetický účinek inzulinu, zvyšuje hladinu cirkulujícího růstového hormonu (GH), který je silným diabetogenním stimulem, a ztrátou zpětné vazby. A je konečně i možné, že látky blokující IGF-1 blokují i inzulinovou signální cestu.
V současné době je možné inhibovat IGF-1 receptor pomocí monoklonálních protilátek nebo proteinkinázového inhibitoru, antisense nukleotidů a proteinů vážících se na IGF-R. (tabulka 3)
Tabulka 3: Anti-IGF-1R léčba – cílená protinádorová léčba
| Protilátky proti IGF-1 |
| KM 3168) a IGF-2 (KM 1468) – snižují polypy u FAP(familální adenomatózní polypózy) myší a metastazování do kostí u ca prostaty (fáze I) |
| Protilátky proti IGF-1R |
| Robatumumab – sarkomy |
| AVE 1642 - inhibice metastáz u karcinomu prsu |
| AMG 479 - kolorektální karcinom, pankreas, ovarium |
| Figitumumab - karcinom plic (fázeI) |
| Tyrozinkinázové inhibitory |
| BMS-554417 a BMS-754807 |
| OSI-906 – adrenokortikální ca fáze III a karcinom prsu fáze II |
| AMPK aktivátory |
| Metformin inzulin, aktivaci AMPK, studie u karcinomu prsu, ovaria,prostaty atp. |
| 5-aminoimidazole-4-carboxamide 1-beta-D-ribonucleoside (AICAR), |
| epigallcatechin-3-gallate, resveratrol, capsaicin, izofl avon genistein |
Ve studiích s protilátkami proti IGF-1R byla pozorována hyperglykemie v důsledku zvýšeného vylučování růstového hormonu při ztrátě zpětné vazby.
Malé molekuly tyrozinkinázových inhibitorů IGF- -1R mají daleko závažnější nežádoucí účinky. Pronikají přes hematoencefalickou bariéru s možnou neurotoxicitou spojenou také s potlačením neuroprotektivního efektu IGF-1. Tyrozinkinázové inhibitory mají ale daleko menší vliv na vznik hyperglykemie než protilátky. Vysvětlením by mohla být skutečnost, že se neakumulují v tak velkém množství ve svalech a neporušují tím funkci inzulinového receptoru. Konečným mechanismem buněčné proliferace nádorových buněk, zprostředkované jak IGF-1R, tak i přes IR je aktivace fosfatidylinositol 3-kinázy (PI3K), AKT, a mTOR. Výzkum se tedy zaměřuje i na tyto uzlové body metabolické cesty inzulinu jako na potenciální terapeutické cíle. Některé mTOR inhibitory jsou již součástí léčebné onkologické praxe, například everolimus a temsirolimus v indikaci metastatického renálního karcinomu. Mohou způsobovat hyperglykemii, hypercholesterolemii a hypertriglyceridemii až u 20 % pacientů. Také inhibice tyrozinkinázy ABL, užívaná u léčby chronické myelózy, může porušit glukózovou homeostázu. Hyperglykemie po nilotinibu byla popsaná v 10 %.(15)
Doporučení pro léčbu pacientů s diabetem a zhoubným nádorem
V současné době neexistují žádná jednoznačná doporučení pro léčbu diabetiků s malignitou. Jedná se o multidisciplinární problém vyžadující koordinaci mezi onkologem a diabetologem. Diabetolog musí provádět pečlivý a důsledný skrínink nejčastějších malignit u svých pacientů a v případě koincidence diabetu a malignity zvážit možnou léčbu metforminem. Onkolog by měl u nemocných s diabetem dbát na léčbu komorbidit, počítat s vyšší imunologickou fragilitou a možnou toxicitou onkologické léčby, nicméně dodržovat dávkovou intenzitu chemoterapie s důrazem na podpůrnou léčbu. Zatím nebyla potvrzena žádná jednoznačná kontraindikace léčby inzulinem u pacientů se zhoubným nádorem a inzulin- dependentním diabetem.(16)
Závěr
Pacienti s diabetem mají vyšší riziko vzniku zhoubného nádoru a častěji na malignity umírají. Vyšší riziko představuje diabetes II. typu. Příčiny nejsou zcela objasněné, nicméně významná role se přikládá inzulinu a IGF-1. Dalšími nezpochybnitelnými faktory jsou obezita, hormonálně aktivní látky a chronický zánět. Riziko je možné snížit zdravým stravováním, redukcí hmotnosti a pravidelnou fyzickou aktivitou. Léčba diabetu pravděpodobně může ovlivňovat pozitivně i negativně riziko zhoubného nádoru nebo jeho průběh. Jednoznačně bylo potvrzeno příznivé protinádorové působení metforminu. Proto musí být všechny léčebné možnosti diabetu zhodnoceny i z hlediska dopadu na vznik a vývoj případné malignity. Do budoucna se zdá slibná i cesta protinádorové terapie, ovlivňující signály směrované k IGF-1 receptoru a metabolické cestě, kterou aktivuje.
doc. MUDr. Petra Tesařová, CSc. Onkologická klinika, Všeobecná fakultní nemocnice a 1. Lékařská fakulta Univerzity Karlovy, PrahaLiteratura
- Simon D, Balkau B. Diabetes mellitus, hyperglycaemia and cancer. Diabetes Metab 2010;36(3):182-91.
- Nicolucci A. Epidemiological aspects of neoplasms in diabetes. Acta Diabetol 2010;47(2):87-95.
- Peairs KS, Barone BB, Snyder CF, Yeh HC, Stein KB, Derr RL, Brancati FL, Wolff AC. Diabetes mellitus and breast cancer outcomes: a systematic review and meta-analysis. J Clin Oncol 2011;29(1):40-6.
- Meyerhardt JA, Ma J, Courneya KS. Energetics in colorectal and prostate cancer. J Clin Oncol 2010;28(26):4066-73.
- Vigneri P, Frasca F, Sciacca L, Pandini G, Vigneri R. Diabetes and cancer. Endocrine-related cancer 2009;16,1103-1123.
- Irwin ML, Duggan C, Wang CY, Smith AW, McTiernan A, Baumgartner RN, Baumgartner KB, Bernstein L, Ballard- Barbash R. Fasting C-peptide levels and death resulting from all causes and breast cancer: the health, eating, activity, and lifestyle study. J Clin Oncol 2011;29(1):47-53.
- DeCensi A, Gennari A. Insulin breast cancer connection: confirmatory data set the stage for better care. J Clin Oncol 2011;1,29(1):7-10.
- Duggan C, Irwin ML, Xiao L, Henderson KD, Smith AW, Baumgartner RN, Baumgartner KB, Bernstein L, Ballard- Barbash R, McTiernan A. Associations of insulin resistance and adiponectin with mortality in women with breast cancer. J Clin Oncol 2011;29(1):32-9.
- Platts J. Insulin therapy and cancer risk in diabetes mellitus. Clin Med 2010;10(5):509-12.
- Call R, Griemsley M, Cadwallader L, Cialone L, et all. Insulin- karcinogen or mitogen? Preclinical and clinical evidence from prostate, breast, pancreatic and colorectal research. Postgraduate medicine 2010;122(3):158-165.
- McFarland MS, Cripps R. Diabetes mellitus and increased risk of cancer: focus on metformin and the insulin analogs. Pharmacotherapy 2010;30(11):1159-78.
- Decensi A, Puntoni M, Goodwin P, Cazzaniga M, Gennari A, Bonanni B, Gandini S. Metformin and cancer risk in diabetic patients: a systematic review and meta-analysis. Cancer Prev Res 2010;(11):1451-61.
- Gallagher EJ, LeRoith D. The proliferating role of insulin and insulin-like growth factors in cancer. Trends Endocrinol Metab 2010;21(10):610-8.
- Danne T, Bolinder J. New insulins and the risk of cancer. Int J Clin Pract Suppl 2010;(166):26-28.
- Vazquez-Martin A, Oliveras-Ferraros C, Del Barco S, Martin- Castillo B, Menendez JA. If mammalian target of metformin indirectly is mammalian target of rapamycin, then the insulin- like growth factor-1 receptor axis will audit the efficacy of metformin in cancer clinical trials. J Clin Oncol 2009;27(33):e207-209.
- Stefansdottir G, Zoungas S, Chalmers J, Kengne AP, Knol MJ, Leufkens HG, Patel A, Woodward M, Grobbee DE, De Bruin ML. Intensive glucose control and risk of cancer in patients with type 2 diabetes. Diabetologia. 2011(e-publ).
Datum přednesení příspěvku: 26. 1. 2012





