Základem léčby je chirurgická léčba, tedy radikální ingvinální orchiektomie (OE) (1), u indikovaných pacientů ve výjimečných případech s T1 tumorem je možné provedení testis šetřícího výkonu s peroperační histologií (tumor solitárního varlete, synchronní bilaterální tumor varlete) (3A). Vstupní neprovedení OE je možné pouze v případě, vyžaduje-li situace okamžité zahájení chemoterapie u pacienta se zvýšenými nádorovými markery a klinickými projevy zhoubného novotvaru varlete. Management terapie po OE by měl být realizován onkologem se zkušenostmi v léčbě nádorů varlete. Pacientům v reprodukčním věku by mělo být nabídnuto vyšetření spermiogramu a kryokonzervace spermatu před zahájením terapie, která může ohrozit plodnost – chemoterapie, radioterapie, chirurgický výkon (2B). Jde o vzácné nádory, a proto je doporučená centralizace terapie do komplexních onkologických center. U všech indikací chemoterapie (kromě
paliativní) je potřeba dodržení 100% dávkové intenzity (1).

20.1 Seminomy
20.1.1 Stadium IA, IB
Představuje přibližně 80 % všech pacientů se seminomem. Nezávisle na zvolené strategii po OE je survival rate ~ 99 %. V 15 % je přítomna subklinická diseminace, obvykle v retroperitoneu.
Rizikové faktory – invaze do rete testis a/nebo nádor větší než 4 cm (riziko relapsu dle přítomnosti rizikových faktorů 0:6 %, 1: 16 %, 2:32 %).
• Orchiektomie a následné přísné sledování (surveillance), nutná dobrá compliance pacienta – preferováno (1).
• Orchiektomie a adjuvantní chemoterapie (CHT) – ke zvážení v případě rizikových faktorů – 1 (preferováno) nebo 2 cykly CBDCA dle AUC 7 (ke zvážení především u nádorů nad 4 cm) (1).
• Orchiektomie a adjuvantní radioterapie (RT) paraaortálních uzlin (20 Gy) – vyhrazená pouze pro vysoce selektovanou skupinu pacientů s rizikovými faktory, u kterých je kontraindikace chemoterapie a kteří nejsou vhodní pro přísné sledování (2B) (po předchozím zákroku v oblasti skrota, třísla nebo dolních kvadrantů břicha je nutné i ozáření ipsilaterálních
ilických uzlin).
20.1.2 Stadium IS
• U seminomů stadia IS předpokládáme regionální uzlinovou nebo vzdálenou diseminaci nezjištěnou zobrazovacími metodami, jedná se o velmi vzácný nález.
• V případě mírné elevace nádorových markerů (HCG, LDH) lze zvolit sledování s kontrolou hladiny nádorových markerů a opakováním zobrazovacích metod (CT hrudníku a břicha + pánve, UZ kontralaterálního varlete) à 2–3 měsíce, při vzestupu markerů nebo nálezu metastáz na zobrazovacích vyšetřeních aktivní léčba (2A).
• Chemoterapie 3 cykly BEP nebo 4×EP (2A).
20.1.3 Stadium IIA
• Orchiektomie a kurativní chemoterapie – 3× BEP nebo 4× EP (2A).
• Orchiektomie a kurativní radioterapie paraaortálních + ipsilaterálních ilických uzlin (30 Gy) (2A).
• Preference chemoterapie vychází z profilu pozdní toxicity radioterapie (sekundární malignity) – jedná se o stejně efektivní terapeutické možnosti.
• V selektovaných případech s hraniční velikostí lymfatických uzlin v RP a negativních TM, lze zvážit před zahájením terapie kontrolní CT hrudníku a břicha za 6 týdnů k potvrzení vstupního stagingu.
20.1.4 Stadium IIB
• Orchiektomie a kurativní chemoterapie (preferováno) – 3× BEP nebo 4× EP (2A).
• Orchiektomie a kurativní radioterapie paraaortálních + ilických uzlin 36 Gy (2B).
20.1.5 Stadium IIC a III – primární léčba
• Good risk (dle IGCCCG indexu) – orchiektomie a kurativní chemoterapie – 3× BEP nebo 4× EP (1).
• Intermediate risk – orchiektomie a kurativní chemoterapie – 4× BEP (1) nebo 4× VIP (při KI bleomycinu) (2A).
Stadium IIC a III – řešení rezidua po primární léčbě
• Není reziduum nebo reziduum na CT do 3 cm a normální nádorové markery (TM) – sledování (2A).
• Přítomno reziduum > 3 cm na CT a normální TM
– PET vyš. (nejdříve 6 týdnů po CHT – pro snížení četnosti falešně pozitivních výsledků po chemoterapii).
• PET scan negativní – sledování (2A).
• PET scan pozitivní
- pokud nedošlo po chemoterapii ke zvětšení tumoru, je vzhledem k nízké pozitivní prediktivní hodnotě PET vyšetření (11–38 %) vhodné kontrolní vyšetření za 6 týdnů.
- RPLND nebo metastazektomie nebo vícečetné biopsie a salvage chemoterapie při viabilním nádoru (viz níže neseminomy) nebo kurativní RT (radioterapie) (2B). V případě operace je vyšší riziko komplikací kvůli desmoplastické reakci po chemoterapii a operaci je vhodné provést v referenčním centru. Progrese onemocnění na CT nebo elevace TM – salvage terapie jako u neseminomů (2A).
20.2 Neseminomy
Rizikové faktory – lymfovaskulární invaze (LVI), přítomnost embryonálního karcinomu, pT3-4. Riziko relapsu je při nepřítomnosti LVI (LVI-) cca 15%, v případě LVI+ se zvyšuje až na cca 50%. Podání 1×BEP sníží riziko relapsu na cca 2% u LVIa 3% u LVI+.
20.2.1 Stadium IA, IB
• Orchiektomie a následné přísné sledování (surveillance) – preferovaná možnost pro pacienty bez rizikových faktorů (absence vaskulární invaze, zejména pT1), podmínkou je spolupracující pacient (1).
• Orchiektomie a adjuvantní chemoterapie – 1 cyklus BEP, preferovaná možnost pro pacienty s rizikovými faktory (vaskulární invaze, pT2-4), dále pro pacienty nevhodné nebo odmítající surveillance, v Evropě přednost před RPLND (kromě teratomů varlete) (1).
• Orchiektomie a primární nerve-sparing retroperitoneální lymfadenektomie (RPLND) – vyhrazená pouze pro vysoce selektovanou skupinu pacientů s rizikovými faktory, kteří odmítnou chemoterapii nebo je chemoterapie kontraindikovaná a nejsou vhodní pro přísné sledování.
Cca 20–30 % pacientů s klinickým stadiem IA a IB má subklinickou diseminaci (až 30 % pacientů má pozitivní lymfatické uzliny při primární RPLND). Při přítomnosti vaskulární invaze (lymfatické či venosní) je riziko diseminace až 50 %. Cca 10 % pacientů s pN0 po primární nerve sparing RPLND relabuje ve vzdálených místech.
20.2.2 Stadium IS
• U neseminomů stadia IS předpokládáme regionální uzlinovou nebo vzdálenou diseminaci nezjištěnou zobrazovacími metodami.
• V případě mírné elevace nádorových markerů (AFP, HCG) lze zvolit sledování s kontrolou hladiny nádorových markerů a opakováním zobrazovacích metod (CT hrudníku a břicha + pánve, UZ kontralaterálního varlete) à 2–3 měsíce, při vzestupu markerů nebo nálezu metastáz na zobrazovacích vyšetřeních aktivní léčba (2A).
• Mírná elevace LDH může být způsobená řadou nálezů. Samostatná elevace pouze LDH by proto neměla být důvodem pro zahájení systémové chemoterapie.
• Kurativní CHT – 3× BEP nebo 4× EP (při KI bleomycinu), po CHT při negativních TM – sledovat (2A).
20.2.3 Stadium IIA
• negativní TM (po OE)
• lymfatické uzliny v RP hraniční velikosti nemusejí představovat metastázy – riziko overtreatment (u 15–35 % pacientů
není u zvětšených uzlin prokázán nádor)
a) kurativní CHT – 3×BEP nebo 4×EP (při KI bleomycinu) (1)
- po CHT při negativních TM a bez rezidua na CT – sledovat, při reziduu na CT (nad 1 cm) – RPLND (2A). Při teratomu nebo nekróze dále sledování. Při ostatních viabilních složkách jsou indikovány 2 cykly zajišťovací chemoterapie (2×EP nebo 2×VeIP nebo 2×TIP).
b) primární nerve-sparing RPLND (2A) – high volume specializovaná centra. Preference u teratomu.
- pN0 – sledování, pN1 a pN2 – CHT (2×EP), sledování jen v případě teratomu, pN3 – CHT jako pac. good risk (4× EP nebo 3× BEP) (2A).
c) sledování s přešetřením (kontrolní CT) za 6 týdnů (2A)
- lze zvážit u uzlin hraniční velikosti.
- je-li za 6 týdnů na kontrolním CT regrese – follow up, stabilizace – kurativní CHT nebo nerve-sparing RPLND, progrese – kurativní CHT při pozitivních TM, kurativní CHT nebo nerve-sparing RPLND při negativních TM
• pozitivní TM (po OE)
• primární CHT – 3×BEP nebo 4×EP (při KI bleomycinu) (1), po CHT – viz výše
20.2.4 Stadium IIB
• negativní TM (po OE)
• kurativní CHT – 3× BEP nebo 4× EP (při KI bleomycinu) (1)
• po CHT při negativních TM a bez rezidua na CT – sledovat, při reziduu na CT (nad 1cm) – RPLND (2A).
• primární nerve-sparing RPLND (2B) – high volume specializovaná centra. Preference u teratomu.
• pN0 – sledování, pN1 a pN2 – CHT (2×EP), sledování jen v případě teratomu, pN3 – CHT jako pac. good risk (4× EP nebo 3× BEP) (2A).
• pozitivní TM (po OE)
• primární CHT – 3×BEP nebo 4×EP (při KI bleomycinu) (1), po CHT viz. výše
20.2.5 Stadium IIC, IIIA,B,C
• IIC, IIIA (good risk) – 3× BEP nebo 4× EP (při KI bleomycinu) (1).
• IIIB (intermediate risk) – 4× BEP nebo 4× VIP (při KI bleomycinu) (1).
• IIIC (poor risk) – 4× BEP nebo 4× VIP (při KI bleomycinu) (1).
– v případě jsou–li pacienti vstupně v horším výkonnostním stavu (KI ≤ 50%) s výrazně symptomatickou nemocí (např. extenzivní metastatické postižení jater nebo plic), neexistují standardní doporučení stran redukce intenzity systémové terapie. Řada menších studií ale prokázala, že redukce iniciální série chemoterapie vede ke snížení akutní mortality bez ovlivnění dlouhodobého výsledku. Počet následných cyklů chemoterapie v plných dávkách by se po úvodní iniciální sérii s redukcí ale neměl snižovat.
Dále dle efektu indukční chemoterapie:
• celková remise s negativními TM – sledování (preferováno) (2A),
• parciální remise s reziduálními masami a negativními TM – RPLND nebo metastazektomie. Při teratomu nebo nekróze dále sledování (1). Při ostatních viabilních složkách jsou indikovány 2 cykly zajišťovací chemoterapie (2× EP nebo 2× VeIP nebo 2× TIP) (2A). Je-li viabilní složka zastoupená méně než v 10 % vzorku, lze individuálně zvážit vynechání zajišťovací chemoterapie s ohledem na toxicitu předchozí terapie (4C).
• inkompletní odpověď (PD – progrese nemoci, SD – stabilizace nemoci, chirurgicky neřešitelné PR – parciální remise nebo pozitivní TM) – indikace k záchranné (salvage) chemoterapii (2A).
Indikace retroperitoneální lymfadenektomie a/nebo metastazektomie
• operabilní zbytkový nádor nebo lymfadenopatie při normálních nebo stabilních markerech (2A).
• indikací k resekci je reziduální tumor > 1cm.
• u reziduálního nádoru < 1cm je riziko relapsu 6–9 %; na prvním místě je proto doporučeno sledování, alternativou je RPLND s přihlédnutím k preferencím pacienta.
• pokud je resekce indikována, standardní možností je bilaterální nervy šetřící RPLND.
• ipsilaterální templátová resekce se vyhýbá disekci kontralaterálního nervu a může být zvážena pro rezidua s průměrem menším než 5 cm, stejně jako u unilaterálních metastáz lymfatických uzlin na před/ a postchemoterapeutických CT snímcích. U nádorů na levé straně je nutná pouze paraaortální resekce, zatímco u nádorů na pravé straně je nutná parakavální a interaortokavální resekce až k iliakálním arteriím. Pouhá resekce reziduálního nádoru (tzv. lumpektomie) by neměla být prováděna.
• laparoskopická nebo robotická RPLND má v expertních centrech mít srovnatelné výsledky s otevřenými postupy u vybraných případů s nízkým objemem reziduálního onemocnění.
20.3 Seminomy, neseminomy – relaps
a) bez předchozí CHT – viz léčba stadia II–III (1)
b) po předchozí CHT (BEP nebo EP)
• časný relaps (do 2 let od ukončení primární terapie)
• chemoterapie (4× VeIP nebo 4× TIP), preferováno
• zvážit resekci při solitárním postižení
• pozdní relaps (více než 2 roky od ukončení primární terapie)
• chirurgická resekce, je-li možná, preferováno
• chemoterapie (4× VeIP nebo 4× TIP)
• v případě nedojde-li k dosažení CR po chemoterapii, vždy zvážit resekci rezidua.
• dle IPFSG (International Prognostic Factors Study Group) skóre je nepříznivá prognóza v době relapsu spojená s přítomností
vysokých hladin TM, nedosažením CR po 1. linii CHT, progression-free intervalem kratším než 3 měsíce, extratestikulárním primem a relapsem do kostí, jater nebo mozku.
• indikace ani optimální protokol high-dose chemoterapie (HD CHT) s transplantací krvetvorných buněk nejsou v současnosti jasné (3).
• u pacientů bez odpovědi na 1. a 2. řadu salvage chemoterapie je indikována paliativní léčba – chemoterapie, radioterapie a chirurgie.
20.3.1 Indikace záchranné chemoterapie
• nárůst markerů po předchozí normalizaci,
• stabilní elevace markerů a neresekabilní nádorové reziduum,
• progrese/relaps dle CT,
• nález viabilního tumoru při RPLND nebo metastazektomií,
• CAVE: optimální léčba pacientů s inoperabilním reziduálním nádorem při normalizaci markerů není známá, podle individuálního rizika lze buď observovat (zvláště pokud je PET negativní) nebo podat chemoterapii 2. řady
• CAVE: pozitivní nález na PET při předchozím PET-negativním nálezu by měl být před indikací pacienta k záchranné chemoterapii ověřen histologicky.
U pacientů s dobrou prognózou je kurabilita 90 %, se střední prognózou je kurabilita kolem 70 %, u pacientů se špatnou prognózou je kurabilita pod 50 %.
Definice kurability: dosažení dlouhodobé kompletní remise po indukční chemoterapii.
Režim přešetřování: přešetření je prováděno vždy až po 4 sériích CHT (nebo 3 sériích CHT, tam kde byl záměr podání 3 sérií), přešetření po 2 sériích CHT je prováděno u pacientů bez poklesu TM nebo při vzestupu TM.
Paliativní chemoterapie
– GEMOX × 6 s restagingem po 3. a 6. cyklu (2B),
– PAGE × 6 s restagingem po 3. a 6. cyklu (2B).
U kurativních chemoterapeutických režimů (1. a 2. linie) je nutné dodržet dávkovou intenzitu i za cenu intenzivní hematologické podpory. Odklad terapie (co nejkratší interval) je možný pro akutní infekci, neutrofily < 500 nebo trombocyty < 100 v den předpokládaného zahájení cyklu. Cytopenie není kontraindikací podání bleomycinu den 8. a 15. (event. Den
9. a 16.)
20.4 Prevence tromboembolické nemoci
• výskyt tromboembolické nemoci (TEN) u pacientů s nádory varlete léčených chemoterapií je častější než u pacientů odpovídající věkové kategorie léčených chemoterapií pro jiný nádor
• profylaxe TEN by měla být zvážená v průběhů chemoterapie, po dobu hospitalizace v rámci zvýšené imobilizace, v případě výskytu jednoho nebo více rizikových faktorů: velikost uzlin > 3,5 cm v retroperitoneu, stadium III onemocnění (intermediate nebo poor-risk), přítomnost centrálního žilního katetru, imobilizace (3B).
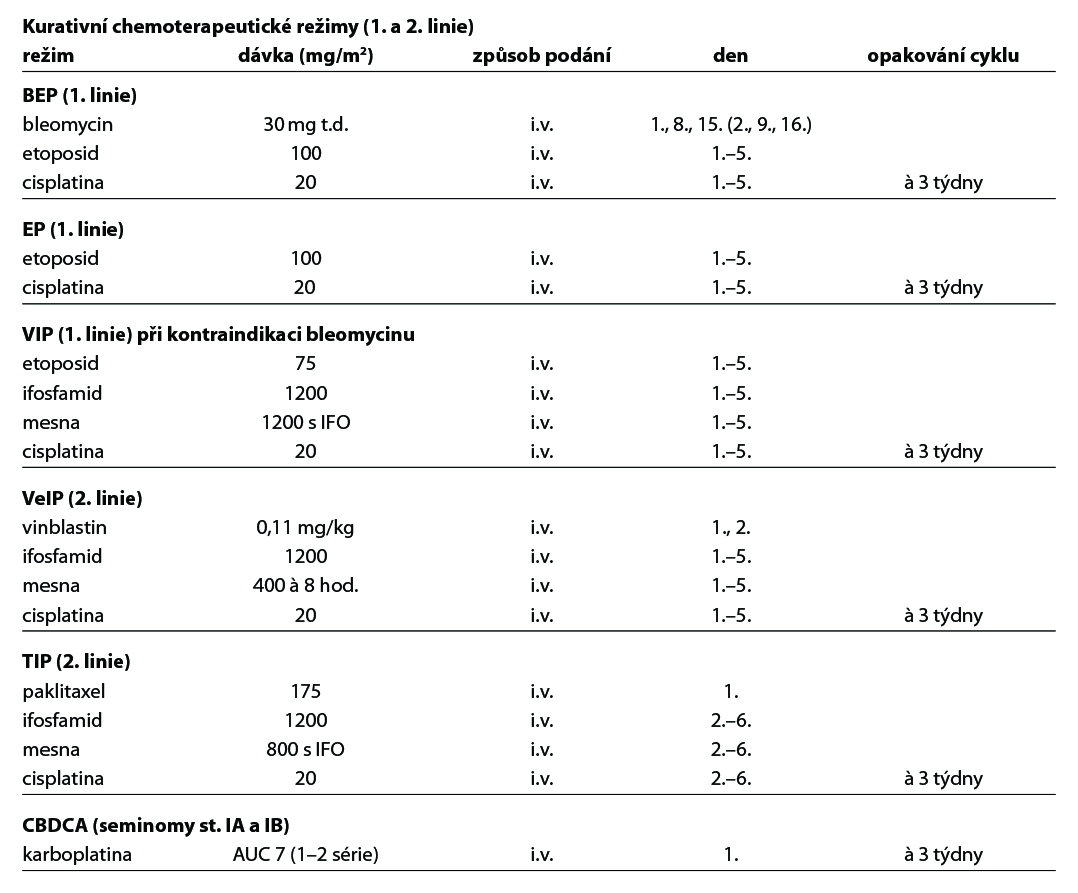
Paliativní chemoterapeutické režimy (3. a další linie) – režimy používané pro těžce předléčené pacienty (nejméně dvě řady kurativní chemoterapie) a pacienty refrakterní na cisplatinu (progrese během nebo do 4 týdnů od ukončení platinové léčby). Indikováno přešetření po 3 sériích chemoterapie.

20.5 Dispenzarizace pacientů po léčbě (follow-up)
Dispenzarizaci provádí onkolog, urolog, případně praktický lékař.
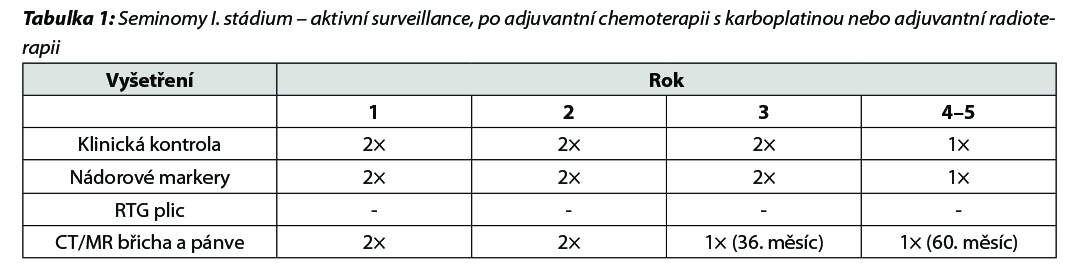

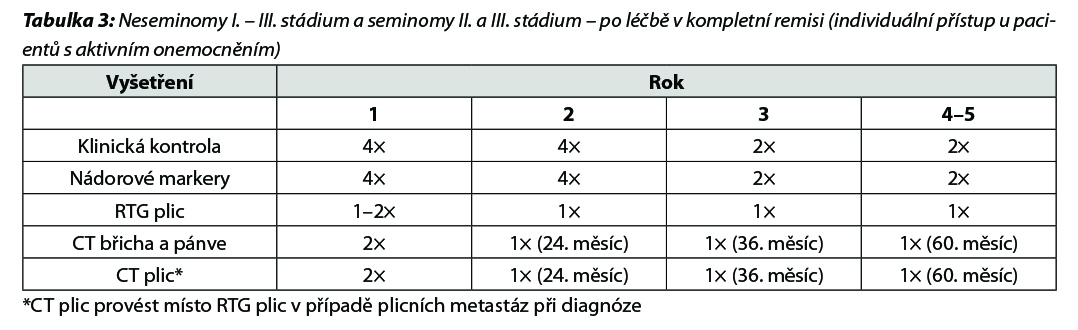
UZ scrota provést při nejasném klinickém nálezu nebo symptomech, edukace o samovyšetřování varlete.
Nejzávažnějšími pozdními nežádoucími účinky po léčbě nádorů varlat jsou kardiovaskulární komplikace, gonadální toxicita a rozvoj sekundárních nádorů, které se typicky mohou vyvíjet mnoho let po léčbě primárního nádoru. Vyšší výskyt pozdních nežádoucích účinku byl pozorován ve skupině pacientů, kteří dostávali chemoterapii, než u pacientů podstupujících pouze samotnou operaci. Během follow up by měli být pacienti cíleně vyšetření a léčení na známé rizikové faktory jako je hypertenze, hyperlipidemie a nedostatek testosteronu. V rámci pravidelných kontrol by měl být rovněž propagován zdravý životní styl. Není shoda ve follow-up schématech (intervaly mezi klinickými kontrolami, nádorovými markery a zobrazovacími metodami). Změna je plně v kompetenci ošetřujícího lékaře dle rizikových faktorů relapsu a klinického průběhu onemocnění.
Literatura:
- Oldenburg J, Berney DM, Bokemeyer C, et al. Testicular seminoma and non-seminoma: ESMO-EURACAN Clinical Practice Guideline for diagnosis, treatment
and follow-up. Ann Oncol. 2022;33(4):362-375. - European Association of Urollogy (EAU), Guidelines on Testicular Cancer 2023
- NCCN Clinical Practice Guidelines in Oncology, Testicular Cancer v. 1. 2023.





