22.1 Stadium 0a (TaN0M0), stadium I (T1N0M0)
Základem léčby je transuretrální resekce (TUR).
Doporučována je jednorázová intravezikální aplikace chemoterapeutika po TUR v den výkonu (optimálně do 6 hodin). Používaná cytostatika: mitomycin-C, epirubicin.
Opakovaná resekce (re-TUR) je doporučena v případě pochybností o úplnosti první resekce, u všech T1 tumorů a v případě absence svaloviny detruzoru v resekátu (neplatí pro TaLG/G1 a primární CIS).
Další postup, případně intravezikální léčba, závisí na riziku recidivy a progrese, které odhadujeme na základě prognostických faktorů:
• Rozlišení Ta a T1.
• Věk
• Stupeň buněčné diferenciace.
• Frekvence předchozích recidiv.
• Počet tumorů, plošný rozsah, případně přítomnost doprovodného ložiska Tis.
Aktualizovaný kalkulátor umožňuje výpočet rizika progrese (v případě obou klasifikací WHO – 1973 nebo 2004/2016 – je vhodné použít WHO 1973). Kalkulátor je dostupný na adrese https://nmibc.net/
Dále jsou nutné vždy pravidelné kontroly spočívající v cystoskopii a cytologickém vyšetření moči – viz follow-up.
Konkrétní postup (podle kalkulátoru rizika):
• U pacientů s nízce rizikovými tumory pouze kontroly.
• U pacientů se středně rizikovými tumory další intravezikální chemoterapie* nebo intravezikální imunoterapie BCG vakcínou.
• U pacientů s vysoce rizikovými tumory intravezikální imunoterapie BCG vakcínou. V případě selhání léčby BCG vakcínou je indikována cystektomie.
• U pacientů s velmi vysokým rizikem je vhodné diskutovat o provedení okamžité radikální cystektomie.
Používaná cytostatika:
mitomycin-C, epirubicin
*Schéma (liší se dle použitého cytostatika): např. u mitomycinu-C se jedná většinou o 4 instilace v týdenních intervalech, další á 4 týdny do celkové doby 12 měsíců.
Používaná imunoterapie:
BCG vakcína
Schéma:
indukční fáze: 6 instilací v týdenních intervalech
udržovací fáze: 3 instilace v týdenních intervalech vždy ve 3, 6, 12 měsících,
v případě vysokého rizika fakultativně dále 3 instilace v týdenních intervalech
vždy à 6 měsíců do celkové doby 3 let.
Po třech nebo šesti měsících léčby je vhodné provést vícečetnou biopsii měchýře k ověření
efektu instilací. (Pokud je k dispozici, je vhodné použít fotodynamickou diagnostiku – PDD).
V případě selhání léčby BCG vakcínou je indikována cystektomie.
U pacientů s Ta/T1 high-grade nádory nebo Tis lze v případě nedostupnosti BCG nebo po selhání intravesikální léčby individuálně zvážit intravesikální termochemoterapii nebo radiofrekvenčně-indukovanou intravesikální chemohypertermii, která se provádí na specializovaných pracovištích.
22.2 Stadium 0is (TisN0M0)
ntravezikální instilace BCG vakcínou.
Schéma:
indukční fáze: 6 instilací v týdenních intervalech
udržovací fáze: 3 instilace v týdenních intervalech vždy ve 3, 6, 12 měsících,
fakultativně dále 3 instilace v týdenních intervalech vždy à 6 měsíců do celkové doby 3 let.
Po třech nebo šesti měsících léčby je možné provést vícečetnou biopsii měchýře k ověření efektu
instilací. (Pokud je k dispozici, je vhodné použít fotodynamickou diagnostiku – PDD). V případě selhání léčby BCG vakcínou je indikována cystektomie.
22.3 Stadium II a III
Staging a radikální chirurgickou léčbu provádí urolog. Indikace k radikální léčbě by měla být na základě rozhodnutí multidisciplinárního týmu.
A. Radikální chirurgická léčba (radikální cystektomie a pánevní lymfadenektomie)
Možnosti neoadjuvantní a adjuvantní systémové léčby:
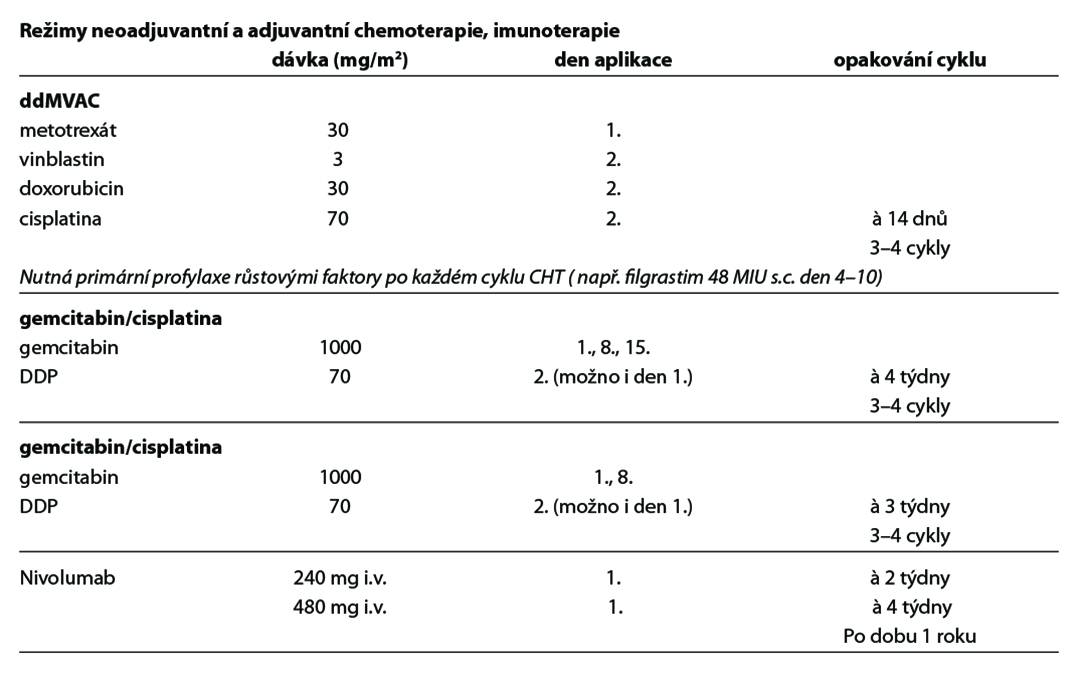
Neoadjuvantní systémová chemoterapie s cisplatinou v případě T2-T4a N0M0 tumorů před cystektomií s cílem eradikace potenciálních mikrometastáz, respektive dosažení downstagingu (úroveň důkazů 1). Pouze s cisplatinou kombinované neoadjuvantní režimy prokázaly prodloužení přežití. V současnosti je neoadjuvantní systémová chemoterapie preferována
před adjuvantní. U pacientů s hraniční či mírnou renální insuficiencí je možno rozdělit dávku cisplatiny na dva dny (35 mg/m2 – den 1 a 2, či den 1 a 8; úroveň důkazů 2B). Perioperativní chemoterapie s karboplatinou není v této indikaci doporučena. MVAC v klasickém dávkování není v neoadjuvanci doporučen pro vyšší toxicitu ve srovnání s režimy ddM- VAC a gemcitabin/DDP.
Adjuvantní systémová chemoterapie je zvažována po cystektomii u lokálně pokročilých nádorů (pT3, pT4) a při průkazu lymfovaskulární invaze u pacientů, kteří nedostali neoadjuvantní chemoterapii a jsou cisplatina fit (definice níže) (úroveň důkazů 2B). Také je možné podání adjuvantní léčby nivolumabem a to v situacích uvedených v schématu níže, při pozitivitě exprese PD-L1 na nádorových buňkách ≥ 1% (úroveň důkazů 2B).
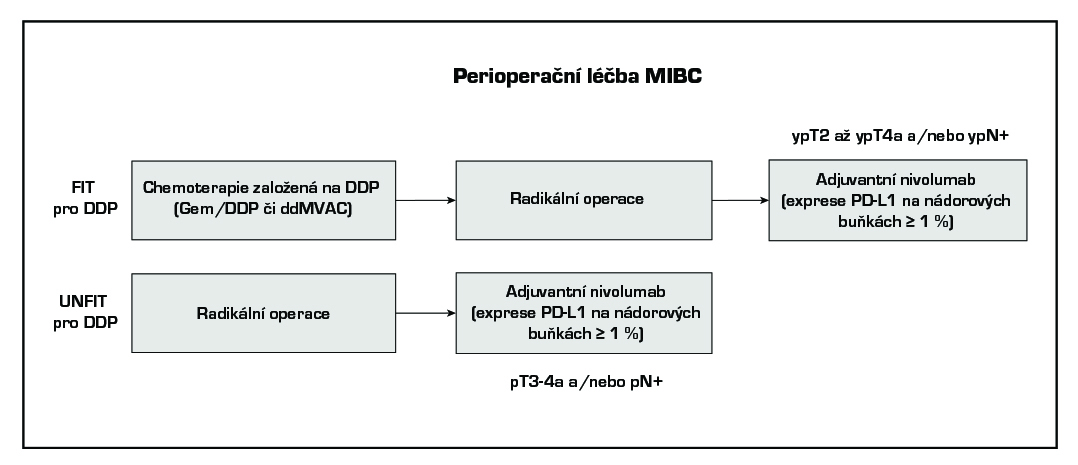
Používaná cytostatika a imunoterapie:
metotrexát, vinblastin, doxorubicin, cisplatina, gemcitabin, nivolumab.
Použité režimy:
gemcitabin/DDP, ddMVAC, nivolumab v monoterapii
B. Multimodální měchýř šetřící postupy (kombinace TUR, radioterapie, systémové chemoterapie) v rámci protokolů u vybraných
a informovaných pacientů (menší nádory T2, bez CIS).
Záchovné režimy:
Vhodné jen pro pacienty neschopné cystektomie nebo cystektomii odmítající. Podmínkou je provedení maximální TUR resekce nádoru (případně ve více dobách).
Příklad režimu chemoradioterapie: DDP 100mg/m2 à 3 týdny + konkomitantní radioterapie.
22.4 Stadium IV (lokálně pokročilý karcinom či metastatické onemocnění)
22.4.1 Lokoregionálně pokročilé nádory TxN1-3M0
A. Radikální chirurgická léčba u operabilních nádorů (radikální cystektomie a pánevní lymfadenektomie). Možnosti neoadjuvantní a adjuvantní systémové léčby:
Neoadjuvantní systémová chemoterapie před cystektomií s cílem dosažení down-stagingu (preference – úroveň důkazů 1). Adjuvantní systémová chemoterapie je zvažovanou možností léčby u cisplatina fit pacientů, zvláště nebyla-li podána neoadjuvantní léčba. Adjuvantní imunoterapie nivolumabem může být indikována, za podmínek uvedeném ve schématu odstavce 22.3. V případě reziduálního nádoru po cystektomii je zvažována radioterapie nebo paliativní chemoterapie dle celkového stavu pacienta.
B. Radioterapie u inoperabilních nádorů či u pacientů neschopných radikální operace, event. v kombinaci se systémovou chemoterapií dle celkového stavu pacienta.
22.4.2 Generalizované nádory TxNxM1
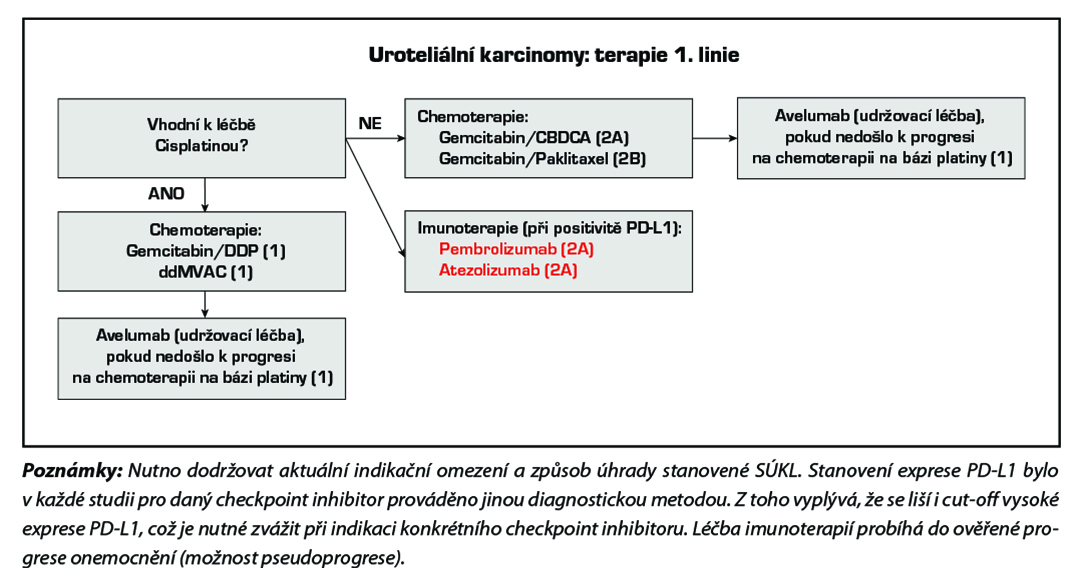
Paliativní systémová chemoterapie dle celkového stavu pacienta. Možno též zvážit imunoterapii checkpoint inhibitory (atezolizumab, nivolumab, pembrolizumab, avelumab).
Prognóza je horší u nemocných ve špatném celkovém stavu (Karnofsky PS <80 %) a s viscerálními metastázami.
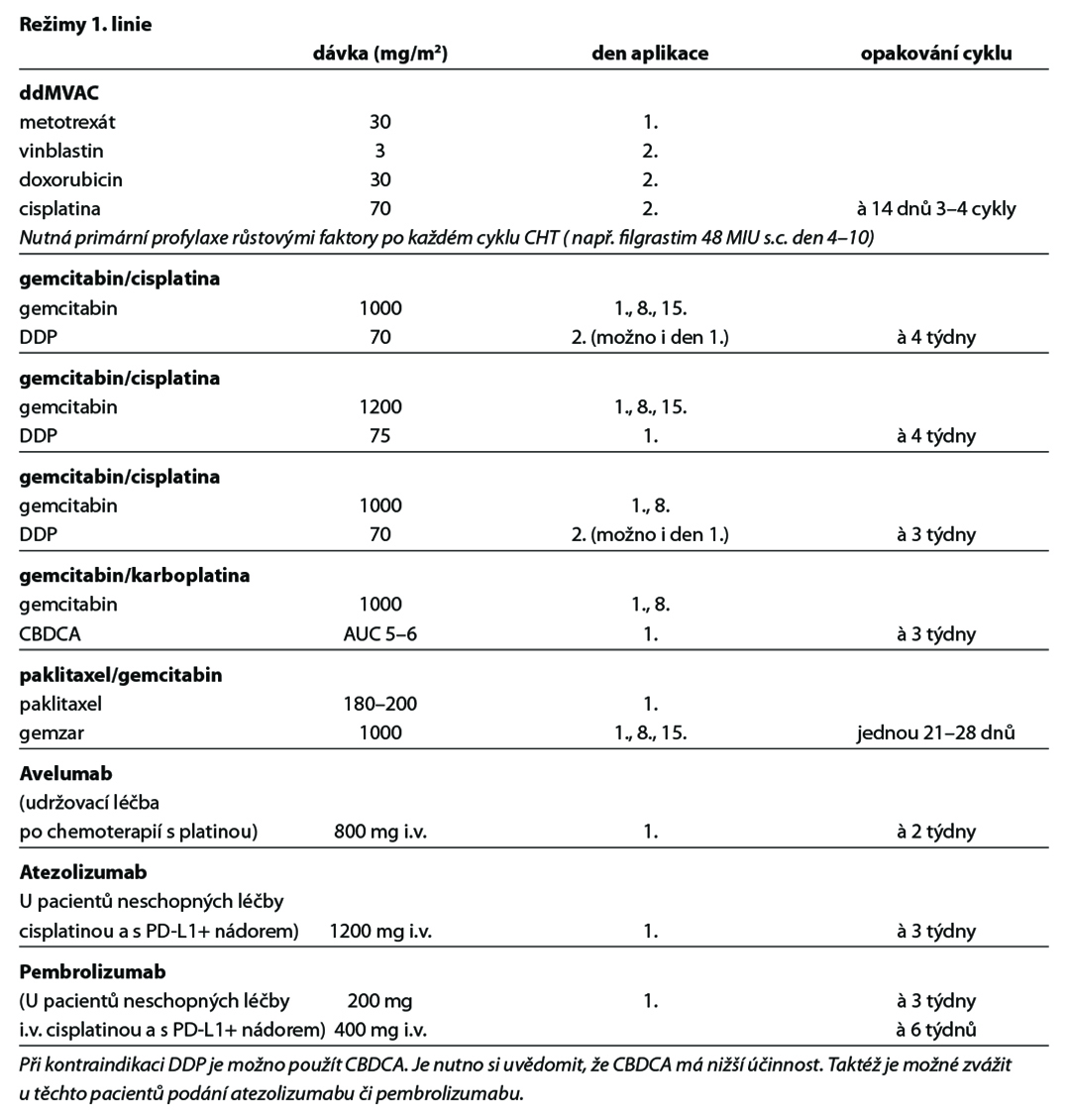
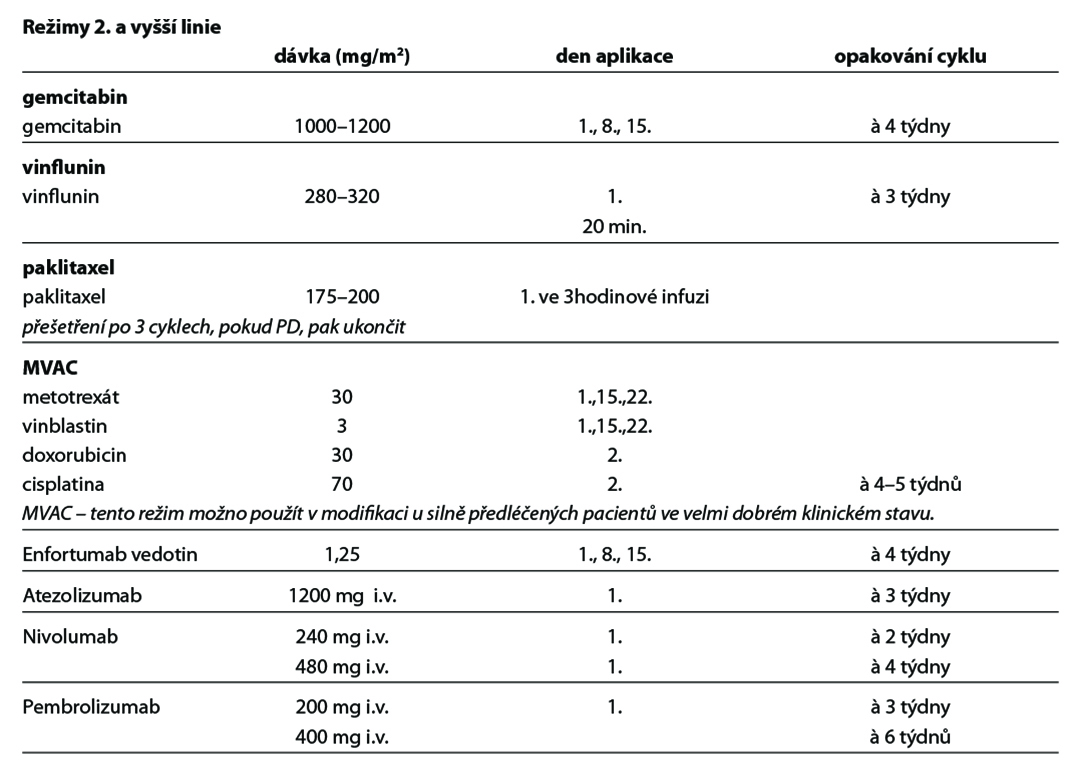
Používaná chemoterapie:
metotrexát, vinblastin, doxorubicin, cisplatina, karboplatina, gemcitabin, paklitaxel, vinflunin, enfortumab vedotin
Použité režimy:
Preferovanými režimy první linie léčby jsou DDP/gemcitabin a ddMVAC (úroveň důkazů 1). Pokud nejsou pacienti k cisplatině vhodní, je v současné době preferována v první linii léčby (před imunoterapií) chemoterapie na bázi karboplatiny. U platinových režimů je po dosažení kontroly onemocnění indikována udržovací léčba avelumabem (úroveň důkazů 1). Individuálně lze v první linii léčby indikovat i pembrolizumab a atezolizumab (úroveň důkazů 2A) při pozitivitě PD-L1 exprese (viz schéma první linie léčby).
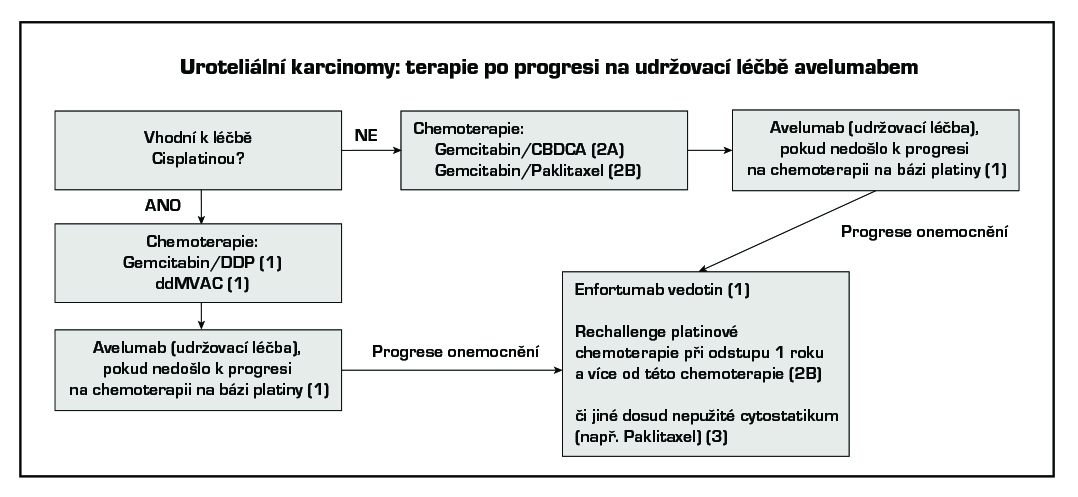
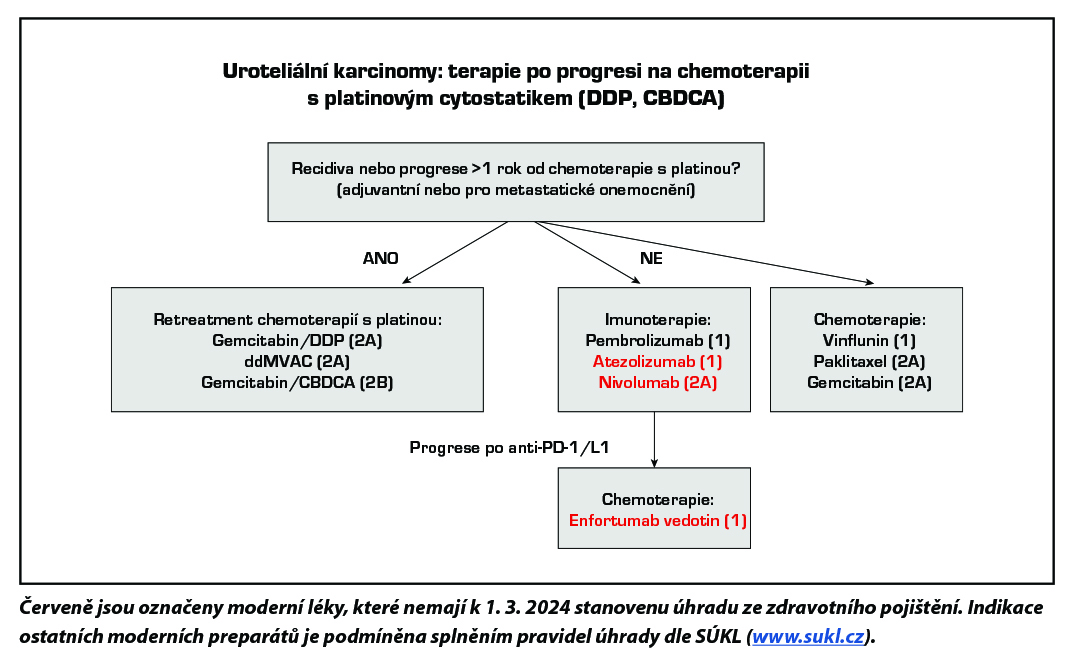
Po vyčerpání efektu první linie lze podat imunoterapii pembrolizumabem nebo atezolizumabem (oba úroveň důkazů 1) nebo nivolumabem (úroveň důkazů 2B) či chemoterapii vinfluninem (úroveň důkazů 1). Enfortumab vedotin je indikován k léčbě pacientů s lokálně pokročilým nebo metastazujícím uroteliálním karcinomem, kteří dříve podstoupili chemoterapii obsahující platinu a terapii inhibitory PD-1 či PD-L1 (úroveň důkazů 1). Monoterapie nebo režimy s taxány či karboplatinou jsou také možnou alternativou (úroveň důkazů 2A) (viz schémata léčby po progresi na první linii léčby).
Checkpoint inhibitory
Atezolizumab
Atezolizumab v monoterapii je indikován k léčbě dospělých pacientů s lokálně pokročilým nebo metastatickým uroteliálním karcinomem po předchozí chemoterapii obsahující platinu nebo kteří jsou považováni za nevhodné pro cisplatinu a jejichž nádory mají expresi PD-L1 ≥ 5 %.
Nivolumab
Nivolumab v monoterapii je indikován k léčbě lokálně pokročilého neresekabilního nebo metastazujícího uroteliálního karcinomu u dospělých po selhání předchozí léčby obsahující platinu bez ohledu na PDL1 expresi.
Pembrolizumab
Pembrolizumab v monoterapii je indikován k léčbě lokálně pokročilého nebo metastazujícího uroteliálního karcinomu u dospělých, kteří dříve podstoupili chemoterapii obsahující platinu bez ohledu na PD-L1 expresi.
Nebo jako monoterapie je indikován k léčbě lokálně pokročilého nebo metastazujícího uroteliálního karcinomu u dospělých, kteří nejsou vhodní pro chemoterapii obsahující cisplatinu a jejichž nádory exprimují PD- L1 s kombinovaným pozitivním skóre (CPS) ≥ 10.
Avelumab
Avelumab je indikován v monoterapii k udržovací léčbě první linie dospělých pacientů s lokálně pokročilým nebo metastazujícím uroteliálním karcinomem bez ohledu na expresi PD-L1, kteří jsou bez progrese po chemoterapii na bázi platiny.
V níže uvedené tabulce jsou uvedeny kontraindikace k podání cisplatiny (cisplatina„unfit“ pacienti) – stačí splnění jedno ho parametru. U poruchy sluchu je indikace k podání cisplatiny na zvážení klinického onkologa. Kromě níže uvedených se uplatňují obecné kontraindikace chemoterapie (ECOG ≥ 3, závažné komorbidity zásadně ovlivňující přežití nebo orgánové funkce, dále aktivní závažná infekce, nesouhlas a nespolupráce pacienta).

Literatura:
- NCCN Guidelines v.3.2023, Bladder Cancer.
- Powles T, Bellmunt J, Comperat E, et al. ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Bladder cancer: ESMO Clinical Practice
Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Mar;33(3):244-258.
Follow up karcinom močového měchýře
Cílem sledování je včasný záchyt relapsu s cílem prodloužení přežití. Klinické vyšetření má být zaměřeno na možné symptomy relapsu a nežádoucí účinky proběhlé léčby. O indikaci jednotlivých vyšetření rozhoduje ošetřující lékař, který provádí dispenzarizaci.
A. Neinvazivní tumor močového měchýře
Základním vyšetřením je cystoskopie a cytologie moči. Četnost návštěv se liší podle rizikové skupiny (viz 22.1.3.)
V případě nízkého rizika kontroly za tři a devět měsíců po TUR a poté ročně po dobu nejméně pěti let. V případě vysokého rizika kontroly à 3 měsíce první dva roky, poté à 6 měsíců do pěti let od TUR a poté ročně dlouhodobě. Kontroly u středního rizika jsou plánovány individuálně mezi výše uvedenými rizikovými skupinami.
Zobrazovací metody: u tumorů vysokého rizika IVU nebo CT-IVU (nebo jiná zobrazovací metoda dle renálních funkcí) jednou ročně dlouhodobě.
B. Invazivní tumor močového měchýře po radikální cystektomii
Dispenzarizace je prováděna ve spolupráci urologa, onkologa, event. praktického lékaře. Součástí sledování jsou laboratorní vyšetření (renální funkce, cytologie moči, močový sediment, jaterní enzymy, elektrolyty, krevní obraz, krevní plyny) prováděny v intervalu 3–6 měsíců po dobu dvou let a poté jednou ročně dlouhodobě.
Zobrazovací metody (CT hrudníku, břicha a malé pánve s vylučovací fází, UZ břicha a pánve) by měla být indikována na základě rizika možné rekurence onemocnění v intervalu à 6 měsíců po dobu 3 let a poté à 1 rok po dobu 5 let. Po uplynutí 5 let se provádí další sledování dle klinického projevu možného relapsu a stupně rizika rekurence onemocnění, jednou ročně by měl být proveden USG ledvin k vyloučení obstrukce horních cest močových. Dispenzarizace po 5 letech je možná ve spolupráci s praktickými lékaři, vždy však ve spolupráci s urologem.
C. Invazivní tumor močového měchýře po záchovné terapii
Dispenzarizace prováděna ve spolupráci onkologa, urologa a event. praktického lékaře. Laboratorní a zobrazovací vyšetření jsou prováděny v podobně jako u pacientů po cystektomii (nemusí být kontrolovány krevní plyny). Dalším vyšetřením v průběhu sledování je pravidelná cystoskopie, cytologie moči a ke zvážení restagingová TUR po ukončení radioterapie. Kontroly by měly být prováděny v intervalu 3–6 měsíců po dobu 2 let a následně v intervalu 6–12 měsíců dlouhodobě. Dispenzarizace po 5 letech je možná ve spolupráci s praktickými lékaři.





