Primární karcinomy jater vznikají z hepatocytů (hepatocelulární karcinom – HCC) nebo z nitrojaterních žlučovodů (intrahepatální cholangiokarcinom – ICC).
6.1 Hepatocelulární karcinom (HCC)
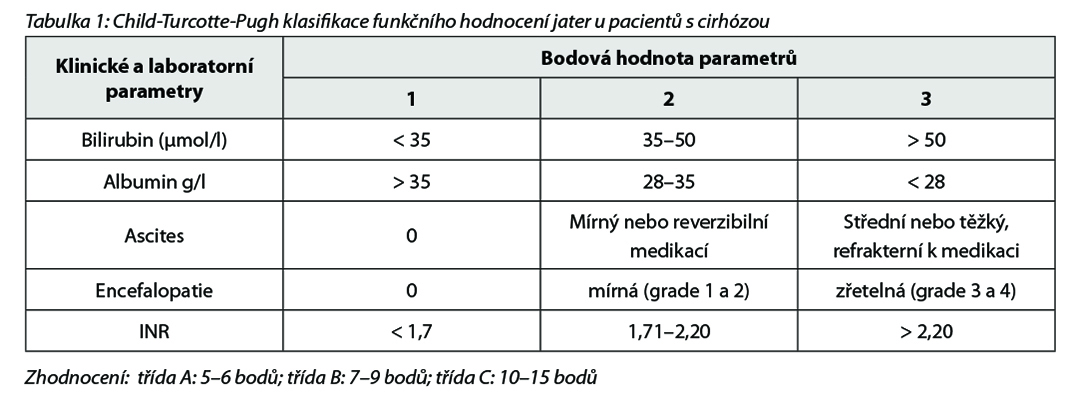
Hepatocelulární karcinom je nejčastějším primárním zhoubným nádorem jater. Téměř ve všech případech onemocnění vzniká v terénu jaterní cirhózy. V případě chronické HBV infekce a méně často nealkoholové steatohepatitidy může dojít ke vzniku HCC i v precirhotických stadiích. Pacienti s cirhózou a chronickou HBV i v precirhotických stadiích jsou proto indikováni k provádění surveillance HCC – ultrasonografickému vyšetření jater v pravidelném intervalu 6 měsíců. Za provádění surveillance rizikových pacientů odpovídá dispenzarizující specialista (nejčastěji hepatogastroenterolog). Při nálezu suspektního ložiska většinou následuje doplnění kontrastního CT břicha a/nebo MR jater s kontrastní látkou. V případě typického vzorce sycení a vymývání kontrastní látky v ložisku lze pouze u pacientů s cirhózou považovat diagnózu HCC za jistou. U nemocných bez cirhózy nelze tato neinvazivní radiologická kritéria uplatnit a ložisko by mělo být histologicky ověřeno cílenou biopsií. Alfa-fetoprotein (AFP) má spíše význam pro odhad biologického chování nádoru a sledování efektu léčby u pacientů, u kterých byl vstupně zvýšený. Pro surveillance není vhodný a nemá být rutinně používán.
Diagnostické metody:
Zobrazovací metody:
Ultrazvuk jater: Surveillance HCC u rizikových skupin pacientů.
Kontrastní CT břicha a hrudníku: Stanovení počtu, velikosti ložisek a jejich vztahu k cévním strukturám, vyloučení extrahepatálního postižení (metastáz) – staging.
MR jater s kontrastní látkou: Stanovení počtu, velikosti ložisek a jejich vztahu k cévním strukturám, zpřesnění charakteru ložisek a jejich diferenciální diagnostika.
PET-CT: indikace v individuálních případech k diagnostice vzdálených metastáz.
Nádorový marker AFP: V rámci primární diagnostiky je význam malý, vhodný k monitoraci vývoje onemocnění v některých případech.
Biopsie: V případě typického vzorce sycení a vymývání kontrastní látky v ložisku lze u pacientů s vysokým rizikem vzniku HCC považovat diagnózu HCC za jistou. Jde typicky o pacienty s jaterní cirhózou, chronickou hepatitidou B nebo o pacienty u kterých byl HCC v minulosti již diagnostikován (po resekci). U nemocných s chronickým jaterním onemocněním bez cirhózy (s výjimkou hepatitidy B) nelze tato neinvazivní radiologická kritéria uplatnit a ložisko by mělo být histologicky ověřeno cílenou biopsií.
Staging:
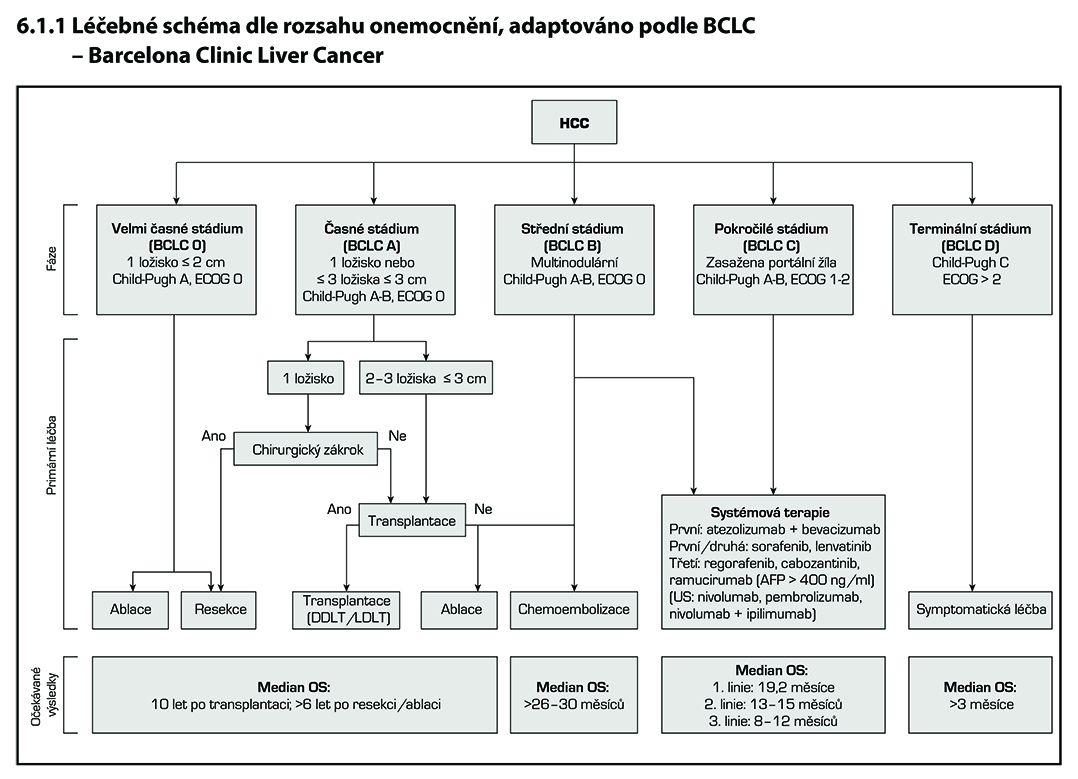
Při rozhodování o léčbě HCC je nutno zvažovat hledisko onkologické (rozsah a lokalizace postižení nádorem), funkční stav jaterního parenchymu (vyjádřeného třídou Child-Turcotte-Pugh klasifikace) a celkový stav pacienta (performance status). Všechny tyto parametry v sobě zahrnuje tzv. barcelonská klasifikace (BCLC – Barcelona Clinic Liver Cancer).
Možnosti radiologických onko-intervenčních metod jsou rozebrány v samostatné kapitole č. 37.
Ramucirumab a cabozantinib ve druhé linii léčby nemají stanovenou úhradu z prostředků zdravotního pojištění
Metaanalýza tří velkých randomizovaných kontrolovaných studií fáze 3 imunoterapie u pacientů s pokročilým HCC: CheckMate-459: nivolumab versus sorafenib v první linii léčby, IMbrave150: atezolizumab plus bevacizumab versus sorafenib v první linii léčby a KEYNOTE-240: pembrolizumab versus placebo ve druhé linii léčby prokázala, že imunoterapie
zlepšila přežití v celkové populaci (HR 0,77; 95% CI 0,63–0,94). Přežití bylo lepší než v kontrolním rameni u pacientů s HCC souvisejícím s HBV (n=574; p=0,0008) a HCC souvisejícím s HCV (n=345; p=0,04). Přežití nebylo lepší než v kontrolním rameni u pacientů s nevirovým HCC (n=737; p=0,39).
Imunoterapie v indikaci léčby HCC nemá úhradu ani registraci.
Léčba
Chirurgická léčba
Jedinou potenciálně kurativní léčbou je chirurgická léčba – transplantace a resekce jater.
Resekce jater:
Resekce jater je metodou první volby pro léčbu HCC v necirhotických játrech. Resekci lze výběrově zvažovat u dobře kompenzovaných pacientů s cirhózou při vyloučení klinicky významné portální hypertenze (anamnéza vaskulární dekompenzace, přítomnost jícnových varixů, zlatým standardem je měření gradientu mezi jaterní a portální žílou – HVPG). Recidiva HCC po resekci bývá u cirhotiků častá.
Transplantace jater:
Výhodou transplantace je zajištění maximální onkologické radikality a současného vyřešení chronického jaterního onemocnění. Nevýhodou je doživotní nutnost imunosuprese. Pro transplantaci jater při HCC v necirhotických játrech neplatí BCLC staging. Tradičním nástrojem pro indikaci HCC k transplantační léčbě jsou při vyloučení známých kontraindikací bez přítomnosti radiologických známek angioinvaze a/nebo extrahepatálního postižení. Aplikace těchto kritérii vede u transplantovaných pacientů k nízkému riziku rekurence HCC, nicméně jsou velice restriktivní. Bylo prokázáno, že rozumné uvolnění těchto kritérií vede k možnosti léčit transplantací výrazně více nemocných bez podstatného zhoršení jejich celkového přežívání. V současné době patří mezi zavedená rozšířená kritéria transplantační léčby u HCC: UCSF kritéria (University od California at San Francisco) nebo Up To Seven kritéria.
Lokoregionální destrukční metody: Transarteriální chemoembolizace a radiofrekvenční ablace jsou rozebrány v kapitole č. 37.
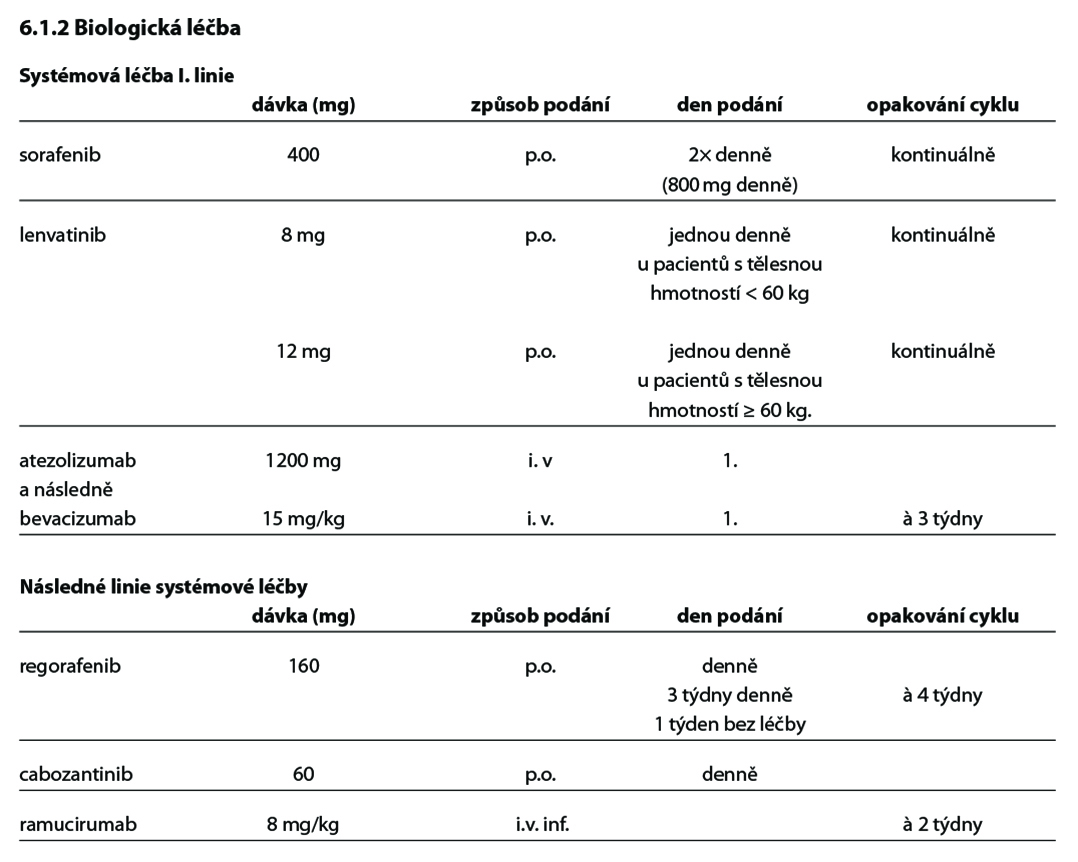
Doporučení pro systémovou léčbu HCC pro pacienty v dobrém stavu PS 0-2, Child Pugh A-B
V první linii systémové léčby HCC lze podat sorafenib nebo lenvatinib nebo atezolizumab s bevacizumabem. Nejsou data podporující podávání kombinované léčby tj. pooperační podání sorafenibu či kombinaci nebo sekvenční podání TACE a sorafenibu. Při progresi na lokálně ablativních metodách lze zahájit léčbu systémovou i ve stadiu B. Při progresi na sorafenibu lze dobře vybraným pacientům v dobrém výkonnostním stavu (PS≤1) podat regorafenib nebo cabozantinib* nebo ramucirumab* při AFP ≥400 ng/ml. Podmínkou je předpoklad dobré spolupráce. Systémová chemoterapie v adjuvantní indikaci a v indikaci paliativní nezlepšuje výsledky přežití.
Sledování:
Pacienti po radikální léčbě by měli být sledování pro jaterní funkce a zobrazovacími metodami CT nebo MR jater v intervalu 3 měsíce první 2 roky, následně v intervalu a 6 měsíců. Pacienti v průběhu paliativní léčby v intervalu 2 měsíce.
6.2 Zhoubný novotvar žlučníku a žlučových cest
Chirurgická resekce je jedinou, potenciálně kurativní metodou léčby nádorů žlučníku a žlučových cest. Onemocnění má
nepříznivou prognózu s uváděným přežitím 5 let v 5–15 % případů. Důvodem je častý vznik lokální recidivy či generalizace
onemocnění. Vzhledem k nízké incidenci tohoto typu nádoru a odlišné charakteristice jednotlivých podtypů (žlučník,
intrahepatální karcinom, perihilární karcinom a distální karcinom žlučových cest) jsou jen velmi limitovaná data o efektivitě
adjuvantní léčby. Většina studií je retrospektivních.
6.2.1. Diagnostika a staging
Nádory žlučníku jsou diagnostikovány často náhodně v resekátu po cholecystektomii, tj. po skončení operačního výkonu. U pacientů tohoto typu s nálezem pT1b a větším je indikována časná reoperace s doplněním lymfadenektomie, resekce jaterního lůžka se snahou o dosažení negativních resekčních okrajů. Před plánovaným resekčním výkonem u pacientů se známou diagnózou karcinomu žlučníku je doporučováno vyšetření jaterních funkcí, CT vyšetření břicha, CT vyšetření plic ke stanovení rozsahu onemocnění. Pro pacienty s ikterem či jako předoperační vyšetření u pacientů s operabilním nádorem žlučových cest je indikováno vyšetření MRCP k potvrzení operability. ERCP je metoda k získání vzorku tkáně k vyšetření či došetření stenoz nejasné etiologie, včetně řešení obstrukčního ikteru zavedením stentu. Diagnostické a terapeutické metody u nádorů žlučových cest byly v posledních letech rozšířeny o transpapilární cholangioskopii. Přímou endoskopickou vizualizací žlučových cest lze posoudit charakter stenozy, provést i cílenou biopsii suspektního nálezu apod. Předoperační stanovení markerů CEA a CA 19-9. U nádorů v rámci chirurgické léčby stagingová laparoskopie.
6.3. Léčba nádorů žlučníku a žlučových cest.
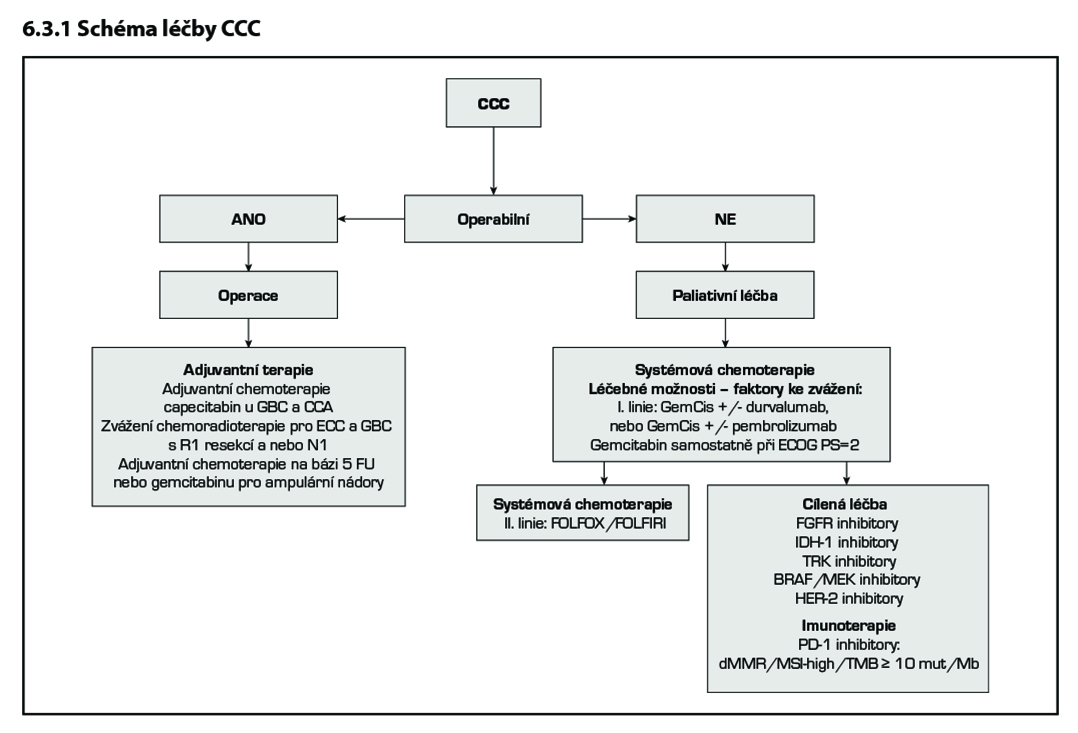
Jedinou potenciálně kurativní metodou léčby je léčba chirurgická. Benefit adjuvantní léčby byl prokázán hlavně u pacientů s R1 resekčním výkonem či pozitivními uzlinami (N+). Relativně novým přístupem je indikace nemocných s hilovým cholangiocelulárním karcinomem (též Klatskinův nádor) k transplantační léčbě. U vysoce selektovaných pacientů s tímto onemocnění bylo dosaženo při aplikaci tzv. Mayo protokolu k signifikantnímu zlepšení celkového přežívání.
Brachyterapie: Indikací k léčbě pomocí brachyterapie jsou maligní striktury žlučovodů, které mohou být kanylovány a zároveň nejsou vhodné k resekci. Další indikací je brachyterapie na oblast zavedeného stentu žlučových cest jako prevence obstrukce (prorůstání) stentu tumorem. Existují dvě možné techniky dle přístupu do žlučových cest – perkutánní drenáží či transduodenálním endoskopickým přístupem.
6.3.2 Stadium I
Po radikálním odstranění karcinomu žlučníku nebo žlučových cest u stadia I (T1N0M0) bez další léčby.
6.3.3 Stadium II
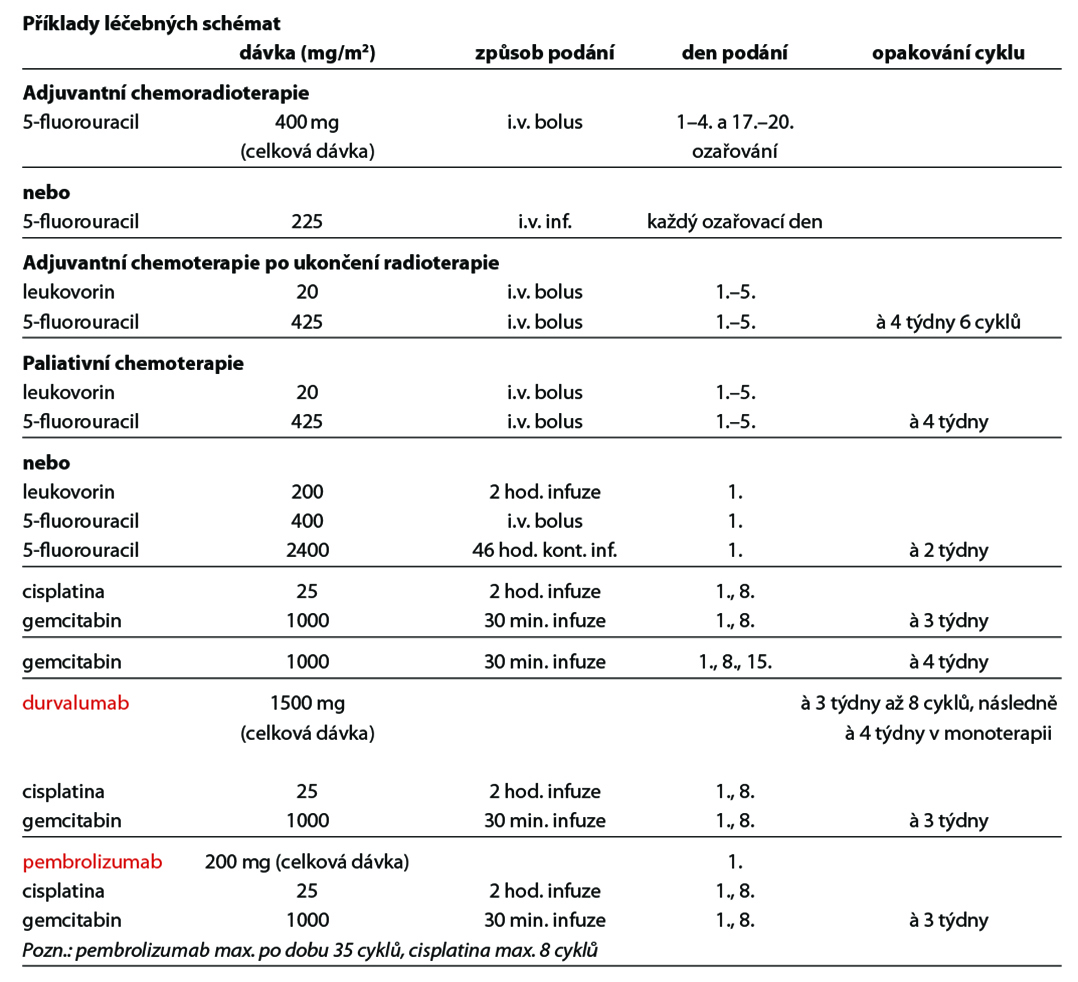
Po radikální resekci (R0) karcinomu žlučníku u stadia II (T2N0M0) je indikovaná adjuvantní chemoradioterapie s podáním 5-fluorouracil, alternativou je systémová chemoterapie na bázi fluoropyrimidinů či gemcitabinu.
V případě intrahepatálního či extrahepatálního karcinomu žlučových cest je po R0 resekci standardem dispenzarizace. Chemoradioterapie není indikovaná.
6.3.4 Stadium III
Po zajištění derivace žluči je indikovaná paliativní chemoterapie založena na 5-fluorouracilu či gemcitabinu nebo paliativní chemoradioterapie s podáním 5-fluorouracil. Z multivariační analýzy vyplynul největší benefit z adjuvantní léčby u pacientů s positivními lymfatickými uzlinami nebo zachyceným karcinomem v resekčním okraji (R1).
6.3.5 Stadium IV
U stadia IV je u pacientů v dobrém celkovém stavu indikovaná paliativní chemoterapie založena na kombinaci platiny a gemcitabinu. Kombinace gemcitabinu s cisplatinou prokázala vyšší efektivitu jako monoterapie a pro pacienty ve velmi dobrém celkovém stavu je doporučována tato kombinace jako léčebný standard. Nově durvalumab v kombinaci s gemcitabinem a cisplatinou je nejefektivnější léčbou v první linii u dospělých pacientů s neresekovatelným nebo metastazujícím karcinomem žlučových cest se zlepšením celkového přežití o 24 %. Jako alternativu lze v této indikaci použit pemrolizumab. V obou případech je nutné žádat o úhradu. Vzhledem k vysoké variabilitě molekulárních prediktorů a vzácnosti onemocnění je indikováno testování NGS. Výsledek testování může v případě prokázání „targetovatelných“ mutací zásadně ovlivnit výběr léčbě do druhé linii. Nejčastěji se jedná o FGFR2 fúzi (10–16 %), IDH1/ IDH2 mutaci (19 %), NTRK fúzi (4 %), HER-2 overexpresi (4–16 %) a BRAF V600E mutaci (1–5 %), MSI-H (2–5 %). V případě průkazu fúze FGFR2 je efektivní léčba pemigatinibem, který je registrován již i v EU i ČR, nicméně o úhradu léčby z prostředků zdravotního pojištění je nutno žádat. V případě IDH1/IDH2 mutace je efektivní léčba ivosidenibem, ten má registraci v EU i ČR, ale o úhradu se musí žádat. V ostatních případech„targetovatelných“ mutací jsou všechna léčiva v podmínkách ČR standardně používána u jiných indikací a proto je potřeba o úhradu v indikaci léčby nádorů žlučových cest a žlučníku žádat. Další možností do druhé linie léčby je kombinace FOLFOX.
6.3.6. Podpůrná léčba
Obstrukce žlučových cest – pokud není řešitelné endoskopickým zavedením stentu, pak je možné řešení cestou PTC. Případná léčba cholangoitidy či léčba bolesti probíhá dle standardních postupů.
6.3.7. Sledování
Pacienti po kurativním výkonu jsou sledováni včetně markerů a CT v intervalu 3 měsíce po dobu 2 let, následně v intervalu 6 měsíců, po 5 letech lze prodloužit interval sledování na jedenkrát ročně. V průběhu paliativní léčby je doporučeno sledování v intervalu 2–3 měsíce.
Literatura:
- Llovet JM, Kelley RK, Villanueva A et al. Hepatocellular carcinoma. Nature Reviews 2021.
- Vogel A, Cervantes A, Chau I et al. ESMO Guidliness Committee. Updated treatment recommendation fo hepatocelular carcinoma (HCC) from the ESMO
Clinical Practice Guidlines. - Pfister D, Núñez NG, Pinyol R, et al. NASH limits anti-tumour surveillance in immunotherapy-treated HCC. Nature. 2021 Apr;592(7854):450-456.
- Reig, M, Forner A., Rimola L, et al. (2022). “BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update.” J Hepatol 76(3): 681-
693. - Javle M, Bekaii-Saab T, Jain A, Wang Y, et al. Biliary cancer: Utility of next-generation sequencing for clinical management. Cancer. 2016 Dec 15;122(24):3838-
3847. - Subbiah V, Lassen U, Élez E, et al. Dabrafenib plus trametinib in patients with BRAFV600E-mutated biliary tract cancer (ROAR): a phase 2, open-label, single-
arm, multicentre basket trial. Lancet Oncol. 2020 Sep;21(9):1234-1243. - Marin JJG, Prete MG, Lamarca A, et al. working group 6 of the COST-action 18122 (Euro-Cholangio-NET) as part of the European Network for the study of
Cholangiocarcinoma (ENSCCA). Current and novel therapeutic opportunities for systemic therapy in biliary cancer. Br J Cancer. 2020 Sep;123(7):1047-1059. - Vogel A, Bridgewater J, Edeline J, et al. Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Nov
10:S0923-7534(22)04699-3. - Oh D.Y., He A.R., Qin S., et al. A phase 3 randomized, double-blind, placebo-controlled study of durvalumab in combination with gemcitabine plus cisplatin
(GemCis) in patients (pts) with advanced biliary tract cancer (BTC): TOPAZ-1. J. Clin. Oncol. 2022, 40, 378. - Kelley RK., et al. Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced
biliary tract cancer (KEYNOTE-966): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2023; 401: 1853–65