Konference: 2007 XIV. Jihočeské onkologické dny
Kategorie: Maligní lymfomy a leukémie
Téma: Postery
Číslo abstraktu: 034p
Autoři: MUDr. Luděk Raida, Ph.D.; doc. MUDr. Tomáš Papajík, CSc.; prof. MUDr. Edgar Faber, CSc.; prof. MUDr. Karel Indrák, DrSc.; MUDr. Antonín Vítek; MUDr. Vladimír Koza (1954 - 2012); Mgr. Kateřina Langová, Ph.D.
V posledním desetiletí se přípravné režimy s redukovanou intenzitou (RIC) a pokrok v podpůrné péči zásadně podílely na nárůstu počtu alogenních transplantací krvetvorných kmenových buněk (HSCT) pro diagnózu maligního lymfomu. Nemyeloablativní předtransplantační přístupy vychází z předpokladu tzv. reakce štěpu proti lymfomu (GvL), která má imunologickým mechanismem zajistit kontrolu a event. úplnou eliminaci nádorových buněk [1, 2]. Příčiny neúspěchu alogenní HSCT jako léčebné metody u nemocných s maligními lymfoproliferacemi jsou v zásadě tři:
- Relaps nebo progrese lymfomu při jeho vysoké proliferační
aktivitě (např. lymfoblastický lymfom) nebo sníženém imunogenním
potenciálu nádorových buněk (nižší exprese hlavního
histokompatibilního komplexu např. u Hodgkinova lymfomu?). K dalším
faktorům, které mohou zvýšit riziko relapsu patří rejekce štěpu a
intenzita potransplantační profylaktické nebo léčebné imunosuprese,
jakož i délka jejího podávání.
- Nemoc štěpu proti hostiteli (GvHD) a její komplikace (infekce)
patří k hlavním příčinám potransplantační mortality (TRM), a to i
přes navozenou remisi lymfomu.
- Výskyt závažných infekčních komplikací, a to i bez předchozí manifestace GvHD, je vyšší u těžce předlečených pacientů, zejména při použití antithymocytárního globulinu (ATG) nebo alemtuzumabu v přípravném režimu.
Výsledky alogenních HSCT jsou demonstrovány na souboru 23 nemocných dispenzarizovaných pro diagnózu maligního lymfomu na Hemato-onkologické klinice FN Olomouc. 19 pacientů bylo rovněž na tomto pracovišti transplantováno. Dva podstoupili alogenní HSCT v Ústavu hematologie a krevní transfúze v Praze a dva na Hematologicko-onkologickém oddělení FN Plzeň.
Soubor nemocných a metody:
Soubor nemocných a stav základního onemocnění
Alogenní HSCT pro diagnózu maligního lymfomu
podstoupilo v průběhu 5 let (od září 2001 do září 2006) 23
nemocných, 14 mužů (60,9%) a 9 žen (39,1%) s věkovým mediánem 47
(26 - 58) let. 4 z nich (17,5%) byli transplantováni pro rekurentní
a/nebo refrakterní Hodgkinův lymfom (HL) a 19 (82,5%) pro
nehodgkinský lymfom (NHL). Z NHL byly zastoupeny 3 (13%)
folikulární lymfomy (FL), 4 (17,4%) difuzní B velkobuněčné lymfomy
(DLBCL), 5 (21,7%) lymfomů z plášťových buněk (MCL), 2 (8,7%)
lymfoblastické (B i T) lymfomy (LBL), 2 (8,7%) periferní T lymfomy
(PTL), 2 (8,7%) T anaplastické velkobuněčné lymfomy (T-ALCL) a 1
(4,3%) lymfom z malých lymfocytů (SLL). O relaps lymfomu z
kompletní remise (CR) dosažené primární nebo předchozí léčbou šlo
pouze u 8 pacientů (34,8%) souboru, dalších 15 nemocných (65,2%)
této léčebné odpovědi před transplantací nikdy nedosáhlo. U
nemocných, kteří bezprostředně před transplantací nedosáhli CR nebo
parciální remise (PR) po minimálně dvou chemoterapeutických liniích
event. doplněných radioterapií (RT), bylo onemocnění považováno za
refrakterní. Těchto pacientů bylo v souboru 16 (69,6%). U 9 (39,1%)
bylo onemocnění v době HSCT považováno za stabilní (SD), v 7
případech (30,5%) se jednalo o jeho progresi (PD). Jediná nemocná
(4,3%) dosáhla před transplantací CR, zbylých 6 (26,1%) pouze PR
choroby.
Přípravný režim
22 příjemců (95,7%) bylo transplantováno po RIC,
pouze jediný pacient (4,3%) s T lymfoblastickým lymfomem podstoupil
standardní myeloablativní přípravu kombinující vysoké dávky
busulfanu a cyklofosfamidu (BUCY). Základem všech aplikovaných RIC
byl fludarabin doplněn busulfanem (8 mg/kg) u 2 (8,7%),
cyklofosfamidem (120 mg/kg) u 14 (60,9%) a melfalanem (140 mg/m2) u
6 (26,1%) nemocných. ATG (Fresenius) a alemtuzumab byly součástí
přípravy v 10 (43,5%), resp.1 (4,3%) případě. Jednorázová aplikace
nízké dávky (2 Gy) celotělového ozáření (LD-TBI) byla součástí
přípravného režimu kombinujícího fludarabin, cyklofosfamid a ATG u
3 pacientů (13%).
Dárci krvetvorných kmenových buněk a kvalita štěpu
12 nemocných (52,2%) přijalo štěp od
HLA-identického sourozence, 7 (30,4%) od HLA-identického (MUD) a 4
(17,4%) od HLA-inkompatibilního nepříbuzného dárce (MMUD).
Periferní kmenové buňky byly jako štěp použity ve 21 (91,3%) a
kostní dřeň ve 2 (8,7%) případech. Medián převedených
mononukleárních (MNC) a CD34+ buněk byl 6,44 (1,83 - 15,65) x
108/kg, resp. 5,37 (2,6 - 10,05) x 106/kg.
Medián CD3+ buněk obsažených ve štěpu byl 2,21 (0,14 - 5,7) x
108/kg. Subpopulace CD4+ a CD8+ lymfocytů byly
zastoupeny v mediánu 1,57 (0,07 - 3,33) x 108/kg, resp.
0,71 (0,07-2,1) x 108/kg.
Prevence GvHD
Prevence GvHD byla u všech nemocných zajištěna
cyklosporinem A (CSP-A). Bez aplikace dalších imunosupresiv u 8
(34,8%) a v kombinaci buď s mykofenolát mofetilem (MMF) nebo
nízkými dávkami methotrexatu (MTX) u 9 (39,1%), resp. u 6 příjemců
(26,1%). Podávání CSP-A bylo zahájeno denní dávkou 2x 3 mg/kg
v den -1 před převodem štěpu. Jeho dávka byla postupně
snižována ode dne +90 do dne +180 po HSCT, kdy byl CSP-A vysazen,
pokud v předchozím období nedošlo k rozvoji akutní nebo chronické
formy GvHD. CSP-A byl postupně redukován a vysazen do dne +100,
pokud příjemce nedosáhl v den +60 kompletního (100%) dárcovského
buněčného chimerismu. Jestliže byla potvrzena progrese lymfomu
(více než 25% nárůst předtransplantační nádorové masy), byl CSP-A
redukován a vysazen během čtyř týdnů. V bezprostředním
peritransplantačním a potransplantačním období byl CSP-A podáván
intravenózně. Pacienti byli převedeni na perorální medikaci,
jakmile odezněly veškeré projevy event. potransplantační
gastrointestinální toxicity. Aplikace MMF byla zahájena v den +1 po
převodu štěpu denní dávkou 2 x 15 mg/kg. Ode dne +30, pak byla jeho
dávka postupně snižována s úplným vysazením v den +60. Při
potvrzení progrese choroby nebo při nedosažení aspoň 75%
dárcovského buněčného chimerismu v den +30, bylo podávání MMF ihned
ukončeno. Podobně jako u CSP-A byl MMF v úvodu aplikován
intravenózně s následným převodem na p.o. medikaci. MTX byl v rámci
prevence GvHD podáván v dávce 10 mg/m2 ve dnech +1, +3 a
+6 po HSCT.
Monitorování buněčného chimerismu
Vývoj buněčného chimerismu byl monitorován v
populaci jaderných buněk, a to v periferní krvi ve dnech +30, +60,
+100, +180, +270 a +360 a v kostní dřeni ve dnech +30, +100, +180 a
+360 po HSCT. K hodnocení zastoupení buněk příjemce a dárce
bylo využito polymorfismů mikrosatelitních oblastí DNA, krátkých
tandemových repeticí (STR). Pro jejich analýzu byla použita
technika kvantitativní polymerázové řetězové reakce v reálném čase
(RT-PCR).
Hodnocení léčebné odpovědi
Potransplantační vyhodnocení dosažené odpovědi
bylo poprvé realizováno mezi dny +180 a +200 po HSCT (po vysazení
imunosuprese). Další komplexní zhodnocení stavu proběhlo kolem dne
+360 a dále vždy po 12 měsících v průběhu sledování. V případě
podezření na relaps nebo progresi lymfomu byla nezbytná vyšetření
provedena ihned, bez ohledu na časový odstup po HSCT. 30. 6. 2007
byl medián potransplantačního sledování souboru 22 (1-65)
měsíců.
Statistická analýza
Vzhledem k počtu nemocných nebyla provedena
žádná komparativní statistická analýza. Sestrojeny byly pouze
Kaplan-Meierovy křivky pravděpodobnosti:
- Přežívání bez choroby (DFS), které bylo v rámci této analýzy
definováno jako interval od dosažení CR choroby do jejího relapsu,
a to bez ohledu na event. úmrtí z jiné příčiny. Data úmrtí z jiných
příčin než progrese lymfomu byla cenzurována a považována za data
poslední kontroly pacienta. Vznikla tak hypotetická modelová křivka
DFS, která může naznačit kurabilní potenciál alogenních
transplantací v léčbě lymfomů (GvL efekt).
- Přežívání bez nežádoucí události (EFS) bylo definováno jako
interval od dosažení CR choroby do jejího relapsu nebo úmrtí z
jakékoliv příčiny. Tato křivka již odráží reálný stav a aktuální
kurabilitu maligních lymfomů
s využitím alogenní HSCT jako léčebné metody. - Celkové přežívání (OS) bylo definováno jako interval od HSCT do úmrtí z jakékoliv příčiny.
Výsledky:
Všichni nemocní obnovili po HSCT krvetvorbu s
přihojením dárcovských buněk. U 22 hodnotitelných příjemců (95,7%)
došlo k vzestupu granulocytů >0,5x109/l v mediánu 15
(7-31) dní po převodu štěpu. Jeden z pacientů (4,3%) vůbec
nerozvinul těžkou neutropenii. Vzestup trombocytů
>20x109/l byl zaznamenán u 20 nemocných (87%) v
mediánu 12 (6-28) dní po HSCT . Ve 3 případech (13%) k
potransplantačnímu poklesu pod hodnotu 20x109/l vůbec
nedošlo. Všichni příjemci s relativně nižší hematologickou
toxicitou podstoupili transplantaci po RIC kombinujícím fludarabin
s cyklofosfamidem. Kompletního (100%) dárcovského buněčného
chimerismu dosáhlo v den +30 13 z 23 (56,5%) a v den +100 18 z 19
(94,7%) hodnotitelných příjemců. Ani v jednom případě nebyla
zaznamenána rejekce dárcovské krvetvorby.
Z časné nehematologické potransplantační
orgánové toxicity dominovalo postižení gastrointestinální,
mucositis I. v 1 (4,3%), II. ve 3 (13%) a III. stupně v 5 (21,7%)
případech, a to pouze u příjemců s aplikací busulfanu nebo
melfalanu v přípravném režimu. U 2 nemocných (8,7%) došlo k rozvoji
renální insuficience a neurotoxicky, II., resp. III. stupně, pro
které bylo nezbytné zaměnit CSP-A v prevenci GvHD za kombinaci MMF
s kortikosteroidy. V souboru nebyl zaznamenán rozvoj venookluzivní
choroby (VOD) jater ani projevy plicní toxicity ve smyslu syndromu
idiopatické pneumonie (IPS), pouze v jediném případě (4,3%) byl
diagnostikován tzv. „plicní přihojovací syndrom“ (PES).
U 8 pacientů (34,8%) byla v průběhu pravidelného
potransplantačního monitorování potvrzena reaktivace
cytomegalovirové (CMV) infekce, avšak bez klinické manifestace.
Všichni podstoupili úspěšnou preemptivní léčbu gancyklovirem nebo
valgancyklovirem.
K rozvoji akutní formy GvHD došlo u 11 příjemců
(47,8%) v mediánu 46 (15-92) dní po HSCT. U 6 nemocných (26,1%)
byla intenzita akutní GvHD II. stupně. III. a IV. stupeň byl
zaznamenán ve 3 (13%), resp. 2 (8,7%) případech. Chronická GvHD
byla pozorována u 10 z 18 (55,5%) hodnotitelných pacientů. Její
limitovaná forma u 6 (33,3%) a extenzivní u 4 (22,2%)
příjemců.
Kompletní remise lymfomu dosáhlo všech 23
nemocných (100%). Relaps choroby byl zaznamenán u 5 z nich (21,7%)
v mediánu 12 (2-17) měsíců po HSCT. Ve všech pěti případech se
jednalo o agresivní formy maligních lymfomů (2x MCL, 1x LBL, 1x
DLBCL, 1x T-ALCL). Čtyři relapsy se rozvinuly na kombinované
imunosupresivní léčbě akutní nebo chronické GvHD. Další léčebné
intervence, včetně aplikace infuzí dárcovských lymfocytů (DLI) u
dvou nemocných navodily druhou potransplantační CR ve 3 případech
(60%). Všechny tyto CR však byly provázeny rozvojem akutní (1x),
resp. chronické GvHD (2x). Zbývající 2 relabující pacienti (8,7%)
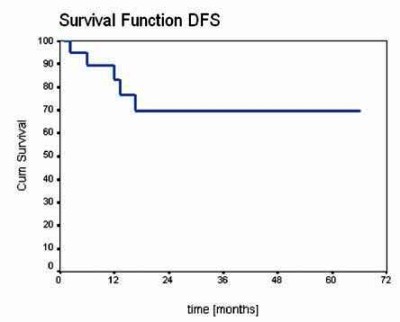
zemřeli na progresi lymfomu 29 a 27 měsíců po HSCT. Modelová
pravděpodobnost pětiletého DFS kalkulující pouze se zaznamenanými
relapsy lymfomu (ne s úmrtími na potransplantační komplikace) byla
69,7% (Graf 1). V průběhu sledování bylo v souboru
zaznamenáno 10 úmrtí (43,5%) v mediánu 4 (1-30) měsíců po
transplantaci. 8 nemocných (34,8%) zemřelo na potransplantační
komplikace. 6 úmrtí (26,1%) souviselo s rozvojem akutní nebo
chronické GvHD, ve dvou případech (8,7%) byla příčinou pouze
infekce (fulminantní hepatitida B v den +30, resp. pneumonie v den
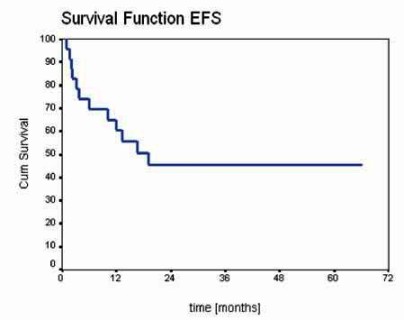
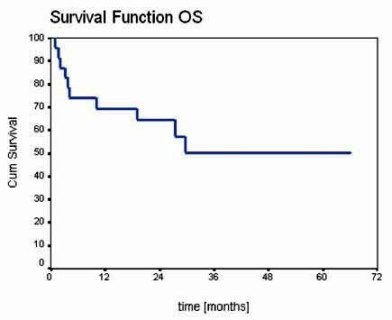
+302). Pravděpodobnost pětiletého EFS a OS byla 45,5%, resp. 50%
(Graf 2 a 3).
Závěry:
Prezentované výsledky potvrzují možnou účinnost
alogenní HSCT jako léčebné metody u nemocných s jinak inkurabilními
rekurentními/refrakterními maligními lymfomy [3, 4, 5, 6]. GvL
efekt bylo možno pozorovat u většiny pacientů tohoto souboru, a to
i v případech agresivních lymfomů s vysokou proliferační aktivitou
a navzdory aplikaci RIC. Až na jediný případ došlo k relapsům na
účinné kombinované imunosupresivní léčbě GvHD a v 60% se podařilo
lymfom opět eliminovat potenciací GvL reakce. Hlavním problémem
však stále zůstává GvHD, která zásadním způsobem ovlivňuje
potransplantační morbiditu a mortalitu. Více než dvacetiprocentní
možný rozdíl mezi DFS a EFS v pěti letech nepřímo odráží problém
GvL reakce a GvHD. Stále zůstává poměrně široký prostor pro
ovlivnění TRM, a to např.:
- Individuální volbou přípravného režimu na základě
předtransplantačních imunologických a dalších parametrů
příjemce.
- Individuální volbou profylaktické potransplantační
imunosuprese, včetně délky jejího podávání.
- Individuálním přístupem v léčbě chronické GvHD (zohlednění její
intenzity a aktivity).
- Při záměru časného a rychlého vysazení profylaktické imunosuprese pro tzv. perzistenci choroby brát v úvahu biologickou charakteristiku lymfomu (subtyp a jeho proliferační aktivita, event. další prognostické parametry), jeho potransplantační stabilizaci s vymizením klinické symptomatologie (zejména u indolentních lymfomů) a rizika rozvoje GvHD.
Vzhledem k řadě proměnných, které ovlivňují výsledek alogenní HSCT u nemocných s maligními lymfomy, bylo a je problematické zahájit současně celou řadu prospektivních klinických studií, jež budou hodnotit jednotlivé faktory v transplantačním přístupu. Aktuálně dostupnější, a snad i přínosnější, by mohly být retrospektivní studie opírající se o multivariační statistické analýzy velkých souborů pacientů.
Práce byla podpořena Výzkumným záměrem MŠMaT
MSM-6198959205.
Literatura:
- Weiden PL, Sullivan KM, Flournoy N, et al. Antileukemic effect
of chronic graft-versus-host disease. Contribution to improved
survival after allogeneic marrow transplantation. N Engl J Med
1981;304: 1529-
1533. - Horowitz MM, Gale RP, Sondel PM, et al. Graft-versus-leukemia
reactions after bone marrow transplantation. Blood 1990; 75:
555-562.
- Anderlini P., Champlin RE. Reduced intensity conditioning for
allogeneic stem cell transplantation in relapsed and refractory
Hodgkin lymphoma: where do we stand? Biology of Blood & Marrow
Transplantation 2006; 12: 599-602.
- De Lavallade H., Mohty M., El-Cheikh J., et al.
Reduced-intensity conditioning allogeneic stem cell transplantation
for patients with chemoresistant or relapsed follicular lymphoma.
British Journal of Haematology 2006; 135: 408-410.
- Dreger P. Allogeneic stem cell transplantation for patients
with resistant high-grade lymphoma: what is the potential of
reduced-intensity conditioning? Annals of Oncology 2002; 13:
1507.
- Válková V., Benešová K., Vítek A., et al. Alogenní transplantace krvetvorných buněk po přípravném režimu redukované intenzity v léčbě lymfoproliferací (výsledky ÚHKT 1999-2005). Trans. Hemat. Dnes 2007; 13:67-70.
Graf 1: Modelová Kaplan-Meierova křivka DFS 23 nemocných po
HSCT.
Graf 2: Kaplan-Meierova křivka EFS 23 nemocných po
HSCT.
Graf 3: Kaplan-Meierova křivka OS 23 nemocných po
HSCT.
Datum přednesení příspěvku: 12. 10. 2007





