Konference: 2011 XXXV. Brněnské onkologické dny a XXV. Konference pro sestry a laboranty
Kategorie: Ostatní
Téma: Postery
Číslo abstraktu: 238p
Autoři: Ing. Jiří Sochor, Ph.D.; prof. MUDr. Tomáš Eckschlager, CSc.; doc.RNDr. Vojtěch Adam, Ph.D.; prof. RNDr. Marie Stiborová, DrSc.; doc.Ing. René Kizek, Ph.D.
Klíčová slova: oxidační stres, nádorové buňky, cytostatika
Úvod
Jeden z největších problému při léčbě rakoviny představuje toxicita podávaných léčiv. Oxidační stres, jako reakce na protinádorová léčiva, není doposud uspokojivě prozkoumán (Il´yasova, et al., Kansal, et al.). Je známo, že souvisí s nerovnováhou mezi koncentrací prooxidantů a antioxidačních mechanismů (Singh, et al.). Ukazuje se, že tyto změny jsou velmi významné u pacientů léčených s onkologickými onemocněními (Reuter, et al.). Přímé měření reaktivních kyslíkových radikálů nebo markerů oxidačního stresu je v klinické medicíně stále obtížné (Franco, et al.). Organismus je ovlivněn působením mnoha faktorů současně (stáří pacientů, výživa, životní prostředí, stres, další onemocnění) a nelze tak spolehlivě určit změnu oxidačního působení vlivem nádoru a následně vlivem léčby (Il´yasova, et al., Omerovic, et al.). Snahou proto je pochopit nejprve procesy na úrovni jednotlivých buněk v izolovaném/neutrálním prostředí bez působení vnějších vlivů.
Cílem našeho experimentu bylo zavedení metod pro stanovení antioxidační aktivity u nádorových buněk a u buněk s přídavkem cytostatického léčiva. Hladina oxidativního stresu byla sledována jako změna antioxidační aktivity nebo alternativně jako antioxidační status. Výsledkem je optimalizace čtyř principielně rozdílných fotometrických metod.
Experimentální část
Analýza antioxidační activity: Pro stanovení antioxidační aktivity byl použit automatický spektrofotometr BS–400 (Mindray, China), který se skládá z kyvetového prostoru (temperovaný na 37±0.1 °C), reagenčního prostoru s karuselem pro reagencie a přípravu vzorků (temperovaný na 4±1 °C) a optického detektoru. Zdrojem světla je halogen-wolframová žárovka. Přenos vzorků a reagencí zabezpečuje robotické rameno s dávkovací jehlou. Obsah kyvet je promíchán automatickým míchadlem ihned po přidání činidla nebo vzorku o objemu 2-45 µl. Kontaminace je minimalizována díky proplachování jak dávkovací jehly, tak míchadla MilliQ vodou. Pro detekci bylo možné využít vlnových délek: 340, 380, 412, 450, 505, 546, 570, 605, 660, 700, 740, 800nm.
Příslušné množství reagencie (DPPH, ABTS, FRAP, DMPD) bylo nepipetováno do kyvety a inkubováno 15 minut s analyzovaným vzorkem. Následně byla změřena absorbance této směsi. Pro výpočet antioxidační aktivity byla použita hodnota absorbance samotné reagencie před inkubací a hodnota absorbance vzorku s reagencií po inkubaci. Tyto hodnoty byly od sebe odečteny. Výsledná hodnota byla vypočtena dle kalibrační křivky na ekvivalent kyseliny galové. Postupy měření a příprava reagencií jsou popsána v protokolu (Sochor, et al.).
Biologické vzorky: K experimentu byly použity buňky linie UKF-NB-4 s amplifikací genu MYCN (sensitivní skupina) a od ní odvozená linie rezistentní k cisplatině, která byla připravena dlouhodobou kultivací se stoupající koncentrací cisplatiny. Ty byla na úrovních 0,1 µM, 1 µM, a 10 µM (+kontrolní vzorek s koncentrací 0 µM). Doba interakce s cisplatinou byla 6 a 48 hodin.
Výsledky a diskuse
Oxidační stres představuje porušení rovnováhy mezi vznikem a odstraňováním reaktivních forem kyslíku. Je vyvolán zvýšenou tvorbou kyslíkových radikálů nebo snížením kapacity antioxidační ochrany (Bulkley, Clutton). Jedním z ukazatelů ochrany před volnými radikály je antioxidační aktivita (Antolovich, et al.).
V oblasti chemických analýz a biologického hodnocení antioxidačních charakteristik byly v posledních letech vypracovány četné metody umožňující stanovení antioxidační aktivity (Schlesier, et al., Sochor, et al.). Jsou principielně odlišné a postupně se vyvíjí jejich modifikace. Jejich základním smyslem je charakterizovat antioxidační aktivitu v podmínkách blízkých fyziologickému prostředí. Metody jejího stanovení se nejčastěji zakládají na přímé reakci studované látky s radikály (zhášení nebo naopak jejich vychytávání) nebo na reakci s přechodnými kovy.
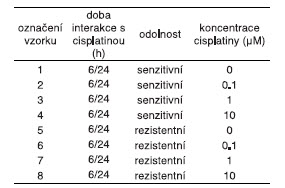
Tabulka 1.: Parametry experimentálních vzorků buněk
V naší studii bylo pro hodnocení antioxidační aktivity použito čtyř rozdílných metodických analýz (DPPH, ABTS, FRAP, DMPD). Tyto metody byly optimalizovány na námi použitý automatický analyzátor BS-400 Mindray. Byly sestaveny kalibrační křivky (Obr. 1 a – d), pro standardní přepočet byla použita kyselina galová.

Tabulka 2.: Shrnutí parametrů pro jednotlivé metody a přepočet na standard kyseliny galové.
V další části experimentu jsme pomocí optimalizovaných metod analyzovali buňky neuroblastomů (Tab. 1).
Hodnoty antioxidační aktivity se lišily v závislosti na koncentraci a působení cisplatiny. Diferenciace výsledků také byla mezi použitými metodami. Toto lze zdůvodnit tím, že každá z metod zháší/vychytává jiný typ volných radikálů. Pomocí této souhrnné detekce jsme získali mnohem komplexnější informace než při analýze samostatných metod. Výsledky buněk, které byly pod vlivem cytostatik, měly nižší hodnoty antioxidační aktivity.
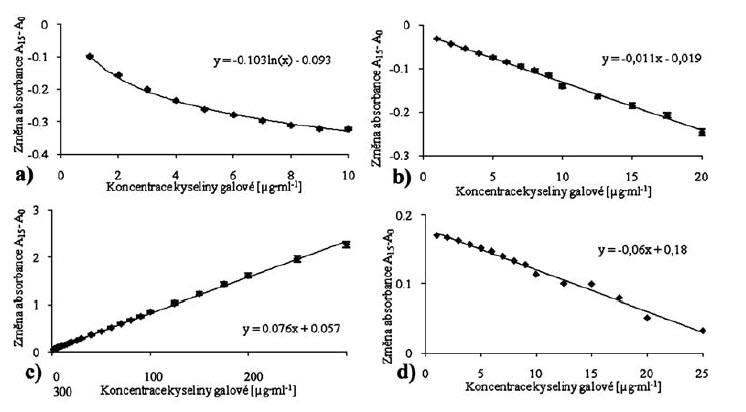
Obr.1.
Absorbance v závislosti na koncentraci standardní látky – kyseliny galové u metod
a) DPPH (2,2-difenyl-1 pikrylhydrazyl),
b) ABTS (2,2‘-azinobis(3-ethylbenzothiazolin-6-sulfonát)
c) FRAP (Ferric Reducing Antioxidant Power)
d) DMPD (N,N-dimethyl-1,4-diaminobenzen).
Závěr
Hledání nových indikátorů detekce oxidačního stresu u onkologických onemocnění je cílem současných výzkumů. K dispozici je jen málo klinických testů, které jsou efektivní, navíc bývají často invazivní a omezené jen na některé typy nádorů. Měření antioxidační aktivity představuje významný aspekt v oblasti klinické medicíny. Naším cílem je využít potenciál této metody u onkologických onemocnění a potvrdit význam oxidativního stresu v průběhu cytostatické léčby.
Literatura:
- Il´yasova, D., et al., (2011): Individual responses to
chemotherapy-induced oxidative stress, Breast Cancer Research and
Treatment, 125: 583-589.
- Kansal, S., et al., (2011): Evaluation of the role of oxidative stress in chemopreventive action of fish oil and celecoxib in the initiation phase of 7,12-dimethyl benz(alpha)anthracene-induced mammary carcinogenesis, Tumor Biology, 32: 167-177.
- Singh, S., et al., (2008): In vitro methods of assay of
antioxidants: An overview, Food Reviews International, 24:
392-415.
- Reuter, S., et al., (2010): Oxidative stress, inflammation, and cancer How are they linked?, Free Radical Biology and Medicine, 49: 1603-1616.
- Franco, R., et al., (2008): Oxidative stress, DNA methylation and carcinogenesis, Cancer Letters, 266: 6-11.
- Il´yasova, D., et al., (2009): Markers of oxidative status in a clinical model of oxidative assault: a pilot study in human blood following doxorubicin administration, Biomarkers, 14: 321-325.
- Omerovic, E., et al., (2008): Aqueous fish extract increases survival in the mouse model of cytostatic toxicity, Journal of Experimental & Clinical Cancer Research, 27: 10.
- Sochor, J., et al., (2010): Fully Automated Spectrometric Protocols for Determination of Antioxidant Activity: Advantages and Disadvantages, Molecules, 15: 8618-8641.
- Bulkley, G. B., (1983): The role of oxygen free-radicals in human-disease processes, Surgery, 94: 407-411.
- Clutton, S., (1997): The importance of oxidative stress in apoptosis, British Medical Bulletin, 53: 662-668.
- Antolovich, M., et al., (2002): Methods for testing antioxidant activity, Analyst, 127: 183-198.
- Schlesier, K., et al., (2002): Assessment of antioxidant activity by using different in vitro methods, Free Radical Research, 36:177-187.
- Sochor, J., et al., (2010): An assay for spectrometric determination of antioxidant activity of a biological extract, Listy Cukrovarnicke a Reparske, 126: 416-417.
Datum přednesení příspěvku: 21. 4. 2011





