Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Chemoterapie
Téma: Léčba monoklonálními protilátkami
Číslo abstraktu: 049
Autoři: doc. MUDr. Ilona Kocáková, Ph.D.; MUDr. Ivo Kocák, Ph.D.; MUDr. Stanislav Špelda; Doc. MUDr. Regina Demlová, Ph.D.; doc. MUDr. Radek Lakomý, Ph.D.; RNDr. Marta Šimíčková, CSc.; prof. MUDr. Rostislav Vyzula, CSc.
Od dubna do prosince 2005 bylo možné pacientům s kolorektálním karcinomem klinického stadia IV podávat bevacizumab v kombinaci s protinádorovou léčbou v rámci specifického léčebného programu (SLP) firmy Roche. Tato léčba probíhala ve vybraných onkologických centrech za předpokladu, že pacient splňoval všechna indikační kriteria pro tuto kombinovanou léčebnou modalitu.
Metodika zpracování
V Masarykově onkologickém ústavu byl pro léčbu pacientů v rámci SLP vypracován protokol vyhodnocující efektivitu a toleranci kombinace dvou základních cytostatik používaných v léčbě kolorektálního karcinomu: kapecitabinu a irinotekanu s konkomitantním podáváním bevacizumabu. Návrh protokolu vycházel z výsledků publikovaných klinických studií fáze II a III a z výsledků preklinických studií:
- Prokazatelná protinádorová účinnost kapecitabinu a irinotekanu v léčbě metastazující kolorektálního karcinomu.
- Srovnatelná účinnost kombinace kapecitabinu a irinotekanu (režim XELIRI) v porovnání s režimem FOLFIRI, procento léčebných odpovědí dosahuje 50%.
- Lepší bezpečnostní profil kombinace XELIRI versus FOLFIRI bez nutnosti centrálního žilního přístupu.
- Možnost plně ambulantní léčby.
- Prokazatelná synergistická protinádorová účinnost kombinace kapecitabinu s bevacizumabem v preklinických studiích.
- Prokazatelná synergistická protinádorová účinnost kombinace irinotekanu s bevacizumabem v preklinických studiích.
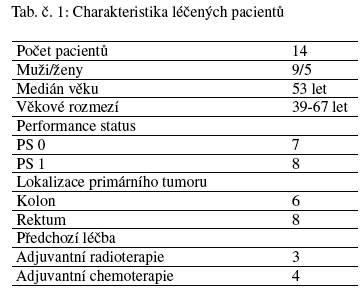
Do tohoto léčebného programu bylo v MOÚ od 3. 5. věku 53 let. U 9 nemocných se jednalo o primárně metastatické onemocnění, u 5 pacientů došlo k časnému relapsu nemoci po skončené adjuvantní léčbě. Bližší charakteristika pacientů a nádorů je uvedena v tabulce č. 1. Podmínkou zařazení do této klinické studie fáze I/II byla níže uvedená kriteria:
- Pacienti starší 18 let s metastazujícím inoperabilním kolorektálním karcinomem, kteří byli plánováni k chemoterapii 1. linie.
- Performance status 0 – 1 a předpokládaná doba přežití delší než 3 měsíce.
- Uspokojivé hematologické a biochemické parametry (neutrofily ≥ 1,5 x 109/L, trombocyty ≥ 100 x 109/L), hodnoty AST, ALT, ALP nepřesahující více než 2,5 x horní limit normálního rozpětí, sérový kreatinin ≤ 1,5 x horní hranice normy. V případě proteinurie ≥ 2+ zjištěné papírkovou metodou byl proveden 24 hodinový sběr moči a celková proteinurie nesměla přesáhnout 1 g/24 hod.
- Interval od předchozího chirurgického zákroku nebo bioptického výkonu činil nejméně 28 dní.
- Pacienti bez přítomnosti CNS metastáz.
- Pacienti bez závažných nehojících se ran, poruch krvácivosti či koagulopatie a nekontrolované hypertenze.
- Nepřítomnost klinicky signifikantního kardiovaskulárního onemocnění.
- Podpis informovaného souhlasu.
Léčebné schéma bylo následující: Kapecitabin 1000 mg/m2 2 x denně, den 2-15, irinotekan 250 mg/m2 den 1, bevacizumab 7,5 mg/kg den 1. Cyklus byl opakován každé 3 týdny. Léčebná odpověď dle RECIST kriterií byla hodnocena po 2-3 cyklech chemobioterapie.
Léčebné výsledky
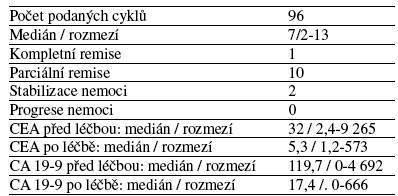
Předběžné výsledky hodnotící efektivitu a toleranci jsou povzbudivé. Léčebnou odpověď hodnocenou k 31. 12. 2005 vystihuje tabulka č. 2. Z nežádoucích účinků léčby stupně ≥ 3 byla zaznamenána pouze granulocytopenie G3 u 1 pacienta. V souvislosti s podáním bevacizumabu jsme u jednoho pacienta pozorovali mírnou epistaxi a u dvou pacientů protenurii nepřesahující 1 gram/den. K přechodnému zvýšení hodnot krevního tlaku došlo u 3 nemocných. U všech pacientů terapie pokračuje: Dávky podávaných cytostatik byly redukovány o 25% u 3 pacientů. Při mediánu léčby 6 měsíců nebyla dokumentována progrese nemoci.
Závěr
Od července 2005 je bevacizumab v ČR registrován pro léčbu pacientů s metastazujícím karcinomem kolorekta v první linii léčby v kombinaci s protinádorovou chemoterapií. V našem početně omezeném souboru byl dokumentován klinický benefit (CR, PR a SD) u všech léčených pacientů, u 4 nemocných s vyjádřeným algickým syndromem (1 x při hepatomegalii, 3x při lokální recidivě) došlo v průběhu léčby ke zmírnění či vymizení symptomů nemoci. Nespornou výhodou tohoto režimu je ambulantní léčba a absence kumulativní toxicity irinotekanu. Lze očekávat, že vedle vysokého procenta léčebných odpovědí povede přidání bioterapie i k prodloužení času do progrese nemoci a prodloužení celkového přežití nemocných.
Literatura
- Ferrara N. Vascular endothelial growth factor: basic science
;and clinical progress. Endocr Rev 200425:581-611.
- Hurwitz H, Fehrenbacher L, Novotny W et al. Bevacizumab plus
irinotecan, fluorouracil, and leucovorin for metastatic colorectal
cancer. N Engl J Med 2004; 350:2335-2342.
- Kabbinavar F, Hurwitz HI, Fehrenbacher L et al. Phase II,
randomized trial comparing bevacizumab plus fluorouracil
(FU)/leucovorin (LV) with FU/LV alone in patients with metastatic
colorectal cancer. J Clin Oncol 2003; 21:60-65
- Kabbinavar F, Schultz J, McCleod M et al. Bevacizumab (a monoclonal antibody to vascular endothelial growth factor) to prolong progression-free survival in first line colorectal cancer (CRC) in subjects who are not suitable candidates for firstline CPT-11. Presented at the American Society of Clinical Oncology Gastrointestinal Symposium, San Francisco, California, January 22-24, 2004.
Jiná léčba
• U 1 pacienta chemoembolizace a radioterapie na oblast jater s efektem rychlé progrese MTS hepatis (léčba v USA)
• U 1 pacienta adjuvantní CHT režimem Xelox po resekci plicních MTS (léčba mimoústavně), do 1 měsíce progrese na plicích

Tab.č.2: Hodnocení léčebné odpovědi podle RECIST kriterií a dynamiky nádorových markerů
Datum přednesení příspěvku: 12. 5. 2006





