Konference: 2008 XV. Jihočeské onkologické dny
Kategorie: Genitourinární nádory
Téma: Nádory ledvin
Číslo abstraktu: 025
Autoři: Doc. MUDr. Milada Zemanová, Ph.D.; Doc. MUDr. Alexandr Poprach, Ph.D.; prof. MUDr. Jindřich Fínek, Ph.D.; prof. MUDr. Stanislav Filip, Ph.D., DSc.; Doc. MUDr. Jana Prausová, Ph.D., MBA; MUDr. Jana Katolická, Ph.D.; MUDr. Martina Vybíralová; MUDr. Lenka Ostřížková; MUDr. Věra Hejzlarová; RNDr. Tomáš Pavlík, Ph.D.
Pokrok v porozumění patogenezi karcinomu ledviny, zejména jeho nejčastější světlobuněčné variantě, má již své léčebné výstupy. Rozpoznání úlohy genu VHL (von Hippel-Lindau ) v regulaci proangiogenních faktorů (1) poskytlo potenciální cíle pro nové preparáty. V současné době jsou již registrovány evropskou agenturou EMEA celkem čtyři léčivé přípravky pro cílenou biologickou léčbu pokročilého a/nebo metastazujícího karcinomu ledviny, a to pro první linii bevacizumab (Avastin ©) v kombinaci s Interferonem alfa (2) a sunitinib (Sutent ©) (3) u pacientů v prognostické skupině dobré a střední, kdy je významně prodlouženo přežití bez progrese. Sunitinib má nyní k dispozici data o prodloužení celkového přežití (6). Pro nemocné s více nepříznivými prognostickými faktory (skupina špatné prognózy podle Motzera)je určen a registrován temsirolimus (Torisel ©), s daty o zlepšení celkového přežití (4). Pro druhou linii je registrován sorafenib (Nexavar ©), který významně prodloužil přežití bez progrese oproti placebu ve studii s 903 pacienty, kteří byli resistentní na léčbu první linie(5).
I když randomizované studie prokazují dobrou toleranci terapie a nižší toxicitu než interferon alfa, vedlejší účinky léčby sorafenibem i sunitinibem nejsou zanedbatelné a jejich spektrum je významně odlišné od nežádoucích účinků chemoterapie i imunoterapie. Závažnější forma toxicity stupně 3-4 se ve studiích se sorafenibem pohybovala od 1% do 13%, nejčastěji ve formě slabosti, kožních změn na dlaních a chodidlech a slizniční reakce v dutině ústní. Sunitinib vyvolal toxicitu stupně 3-4 až v 16%, častější zde je zvýšení krevního tlaku, hypothyreóza, průjem, nevolnost, a rovněž slizniční změny a syndrom ruka-noha. Hematologická toxicita je méně častá i závažná u obou preparátů, ale je častěji pozorována u sunitinibu (kolem 10% pacientů s projevy neutropenie, lymfopenie a trombocytopenie stupně 3-4). Vzácněji se objevují příhody jako srdeční ischemie, pokles komorové ejekční frakce nebo krvácení do gastrointestinálního traktu (7). V registračních studiích fáze 3 je uváděno přibližně 10% pacientů, kteří ukončili terapii pro nežádoucí účinky, ale při podávání mimo studie v obecné populaci jsou tato čísla vyšší, Choueri (8) uvádí ukončení léčby pro toxicitu ve 29% u sunitinibu, 21% u sorafenibu a nadpoloviční počet nemocných, u kterých musela být pro nežádoucí účinky dávka redukována nebo léčba dočasně přerušena. Málo je známo o tom, zda při sekvenčním podávání biologické léčby po selhání jednoho preparátu nedochází k vystupňování toxicity.
Biologická léčba metastazujícího karcinomu ledviny v podobě sunitinibu a sorafenibu je v České republice dostupná ze zdrojů veřejného zdravotního pojištění od druhého čtvrtletí 2007, i když úhradová vyhláška umožňuje podání obou preparátů v druhé linii léčby až po selhání standardní imunoterapie. Podávání je vyhrazeno pro komplexní onkologická centra a registrace léčených je prováděna pomocí sytému RENIS, který byl vytvořen primárně jako parametrická databáze a informační systém pro sběr a analýzu dat o terapii pacientů se zhoubným nádorem ledvin. V první fázi slouží jako základna pro evidenci a validní monitoring nákladné farmakoterapie u této diagnózy. Registr RENIS umožňuje zpracování dat získaných u neselektované populace pacientů léčených na území České Republiky. Cílem této studie je zejména zhodnotit frekvenci a závažnost nežádoucích účinků ve vztahu k výsledkům terapie. Prevence, rozpoznání a okamžitá léčba vedlejších účinků má klíčový význam, protože se tím může zabránit redukci dávky nebo ukončení podávání, což podmiňuje účinnost vlastní terapie. Neméně důležité je také zvládnutí nežádoucích účinků pro ovlivnění kvality života nemocných při dlouhodobé nepřetržité terapii.
PACIENTI A METODY
Pro tuto prezentaci byla analyzována data nemocných s validními záznamy v registru RENIS z center, která souhlasila s publikací výsledků na JOD. Kromě center spoluautorů, ve kterých bylo zařazeno 77% všech validních záznamů, byla do analýzy zařazena data z KOC Jihlava, České Budějovice, FN Královské Vinohrady Praha, FN Brno-Bohunice, Ústí nad Labem, Chomutov, Pardubice, Olomouc, Nový Jičín. Analýza dat byla provedena v Institutu biostatistiky a analýz Masarykovy University Brno.
Výsledky: Z databáze RENIS bylo k 8.9.2008 získáno 353 validních záznamů nemocných léčených pro pokročilý a/nebo metastazující karcinom ledviny. Jednalo se o 88 (24,9%) žen a 265 (75,1%) mužů o průměrném věku 56 let (rozptyl 23 - 77 let). Podle morfologické klasifikace převažoval v 95% konvenční světlobuněčný renální karcinom, ve 4% byl zjištěn papilární karcinom, 1x (0,3%) byl zařazen chromofobní karcinom a ve dvou případech nebyla bližší morfologie uvedena. Při vstupu do registru mělo 98% nemocných vzdálené metastázy, nejčastěji (69%) plicní, dále v lymfatických uzlinách (38%), kostech (31%) a játrech (18%). Celkový stav pacientů při vstupu do registru (PS dle WHO) byl PSO v 25%, PS1 v 57% a PS2 nebo více v 18%. Úbytek na váze před vstupem do registru byl zjištěn u 47% nemocných, v průměru 6,3 kg. Nefrektomie pro primární nádor byla provedena u 298 (84%) pacientů. 190 (54%) nemocných zahájilo léčbu sunitinibem, u 19 (10%) z nich byl jako další linie podán sorafenib. Léčba sorafenibem byla při vstupu do registru indikována u 163 (46%) pacientů, z nich zatím 25 (15%) dostalo v další řadě sunitinib.
U nemocných léčených sunitinibem byl zjištěn medián doby podávání 5,9 měsíce. Redukce dávky je zjišťována pomocí tzv. léčebných epizod, což je období, ve kterém je podávána určitá nezměněná dávka. U sunitinibu bylo u 190 pacientů zaznamenáno celkem 331 léčebných epizod, plná nebo eskalovaná dávka byla podávána v 84%, zatímco redukce dávky nastala u 10% těchto epizod na 37,5 mg a u 6% na 25 mg. Medián doby podávání sorafenibu byl 4,5 měsíce, počet léčebných epizod je 339 (u 163 pacientů), redukce dávky na 600 mg proběhla u 4,1% epizod, na 400 mg u 19% epizod a na 200 mg u 2,4% epizod.
Alespoň jeden nežádoucí účinek (NÚ) byl zaznamenán u 193 (55%) nemocných a celkem bylo zaznamenáno 335 NÚ. Specifikaci NÚ a jejich četnost podle druhu preparátu zobrazuje tabulka 1.
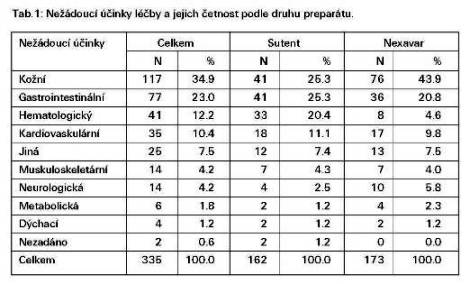
Důvodem pro ukončení první léčebné epizody nebo změnu dávky v první léčebné epizodě byly NÚ v 51%. Léčba byla dosud ukončena u 118 pacientů (33,4%), ale jen u 15 z nich (12,7%) byly příčinou nežádoucí účinky, dalších 5 pacientů (4,2%) ukončilo terapii na vlastní přání. Medián doby do progrese je 8,8 měsíce a medián přežit 16 měsíců, tyto výsledky je ovšem nutné hodnotit s opatrností, protože velké procento pacientů má krátkou dobu sledování.
ZÁVĚRY
Na podkladě analýzy retrospektivních dat neselektované populace nemocných s pokročilým karcinomem ledviny léčených sunitinibem a sorafenibem lze konstatovat, že jsme zaznamenali obdobné spektrum nežádoucích účinků, jako je uváděno v registračních studiích. Ačkoli alespoň přechodná změna dávky pro nežádoucí účinky byla zaznamenána u téměř poloviny pacientů, k ukončení léčby pro intoleranci nebo na přání pacienta došlo u 20 nemocných, což je 17% ze všech dosavadních ukončení, ale jen 5,6% ze všech zařazených pacientů. Pro prevenci, rozpoznání a okamžitou léčbu nežádoucích účinků je kromě soustředění léčby pacientů ve zkušených velkoobjemových centrech doporučována týmová spolupráce se zapojením praktických lékařů, onkologických sester, dermatologů, kardiologů eventuelně gestroenterologů a maximální poučení pacientů o povaze a závažnosti nežádoucích účinků.
Literatura
- Cohen H. T., McGovern F. J. Renal-cell carcinoma. N Engl J Med
2005, 353:2477-2490
- Escudier B, Eisen T, Stadler WM, et al. Sorafenib in advanced
clear-cell renal-cell carcinoma. N Engl J Med
2007;356:125-34.
- Motzer R. J., Hutson T. E., Tomczak P., et al. Sunitinib versus
interferon alfa in metastatic renal-cell carcinoma. N Engl J Med
2007; 356:11 5-24.
- Hudes G., Carducci M., Tomczak P., et al. Temsirolimus,
interferon alfa, or both for advanced renal-cell carcinoma. N EnglJ
Med 2007;356:2271-81.
- Escudier B., Eisen T., Stadler W. M., et al. Sorafenib in
advanced clear-cell renal-cell carcinoma. N Engl J Med,
2007;356:125-34.
- Negrier S., Figiin R. A., Hutson T. E. et al. Overall survival
with sunitinib versus interferon-alfa as first-line treatment of
metastatic renal cell carcinoma. Ann Oncol. 2008, 19, suppl. 8:viii
190
- Bhojani N., Jeldres O, Patard J. J. et al. Toxicities
associated with the administration of sorafenib, sunitinib, and
temsirolimus and their management in patients with metastatic renal
cell carcinoma. Eur Urology 2008, 53:917-930
- Choueiri T. K., Brick A. J., McDermott D. et al. Treatment and dosing patterns for angiogenesis inhibitor therapies in patients with metastatic renal cell carcinoma. Ann Oncol. 2008, 19, suppl.8:viii191
Datum přednesení příspěvku: 11. 10. 2008





