Konference: 2015 XXII. Jihočeské onkologické dny
Kategorie: Maligní melanom a nádory kůže
Téma: Nádory kůže
Číslo abstraktu: 05
Autoři: doc. MUDr. Vuk Fait, CSc.; MUDr. Vojtěch Chrenko, CSc.; MUDr. Radim Šimůnek
v programu pod názvem: CHIRURGIE V TERAPII MALIGNÍHO MELANOMU
Úvod:
Maligní melanom je nádor vycházející z melanocytů a tedy v absolutní většině případů se jedná o nádor vycházející z kůže. Relativně vzácný okulární melanom lze považovat za jiné onemocnění a vymyká se tomuto sdělení. Ještě vzácnější primární melanomy jiných lokalizací, především slizničních, jsou potom řešeny podobně jako běžněji se vyskytující nádory stejných topik, například melanom rekta je chirurgicky řešen obdobně jako karcinom rekta.
Melanom je značně radio a chemorezistentní, skutečně hmatatelné úspěchy systémové terapie jsou novinkou posledních let, takže hlavní tíha terapie melanomu prozatím stále spočívá na chirurgii.
Chirurgická léčba melanomu tento provází od jeho prvních popisů, tedy Johnem Hunterem v roce 1787 a pozdějších spojených například s Laennecem a s Dupuytrenem.1
Samotné chirurgické řešení je podobné jiným nádorům s tendencí k lymfatickému metastazování. Jistou zvláštností kožního melanomu je pak u jiných nádorů málo častá tendence k zakládání satelitních a intranzitních metastáz. Epidemiologicky pak vidíme v současnosti jak výrazný nárůst počtu melanomů, který značným způsobem souvisí se zvýšenou expozicí UV záření, tak ale na druhé straně i relativní pokles primárně pokročilých melanomů, související jak s osvětou a zdravotním dohledem, tak ale pravděpodobně i s jinými faktory.
Jak tendence k tvorbě satelitů, tak dříve časté velmi pokročilé nálezy vedly k doporučením z dnešního hlediska téměř absurdního rozsahu resekčních výkonů, a pozůstatky těchto doporučení v menší míře stále přetrvávají.1, 2
Diagnostika:
Diagnostika melanomu je především klinická a dermoskopická, nicméně kromě případů, kdy je klinická, případně dermoskopická diagnóza jednoznačná, existuje řada případů, kdy je klinický nález hraniční nebo nejistý, v některých případech pak může klinická diagnostika selhat zcela. V těchto případech je plně indikováno histologické ověření. Ve většině případů je nejvhodnější kompletní odstranění suspektní kožní morfy s malým lemem, obvykle se doporučuje 1-2mm. Důvodem je, aby bylo možno ložisko odstranit v lokální anestézii s lineární suturou. Pokud toto není možné pro velikost nebo lokalizaci, je vhodné odebrat prostou biopsii, obvykle incizní. Ústně tradovaná doporučení o nevhodnosti lokální anestézie a biopsií nejsou podložená.
Specifickým problémem pro diagnostiku mohou někdy být iniciální případy subunguánního akrolentiginosního melanomu, zde opět při nejasnosti je nutné bioptické ověření, vyžadující ovšem nepříjemnou fenestraci nehtu.
Samostatnou kapitolou jsou metastázy neznámého prima, nejčastěji se jedná o metastázy lymfatické. Diagnostika je možná pouze z histologie, ať již z jehlové biopsie nebo po extirpaci. Dodatečně se mnohdy podaří zjistit primum, často regredovaný melanom, někdy i dříve odstraněný a nepoznaný melanom, část případů však zůstává bez nálezu prima.2, 3
Staging:
Staging melanomu je podobně jako u většiny dalších solidních nádorů definován TNM klasifikací, která má u melanomu několik zvláštností. Na prvním místě je to možnost stanovení T kategorie jedině na podkladě histologie, tedy pouze pT. Zkušený dermoskopista je sice schopen v některých případech T klasifikaci odhadnout, ale nikoliv definitivně stanovit. T klasifikace je tedy stanovena vždy až po odstranění prima.
Zajímavostí je zařazení satelitních a intrazitních metastáz do N klasifikace. Toto je sice zcela logické, ale je nutno si uvědomit, že díky němu je i drobný satelit v blízkosti primárního nádoru důvodem k zařazení do III. stádia. Stav uzlin lze posuzovat klinicky, což je v současné době považováno již za pouze orientační vyšetření, velmi přesné vyšetření je pomocí USG. V současnosti nejpřesnější metodou je pak sentinelová biopsie.
K vyloučení vzdálených metastáz (nebo přesněji ke stanovení klasifikace M0) se využívá kombinace vyšetření zahrnujících nejpravděpodobnější lokality metastazování, tedy nejčastěji rtg plic a USG jater. V rámci studií pak bývá vyžadováno mnohem extenzivnější přešetření včetně CT mozku. Vyšetření, které je ve stagingu melanomu zcela suverénní, je PET, případně PET/CT, které je ale nutno indikovat uvážlivě jak pro náročnost, tak cenu vyšetření.
Chirurgické řešení primárního melanomu
Řešení primárního melanomu kůže znamená jeho kompletní odstranění s dostatečným lemem zdravé tkáně, tedy kůže, v okolí a následné řešení vzniklého defektu. První otázkou je, co znamená dostatečný lem. Historicky byla doporučení pro excizi melanomu značně drastická, jedno z prvních doporučení bylo 2 palce (tedy asi 5 cm) v kůži a další 1 palec navíc v podkoží s odstraněním svalové fascie. V minulosti proběhla řada studií o rozsahu excize a jediným signifikantním výsledkem byla vždy nutnost histologicky kompletního odstranění.1, 2, 3
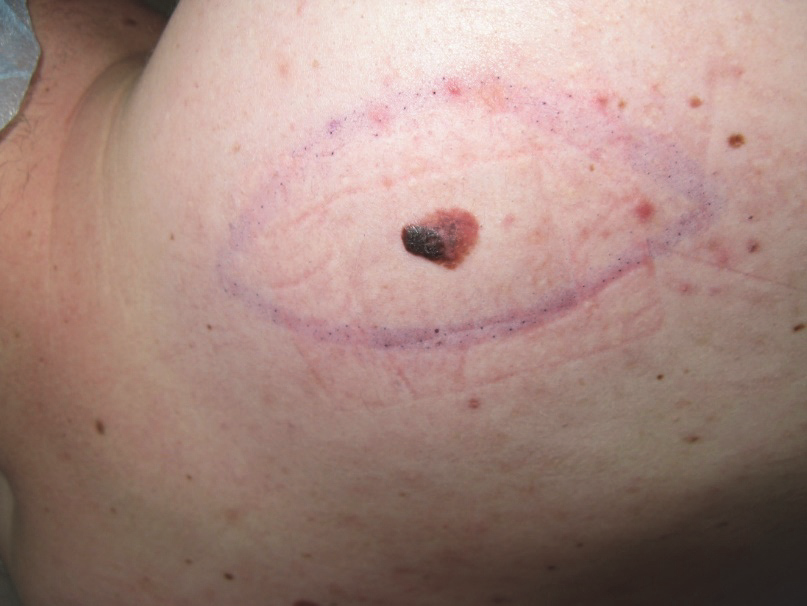
Následující tabulka udává v současné době doporučené kožní okraje. Zdravý okraj do spodiny by měl být minimálně stejný jako tloušťky tumoru, ale nikdy (s výjimkou přímého prorůstání) by neměl přesahovat povrchní svalovou fascii, která je chápána jako anatomická bariéra prorůstání.
Obr. 1: Melanom s naznačeným rozsahem excize.
|
Tloušťka melanomu |
Doporučené klinické okraje |
|
In situ |
0,5-1,0 cm |
|
pod 1 mm |
1,0 cm |
|
1,01-2 mm |
1-2 cm |
|
2,01-4mm |
2 cm |
|
4 mm |
2 cm |
|
Okraje mohou být modifikovány dle anatomických a funkčních potřeb. |
|
Tabulka 1: Doporučené okraje
Doporučené okraje jsou chápány jako okraje ve vitální tkáni, tedy při hodnocení okrajů po fixaci je nutno počítat s výrazným smrštěním tkáně.
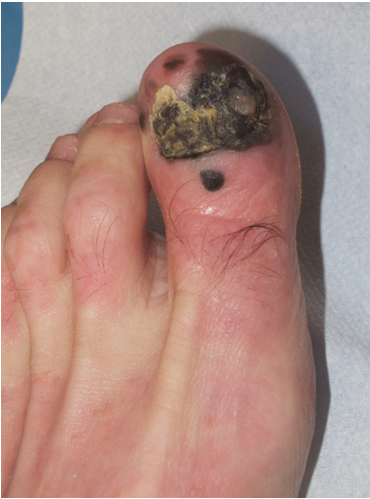
Specifickou situací je pak subunguánní akrolentiginosní melanom, kdy je doporučována exartikulace distálního článku prstu.
Obr. 2:. Akrolentiginózní subunguánní melanom se satelitem
Po odstranění kožní léze s lemem zdravé tkáně vždy vznikne kožní defekt, který je nutno uzavřít. V absolutní většině případů při vhodně vedeném řezu lze defekty uzavřít lineární suturou.
Obr. 3:. Limbergova laloková plastika po zhojení
V případech, kdy toto možné není, lze využít prakticky jakýkoliv plasticko-chirurgický postup krytí defektu. V praxi se nejčastěji jedná o lalokové plastiky z blízkého okolí, v některých oblastech je vhodné řešení dermoepidermálním štěpem, velmi problematickou oblastí je pak ploska nohy a pata, kde mnohdy nelze defekt řešit jinak než ponecháním k vygranulování se sekundárním zaštěpováním.
Sentinelová biopsie
Sentinelová biopsie je de facto diagnostická procedura, která však ale může být někdy chápána i jako terapeutická. Zajímavostí je, že sentinelová biopsie v dnešním smyslu byla vyvinuta právě pro melanom, a pro ostatní topiky, tedy především karcinom prsu, začala být používána až následně.4
Primárním cílem sentinelové biopsie bylo selektovat pacienty s přítomným lymfatickým metastazováním, kteří by mohli mít užitek z lymfadenektomie.5, 6
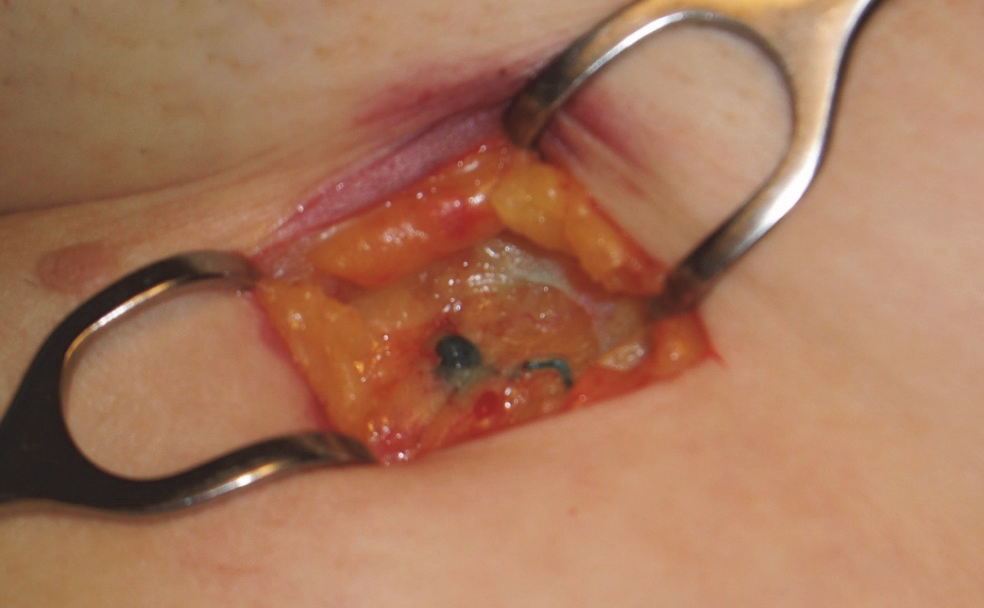
Principem sentinelové biopsie je to, že pokud dojde k lymfatickému metastazování, tak uvolněný nádorový cluster cestuje přítomnými lymfatickými cestami do spádové lymfatické oblasti a zde do jedné (nebo několika) definovatelných uzlin.
Obr. 4:. Sentinelová uzlina se zbarvenou přívodnou lymfatickou cévou.
Pokud jsou tato uzlina nebo uzliny odstraněny a důkladně vyšetřeny a nejeví známky metastatického postižení, pak jsou s pravděpodobností blížící se jistotě nepostiženy i další uzliny v této oblasti. V praxi to znamená klasifikaci pN0.
První popsanou metodou identifikace uzliny bylo barvení vitálním barvivem, s vypreparováním a sledování zbarveného lymfatického kolektoru k barvící se uzlině. Tato metoda byla záhy doplněna a z velké části nahrazena aplikací koloidu značeného izotopem technecia a vyhledáváním pomocí ruční gamma sondy. Tato metoda navíc v kombinaci s vyšetřením pod gamma kamerou umožňuje přesnější identifikaci regionální lymfatické oblasti.
V současné době je přítomnost gamma sondy nezbytnou podmínkou pro tento výkon, operující chirurg však musí vždy ovládat obě metody a dle potřeby je kombinovat. Postupně se objevují i další metody pro identifikaci sentinelové uzliny, z nichž některé se mohou uplatnit (například metoda detekce pomocí magnetické sondy), jiné jsou spíše pouhou zajímavostí. Princip metody ale stále zůstává stejný.8
K problematice sentinelových biopsií patří i způsob vyšetření patologem, který by mohl být námětem na samostatný článek. Principem je však sériové kompletní prokrájení celé uzliny se standardním barvením a imunohistochemií. Takto extenzivní vyšetření, současně se selektivním zaměřením na místo nejvyšší pravděpodobnosti výskytu, způsobuje, že sentinelová biopsie je pro detekci lymfatických metastáz mnohem přesnější než vyšetření resekátů po lymfadenektomii, a je tedy zajímavá i pro mnohé jiné nádory. Přesnost detekce metastáz v sentinelové uzlině pak může být dále zvýšena molekulárními metodami, například detekcí pomocí RT-PCR. Od těchto metod však v současné době většina pracovišť ustupuje, neboť kromě toho, že se jedná o velmi nákladné metody, přinášejí výsledky, které se nedají klinicky využít.7
Sentinelovou biopsii v současné době indikujeme u melanomů s přítomnou nodularitou a nebo s regresí, v případě histologicky verifikovaných melanomů pak při tloušťce nad 1mm, u mladých pacientů nebo v případě nejasností i u tenčích, běžnou spodní hranicí je 0,7mm, ve výjimečných případech 0,5mm. Sentinelová biopsie ale může být někdy indikována i patologem u nejasných rizikových lézí jako poslední možnost jak diagnostikovat atypický melanom.9, 10, 11
V současné době ale opět vyvstává problém, jak reagovat na výsledek sentinelové biopsie. Pokud je tato negativní, pak není již další chirurgické řešení nutné. Pozitivní nález však dnes již neznamená nutně indikaci k lymfadenektomii. Proběhla řada pokusů jak blíže hodnotit postižení sentinelové uzliny v kontextu se samotným nádorem s ohledem na vhodnost lymfadenektomie, tyto však dosud nevedly, na rozdíl od karcinomu prsu, k využitelným závěrům, pravděpodobně díky obrovskému množství faktorů, které mohou výsledky ovlivňovat. Současná doporučení se tedy pohybují spíše na úrovni empirie. Konkrétně na našem pracovišti nedoporučujeme doplnění lymfadenektomie při nálezu izolovaných tumorózních buněk a velmi váháme při nálezu mikrometastáz, tedy metastáz do velikosti 2mm.
Regionální lymfadenektomie
Terapeutickým opatřením při průkazu metastáz v spádové lymfatické oblasti je lymfadenektomie, nazývaná též dissekce nebo exenterace. Průkaz metastáz může být klinický, v současném bodě nejčastěji sonografický, další indikací k výkonu je nález metastázy v sentinelové uzlině. Tato indikace je v současné době částečně zpochybněna, některé pochybnosti by mohla objasnit probíhající studie MSLT-2.12, 13, 14, 15
Dle lokalizace se nejčastěji jedná o dissekci axilly, ilioinguinální dissekci, dissekce krční, vzácně pak popliteální.16 Všechny výkony se běžně operují otevřeně, především v axillární oblasti existují snahy o zavedení endoskopického přístupu. Tyto se zatím příliš neprosadily, na rozdíl od dutinových endoskopií totiž nepřinášejí žádné zásadní výhody.
a) Dissekce axilly.
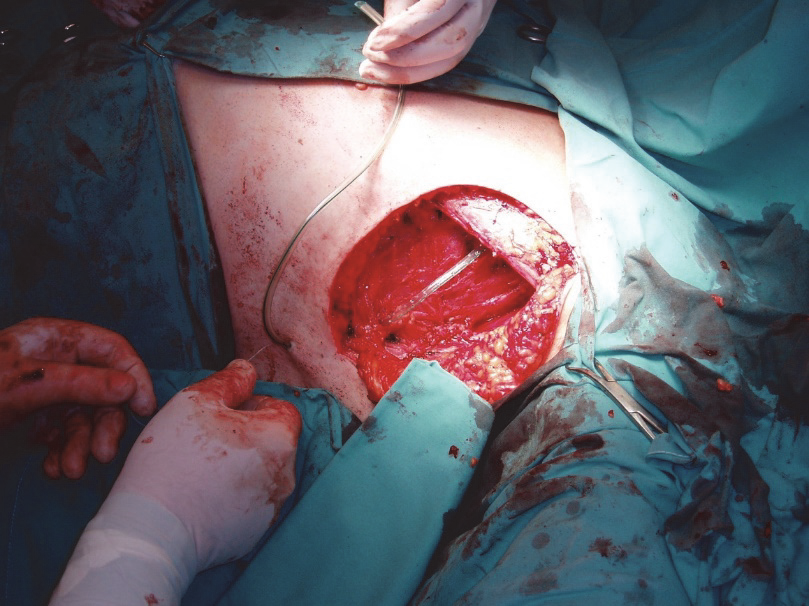
Axilla je nejčastější spádovou oblastí pro melanomy a tedy i axillární dissekce je relativně nejčastější z lymfadenektomií pro melanom. Výkon je velmi podobný axillární dissekci pro karcinom prsu, a tedy nebývá technicky problematický.17 Kožní řez může být veden různými způsoby, nám se nejlépe osvědčuje obloukovitý řez při okraji ochlupení, následuje expozice okraje velkého pektorálního svalu, poté malého pektorálního svalu, oddělení obsahu axilly od hrudní stěny, tedy od m. serratus po m. subscapularis, za vypreparování a zachování n. thoracicus longus. Intercostobrachiální nervy se běžně resekují, při minimálním postižení se lze pokusit o zachování 1. intercostobrachiálního nervu, které ale nesmí být na úkor radikality. V kraniální oblasti po protětí axillární fascie je exponována v. axillaris a postupně proťaty všechny kaudální odstupy s výjimkou v. thoracodorsalis, která je zachována ve svazku s a. a n. thoracodorsales.
Obr. 5: Dissekce axilly.
Následuje snesení obsahu do spodiny, tvořené mediálně m. subscapularis, laterálně m. latissimus dorsi, kompletně po okraj m. latissimus dorsi. Poté je preparát oddělen od kožního laloku. Součástí je i odstranění uzlin v III. etáži axilly, tedy po elevaci nebo v případě nutnosti protětí malého pectorálního svalu. Nutnost odstraňování III. etáže je minimálně u malých postižení diskutabilní, zvyšuje totiž výrazně možnost lymfedému.18 V případě masivního postižení je pak rozsah operace mnohdy modifikován tak, aby byl nádor odstraněn kompletně. Dutina po lymfadenektomii je drénována, serózní sekrece trvá obvykle kolem týdne, v některých případech však může přetrvávat i několik týdnů.
Pozdními následky mohou být lymfedémy končetiny, neuropatie, při nedostatečné rehabilitaci pak i omezení pohybů v ramenním kloubu.
b) Ilioinguinální dissekce
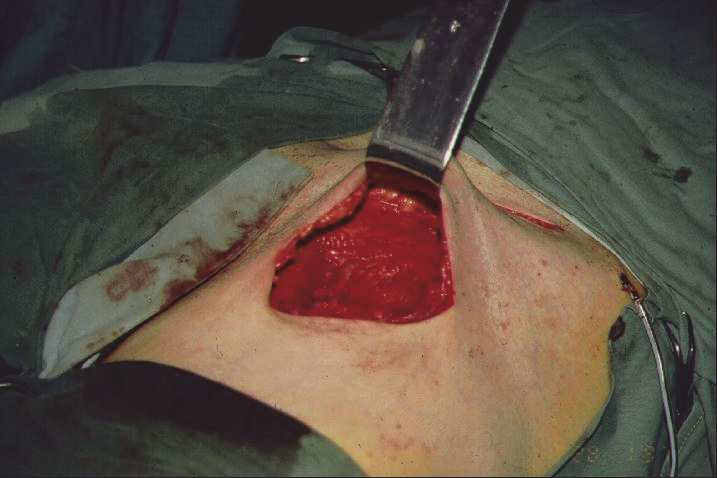
Způsobem řešení metastáz v inguině a v oblasti zevních ilických uzlin je ilioinguinální dissekce. Jedná se o spojení odstraňování uzlin v oblasti v třísle a na stehně a současně v oblasti zevních ilických uzlin. Toto spojení je nutné, neboť tyto oblasti jsou velmi těsně propojeny a již při sentinelové biopsii nebývá výjimkou, že jsou přítomny jedna sentinelová uzlina v třísle a druhá v oblasti zevních ilických uzlin. Samotný výkon je již mnohem méně standardizován než axillární dissekce, důvodem jsou i mnohdy výrazně jiné anatomické poměry u různých jedinců. Principem je v oblasti třísla odstranění tuku s uzlinami v celém rozsahu od Poupartu až po vstup femorálních cév pod svalovou fascii. Součástí může být resekce v. saphena magna. V oblasti zevních lilických cév je nutné proniknutí do retroperitonea, ve většině případů střídavým řezem nad Poupartem, v případě většího postižení je možno použít pararektální řez, nebo ve specifických případech je možno kompletně protnout Poupartův vaz, ve výjimečných případech pak lze výkon kombinovat s transperitoneálním přístupem.
Výkony jsou opět komplikovány velmi často protrahovanou serózní tvorbou, v dlouhodobém horizontu pak jsou zatíženy velmi často vznikem lymfedémů, ještě později pak typicky posuny v sakroiliakálním kloubu jako následkem změněného způsobu chůze.
Obr. 6: Dutina po odstranění inguinálních uzlin.
c) Krční dissekce
Krční dissekce se poněkud vymykají tomuto sdělení, jedná se o poměrně náročné výkony, s rizikem zcela specifických komplikací, souvisejících s anatomickými poměry. Technicky jsou tyto výkony odpovídající lymfadenektomiím používaným u nádorů hlavy a krku. Tyto výkony jsou v současnosti zcela správně vyhrazeny ORL pracovištím, naše pracoviště má s nimi tedy zcela minimální a navíc pouze historické zkušenosti.
Řešení lokoregionálních relapsů
Jednou ze základních vlastností všech maligních nádorů je tendence k relapsům. U melanomu je tato tendence zcela zásadní, navíc, melanom je schopen založit relaps i po mnoha letech, konkrétně jsme zažili relaps po 25 letech po odstranění primárního nádoru.
a) Lokální recidivy
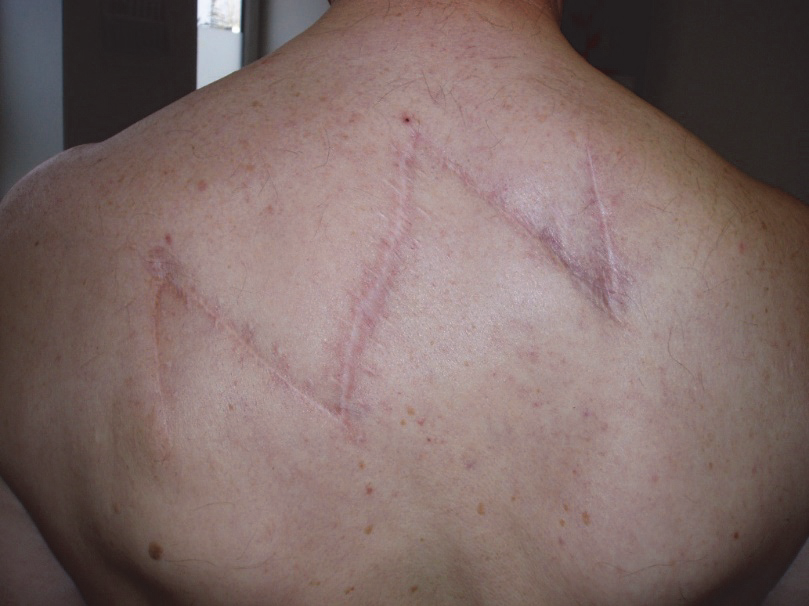
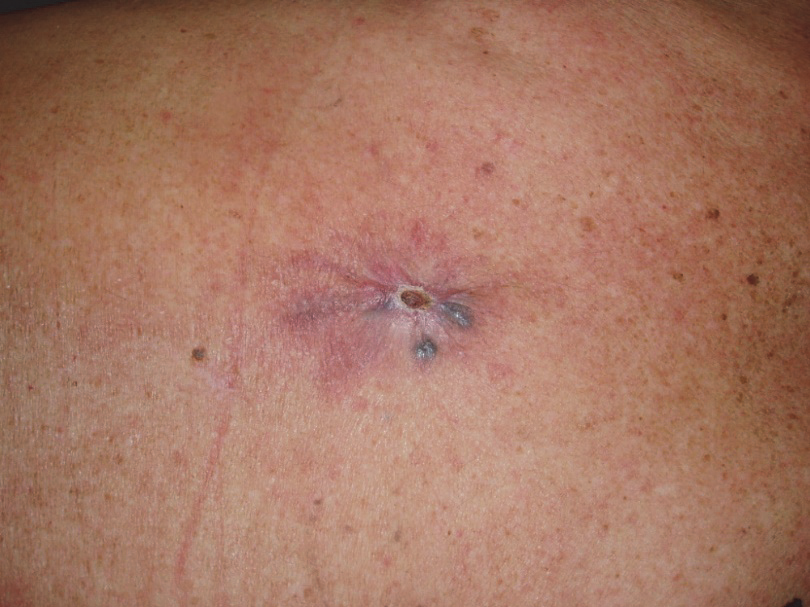
Lokální recidiva je růst nádoru v jizvě nebo její bezprostřední blízkosti. Příčinou vzniku může být teoreticky nedostatečné odstranění nádoru, ať již nekompletní odstranění nádoru, nebo spíše existence subklinického satelitu mimo resekovanou oblast. Rozšiřování resekčních okrajů nad doporučené hodnoty však riziko lokálních recidiv nesnižuje, tedy s určitým procentem lokálních recidiv je u melanomu bohužel nutno počítat.
Obr. 7: Lokální recidiva.
Řešit lokální relapsy lze nejčastěji reresekcí, méně často v případech, kdy reresekce již není možná se lze pokusit o ovlivnění radioterapií.
b) Regionální uzlinové relapsy
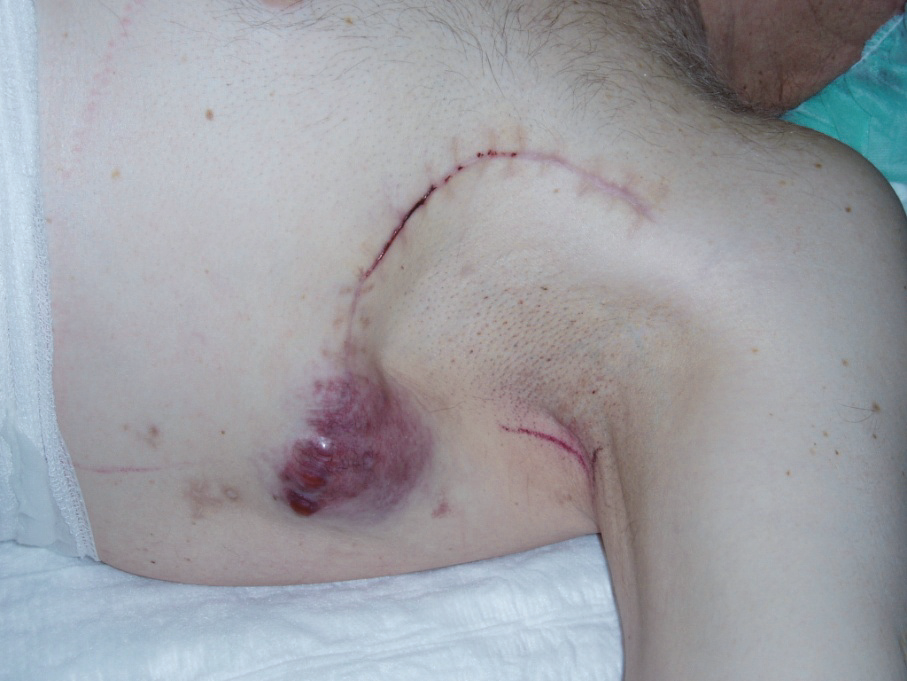
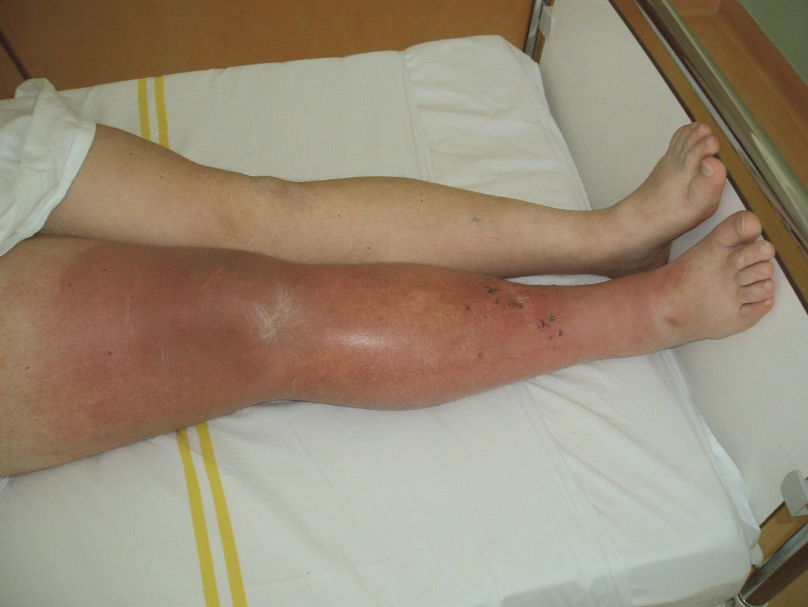
Regionální uzlinový relaps je metastáza v lymfatické uzlině, nebo případně i mimo ni v regionální lymfatické oblasti. Může vzniknout i po předchozí negativní sentinelové biopsii, příčinou může být nesprávná identifikace uzliny, falešná negativita sentinelové biopsie se pohybuje kolem 5 %, další častou příčinou je nové metastazování do uzlinové oblasti z mezilehlých lymfatik nebo z lokální recidivy. Další možností je relaps v oblasti již po proběhlé lymfadenektomii.
Obr. 8: Relaps v axille po direkci.
Řešení je pokud možno opět chirurgické, pokud již lymfadenektomie v této oblasti neproběhla, pak je nutné ji doplnit. V případě relapsu v místě již proběhlé dissekce se lze pokusit o reoperaci, zde se jedná většinou již o výkony velmi individuální, jak dle rozsahu postižení, tak i dle skutečné radikality výkonu předchozího (Bohužel poměrně často se setkáváme s těmito relapsy u pacientů, kteří měli lymfadenektomii na pracovištích s malou zkušeností s melanomy.), při těchto výkonech je nutno počítat s možností mnohem větší devastace a následných obtíží. Zvláště po redissekcích je vždy vhodné zvažovat adjuvantní radioterapii.
c) Intranzitní metastázy
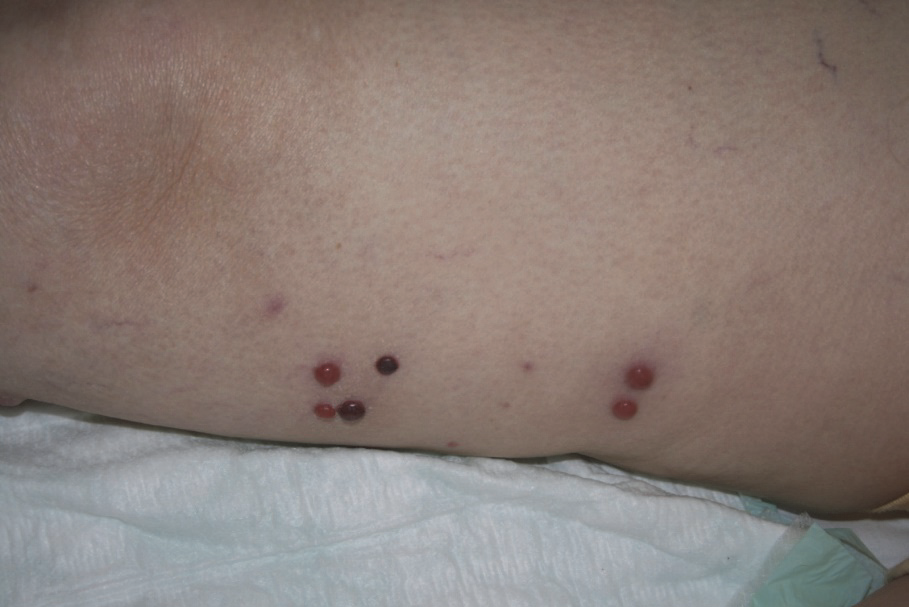
Intranzitní metastázy jsou metastázy rostoucí v lymfatických cestách mezi primem a regionálními lymfatickými uzlinami, obvykle jsou lokalizovány v podkoží nebo v kůži. Tento typ metastáz je pro melanom typický a u jiných nádorů se vyskytuje velmi vzácně.
Obr. 8:. Intransitní metastázy(a)
Řešení je obvykle opět chirurgické, při máločetném postižení je obvykle možné relativně jednoduché odstranění excizí. Při mnohočetném postižení je vždy ke zvážení použití radioterapie, ať již samostatně nebo v kombinaci s chirurgickým výkonem.19
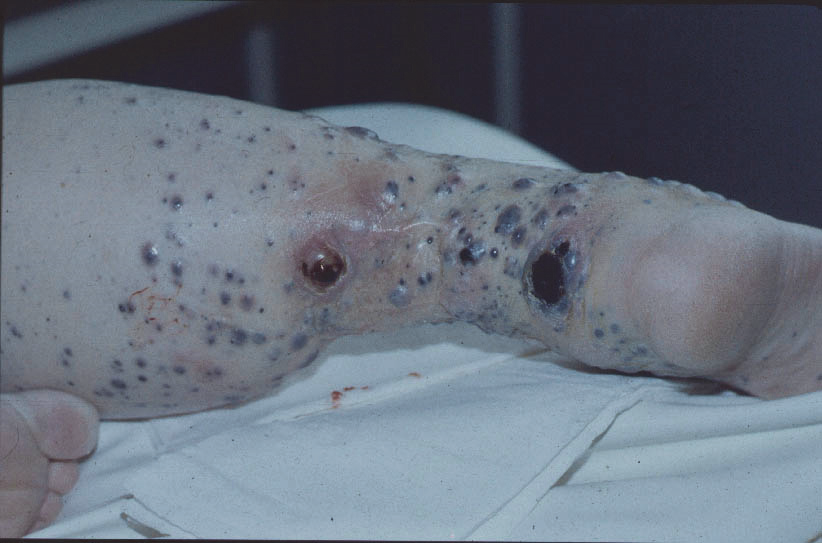
d) Mnohočetný končetinový relaps
Zcela specifickým relapsem pro melanom je mnohočetný končetinový relaps. Jedná se vlastně o mnohočetné intranzitní metastázy v oblasti končetiny, nejprve v oblasti mezi lokalizací prima a regionálními uzlinami, při pokročilejším stavu pak bývá postižena větší část končetiny, bez ohledu na původní lokalizaci nádoru. Kupodivu, i při poměrně velkém rozsahu nádorového postižení jsou tito pacienti velmi často velmi dlouho bez známek vzdálené disseminace. Pokud se tento stav vyskytne po dissekci nebo sentinelové biopsii, případně současně se zablokováním uzliny nádorovým postižením, pak se uvažuje o jakémsi „uvěznění“ lymfaticky se šířících nádorových buněk v tomto prostoru. Skutečně, u těchto pacientů jsou tyto stavy poněkud častější, ale vyskytují se i u pacientů bez jakéhokoliv zásahu nebo patologie v oblasti regionálních uzlin. V naprosté většině případů se jedná o postižení dolní končetiny.
Obr. 9:. Mnohočetný končetinový relaps.
Terapeuticky se v těchto případech neuplatňují amputační výkony, které nevedou k prodloužení života, velmi rychle po nich vzniká recidiva v pahýlu a amputace navíc vždy znamená výrazné zhoršení kvality života. Metodou volby u tohoto typu postižení je izolovaná hypertermická perfuze.20
Přestože se jedná o techniku historicky již velmi starou, pro její technickou a hlavně organizační náročnost, se jedná stále o spíše výjimečný postup Jedná se o regionální aplikaci chemoterapie v kombinaci s lokálním zvýšením tělesné teploty. Přístup je z větší části chirurgický, jedná se o napojení končetiny na mimotělní oběh s izolací od systémového oběhu, s elevací teploty na 39-40 °C a aplikací chemoterapie (nejčastěji Melphalan) ve velmi vysoké dávce, a ponecháním cytostatika v oběhu po dobu zhruba 1 hodiny.21 Podání chemoterapie pouze do končetiny výrazně redukuje, až eliminuje, systémovou toxicitu, a velmi vysoká dávka v kombinaci s hypertermií a dlouhou expozicí zásadním způsobem zvyšuje účinnost. Procento objektivních odpovědí, které je u melanomu při systémovém podání nejúčinnějších cytostatik kolem 20 % se zvyšuje až na 85 %.23 Kompletních regresí je pochopitelně méně, pohybují se kolem 35 %. Ač je tato metoda považována za paliativní, existují pacienti, u nichž je možno dosáhnout dlouhodobé kompletní remise. Tato metoda byla opakovaně zkoušena i v adjuvanci, ale v této indikaci nikdy neprokázala benefit při současně značném riziku.
Obr. 11:. Kožní reakce po izolované hypertermické perfuzi
Metoda je ovšem značně komplikovaná a náročná pro pacienta, s množstvím závažných nežádoucích účinků i možností závažných komplikací. Je tedy nutno vždy velmi pečlivě zvažovat indikační kritéria. Nevhodného pacienta tento postup spíše poškodí.
Řešení vzdálených relapsů
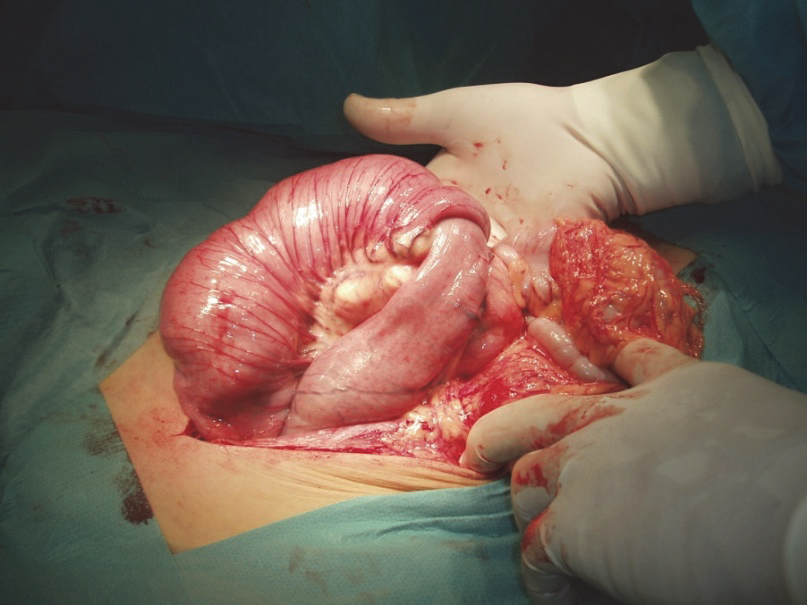
Melanom je schopen zakládat vzdálené metastázy hematogenní cestou prakticky kdekoliv, predilekční místa jsou plíce, méně často játra, mozek, dále kůže a podkoží a extraregionální lymfatické uzliny, výjimkou nejsou metastázy do GIT, poměrně specificky pak do oblasti horního GIT, nejčastěji do tenkého střeva a žaludku.23 Melanom je však schopen zakládat metastázy i na tak neobvyklých místech jako je například myokard
Obr. 12: Invaginace ilea způsobená metastázou melanomu.
Mnohočetné metastázy jsou pochopitelně mimo možnosti chirurgického řešení, i když i zde je mnohdy možnost paliativních výkonů. Kurativně lze zasahovat u solitárních nebo máločetných postižení jednoho orgánu. Přednost mají resekční výkony a překvapivě, především pacienti se solitární metachronní metastázou mohou mít někdy velmi dlouhé přežití. (24)
Závěr
Chirurgické řešení je u melanomu v současné době hlavní terapeutickou modalitou, s rozvojem možností systémové terapie bude pravděpodobně ubývat potřeba regionálních výkonů, podobně, jak se dnes děje například u karcinomu prsu. Podobně jako u karcinomu prsu je však nutno počítat s tím, že vždy budou existovat případy vůči systémové terapii resistentní a tedy opět určené především pro chirurgické řešení. Zásadní bude asi i do budoucna úloha při diagnostice a řešení primárního nádoru.
Literatura:
- Balch C.M (ed) et al Cutaneous melanoma, 1992, Lippincott, Philadelphia, 582p.
- Mozzillo N, Ascierto PA. Melanoma: the role of surgery in the era of new therapies. J Transl Med 2014;12:195.
- Teng J, Halbert T, McMurry TL, Levine PA, Christophel JJ. Histopathologic margin distance in survival in resection of cutaneous melanoma of the head and neck. Laryngoscope 2015;125:1856–60.
- Morton DL, Wen DR, Wong JH, Economou JS, Cagle LA, Storm FK, et al. Technical details of intraoperative lymphatic mapping for early stage melanoma. Archives of surgery (Chicago, Ill : 1960) 1992;127:392–9.
- Cascinelli N, Belli F, Santinami M, Fait V, Testori A, Ruka W, et al. Sentinel lymph node biopsy in cutaneous melanoma: the WHO Melanoma Program experience. Ann Surg Oncol 2000;7:469–74.
- Fait V, Chrenko V, Žaloudík J. Sentinelová lymfadenektomie u maligního kožního melanomu, krátkodobé výsledky a prognostický význam. Rozhledy v chirurgii : měsíčník Československé chirurgické společnosti 1998;77:466–73.
- Egger ME, Callender GG, McMasters KM, Ross MI, Martin RCG, Edwards MJ, et al. Diversity of stage III melanoma in the era of sentinel lymph node biopsy. Ann Surg Oncol 2013;20:956–63.
- Stoffels I, Dissemond J, Pöppel T, Schadendorf D, Klode J. Intraoperative Fluorescence Imaging for Sentinel Lymph Node Detection: Prospective Clinical Trial to Compare the Usefulness of Indocyanine Green vs Technetium Tc 99m for Identification of Sentinel Lymph Nodes. JAMA Surg 2015;150:617–23.
- Mu E, Lange JR, Strouse JJ. Comparison of the use and results of sentinel lymph node biopsy in children and young adults with melanoma. Cancer 2011;118:2700–7.
- Jaukovic L, Sijan G, Rajović M, Kandolf-Sekulovic L, Radulovic M, Mijuskovic Z, et al. Lymphoscintigraphy and sentinel lymph node biopsy, in cutaneous melanoma staging and treatment decisions. Hell J Nucl Med 2015;
- Kachare SD, Singla P, Vohra NA, Zervos EE, Wong JH, Fitzgerald TL. Sentinel lymph node biopsy is prognostic but not therapeutic for thick melanoma. Surgery 2015;0.
- Sondak VK, Zager JS. Melanoma: MSLT-1--putting sentinel lymph node biopsy into context. Nat Rev Clin Oncol 2014;11:246–8.
- Morton DL. Overview and update of the phase III Multicenter Selective Lymphadenectomy Trials (MSLT-I and MSLT-II) in melanoma. Clin. Exp. Metastasis 2012;29:699–706.
- Nagaraja V, Eslick GD. Is complete lymph node dissection after a positive sentinel lymph node biopsy for cutaneous melanoma always necessary? A meta-analysis. European Journal of Surgical Oncology (EJSO) 2013;39:669–80.
- Rovenská E. Sentinelová biopsia u maligného melanómu. Vnitřní lékar̆ství 2014;60:484–9.
- Morcos B, Al-Ahmad F. Metastasis to the popliteal lymph nodes in lower extremity melanoma and their management. Surg Oncol 2011;20:e119–22.
- Rossi CR, Mozzillo N, Maurichi A, Pasquali S, Macripò G, Borgognoni L, et al. Number of Excised Lymph Nodes as a Quality Assurance Measure for Lymphadenectomy in Melanoma. JAMA Surg 2014;
- Nessim C, Law C, McConnell Y, Shachar S, McKinnon G, Wright F. How Often do Level III Nodes Bear Melanoma Metastases and does it Affect Patient Outcomes? Ann Surg Oncol 2013;20:2056– 64.
- Speicher PJ, Meriwether CH, Tyler DS. Regional therapies for in-transit disease. Surg Oncol Clin N Am 2015;24:309–22.
- Klop WM, Vrouenraets BC, van Geel BN, Eggermont AM, Klaase JM, Nieweg OE, et al. Repeat isolated limb perfusion with melphalan for recurrent melanoma of the limbs. J Am Coll Surg 1996;182:467–72.
- Nieweg OE, Kroon BBR. Isolated limb perfusion with melphalan for melanoma. J Surg Oncol 2014;109:332–7.
- Paulsen IF, Chakera AH, Drejøe JB, Klyver H, Dahlstrøm K, Oturai PS, et al. Tumour response after hyperthermic isolated limb perfusion for locally advanced melanoma. Dan Med J 2014;61:A4741.
- Němec L, Fait V, Silák J. Gastrointestinální metastázy maligního melanomu. Rozhledy v chirurgii: měsíčník Československé chirurgické společnosti 2010;89:594–8.
- Howard JH, Thompson JF, Mozzillo N, Nieweg OE, Hoekstra HJ, Roses DF, et al. Metastasectomy for Distant Metastatic Melanoma: Analysis of Data from the First Multicenter Selective Lymphadenectomy Trial (MSLT-I). Ann Surg Oncol 2012;
Text ve stejné podobě recentně vychází v časopise Farmakoterapie, tímto děkujeme redakci za umožnění publikace i v tomto sborníku
Datum přednesení příspěvku: 16. 10. 2015