Konference: 2006 XXX. Brněnské onkologické dny a XX. Konference pro sestry a laboranty
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Imunologie nádorů
Číslo abstraktu: 214
Autoři: Mgr. Radovan Horák; Mgr. Silvie Dudová; Petra Vidláková; Mgr. Darina Očadlíková; RNDr. Libor Hanák, PhD.; doc. MUDr. Vuk Fait, CSc.; MUDr. Ivo Kocák, Ph.D.; prof. MUDr. Jan Žaloudík, CSc.; Prof. MUDr. Jaroslav Michálek, Ph.D.
Maligní melanom je nádorové onemocnění kůže vznikající transformací melanocytů. Nejčastěji se vznik melanomu dává do souvislosti s opakovanou expozicí pokožky UV záření. Přestože včasná diagnostika tohoto typu nádoru vede ve většině případů ke kompletnímu vyléčení, pokročilá metastazující stádia maligního melanomu se řadí k nejagresivnějším onkologickým onemocněním. Současně je melanom považován za relativně vysoce imunogenní nádorové onemocnění, což jej předurčuje stát se úspěšným cílem imunoterapie (1). Předpokladem je, že nádorová buňka předkládá na svém povrchu antigeny, které mohou být rozpoznány efektorovými buňkami imunitního systému organismu. Těmito antigeny jsou nejčastěji fragmenty defektních či jinak pozměněných proteinů, které v nádorové buňce vznikají v důsledku její transformace (2). Aby imunitní odpověď organismu na nádorovou buňku byla účinná, je zapotřebí, aby efektorové buňky jevily k nádorovým antigenům dostatečnou afinitu. Dále je nutné, aby se antigenní struktury vyskytovaly na buněčném povrchu v dostatečném množství a aby buňka poskytla efektorovým buňkám další potřebné kostimulační signály. Tyto podmínky však často nejsou splněny a nádor tak uniká imunitnímu dozoru organismu (3). Jedna z imunoterapeutických možností je založena na výběru a expanzi populace nádorově-specifických lymfocytů in vitro (4). Existují dva rozdílné postupy, jak získat populace těchto nádorově-specifických lymfocytů. První způsob spočívá v extrakci lymfocytů přímo ze stromatu vlastního nádoru, popřípadě ze sentinelové uzliny drénující oblast nádoru (5). Tyto buňky se nazývají tumor infiltrující lymfocyty (TIL) a předpokládá se, že v souboru takto získaných buněk se vyskytují populace se specifickou reakcí proti nádoru. Druhým způsobem získání nádorově-reaktivních lymfocytů je indukce protinádorového potenciálu zprostředkovaně přes antigen-prezentující buňky ex vivo (6). Takto získané buňky se označují jako cytotoxické lymfocyty (CTL) a indukce jejich specifity proti nádoru se provádí ve směsné kultuře, kde autologní dendritické buňky naložené nádorovým antigenem aktivují naivní T lymfocyty. V této studii byly pro analýzu individuálních nádorově-reaktivních klonů T lymfocytů využity vzorky získané od dvou pacientů s melanomem. Byla studována jedinečná sekvence aminokyselin variabilní (V) a hypervariabilní (DJ) oblasti T lymfocytárního receptoru beta (TCRB), která jednoznačně definuje individuální klony T lymfocytů. Vzorek od pacienta A představovaly buňky TIL a vzorek od pacienta B představovaly buňky CTL.
2. Materiál a metody
2.1 Příprava buněk TIL
Resekovaná nádorem infiltrovaná lymfatická uzlina pacienta s metastázujícím melanomem byla převedena do suspenze v kompletním kultivačním médiu X-Vivo 15 obsahujícím L-glutamin, antibiotika a 5% lidské AB sérum. Pro podporu expanze buněk byl do suspenze přidán IL-2 (103 IU/ml). Byla udržována stálá buněčnost suspenze 1-2x106/ml média. Každé 2-3 dny bylo médium měněno. Po první výměně byl ke kultuře přidán phytohemaglutinin m(PHA) v množství 10 g/ml. Dále byly do kultury přidávány alogenní ozářené mononukleární buňky periferní krve (tzv. „feeder cells“) v poměru 1:1 k TIL. Takto byly TIL kultivovány 7 týdnů, přičemž bylo dosaženo expanze na hodnoty přesahující 109 TIL. Tato metodika byla v naší laboratoři úspěšně zavedena a již dříve publikována (7).
2.2 Příprava buněk CTL
Mononukleární buňky byly ze vzorku nesrážlivé periferní krve pacienta s metastázujícím melanomem separovány pomocí gradientové centrifugace (Histopaque 1077). Tyto byly pak dále 2 hodiny kultivovány v kompletním médiu při 37°C. Poté byla oddělena neadherentní frakce v supernatantu od frakce adherentní. Adherentní frakce obsahovala prekurzory dendritických buněk (DB). Neadherentní frakce obsahovala zejména T lymfocyty. Frakce T lymfocytů byla před vlastní stimulací kultivována v kompletním médiu. Frakce prekurzorů DB byla kultivována v kompletním médiu obohaceném o IL-4 (100 ng/ml) a GM-CSF (800 U/ml) pro stimulaci k diferenciaci ve zralé DB. Sedmý den kultivace byl do kultury vložen antigen – ozářené nádorové buňky z resekované nádorem infiltrované uzliny – ke azpracování dendritickými buňkami. Osmý den byl přidán TNF-á (40 ng/ml) a devátý den byly přidány T lymfocyty ve stimulačním poměru 20:1 (T lymfocyty:DB). Tato metodika je v naší laboratoři již s úspěchem zavedena při přípravě myelom-reaktivních T lymfocytů (8,9). Separace T lymfocytů specificky reaktivních proti melanomu byla provedena pomocí magnetické separace na g základě produkce interferonu gama (IFN-ă) jako markeru aktivace. Zvýšené čistoty výstupní frakce bylo dosaženo dvojitou separací (10). Pozitivní frakce aktivovaných T lymfocytů byla dále expandována kultivací v kompletním médiu s přídavkem IL-2 (500 UI.ml-1) 2-3x týdně, phytohemaglutininu jednorázově a „feeder cells“ 1x týdně. Během pěti týdnů bylo dosaženo expanze na více než 108 CTL (10).
2.3 Klonotypový esej
Pro izolaci mRNA buněk byly použity alikvotní objemy vzorků TIL nebo CTL obou pacientů tak, aby suspenze obsahovala
106 buněk. Izolace mRNA byla provedena pomocí izolačního kitu QIAGEN Oligotex® Direct mRNA Kit (Bio-Consult Laboratories, spol. s r. o., Praha, ČR) podle dodávaného protokolu. Výsledkem byla mmdvojice vzorků po 20 µl mRNA od obou pacientů. 3 µl mRNA byly použity do následné reversní transkripce, zbytek vzorku byl zamražen na –80°C. Pro provedení reversní transkripce mRNA do cDNA byl použit BD SMART™ RACE cDNA Amplification Kit (I.T.A.-Intertact, s.r.o., Praha, ČR) podle pokynů výrobce. Tato procedura zahrnuje přichycení kotvy (BD SMART II™ A) ke 3’-konci vznikající cDNA a to v dalším kroku umožňuje ohraničení požadované oblasti specifickými primery (viz Obr. 1).
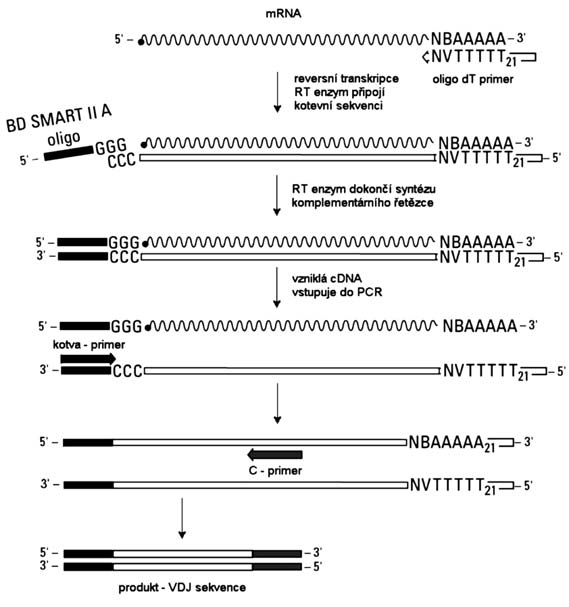
Obr. 1.:
Schéma průběhu reversní transkripce a PCR
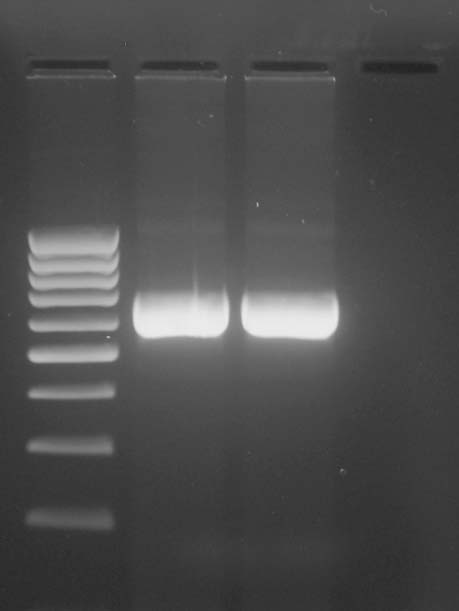
Obr. 2.:
Elektroforetogram zleva 100 bp standard,
pacient A (TIL), pacien B (CTL), negativní kontrola
2.4 PCR
Reversní transkripcí vzniká soubor cDNA odpovídající kompletnímu transkriptomu buňky. Pouze některé molekuly cDNA nesou genetickou informaci pro TCR receptor a mohou tedy být potenciálním templátem pro PCR. Všechny molekuly cDNA však obsahují připojenou kotvu, specifita PCR reakce pro TCR receptor je tedy dána výhradně přítomnosti sekvence konstantní oblasti C. Primer (C-primer) specifický ke konstantní oblasti byl navržen s ohledem na výrobcem doporučenou Ta PCR programu (68°C) a je komplementární k okraji C-regionu genu pro TCR (5’-GCTTCTGATGGCTCAAACACAGCGACCT3’). Očekávaný produkt zahrnující sestavu subgenů VDJ má délku ~550 bp. Pro vlastní reakci byl použit BD Advantage 2 PCR Kit (I.T.A.Intertact, s.r.o., Praha, ČR). PCR program: 95°C – 1 min, 5x(95°C-30 s, 74°C-1 min), 5x(95°C-30 s, 73°C-1 min), 25x(95°C-
30 s, 72°C-1 min), 72°C – 1 min. Složení reakce podle doporučení výrobce. Produkt PCR reakce byl zviditelněn pomocí gelové elektroforézy na 2% agarózovém gelu (Obr. 2.) Extrakce produktu z gelu a jeho přečištění bylo provedeno pomocí QIAGEN QIAquick Gel Extraction Kitu (Bio-Consult Laboratories, spol. s r. o., Praha, ČR).
2.5 Klonování amplikonu do bakterií, sekvenování
Protože extrahovaný a purifikovaný produkt představující VDJ sestavu subgenů teoreticky obsahuje celý soubor různých sekvencí, bylo nutné tento produkt klonovat do bakterií a následně analyzovat jednotlivé klony, které představují diskrétní, unikátní sekvence VDJ subgenů. Pro klonování byl použit kit pGEM T Easy vector (Promega, Madison, Wisconsin). Bakterie byly vysety na plotny s Ampicilinem a IPTG. Bylo vybráno 22 (pacient A) a 16 (pacient B) pozitivních kolonií, byla provedena PCR a purifikované produkty byly sekvenovány.
2.6 Zpracování in silico
Získané sekvence jednotlivých klonů byly zpracovány bioinformatickými nástroji, které jsou pro akademické použití k dispozici na stránkách IMGT, the international ImMunoGeneTics information system® (http://imgt.cines.fr) a NCBI-BLAST (http://www.ncbi.nlm.nih.gov/blast).
3. Výsledky diskuse
Tab. 1. znázorňuje zastoupení V a J subgenů a unikátních aminokyselinových sekvencí v jednotlivých klonech variabilní oblasti TCR u obou pacientů. V tabulce jsou uvedeny označení subgenů V a J podle mezinárodní nomenklatury IMGT, v prostředním sloupci je uvedena aminokyselinová sekvence oblasti CDR3 (complementarity determining region 3, IMGT). V případě pacienta A (TIL buňky) se podařilo analyzovat celkem 22 klonů, analýzou byl odhalen signifikantně frekventovaný klon s četností 7/22 tj. 31,8 %. V případě pacienta B (CTL buňky) se podařilo analyzovat celkem 16 klonů, analýzou byl odhalen signifikantně frekventovaný klon s četností 6/16 tj. 37,5 %. Ačkoli prozatím nelze ověřit, zda-li je soubor přibližně dvaceti prvků dostatečně velký pro stanovení validních závěrů, je zřetelné, že přibližně třetina T lymfocytů je specificky reaktivní vůči určitému antigenu. Nebyl ani pozorován zásadní rozdíl v tom, zda-li analýza byla provedena se vzorkem buněk TIL nebo CTL. Lze proto usuzovat, že oba typy buněk TIL i CTL jeví podobný potenciál reagovat na nádorový antigen. Pro ověření tohoto tvrzení bude zapotřebí provést další experimenty. Jednak otestovat TIL i CTL téhož pacienta k ověření zda stejný nádorově-reaktivní klon bude nalezen v obou typech buněk přítomných jak v nádorem infiltrované tkáni tak i v periferní krvi. K přesnějším závěrům by také přispělo rozšíření počtu analyzovaných klonů a nebo separování unikátních klonů jinou metodou než klonováním do bakterií, např. pomocí denaturační gradientové gelové elektroforézy (DGGE).
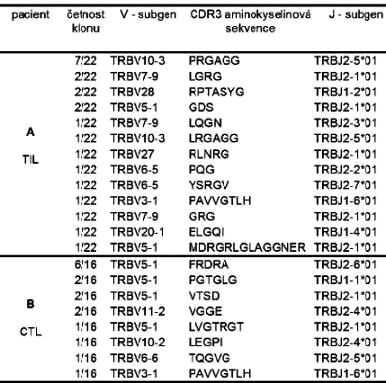
Tab. 1. Zastoupení unikátních klonů buněk podle specifity jejich TCR receptoru
Soubor separovaných T lymfocytů ve vzorcích, které vstupovaly do studie, obsahoval směs všech aktivovaných T lymfocytů, tedy jak CD4+ tak CD8+ lymfocytů. Oba typy T lymfocytů jsou nezbytné pro úspěšnost reakce proti nádoru (1). Vyplývá z toho však ta skutečnost, že z výsledků nelze rozlišit, zda majoritní klony patří k CD4+ nebo CD8+ populaci. Pokud by do analýzy vstoupily vzorky buněk separovaných podle kritéria CD4/CD8, bylo by možné dále posoudit funkci Th /Tc lymfocytů v protinádorové odpovědi.
4. Závěr
Studie potvrdila představu, že ve spektru nádorově-reaktivních T lymfocytů existují majoritní imunodominantní klony. V obou případech (TIL i CTL) byl zjištěn přibližně třetinový podíl majoritního klonu. Tato skutečnost však není vzhledem k omezenému souboru dostatečně validní a bude nutné výsledky potvrdit v průběhu dalších studií. Podařilo se však úspěšně zavést tzv. klonotypový esej jako novou metodu exaktní charakterizace T lymfocytů na základě aminokyselinové sekvence jejich TCRB. Tato metodika bude nadále používána a její univerzálnost překračuje vymezenou oblast studia melanomu, neboť její obecné použití lze rozšířit na celý obor nádorové popř. transplantační imunologie.
5. Citovaná literatura
- Michálek J., Svoboda M.: Buněčná imunoterapie nádorů. Klinická
onkologie 2003, 16, (145-148)
- Greenberg PD. Adoptive T cell therapy of tumors: mechanisms
operative in the recognition and elimination of tumor cells. Adv
Immunol 1991, 49, (281-9)
- Michálek J., Svoboda M.: Buněčná imunoterapie nádorů. Klinická
onkologie 2003, 16, (145-148)
- Rosenberg SA. Progress in human tumor immunology and
immunotherapy. Nature 2001, 411, (380-6)
- Rosenberg SA, Dudley ME. Cancer regression ina patiens with
metastatic malanoma after the transfer of autologous antitumor
lymphocytes. PNAS 2004, 101. (14639-45)
- Dudley ME, et al. Cancer regression and autoimmunity in
patients after clonal repopulation with antitumor lymphocytes.
Science 2002, 298, (850-4)
- Michálek J, et al. Charakteristika tumor infiltrujících
lymfocytů u pacientů s metastázujícím melanomem. Edukační sborník,
Brno : Masarykův onkologický ústav, 2005, (306-7)
- Michálek J, Očadlíková D, Zahradová L, Kovářová L, Penka M,
Hájek R. Identification and Expansion of Myeloma-Specific Cytotoxic
T Cells in vitro. Blood 2005, 106, (513-8)
- Očadlíková D, et al. Isolation and Expansion of Allogeneic
Myeloma-Specific Interferon-Gamma Producing T Cells for Adoptive
Immunotherapy. Medical Oncol 2006, v tisku.
- Očadlíková D, et al. Identifikace myelom-specifických T-lymfocytů na základě produkce interferonu gamma. Klinická onkologie 2005, 18, (55-58)
Práce byla podpořena grantem GAČR č . 301/04/1387.
Datum přednesení příspěvku: 13. 5. 2006





