Konference: 2009 XVI. Jihočeské onkologické dny
Kategorie: Nádorová biologie/imunologie/genetika a buněčná terapie
Téma: Diagnostika, patologie, cytologie, genetika, TNM
Číslo abstraktu: 011
Autoři: MUDr. Aleš Panczak, CSc.; Mgr. Bc. Eva Suttrová (Hirmerová); MUDr. Jaroslav Kotlas; doc. MUDr. Milada Kohoutová, CSc.
Rakovina plic patří celosvětově mezi nejčastější nádorové onemocnění; také v České republice morbidita a mortalita na nádory plic dlouhodobě vzrůstá, v současnosti především u žen. Jakkoli se jedná o onemocnění ponejvíce spojené s kuřáctvím cigaret, genetické faktory mají při jeho vzniku, progresi, terapii a prognóze významnou úlohu.
Genetické faktory se podle klasických odhadů podílejí na vzniku plicní rakoviny nejméně z 10-15%. Týká se to asi 100 000 lidí na celém světě a asi 16 až 20 tisíc úmrtí ročně; v ČR pak kolem 500 mužů a asi 150-200 žen a odhadem asi 430 úmrtí u mužů a 130 úmrtí u žen.
Ve skutečnosti je nádorové bujení nemocí buněčného cyklu, což je obsáhlý komplex navýsost geneticky řízených pochodů, interakce velkého počtu geneticky definovaných molekul. Proto představuje každý nádor soubor celé řady genetických chyb. Doposud bylo u plicní rakoviny popsáno více než 50 molekulárních abnormalit u tumor supresorických genů a přes 100 v onkogenech, tedy ponejvíce molekul, které se podílejí na regulaci buněčného cyklu.
Cílem tohoto příspěvku je ukázat současná zadání pro genetický výzkum a klinickou genetickou praxi.
Genetická analýza na úrovni nádorové tkáně/buňky:
Tak jako i u jiných typů rakoviny vnitřních
orgánů, i ve výzkumu rakoviny plic sílily v posledních letech
požadavky poznat determinanty kancerogeneze na úrovni nádorové
buňky - od jednoduchých rodinných cytogenetických (především
strukturálních) variant, přes klasickou CGH až po současné metody
molekulární genetiky na úrovni mikročipů.
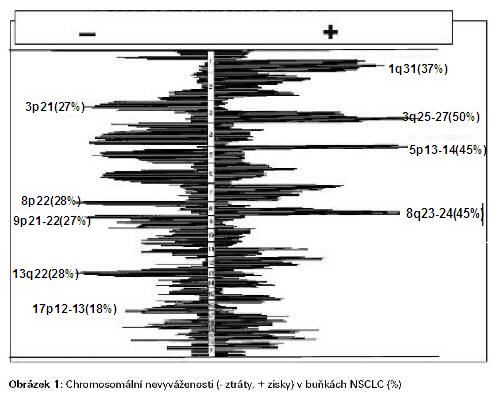
V buňkách z rakoviny plic byly pozorovány
nejrůznější genetické abnormality, jak na úrovni cytogenetické
(chromosomální aberace), molekulárně genetické, tak i molekulárně
cytogenetické (Obrázek 1). Nejběžnější genetickou alterací v
primárním nádoru jsou mutace v genu p53 zjišťované jak
sekvenční analýzou nádorové DNA, tak i na úrovni exprese proteinu v
nádoru (imunohistochemie) - dle některých studií jsou tyto alterace
negativním prognostickým faktorem přežití. Podobně jsou s horším
přežíváním asociovány mutace a změněná exprese genu p21 či
detekce bodových mutací v onkogenu K-ras nebo overexprese
erbB-2.
Předmětem zájmu výzkumníků je kromě DNA izolované
z periferní krve (příp. ze stěru bukání sliznice či fibroblastů),
kde je pátráno po zárodečných mutacích nejrůznějších genů, též DNA
izolovaná ze vzorků plicních nádorů získaných post mortem
(nejčastěji parafinové řezy) či peroperačně (nativní nebo zamražená
tkáň) nebo při instrumentálních diagnostických a bioptických
výkonech (ponejvíce suspenze buněk při bronchoskopii, dále pak z
bronchiální laváže či z biopsií při videothorakoskopii). Nověji je
studována DNA původem ze sputa a dokonce v kondenzátech
vydechovaného vzduchu. V několika posledních letech se, alespoň v
zahraničí, zaměřuje pozornost na cirkulující nádorovou DNA
izolovanou z plasmy, příp. séra.
Také my jsme nedávno tuto metodiku zavedli v DNA
diagnostické laboratoři našeho ústavu s cílem kvantifikovat
celkovou plasmatickou DNA u nádorových nemocných a pokusit se
prokázat zastoupení DNA pocházející z nádorových buněk v celkové
DNA izolované z plasmy a vyčíslit její podíl (Hirmerová et al.,
Poster č. 5 a tento sborník, JOD 2009).
Farmakogenetika terapie plicní rakoviny:
Zavedení celé řady polymorfismů (především
enzymatických) a jejich testování u pacientů s nádory plic má za
cíl individualizaci a tím i zkvalitnění protinádorové terapie.
Typickým příkladem je stanovení genotypů µ (mí) a θ (théta)
u glutathion s-transferasy (GSTM1 a GSTT1). Jde o enzym, který
vykazuje antiapoptotickou aktivitu a účastní se též v resistenci
buněk na protinádorovou chemoterapii (Carlsten et al., 2008).
Podobně významným je testování somatických mutací
ve výše zmíněném EGFR pro terapii první generací inhibitorů EGFR
(gefitinib a erlotinib) u pacientů s nemalobuněčnými formami plicní
rakoviny (Lynch et al. 2004, Pugh et. al. 2007, Riely 2008).
Samostatnou kapitolu představuje výzkum
genetických determinant v metastazování karcinomů plic, protože
právě terapuetické blokování některých těchto molekul a mechanismů
lze využít v prevenci metastáz (Yamashita et. al., 2007; Decock et
al., 2008).
Predispoziční studie:
Hlavní směry aktuálního výzkumu na úrovni velkých
populačních vzorků se zaměřují na asociační studie jednotlivých
oblastí našeho genomu (GWAS) s predispozicí ke vzniku nádoru (ale i
třeba s predispozicí ke kuřáckému habitu).
Plicní rakovina je onemocnění značně heterogenní
(např. jednotlivé histotypy) a jen vzácně je součástí monogenních
tzv. hereditárních nádorových syndromů. Považujeme ji za
multifaktoriální onemocnění s účastí mnoha genů a výrazným vlivem
prostředí (kouření aktivní i pasivní, průmyslové škodliviny
atd.).
Vrozená predispozice k plicní rakovině je
polygenně determinovaná. Přičemž jen zcela výjimečně lze u
familiárních případů (početné případy ca plic opakující se ve více
generacích) najít zárodečnou mutaci některého ze známých tumor
supresorických genů (APC, RB1, NF2, MSH2 aj.).
Největší zastoupení v populaci však mají nádory
sporadické (non-familiární, tj. bez opakování v rodině), kde
předpokládáme predispozici způsobovanou dosud neznámými geny.
Jednotlivé výsledky statistik si mnohdy protiřečily: některé
popírají a jiné naznačují, že se zárodečné mutace ´velkých´ tumor
supresorických genů p53, RB1 a p 16 (pravděpodobně)
podílejí či nepodílejí na susceptibilitě ke karcinomu plic (Hwang
et al. 2003, Dai et al. 2003). Další hypotetické lokusy (asi 20)
byly vytipovány v experimentech na geneticky definovaném zvířecím
modelu (rekombinantní kongenní myší kmeny, knock-out mutanty aj.) a
jsou nyní studovány na základě syntenie mezi myšími a lidskými
chromosomy (Démant 2003).
V posledních letech počet publikací, které se
zabývají genetikou, molekulární genetikou a molekulární
epidemiologií plicní rakoviny, nebývale narostl. Prvním takovým
milníkem byl r. 2004, kdy bylo publikováno několik velkých
multicentrických studií, které poukázaly na význam mutací v genu
pro receptor epiteliálního růstového faktoru (EGFR) (Paetz et al.
2004, Pao et al. 2004, Lynch et al. 2004) a další velký lokus pro
susceptibilitu k plicní rakovině byl mapován do 6q23-q25
(Bailey-Wilson et al., 2004). Jiné práce studují aberantní metylaci
promotorů nejrůznějších genů jako biomarkerů pro diagnostiku plicní
rakoviny (Hsu et al. 2005, Schmiemann et al. 2005).
Druhým ´zlomem´ byl nejspíše loňský rok, kdy tři
nezávislé GWAS studie na různých kavkazských populacích (Amos, C.I.
et al., 2008, Hung, R.J. et al., 2008, Thorgeirsson, T.E. et al.,
2008) ukázaly na další lokusy susceptibility k rakovině plic (a
zřejmě i závislosti na nikotinu), které mapují do oblasti genů pro
podjednotky nikotinového acetylcholinového receptoru na chromosomu
15q25. Čtyři jednonukleotidové polymorfismy této oblasti jsme
zavedli v naší laboratoři a na jiném místě (Hirmerová et al.,
Poster č. 5 a tento sborník, JOD 2009) přinášíme výsledky pilotní
studie na české populaci.
Genetické poradenství:
Z pohledu praktické klinické genetiky jsou
výstupy recentního výzkumu zatím omezeně použitelné a dostupné,
nicméně klinické genetické poradenství v rodinách s výskytem
plicních nádorů se postupně prosazuje ve světě a zavádíme je i na
ambulanci našeho ústavu.
Při stanovování rizika opakování nádoru pro osoby
dosud bezpříznakové se (podobně jako u jiných nádorů) zavádějí
rizikové modely založené na dotaznících zaměřených na anamnestické
údaje osobní a rodinné. Protože pro populaci ČR zatím takové
nástroje nemáme, lze s určitými omezeními použít modely
konstruované na kavkazských populacích jako jsou např.
pravděpodobnostní tabulky Spitzové a kolektivu. (Spitz et al.,
2007).
Ve klinické poradenské praxi jsme zachytili např.
několik rodin na základě hospitalizace nemocného mladšího 55 let
postiženého plicní rakovinou, kde se u blízkých příbuzných (též v
mladších věkových kategoriích) nacházejí současně bronchogenní ca,
ca tlustého střeva, ca žaludku, jakož i ca ovarií a dělohy, méně
často pak ca ledvin (Obrázek 2). Nápadný je i výskyt nádorových
duplicit v těchto rodinách. Koincidence rakoviny plic a tlustého
střeva ve zmíněných rodinách implikuje otázku, zda alespoň u části
nemocných bronchogenním karcinonem se na vzniku onemocnění
nepodílejí mutace v genech (AFP, MUTYH, MMR aj.), které jsou
v laboratoři ÚBLG 1. LF UK a VFN vyšetřovány již více než 10
let.

Spolupráce na výzkumu v ČR:
Specialistům v oboru pneumologie a onkologie
nabízíme spolupráci při molekulárně genetickém výzkumu plicní
rakoviny, především nemalobuněčných typů (NSCLC).
Předmětem našeho zájmu jsou vzorky plicních
nádorů získaných post mortem (nejčastěji parafinové řezy) či
peroperačně (nativní nebo zamražená tkáň) nebo při instrumentálních
diagnostických a bioptických výkonech (ponejvíce suspenze buněk při
bronchoskopii), dále pak vzorky periferní krve osob s nádorem i
bez, zejména těch, které nikdy nekouřily. Ze vzorků nádorů a
kontrolních budeme izolovat DNA a molekulárně genetické vyšetřování
z nádorové a nenádorové (kontrolní, tj. periferní krev, vzdálená
uzlina) tkáně se zaměří na stanovení mutátorového fenotypu
nádorových buněk (detekce poruchy opravného systému MMS) a
vybraných polymorfismů (cytochrom P, glutathion-S-transferáza, TP53
a další).
Další naši cílovou skupinu představují rodiny s
opakovaným výskytem nádorových onemocnění plic ve více generacích,
rodiny s více typy nádorů včetně rakoviny plic a konečně jedinci s
nádorovými duplicitami či triplicitami (alespoň jeden primární
nádor musí postihovat plíci) a jejich příbuzní.
Literatura:
- Amos, C.I. et al.: Genome-wide association scan of tag SNPs
identifies a susceptibility locus for lung cancer at 15q25.1. Nat.
Genet., 40,616-622, 2008.
- Bailey-Wilson, J. E.; Amos, C. I.; Pinney, S. M.; Petersen, G.
M.; de Andrade, M.; Wiest, J. S.; Fain, P.; Schwartz, A. G.; You,
M.; Franklin, W.; Klein, C.; Gazdar, A.; and 1 5 others : A major
lung cancer susceptibility locus maps to chromosome 6q23-25. Am. J.
Hum. Genet. 75: 460-474, 2004.
- Carlsten C., Sagoo G.S., Frodsham A.J., Burke W., Higgins J.P.:
Glutathione S-tranferarase M1 (GSTM1) polymorphism a nd lung
cancer: a literature-based systematic HuGE review and
meta-analysis. Am. J. Epidemiol. 167: 759 - 774, 2008.
- Dai, Z.; Zhu, W.-G.; Morrison, C. D.; Brena, R. M.; Smiraglia,
D. J.; Raval, A.; Wu, Y.-Z.; Rush, L. J.; Ross, P.; Molina, J. R.;
Otterson, G. A.; Plass, C.: A comprehensive search for DNA
amplification in lung cancer identifies inhibitors of apoptosis
cIAP1 and cIAP2 as candidate oncogenes. Hum. Molec. Genet. 12:
791-801, 2003.
- Decock J, Paridaens R, Ye S.: Genetic polymorphisms of matrix
metalloproteinases in lung, breast and colorectal cancer. Clin
Genet. 73(3):197-211, 2008.
- Démant P.: Cancer susceptibility in the mouse: genetics,
biology, and implications for human cancor. Nat. Rev. Genet. 4:
721-734,2003.
- Hsu, H. S., Wen, C. K., Tang, Y. A., Lin, R. K., Li, W. Y.,
Hsu, W. H., Wang, Y. C.: Promoter hypermethylation is the
predominant mechanism in hMLH1 and hMSH2 deregulation and is a poor
prognostic factor in nonsmoking lung cancer. Clin. Cancer Res. 2005
Aug 1;11(15):5410-6.
- Hung, R.J. et al.: A susceptibility locus for lung cancer maps
to nicotinic acetylcholine receptor subunit genes on 1 5q25.
Nature, 425, 633-637, 2008.
- Hwang, S.-J.; Cheng, L. S.-C.; Lozano, G.; Amos, C. I.; Gu, X.;
Strong, L. C. : Lung cancer risk in germline p53 mutation carriers:
association between an inherited cancer predisposition, cigarette
smoking, and cancer risk. Hum. Genet. 113: 238-243,
2003.
- Lynch, T. J.; Bell, D. W.; Sordella, R.; Gurubhagavatula, S.;
Okimoto, R. A.; Brannigan, B. W.; Harris, P. L.; Haserlat, S. M.;
Supko, J. G.; Haluska, F. G.; Louis, D. N.; Christiani, D. C.;
Settleman, J.; Haber, D. A.: Activating mutations in the epidermal
growth factor receptor underlying responsiveness of non-small-cell
lung cancer to gefitinib. New Eng. J. Med. 350: 2129-2139,
2004.
- Paez, J. G.; Janne, P. A.; Lee, J. C.; Tracy, S.; Greulich, H.;
Gabriel, S.; Herman, P.; Kaye, F. J.; Lindeman, N.; Boggon, T. J.;
Naoki, K.; Sasaki, H.; Fujii, Y.; Eck, M. J.; Sellers, W. R.;
Johnson, B. E.; Meyerson, M.: EGFR mutations in lung cancer:
correlation with clinical response to gefitinib therapy. Science
304: 1497-1500,2004.
- Pao, W.; Miller, V.; Zakowski, M.; Doherty, J.; Politi, K.;
Sarkaria, I.; Singh, B.; Heelan, R.; Rusch, V.; Fulton, L.;Mardis,
E.; Kupfer, D.; Wilson, R.; Kris, M.; Varmus, H.: EGF receptor gene
mutations are common in lung cancers from ´never smokers´ and are
associated with sensitivity of tumors to gefitinib and erlotinib.
Proc. Nat.Acad. Sci. 101: 13306-13311, 2004.
- Riely GJ: The use of first-generation tyrosine kinase
inhibitors in patients with NSCLC and somatic EGFR mutations. Lung
Cancer 60, Suppl 2:S19-22, 2008.
- Samara, K. et al.: Microsatellite DNA instability in benign
lung diseases. Respir Med 100, 202-21, 2006.
- Sequist, L. V., Josuu, V. A., Janne, P. A., Bell, D. W.,
Fidias, P., Lindeman, N. I., Louis, D. N., Lee, J. C., Mark, E. J.,
Longtine, J., Verlander, P., Kucherlapati, R., Meyerson, M., Haber,
D. A., Johnson, B.E., Lunch, T. J.: Epidermal growth factor
receptor mutation testing in the care of lung cancer patients.
Clin. Cancer Res. 2006 Jul 15; 12(14 Pt 2): 4403s-4408s.
- Schmiemann, V., Bocking, A., Kazimirem, M,. Onofre, A. S.,
Gabbert, H. E., Kappes, R., Gerharz, C. D., Grote, H. J.:
Methylation assay for the diagnosis of lung cancer on bronchial
aspirates: a cohort study. Clin. Cancer Res. 2005 Nov
1;11(21):7728-34.
- Sozzi, G. et al.: Quantification of free circulating DNA as a
diagnostic marker in lung cancer. J Clin Oncol 21,3902-3908,
2003
- Spitz MR, Hong WK, Amos CI, Wu X, Schabath MB, Dong Q, Shete S,
Etzel CJ: A risk model for prediction of lung cancer. J Natl Cancer
Inst. 99(9):715-26, 2007.
- Thorgeirsson, T.E. et al.: Avariant associated with nicotine
dependence, lung cancer and peripheral arterial disease. Nature,
452, 638-642, 2008.
- Xue, X., et al.: Circulating DNA and lung cancer. Ann NY Acad
Sci 1075,154-164, 2006.
- Yamashita S, Masuda Y, Matsumoto K, Okumura Y, Matsuzaki H, Kurizaki T, Haga Y, Katafuchi S, Murayama T, Ikei S, Kawahara K.: Down-regulation of the human PRL-3 gene is associated with the metastasis of primary non-small cell lung cancer. Ann Thorac Cardiovasc Surg. 13(4):236-9, 2007.
Datum přednesení příspěvku: 23. 10. 2009





