Konference: 2010 XVII. Jihočeské onkologické dny
Kategorie: Zhoubné gynekologické nádory
Téma: Epidemiologie, etiologie, screening, patologie
Číslo abstraktu: 002
Autoři: MUDr. Lucie Mouková, Ph.D.; MUDr. Richard Feranec; MUDr. Josef Chovanec, Ph.D.
Velký posun v prevenci karcinomu děložního hrdla způsobilo ve světě objevení vakcín proti HPV infekci. V České republice byla aplikována první vakcína proti HPV infekci dne 5. 12. 2006. Ke dni 31. 12. 2009 bylo naočkováno přibližně 112 830 klientů. Optimální vakcinace se provádí u dětí a mladistvích, kteří ještě nezahájili sexuální život. Účinek proti HPV typ 16 a 18 se udává až 100 %. Dívky a ženy, které již měly pohlavní styk, by dle doporučení České gynekologicko-porodnické společnosti (ČGPS) měly před vakcinací absolvovat gynekologické vyšetření. Účinek vakcinace se při normálním gynekologickém nálezu udává kolem 80 %. Pro veřejnost bývá stále diskutabilní věková hranice vakcinace, která je limitována studiemi jednotlivých preparátů. Dle vyjádření ČGPS není vakcinace u žen nad 26 let a vakcinace mužů postupem non lege artis. Dle doporučení ČGPS mohou být očkovány i ženy s abnormálním výsledkem cytologie, kondylomaty či ošetřenou prekancerózou v anamnéze. Je nutné brát v úvahu, že se nejedná o vakcíny terapeutické, tudíž benefit z vakcinace je nižší. Vakcinace v době gravidity je kontraindikována. V provedených studiích sice došlo k neplánovanému otěhotnění několika vakcinovaných žen, ale procento těhotenských abnormalit bylo stejné jako u nevakcinovaných žen. Dle základních vakcinačních schémat je nutné k dosažení adekvátní účinnosti vakcinace aplikovat všechny 3 dávky s respektováním vakcinačních schémat jednotlivých preparátů. Při plánované současné vakcinaci proti jinému onemocnění je vhodné interval vakcinace posunout alespoň o 1–2 týdny z důvodů odlišení pozdních nežádoucích reakcí. Pokud je zapotřebí podat zároveň dvě různé vakcíny v týž den, doporučuje se aplikovat vakcíny na rozdílná místa. Při nachlazení či nemoci by měla být vakcinace odložena alespoň o 14 dnů! Při oslabeném imunitním systému organismu nemusí být dosaženo adekvátního efektu vakcinace. Samotná aplikace vakcíny se provádí intramuskulárně do oblasti deltového svalu horní části paže či do anterolaterální oblasti stehna. V současné době není preskribce receptů v České republice omezena, takže vakcíny může předepsat kterýkoliv lékař. U dětí se doporučuje vakcinace pediatrem, u dívek a žen gynekologem. V současné době jsou na českém trhu k dispozici dvě rekombinantní profylaktické vakcíny - vakcína Silgard a vakcína Cervarix.
Kvadrivalentní vakcína Silgard je ve světě známá pod názvem Gardasil. Jedna dávka obsahuje 20 ug proteinu L1 typu HPV 6, 40 ug proteinu L1 typu HPV 11, 40 ug proteinu L1 typu HPV 16, 20 ug proteinu L1 typu HPV 18. Dle registrace přípravku možno vakcinovat chlapce i dívky od 9 let do 15 let, dále dívky a ženy od 16 let do 26 let. Od září 2009 je schválena Evropskou komisí účinnost pro ženy ve věku od 24 let do 45 let. Vakcína je indikována v prevenci vysokého stupně cervikální dysplazie (CIN 2 a CIN 3), vysokého stupně vulvárních a vaginálních dysplastických lézí a karcinomu děložního hrdla iniciovanými HPV typy 16 a 18, bradavic zevního genitálu v příčinné souvislosti s HPV typem 6 a 11.
Bivalentní vakcína Cervarix obsahuje 20 ug proteinu L1 typu HPV 16, 20 ug proteinu L1 typu HPV 18. Dle registrace přípravku se vakcinují ženy a dívky ve věku 15 let až 25 let. Vakcína je indikována k prevenci vysokého stupně cervikální intraepiteliální neoplazie (CIN 2 a CIN 3) a karcinomu děložního hrdla, způsobené HPV typem 16 a 18.
Nežádoucí účinky neživých vakcín jsou minimální, nejčastěji bývá bolestivost a zarudnutí v místě vpichu. U obou vakcín je prokázána zkřížená protekce proti dalším high risk HPV typům, které se podílí cca ve 20 % na karcinomech děložního hrdla. Ceny obou vakcín jsou přibližně stejné. Jednotlivé pojišťovny přispívají na vakcinaci různou měrou. Některé pojišťovny hradí vakcinaci i u chlapců.
Tab. Úhrada vakcinace proti HPV infekci zdravotními
pojišťovnami pro rok 2010 v ČR
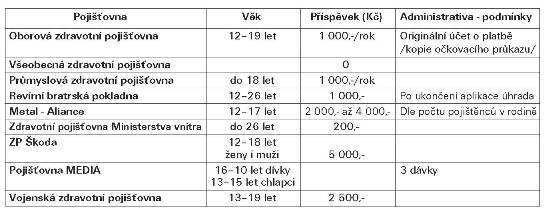
Celosvětově zemře na karcinom děložního hrdla
více než 650 žen/den, což je cca 240 000 žen/rok. Dle dostupné
literatury se HPV typ 16 a 18 podílí na 70 % rakoviny děložního
hrdla a zkřížená protekce proti dalším HPV typům dává benefit cca
ve 20 %. Zavedení organizovaného cervikálního screeningu a
celoplošné vakcinace proti HPV infekci může být slibnou cestou v
prevenci rakoviny děložního hrdla. V očekávání je zveřejnění studií
na vakcinaci proti HPV u mužů v souvislosti s prevencí análního
karcinomu. Výsledky těchto studií byly poprvé prezentovány na
EUROGIN 2010. Terapeutické a terapeuticko-profylaktické vakcíny
jsou dosud ve fázi klinických experimentů. V budoucnu by mohly
přinést velký zlom nejen v prevenci a léčbě karcinomu děložního
hrdla, ale i dalších HPV etiologicky souvisejících tumorů.
Literatura
- Cibula D., Petruželka L. a kol.: Onkogynekologie, 1. vydání, Praha: Grada 2009: 393–394, 399–400.
- Tachezy R.: Epidemiologie genitální papillomavirové infekce ve světě a ČR, HPV a karcinom děložního čípku,Moderní gynekologie a porodnictví 15/2006, č. 4 supplementum A: 589–594.
- HPV a vakcinace: Moderní gynekologie a porodnictví, 16/2007 č. 4,supplementum.
- Schwarz T. F.: Human papillomavirus - 16/18 candidate vaccine adjuvanted with ASO4 and its impact on the incidence of cervical cancer. Expert. rev. Obst. Gynecology, 2007.2(3): 293–303.
- Olson S. E.: Villa L. L., Costa R. L. R. et al., Induction of immune memory following administration of prophylactic quadrivalent human papillomavirus (HPV) types 6/11/16/18 L1 virus - like particle (VLP) vaccine. Vaccine 2007, 25: 4931–9.
- Paavonem J., Lehtinen M.: Introducing Human Papillomavirus vaccines: Great hopes but questions remain, HPV Today, Newsletter on Human Papillomavirus, No. 14 Febr. 2008: 6–8.
- Bosch F. X., Castellsague X., Sanjosé S.: HPV and cervical cancer: screening or vaccination. Br J Cancer 2008, 98: 15–21.
- Kahn J. A.: HPV Vaccination for the Prevention of Cervical Intraepithelial Neoplasia, The New England Journal of Medicine, vol. 361, No. 3: 271–278.
- Stern P. L.: Prophylactic HPV vaccines, HPV Today, Newsletter on Human Papillomavirus, No. 14 Febr.2008: 4–5.
- Fait T. a kol., Očkování proli lidským papilomavirům. Kvadrivalentní HPV vakcína Silgard tři roky v klinické praxi, Maxdorf 2009.
- Joura E. A., Leodolter S., Hernanandez - Avila M. et al.: Efficacy of quadrivalent prophylactis HPV (type 6,11, 16, 18) L1 virus - like particle vaccinae against high grade vulval and vaginal lesions: a combined analysis of three clinical trials. Lancet, 2007, 369: 1693–702.
- De Villiers E. M., Fauqet C., Broker T. R. et al.: Classification of papillomaviruses,Virology, 2004, 265: A16–23.
- Mouková L., Feranec R., Chovanec J., Vakcinace proti Lidskému papillomaviru (HPV) v České republice, Klinická onkologie 2010, 23 (2): 125–126
Datum přednesení příspěvku: 15. 10. 2010





